Résumé
Les transitions épithélium-mésenchyme (EMT) contrôlent de multiples étapes de la morphogenèse et de l’organogenèse. Le mésenchyme est apparu il y a huit cents millions d’années pour la première fois chez des diploblastes. Ce mécanisme a été conservé au cours de l’évolution et intervient dès le stade de la gastrulation dans très nombreuses espèces pour assurer la formation du mésoderme. Les mécanismes de signalisation des EMT, bien que diversifiés, convergent vers la machinerie adhésive. Les mécanismes des EMT sont aussi étroitement associés à ceux contrôlant la détermination et la différenciation. Les EMT sont réactivées dans les tissus adultes soumis à des agents toxiques ou au cours de la réparation tissulaire. Les EMT sont potentiellement critiques lors du processus invasif des carcinomes. Ils conduisent à la formation de cellules de phénotype mésenchymateux qui franchissent la barrière endothéliale et disséminent. Une transition mésenchyme-épithélium conduit à la formation de macro-métastases aux sites secondaires. L’état mésenchymateux transitoire des carcinomes confère des propriétés de cellules souches, une protection contre la mort cellulaire, une immunosuppression, et une résistance aux molécules de chimiothérapies et aux thérapies ciblées .
Summary
Epithelial-mesenchymal transition (EMT) is a major process controlling multiple developmental events. The mesenchyme appeared as a transient state in diploblasts more than 800 million years ago. EMT has been conserved through evolution to control morphogenetic events, such as the formation of the three primary germ layers during gastrulation. Interestingly, related signal transduction pathways are remarkably conserved in many species. In the animal kingdom, EMT controls the intercellular adhesion machinery and its associated cytoskeleton. EMT pathways are also intimately involved in determination and differentiation programs, and are reactivated in adult tissues following injury or exposure to toxic agents. EMT is likely to play a role in early steps of carcinoma invasion, enabling blood or lymph vessel intravasation. Mesenchymal-like carcinoma cells undergo a mesenchymal to epithelial transition at distant sites from the primary tumor, and eventually form macrometastases. The mesenchymal-like state of cancer cells confers stemness, protection from cell death, immune escape and, most importantly, resistance to conventional and targeted therapies. Current strategies based on the EMT concept are aimed at designing new therapeutic approaches that interfere with the plasticity of carcinoma cells.
INTRODUCTION
Les épithéliums résultent d’un assemblage cohérent de cellules hautement polarisées reposant sur une lame basale. Les cellules épithéliales possèdent des jonctions adhésives caractéristiques localisées dans le domaine membranaire latéral. Les jonctions adhérentes et les desmosomes sont des structures spécialisées identifiées à l’origine par microscopie électronique. Les cellules forment aussi des jonctions serrées au niveau apical du domaine latéral ; ces jonctions assurent un contrôle strict du flux ionique et par voie de conséquence forment une barrière très étanche. Les cellules mésenchymateuses forment un réseau très lâche de cellules isolées insérées dans une matrice extracellulaire dense. Les cellules mésenchymateuses interagissent de façon très préférentielle avec certains composants de la matrice extracellulaire et demeurent séparées des épithéliums par une membrane basale. Dès les premiers stades du développement, les cellules mésenchymateuses communiquent avec les épithéliums afin de promouvoir une différenciation des tissus et des ébauches d’organes. Ainsi les interactions épithélium-mésenchyme jouent un rôle capital dans la morphogenèse et l’organogenèse et ont fait l’objet de très nombreux travaux pour identifier les facteurs responsables de ces interactions réciproques. Certaines cellules épithéliales peuvent modifier leur morphologie au sein des épithéliums et forment localement des invaginations ou des évaginations par constriction différentielle du domaine apical. Elles peuvent aussi considérablement modifier leurs propriétés adhésives et se dissocier de l’épithélium pour adopter une morphologie mésenchymateuse. Ce processus appelé transition épithélium-mésenchyme (en anglais abrévié EMT) contribue de façon décisive à la formation du plan de l’embryon au cours de la gastrulation, puis pendant la morphogenèse. L’EMT est aussi impliquée dans un certain nombre de pathologies dont le cancer. L’EMT fait aujourd’hui l’objet de recherches dans de nombreux laboratoires dont les travaux sont cités dans des revues récentes de notre laboratoire [1-3].
EMT au cours de l’embryogenèse et de l’organogenèse
La gastrulation chez les espèces les plus primitives, les diploblastes, fait intervenir différents mécanismes contrôlant la plasticité des épithéliums [4]. La formation d’une bicouche peut impliquer un mouvement cohérent de cellules épithéliales par involution, ingression ou par délamination de cellules épithéliales (EMT). L’EMT est un mécanisme très ancien apparu il y a près de huit cents millions d’années qui a été conservé au cours de l’évolution chez les métazoaires.
L’embryon de drosophile gastrule par invagination suivi d’une EMT. Un crible génétique a permis d’identifier les voies de signalisation aboutissant à l’enclenchement de l’EMT et à la formation du mésoderme. Toll induit la translocation du facteur NFκb dans le noyau assurant l’induction de la transcription de deux gènes, Snail et Twist, codant des facteurs de transcription contribuant à l’exécution du programme EMT dans de très nombreuses espèces [5]. Snail, un facteur de transcription à doigt de zinc, est un répresseur transcriptionnel de nombreux gènes dont celui codant la E-cadhérine, une glycoprotéine transmembranaire responsable de l’adhérence intercellulaire dépendant du calcium des cellules épithéliales. Mais Snail contribue aussi à la répression de la différenciation du neurectoderme et à l’arrêt de la division cellulaire. Twist est un facteur de transcription ( basic helix loop helix ;
bHLH) qui contrôle la constriction apicale des cellules en agissant sur la contraction du réseau d’acto-myosine et module les interactions intercellulaires. Un scénario similaire se produit chez l’oursin, où Snail et Twist contrôlent la répression du gène codant la protéine E-cadhérine mais aussi son endocytose, permettant une dissociation très rapide de l’épithélium pour former le mésenchyme primaire de l’embryon. Divers facteurs de transcription ont été identifiés dans cette voie de signalisation induite par Wu [6].
Chez les vertébrés, on retrouve deux membres de la famille Snail, SNAI1 et SNAI2 (appelé Slug à l’origine), et Twist dans différents programmes d’EMT au cours de la gastrulation ou dans la formation des cellules de la crête neurale. Cependant les voies de signalisations présentent des caractéristiques spécifiques dans chaque famille de vertébrés. Les éléments les plus importants de ces voies de signalisation concernent le contrôle de la morphologie des cellules et leurs propriétés adhésives, ainsi que l’inhibition de la prolifération et le maintien de la survie cellulaire. Le programme EMT est par ailleurs étroitement lié aux programmes contrôlant la formation et la différenciation des lignages cellulaires [3].
De même, l’EMT contrôle la formation et la morphogenèse des somites, structures métamériques, à l’origine des vertébrés du derme et des muscles thoraciques, abdominaux et des membres. Le récepteur c-Met et son ligand le facteur de croissance hépatique (HGF) est impliqué dans la délamination des cellules du myotome au niveau des bourgeons de membres. La morphogenèse du tractus germinal masculin fait intervenir une EMT accompagnant la régression des canaux de Muller. Cette EMT est contrôlée par l’hormone mullérienne ( Mullerian inhibiting substance ), un membre de la superfamille des TGFβ. On retrouve aussi une contri-
Fig. 1. — Modèle générique de la gastrulation chez les amniotes.
bution de l’EMT dans la formation des cordons testiculaires et dans la soudure des deux segments du palais secondaire pour former la voûte palatine [1-3].
L’EMT intervient de façon prépondérante dans l’histogenèse du cœur. Trois cycles EMT et MET participent à la formation de la splanchnopleure, puis du myocarde et de l‘endocarde et, enfin, à la formation des valves atrio-ventriculaires. Les facteurs de croissance de la famille TGFβ, la voie Notch et les récepteurs ErbB participent à la formation des valves cardiaques [3].
Ainsi l’EMT et son mécanisme inverse la MET contribuent de façon majeure aux étapes précoces du développement. Une mutation affectant une des voies de signalisation prépondérantes de l’EMT provoque un arrêt du développement. Les mutations des gènes codant le récepteur 1 des facteurs de croissance fibroblastique (FGFR1), un de ses ligands, FGF4 ou SNA1 provoquent un arrêt au stade gastrula chez la souris [7]. L’inactivation du gène c-Met bloque la formation des muscles des membres et la mutation des facteurs de transcription Hey dans la voie Notch provoque des malformations cardiaque majeures [8].
Chez l’adulte, l’EMT n’intervient que dans de très rares situations physiologiques comme l’intériorisation des cellules de l’épithélium ovarien au cours de l’ovulation [9]. Elle joue cependant un rôle majeur dans la cicatrisation des épithéliums. Ce sujet est amplement abordé dans ce volume dans l’article présenté par Pierre Savagner. Des données récentes montrent que chez le poisson zèbre, l’épicarde peut donner naissanceàdesvaisseauxcoronariensfacilitantlarégénérationdumyocarde.Onpeutdonc espérer que la régénération tissulaire puisse être accélérée par une EMT [10].
Fibroses
Cependant il faut souligner que l’EMT contribue au développement de la fibrose de plusieurs organes comme le rein, le foie et le cœur [11, 12]. La fibrose constituée par une matrice extracellulaire très réticulée et des fibroblastes provoque un dysfonctionnement grave de ces organes. Des modèles transgéniques murins ont montré qu’une fraction des fibroblastes de fibrose rénale provenait de l’épithélium rénal ou de l’endothélium cardiaque dans le cas de la fibrose du cœur. La voie de signalisation activant le récepteur conventionnel au TGFβ a été mise en évidence dans plusieurs pathologies fibrotiques. Des essais précliniques basés sur un traitement par des inhibiteurs de cette voie de signalisation comme le facteur antagoniste BMP7 ont montré leur efficacité. La preuve formelle d’un tel mécanisme n’est pas définitivement établie chez l’homme ; mais de nombreux indices tendent à confirmer l’origine épithéliale d’une fraction des fibroblastes activés. Les articles présentés dans ce volume par Jean-Claude Dussaule et Éric Rondeau font le point sur cette question d’actualité en pathologie.
Progression des carcinomes
Les carcinomes apparaissent au sein des épithéliums après transformation cellulaire. Des événements génétiques comme des mutations ponctuelles activatrices, des délétions ou des amplifications de régions chromosomiques ainsi qu’une altération du contrôle de l’expression des gènes par des mécanismes épigénétiques interviennent dans les phases précoces de la transformation cellulaire. Les zones lésées peuvent conduire successivement à une hyperplasie bénigne suivie par des stades de type adénomateux, avant d’acquérir des propriétés malignes. À ce stade les carcinomes sont confinés dans l’épithélium bordé par une membrane basale et qualifiés ainsi d’ in situ . Dès ce stade et contrairement au dogme bien établi d’une non dissémination des cellules carcinomateuses dans le microenvironnement sous-jacent à l’épithélium, on a récemment mis en évidence que des cellules issues du carcinome primitif ont atteint des organes distants [13, 15]. Ceci laisse supposer que le processus invasif ait déjà débuté dans certaines régions du carcinome in situ où la membrane basale est déjà fragmentée. Ces zones de micro-invasion sont difficiles à détecter dans le cadre de l’analyse pathologique de routine qui ne fait l’objet que de quelques coupes histologiques au sein de la tumeur primitive.
La détection de cellules micro-métastatiques dans le sang circulant ou dans la moelle osseuse de la crête iliaque ou du sternum démontre que la dissémination des carcinomes implique une EMT à un stade précoce des formes invasives. La visualisation d’un processus EMT au sein d’un carcinome mammaire est très difficile car il est impossible de reconnaître avec certitude une cellule maligne isolée au sein du stroma tumoral par histologie classique. Tout récemment de telles cellules ont été mises en évidence dans des carcinomes mammaires au contact de cellules endothé- liales et en association avec des macrophages [16]. Des modèles expérimentaux utilisant la microscopie bi-photonique ont permis de visualiser en temps réel la dissociation des cellules malignes de carcinomes mammaires et leur migration vers les capillaires sanguins ou lymphatiques voire même leur pénétration dans les vaisseaux [17, 18]. Des cellules isolées présentant toutes les caractéristiques d’une EMT sont présentes dans la zone de la progression des carcinomes colorectaux. Il est proposé que ces cellules proviennent de structures épithéliales du carcinome et reforment, à leur tour, un nouvel îlot épithélial accomplissant ainsi de nombreux cycles EMT/MET aussi bien au sein de la tumeur primitive que dans la métastase [19].
De très nombreux travaux ont été consacrés à l’étude de la plupart des types de carcinomes. Le processus d’EMT est invoqué dans la majorité d’entre eux. Il reste cependant à démontrer de façon formelle que cette transition est bien responsable de l’invasion locale ou de la dissémination à distance. En effet le mécanisme de migration collective de feuillets épithéliaux peut aussi contribuer à l’invasion locale voir même à la dissémination dans les ganglions lymphatiques [20, 21].
Modèles d’étude de l’EMT des carcinomes
Les travaux pionniers de Elisabeth Hay et coll., ont ouvert la voie à l’étude in vitro de l’EMT grâce à la mise au point de culture d’un épithélium sur un gel tridimensionnel de collagène [22]. Il a fallu cependant attendre une vingtaine d’années pour découvrir l’existence de facteurs solubles capable d’induire la dissociation de cellules épithéliales. Il revient à Sir Michael Stoker d’avoir découvert un facteur d’origine fibroblastique capable de dissocier des cellules épithéliales rénales [23]. Ce facteur appelé à l’origine scatter factor s’est avéré être identique à un facteur de croissance d’origine hépatique appelé hepatocyte growth factor (HGF). Dans le même temps d’autres facteurs de croissance ont montré leurs propriétés dissociantes et motogè- nes, comme les facteurs de croissance fibroblastique FGF1, 7, 10, des membres de famille EGF, l’IGF1, 2 ou le TGFβ1 [1]. De nombreuses voies de signalisation ont été mises en évidence dans l’EMT in vitro impliquant l’activation de récepteurs transmembranaires et en aval de nombreux effecteurs. Un ou plusieurs facteurs de transcription de la famille Snail, Twist ou Zeb sont fréquemment associés à l’EMT [3]. Chacun de ses facteurs de transcription active ou réprime un grand nombre de gènes dont une fraction seulement intervient directement dans l’exécution du programme de dissociation. Ainsi SNAI1 protège contre l’apoptose et Twist joue un rôle capital dans la protection contre la sénescence des cellules au cours du processus de transformation. Ces études sont décrites en détail dans l’article présenté par Alain Puisieux [24]. L’ensemble des études réalisées in vitro sur des lignées cellulaires de carcinomes démontrent que les mécanismes contrôlant l’EMT au cours du développement embryonnaire on été en grande partie réutilisés par les cellules malignes [3]. Plusieurs modèles murins transgéniques de tumeurs mammaires ont permis de mettre en évidence une EMT au sein de la tumeur primitive et de déterminer son importance dans la progression métastatique et dans la récidive. D’autres modèles reposant sur l’inoculation de cellules malignes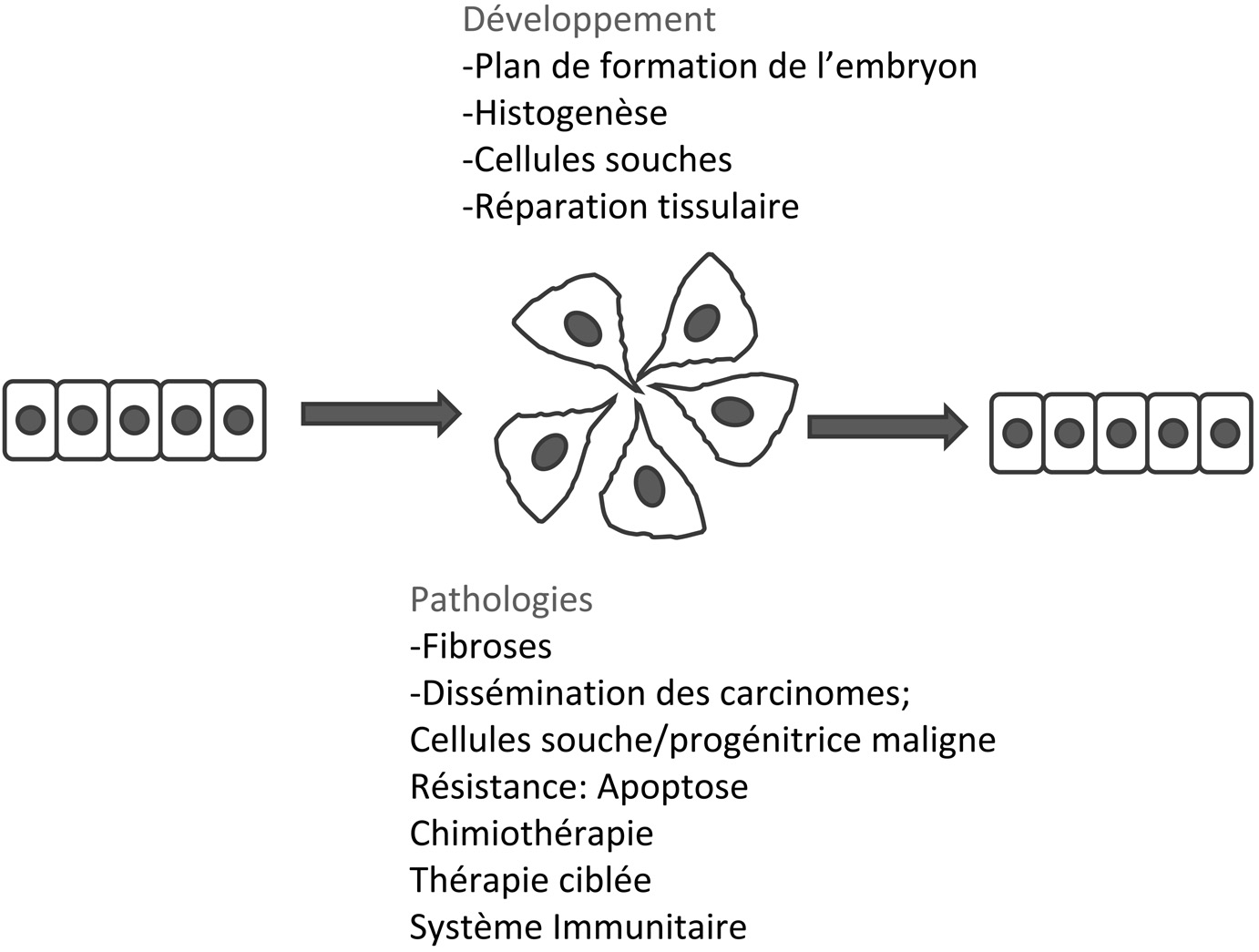
Fig. 2. — La transition épithélium-mésenchyme, un mécanisme essentiel du développement des métazoaires et ses effets adverses dans les pathologies.
ont permis de démontrer l’importance de certains facteurs de croissance et facteurs de transcription associés à l’EMT dans les différentes étapes de progression tumorale. Ces modèles sont utilisés aujourd’hui pour définir plus précisément les proprié- tés des cellules mésenchymateuses qui apparaissent transitoirement dans les carcinomes. Les cellules mésenchymateuses sont plus résistantes à l’apoptose. L’EMT confère aussi des propriétés immunosuppressives qui facilitent la dissémination [25].
Des sous populations cellulaires malignes sélectionnées par cytométrie de flux et capables de former des sphéroïdes in vitro et des tumeurs in vivo après injection d’un très petit nombre de cellules présentent un phénotype mésenchymateux. Cette observation a conduit à émettre l’hypothèse que l’EMT confère des propriétés de cellules souches [26, 27]. Cette hypothèse a reçu un certain nombre de confirmations expérimentales aussi bien in vitro qu’in vivo . Elle s’applique aussi aux cellules normales. Le maintien de l’état mésenchymateux fait intervenir des facteurs de transcription comme Zeb1 et Zeb2 qui sont eux-mêmes réprimés par des micro ARN des familles 200 et 205 [28]. De fait, diverses boucles rétroactives et des modifications post-traductionnelles peuvent ajuster très finement le niveau d’expression de ces facteurs effecteurs de l’EMT. Enfin des propriétés de résistance à la chimiothérapie conventionnelle apparaissent fortement corrélées avec le phénotype mésenchymateux. Plusieurs grandes entreprises pharmaceutiques envisagent des criblages de petites molécules ou d’anticorps permettant de pallier la résistance aux thérapies anticancéreuses.
Notre laboratoire s’est engagé dans cette voie et a mis au point une méthode de criblage à haut débit afin de déterminer la combinaison la plus pertinente de petites molécules inhibitrices de voies de transductions conférant le phénotype mésenchymateux [29].
CONCLUSION
Après plus de quarante années suivant les travaux pionniers des embryologistes, le concept de l’EMT a permis de faire progresser notre connaissance des grands principes fondateurs de la formation du plan des embryons et plus récemment de mieux appréhender le processus invasif et métastatique des tumeurs. Ce concept doit apporter de nouvelles stratégies thérapeutiques pour retarder, voire inhiber totalement les mécanismes de résistance aux traitements anticancéreux qui inéluctablement assombrissent le pronostic vital des patients.
BIBLIOGRAPHIE [1] Thiery, J.P. — Epithelial-mesenchymal transitions in tumor progression.
Nature Cancer
Review, 2002, 2 , 442-454.
[2] Thiery J.P., and Sleeman J.P. — Complex networks orchestrate epithelial-mesenchymal transitions. Nat. Rev. Mol. Cell. Biol., 2006 7 , 131-142.
[3] Thiery J.P., Acloque H., Huand Y.J.H., Nieto A. — Epithelial-mesenchymal transitions in development and disease. Cell, 2009, 139 871-890.
[4] Price A.L., Patel N.H. — The evolution of gastrulation: Cellular and Molecular Aspects.
In
Gastrulation: From Cells to Embryo, C.D. Stern, ed. (Cold Spring Harbor, Cold Spring Harbor Laboratory Press) 2004 , pp 695-701 .
[5] Kolsch V., Seher T., Fernandez-Ballester G.J., Serrano L., Leptin M. — Control of Drosophila gastrulation by apical localization of adherens junctions and RhoGEF2. Science, 2007, 315 , 384-386.
[6] Wu S.Y., McClay D.R. — The Snail repressor is required for PMC ingression in the sea urchin embryo. Development, 2007, 134 , 1061-1070.
[7] Ciruna B., and Rossant J. — FGF signaling regulates mesoderm cell fate specification and morphogenetic movement at the primitive streak. Dev. Cell, 2001, 1 , 37-49.
[8] Fischer A., Steidl C., Wagner T.U., Lang E., Jakob P.M., Friedl P et al., — Combined loss of Hey1 and HeyL causes congenital heart defects because of impaired epithelial to mesenchymal transition. Circ. Res., 2007, 100 , 856-863.
[9] Ahmed N., Maines-Bandiera S., Quinn M.A., Unger W.G., Dehar S., and Auersperg N. — Molecular pathways regulating EGF-induced epithelio-mesenchymal transition in human ovarian surface epithelium. Am. J. Physiol. Cell Physiol., 2006, 290 , 1532-1542.
[10] Lepilina A., Coon A.N., Kikuchi K., Holdway J.E., Roberts R.W., Burns C.G., et al. — A dynamic epicardial injury response supports progenitor cell activity during zebrafish heart regeneration. Cell, 2006, 127 , 607-619.
[11] Nielson E.G. — Mechanisms of disease: fibroblasts-a new look at an old problem.
Nature Clin.
Practice Nephrology , 2 , 101-107.
[12] Kalluri R. Weinberg R.A. — The basics of epithelial mesenchymal transition.
J. Clin. Invest., 2009, 119 , 1420-1428.
[13] Pantel K., Alix-Panabières C., and Riethdorf S. — Cancer micrometastases.
Nature Rev.
Clinic. Oncol., 2009, 6 , 339-351.
[14] Husseman Y., Geigl J.B., Shubert F., Musiani P., Meyer M., Burghart E., et al. — Systemic spread is an early step in breast cancer.
Cancer Cell, 2008, 13 , 58-68.
[15] Bidard F.C., Vinvent-Salomon A., Gomme S., Nos C., de Rycke Y., Thiery J.P., et al. —
Disseminated tumor cells of breast cancer patients: a strong prognostic factor for distant and local relapse. Clin. Cancer Res., 2008, 14 , 3306-3311.
[16] Robinson B.D., Sica G.L., Liu Y.F. Rohan T.E., Gertler F.B. Condeelis J.S., et al. —
Tumor microenvironment of metastasis in human breast carcinoma: a potential prognostic marker linked to hematogenous dissemination. Clin. Cancer Res., 2009, 15 , 2433-2441.
[17] Condeelis J., and Segall J.E. — Intravital imaging of cell movement in tumours.
Nat. Rev.
Cancer , 2003 , 3, 921-930.
[18] Giampieri S., Manning C., Hooper S., Jones L., Hill C.S., and Sahai E. — Localized and reversible TGFβ signaling switches breast cancer cells from cohesive to single cell motility.
Nature Cell Biol ., 2009 , 11 , 1287-1296.
[19] Brabletz T., Jung A., Spaderna S., Hlubek F., and Kirchner T. — Opinion: migrating cancer stem cells — an integrated concept of malignant tumour progression. Nat. Rev. Cancer , 2005, 5 , 744-749.
[20] Friedl P., and Gilmour D. — Collective cell migration in morphogenesis, regeneration and cancer. Nature Rev. Mol. Cell. Biol., 2009, 10 , 445-457.
[21] Thiery J.P. — Metastasis: Alone or Together.
Current Biol., 2009, 19 , 1121-1123.
[22] Hay E.D. — An overview of epithelio-mesenchymal transformation.
Acta Anat. , 1995, 154 , 8-20.
[23] Stoker M., Gheradi E., Perryman M., Gray J. — Scatter factor is a fibroblast-derived modulator of epithelial cell mobility. Nature, 327, 239-242.
[24] Ansieau S., Bastid J., Doreau A., Morel A.P., Bouchet B.P., Thomas et al. — Induction of
EMT by twist proteins as a collateral effect of tumor-promoting inactivation of premature senescence. Cancer Cell , 2008, 14 , 79-89.
[25] Kudo-Saito C., Shirako H., Takeuchi T., and Kawakami Y. — Cancer metastasis is accelerated through immunosuppression during Snail-induced EMT of cancer cells. Cancer Cell , 2009, 15 , 195-206.
[26] Morel A.-P., Lièvre M., Thomas C., Hinkal G., Ansieau S. and Puisieux A. — Generation of breast cancer stem cells through epithelial-mesenchymal transition. PLos One , 2008, 3 , e2888.
[27] Mani S.A., Guo W., Liao M.J., Eaton E.N., AYYANAN A., Zhou A.Y., et al . — The epithelial-mesenchymal transition generates cells with properties of stem cells.
Cell , 2008, 133 , 704-715.
[28] Wellner U., Schubert J., Burk UC., Schmalhofer O., Zhu F., Sonntag A., et al . — The
EMT-activator ZEB1 promotes tumorigenicity by repressing stemness-inhibiting microRNAs.
Nat. Cell Biol. , 2009, 11 , 1487-95.
[29] Chua K.N., Ma J., Thiery J.P. — Targeted therapies in control of EMT in carcinoma and fibrosis. Drug Discol. Today , 2008, 4 , 261-267.
DISCUSSION M. Jean-François BACH
Peut-on définir le moment auquel la transformation en cellules mésenchymateuses devient définitive après l’état de transition ?
La transformation en cellules mésenchymateuses se produit assez rapidement au cours du développement embryonnaire aux sites de transition épithélium-mésenchyme (EMT).
Il faut noter cependant que le programme EMT n’intervient que pour une part dans la différenciation en cellules mésenchymateuses. L’inhibition de la délamination ne bloque pas complètement le programme de différenciation qui fait intervenir d’autres voies de signalisation (voir Figure 1).
M. Jean-Jacques HAUW
Existe-t-il des modifications des molécules extracellulaires (collagène, laminine…) lors de la transformation en cellule souche mésenchymateuse lui permettant de migrer d’un cancer « in situ » vers la microcirculation ?
Il est vraisemblable que certaines glycoprotéines de la matrice extracellulaires comme le collagène de type 1, la laminine 5 et la ténascine C interviennent dans ce processus de dissémination des cellules souches mésenchymateuses malignes. Il demeure cependant nécessaire d’identifier ces glycoprotéines et protéoglycannes dans les carcinomes dans la zone périphérique proche des sites d’intravasation dans les vaisseaux. Il faudrait par ailleurs disposer de marqueurs spécifiques des cellules souches malignes pour affirmer que ces cellules contribuent au microenvironnement tumoral.
M. Maurice TUBIANA
Les mécanismes d’induction de la TEM qui interviennent dans les phénomènes physiologiques (réparation d’une plaie cutanée) ou pathologiques (progression d’un cancer) ont-ils des similarités ou sont-il totalement différents ? Dans la mesure où l’on peut répondre à cette question, ce mécanisme d’induction apparaît-il le même pour tous les types de cancer ou se différencie-t-il selon le type de cancer ? A-t-on observé une réversibilité de la TEM dans certains des processus de cancérogenèse ?
Les mécanismes d’induction de l’EMT au cours de la réparation tissulaire et la progression des carcinomes partagent certains inducteurs et effecteurs de programme, Mais il existe aussi des différences significatives dans les différentes étapes de l’EMT. Pierre Savagner insiste dans son article sur l’état métastable de l’épithélium cutané au cours de la réparation. Cet état est aussi présent dans les cellules des carcinomes mais la transition vers l’état mésenchymateux peut atteindre un stade beaucoup plus avancé. De plus des différences fondamentales existent entre ces deux types d’EMT. Les cellules des carcinomes doivent pénétrer dans les vaisseaux pour se disséminer. Des mécanismes spécifiques de cette étape ne sont pas nécessairement actifs lors de la cicatrisation de blessure. Les mécanismes contrôlant l’EMT différent selon le type de carcinome. Différents inducteurs de l’EMT peuvent intervenir dans les carcinomes mammaires, les carcinomes colorectaux ou pulmonaires. Plusieurs types d’inducteurs peuvent contribuer à la dissémination tumorale au sein d’une même tumeur. Ainsi l’hypoxie, provoque une EMT dans les zones mal irriguées de la tumeur alors que certains facteurs de croissance comme l’EGF, l’HGF le TGFbeta ou l’IGF1 produit de façon autocrine ou paracrine par les cellules du microenvironnement peuvent intervenir dans d’autres territoires de la tumeur primitive.
On observe une réversion du phénotype mésenchymateux très transitoire dans un grand nombre de carcinomes. Les métastases ont assez souvent un phénotype similaire à celui de la tumeur primitive voir quelquefois plus différencié signant ainsi une réversion complète de l’EMT.
Bull. Acad. Natle Méd., 2009, 193, no 9, 1969-1979, séance du 1er décembre 2009


