Résumé
Le concept de cartographie fonctionnelle du corps calleux (CC) est né des études lésionnelles chez l’homme et des recherches anatomiques chez les autres mammifères. Notre étude a pour but de décrire cette cartographie du CC humain obtenue pour la première fois in vivo et en utilisant une technique non invasive : l’Imagerie par Résonance Magnétique Fonctionnelle (f-IRM). Nous avons testé l’activation corticale et au niveau du CC par effet BOLD pendant la stimulation sensorielle (tactile, gustative, visuelle) et motrice sur 38 volontaires. Nous avons également évalué l’organisation axonale de la substance blanche au niveau du CC chez 16 de ces 38 volontaires en imagerie par tenseur de diffusion (DTI) et tractographie par tenseur de diffusion (DTT). La stimulation du goût comporte une activation de la partie antérieure du CC, l’activation motrice de sa partie centrale, la stimulation tactile de sa partie centrale et postérieure, et la stimulation visuelle celle du splenium du CC. La reconstruction par DTT des faisceaux du CC qui connectent les aires corticales primaires activées du goût, motrices, somato-sensorielles et de la vision, démontrent des corrélations anatomiques de l’activation fonctionnelle du CC avec des faisceaux qui empruntent le CC, respectivement au niveau du genou, du corps antérieur et postérieur et du splenium, en correspondance avec les sites d’activation fonctionnelle du CC détectés par effet BOLD. Ces données démontrent que la topographie fonctionnelle du CC peut être explorée pour la première fois in vivo chez l’homme par f-IRM, avec des perspectives d’application en la pratique clinique courante, surtout pour la planification des actes neurochirurgicaux.
Summary
The concept of a topographical map of the corpus callosum (CC) has emerged from lesion studies in humans and from anatomical tracing investigations in other mammals. We conducted the first in vivo study aimed at outlining the topographical organization of the normal human CC, using non-invasive functional magnetic resonance imaging (fMRI). We tested cortical and callosal activation by the BOLD effect during simple sensory stimulation (tactile, gustatory and visual) and simple motor tasks in 38 volunteers. The axonal organization of callosal white matter was also studied in 16/38 subjects, using diffusion tensor imaging (DTI) and diffusion tensor tractography (DTT). Activation foci evoked by taste stimuli were detected in most subjects in the anterior part of the CC, those elicited by motor tasks lay in the central portion of the body of the CC, and those elicited by tactile stimulation of different body regions lay in the posterior part of the body. Activation foci evoked by visual stimulation were seen in the splenium of the CC. Callosal fibers interconnecting the primary cortical areas activated by taste stimulation, motor tasks, and tactile and visual stimuli were shown by DTT. Anatomical correlates of the BOLD activation foci were demonstrated in the CC, with fibers crossing it at the level of the genu, anterior and posterior body, and splenium, respectively. This study demonstrates for the first time that the functional topographical organization of the human CC can be explored by fMRI in vivo . Our findings may have clinical implications, especially for neurosurgical planning.
INTRODUCTION
Le corps calleux (CC) connecte les hémisphères, cérébraux en fournissant le transfert des informations et leur intégration corticale inter-hémisphérique. Des recherches post mortem [1] sur des patients avec des lésions du CC ou ayant subi une section chirurgicale : callosotomisés [2-5] comme les données électro-physiologiques et neuro-anatomiques recueillies chez des primates [6, 7] ont suggéré une organisation topographique du CC. (Fig 1). Une telle organisation serait basée sur des régions spécifiques pour chaque modalité [8] : les faisceaux antérieures qui connectent les lobes frontaux devraient transférer les informations sur l’activité motrice, les faisceaux postérieurs qui connectent les lobes pariétaux, temporaux et occipitaux seraient responsables de l’intégration des informations somato-sensorielles (moitié postérieure du CC central), auditives (isthme) et visuelles(splenium).
Une organisation topographique du CC basée sur des régions spécifiques pour chaque modalité a été confirmée par des études chez des patients après résection chirurgicale du CC : comme l’étude menée par notre groupe, en stimulation tactile [2, 9-11] ; d’autres études ont démontré que le splenium du CC est essentiel pour le transfert inter-hémisphérique des informations visuelles [12, 13] et auditives [14, 15].
Fig. 1. — Organisation topographique du corps calleux selon les recherches sur des sujets callosotomisés.
Notre groupe de recherche interdisciplinaire est composé par des neurophysiologistes, des neurologues, des neurochirurgiens et des neuroradiologues de l’Université Polytechnique des Marches, et l’activité de recherche se déroule dans le Centre de IRM de l’Hôpital d’Ancona. L’objectif de notre recherche était de confirmer pour la première fois chez l’homme in vivo les résultats des recherches nommées ci-dessus:
l’outil de cette recherche chez le sujet humain vivant c’est l’Imagerie de Résonance Magnétique Fonctionnelle (IRM-f) du cerveau, basée depuis ces dernières années sur la détection de l’effet BOLD (Blood Oxygenetaion Level Dependent) et sur les études de diffusion des molécules d’eau dans l’encéphale.
L’effet BOLD se base sur le fait que l’activation corticale détermine une augmentation du débit hématique régionale, et par conséquent une variation de la p0 dans le 2 sang veineux correspondent au territoire activé ; la IRM nous permet la détection de l’oxyhémoglobine et de la désoxyhémoglobine au niveau du cerveau : il est possible de mesurer le signal qui est en rapport avec la présence de ces deux substances au niveau de certaines régions du cerveau pendant des périodes alternés de stimulation et de repos, et la différence entre les valeurs mesurés, évaluée par des méthodes d’analyse statistique, donne la mesure de l’activation régionale du cortex cérébral correspondante à la stimulation effectuée, et nous permet d’en identifier la topographie cérébrale.
L’imagerie IRM du tenseur de diffusion (IRM-TD) et de la tractographie en tenseur de diffusion (TTD) nous ont procuré une technique non invasive pour évaluer les faisceaux de la substance blanche et la connectivité neuronale. La IRM-TD se base sur la mesure de la propriété de diffusion locale de l’eau libre intercellulaire selon un modèle de tenseur [16, 17]. Le coefficient de diffusion apparent (CDA) mesure la moyenne des mouvements moléculaires désordonnés de l’eau libre intercellulaire (dites « Browniens » du nom de Robert Brown), dans toutes les directions de l’espace [18], et l’index d’anisotropie fractionnelle (FA) fait référence à la direction vers laquelle la diffusion montre une dépendance directionnelle (strictement angulaire). Dans les fibres myélinisées de la substance blanche, la diffusion est anisotropique, puisque l’axe selon lequel le mouvement brownien est le plus grand suit le grand axe des axones [19, 20] : la reconstruction statistique des directions des faisceaux neuronaux et leur codage coloré dans les trois plans de l’espace matérialisent des images de coupes de l’encéphale. L’anisotropie de la diffusion comporte la TTD, procédure de calcul statistique par des logiciels (déterministes ou probabilistes) qui permet la reconstruction virtuelle des principaux faisceaux de fibres nerveuses à myéline de la substance blanche [16, 21, 22]. Elle offre des informations sur la connectivité impossibles à obtenir in vivo par d’autres méthodes. Ses limites majeures sont l’imperfection technique de la neuro-anatomie reconstruite. Cela est dû à sa capacité limitée à calculer les croisements de fibres et les régions à bas rapport signal/bruit [23]. Cette limitation n’empêche pas la méthode de distinguer les différentes populations axonales de la structure microscopique de la substance blanche, à la condition d’interpréter les données avec prudence [24]. La TTD a été utilisée pour visualiser les principaux faisceaux des fibres du CC [25-29], et dans le contexte de notre recherche pour confirmer in vivo chez l’homme la segmentation du
CC en régions qui correspondent aux faisceaux des fibres connectant des zones corticales discrètes.
Des études précédentes sur la représentation corticale de la sensitivité tactile et gustative chez des témoins [30] nous avaient conduits à noter, parfois, une différence de signal due à l’effet BOLD au sein du CC, à des emplacements correspondant au croissement des faisceaux provenant des zones corticales activées. Des travaux qui documentaient l’activation fonctionnelle du CC pendant des tests de comportement [31, 32] nous ont encouragé à re-analyser les données de Résonance Magnétique fonctionnelle (IRM-f) chez des sujets normaux, pour rechercher la présence d’un effet BOLD dans la commissure par stimulation sensorielle et/ou motrice, afin de tracer une carte fonctionnelle du CC. Chez l’homme vivant pour la première fois les donnés obtenues par effet BOLD ont été comparées avec les donnés anatomiques obtenues par IRM-TD et TTD.
MATÉRIEL ET MÉTHODES
Nous avons examiné trente-huit témoins volontaires présumés sains (étudiants ou médecins), dont vingt femmes, d’âge 22 à 51 ans. Tous ces sujets ont donné leur accord informé à la participation à cette étude, et le protocole de recherche a été approuvé par le Comité Éthique de l’Université.
Nous avons utilisé un Scanner 1,5 T Signa Excite NV/i, General Electric Medical System, Millwaukee, USA, équipé de gradients de 50mT/m. Après avoir acquis des données avec technique 3D SPGR, les images fonctionnelles ont été recueillies dans une séquence EPI (dix coupes jointives de 5 millimètres d’épaisseur) et après des images axiales 2D SPGR à haute résolution, sur dix niveaux sélectionnés, pour superposer les images d’activation fonctionnelle sur des repères anatomiques et visualiser les vaisseaux.
Pour l’étude de l’effet BOLD nous avons examiné trente-huit sujets : chaque sujet à été soumis à une ou plusieurs épreuves, pour un total de cinquante-huit tests de IRM fonctionnelle (voire le tableau pour des renseignements détaillés) ; pendant chaque épreuve mille images fonctionnelles axiales (cent pour chaque section) ont été acquises pendant le cycle de stimulation (dix périodes de repos et de stimulation alternés). Les modèles des stimulations sensorielles ont été détaillés dans des articles précédents ( pour le goût voir [30] ; p our la stimulation tactile voir [33] ; pour la stimulation visuelle voir [34]) ; pour l’activation motrice on a effectué dix périodes de repos et de stimulation (alternance de flexion-extension du même doigt de la main).
Les donnés de l’analyse fonctionnelle ont été examinées avec le software Brain Voyager QX, Brain Innovation, Maastricht, Hollande. Les sections ont été transformées dans un espace Talairach [35]. L’analyse statistique a été faite selon le modèle linéaire générale (GLM).
L’analyse du signal a été effectuée en sélectionnant des régions d’intérêt dans des zones différentes du CC. Quand le signal était plus élevé que le signal de base (P<0,05) pendant une stimulation, et s’il corrélait temporellement avec le modèle de stimulation, on acceptait que ce signal soit évoqué par le modèle de stimulation périphérique.
Pour l’étude de IRM-TD nous avons examiné seize des trente-huit témoins, et nous avons obtenu des renseignements sur les faisceaux de fibres qui connectaient les régions corticales activées par la stimulation périphérique sensorielle et/ou motrice dans trente-cinq des cinquante-huit tests de IRM-f pour l’étude de l’effet BOLD (voire le tableau pour des renseignements détaillés). Pour chaque test une série d’images axiales obliques a été acquise par mesure de la diffusion selon vingt-cinq directions non-colinéaires dans l’espace, la valeur b étant 1000.
Pour l’analyse IRM-TD, le software Functool 3.1.22 (GEMS) a été utilisé. Son option « FiberTrak » permet d’obtenir des images colorées 2D d’orientation, des cartes de tractographie et des images 3D de TTD.
Après avoir sélectionné des régions d’intérêt corticales correspondant aux zones dans lesquelles on avait observé un effet BOLD, on effectuait deux analyses diffé- rentes : évaluation des faisceaux en provenance de cette région, puis analyse des faisceaux de fibres inter hémisphériques connectant deux régions homologues opposées.
RÉSULTATS ET DISCUSSION
Base de l’activation du CC
Occasionnellement, un effet BOLD a été décrit dans le CC comme corrélé avec un comportement moteur [31, 32]. On a expliqué cet effet comme conséquent à l’entraî- nement des astrocytes [36, 37] présents dans le CC avec des capillaires [38].
Fig. 2. — Stimulation gustative : activation corticale par effet BOLD (gauche), analyse TTD des faisceaux de fibres à provenance des régions corticales activées (centre) et activation par effet BOLD du CC (droite).
Fig. 3. — Stimulation tactile : activation corticale par effet BOLD (gauche), analyse TTD des faisceaux de fibres à provenance des régions corticales activées (centre) et activation par effet BOLD du CC (droite).
Fig. 4. — Stimulation visuelle : activation corticale par effet BOLD (gauche), analyse TTD des faisceaux de fibres à provenance des régions corticales activées (centre) et activation par effet BOLD du CC (droite).
Fig. 5. — Localisation à l’intérieur du CC des zones activés par effet BOLD : les quatre groupes correspondent à des stimulation différentes ; chaque point correspond à un témoin, et la localisation est identifiée selon les coordonnées de Talairach.
Topographie de l’activation du CC
Nous avons évalué l’activation due à la stimulation gustative chez quatorze témoins ; le protocole de stimulation était : 30″ de repos, 15″ de stimulation, 45″ de repos, 15″ de stimulation, 45″ de repos. Le stimulus sucré était une solution 10 % de saccharose (cinq sujets), le stimulus salé était une solution 1M de Na Cl (9 sujets), le stimulus amer était une solution 0.002 M de quinine (trois sujets) et le stimulus neutre était de l’eau distillé. Pendant des sessions différentes on appliquait le stimulus tant à droite qu’à gauche. Chez tous les témoins on apercevait l’activation de l’aire gustative primaire (GI, opercule fronto-pariétale) dans les deux hémisphères [30].
Au niveau du CC le foyer d’activation est détectée dans le genou et la portion antérieure du CC (Fig. 2 et 5 C) dans la même zone où on trouve l’activation due à la stimulation tactile de la langue : en effet, la nature complexe du goût comporte une composante tactile.
Nous avons évalué l’activation due à la stimulation motrice chez huit témoins : le protocole était dix périodes de repos et de stimulation de 30″ alternés, et la stimulation était la flexion et la distension des doigts d’une main (droite et/ou gauche, pendant des sessions différentes).
Nous avons évalué l’activation due à la stimulation tactile chez vingt et un témoins :
le protocole était vingt périodes de repos et de stimulation de 15″ alternés, et le stimulus était le frottement continué à la fréquence de 1 Hz de la peau par une éponge ou par un tampon d’ouate ; pendant le repos on continuait le mouvement de l’objet sans toucher la peau. Nous avons stimulé plusieurs régions différentes du corps, toujours à gauche et parfois même à droite : main (quatorze témoins), face (quatre témoins), langue (quatre témoins), avant-bras (trois témoins), bras (trois témoins), épaule (cinq témoins), tronc (cinq témoins), cuisse (cinq témoins), jambe (quatre témoins), pied (cinq témoins). Chez tous les témoins on apercevait l’activation controlatérale de l’aire motrice primaire (MI, circonvolution précentrale).
L’activation du CC en rapport avec l’activité motrice et la stimulation tactile des régions controlatérales différentes du corps se trouve localisée dans la partie anté- rieure et postérieure du corps et dans l’isthme (Fig. 3 et 5 A-B). Cette zone est plus postérieure que ce que l’on a identifié chez les animaux, mais correspond aux résultats de quelques études récentes des fibres motrices du CC chez l’homme [29, 39]. Ce déplacement postérieur a été expliqué par les plus grandes dimensions du cortex pré-frontal chez l’homme, comparé avec le singe et, en conséquence, en rapport avec le volume majeur de la partie antérieure du CC qui connecte ces régions du cerveau dans les deux hémisphères [29, 39].
La stimulation tactile évoquait l’activation de l’aire somato-sensorielle primaire controlatérale (SI, circonvolution postcentrale) dans des zones correspondantes au mappage connu [40].
La stimulation de certaines régions du corps évoquent des réponses dans plusieurs zones du CC. La stimulation tactile de la main (Fig. 3 et 5 B) et du pied, p.ex., donne une réponse dans la partie antérieure du CC postérieur, dans la même région que celle activée par le mouvement de la main, en association avec une autre réponse plus postérieure, au niveau de la jonction isthme/splenium. L’activation plus anté- rieure pourrait être associée à l’activation du cortex moteur, induite par la stimulation tactile de cette région [11].
Nous avons évalué l’activation due à la stimulation visuelle chez quinze sujets. Le protocole était une échiquier clignotant à la fréquence de 1 Hz avec alternance de périodes de repos et de stimulation de 15″ pour 5′ ; la stimulation était dirigée vers le champ visuel gauche, droite ou centrale. La stimulation visuelle évoquait l’activation de l’aire visuelle primaire (VI, scissure calcarine) controlatérale après stimulation latérale, ou bilatérale après stimulation centrale. L’activation visuelle évoque des réponses au niveau du splenium du CC (Fig. 4, 5 D).
Pour l’analyse topographique les images de l’effet BOLD étaient superposées aux images anatomiques à plus haute résolution spatiale et co-registrées ; la localisation des foyers de réponse au niveau du CC était mesurée par un système de coordonnées dans un espace Talairach [35].
Concordance avec les donnés TTD .
La topographie du CC (Fig. 6), telle qu’obtenue par analyse TTD des faisceaux des fibres qui connectent les régions corticales activées dans les deux hémisphères, est en accord avec les études de l’effet BOLD détecté dans le CC et avec les études précédentes de l’organisation topographique des fibres du CC [25, 27-29]. Les faisceaux qui connectent les régions corticales pré-frontales empruntent la partie antérieure du CC ; ces faisceaux qui connectent les régions motrice et pré-motrice croisent au niveau de la partie centrale du CC (voir aussi [39]). Les faisceaux qui connectent les régions corticales pariétales croisent au niveau de la partie posté- rieure du CC et les faisceaux provenant de la région occipitale croisent au niveau du splenium [24, 26]. Dans tous les cas, les faisceaux détectés par TTD qui proviennent des régions corticales activées par chaque type de stimulation croisent le CC au niveau de la zone où on trouve l’activation par effet BOLD du CC la plus évidente. La coïncidence générale de l’activation BOLD du CC (Fig. 7) et le point de croisement des faisceaux des fibres inter-hémisphériques reconstruits par TTD suggère fortement que les zones du CC évoquées par stimulation corticale pourraient être dues à l’activation des fibres qui connectent les régions corticales activées et qui transportent des informations spécifiques.
Fig. 6. — Représentation schématique de l’organisation topographique du CC chez l’homme obtenue par analyse TTD des faisceaux de fibres qui connectent les régions corticales activées dans les quatre groupes.
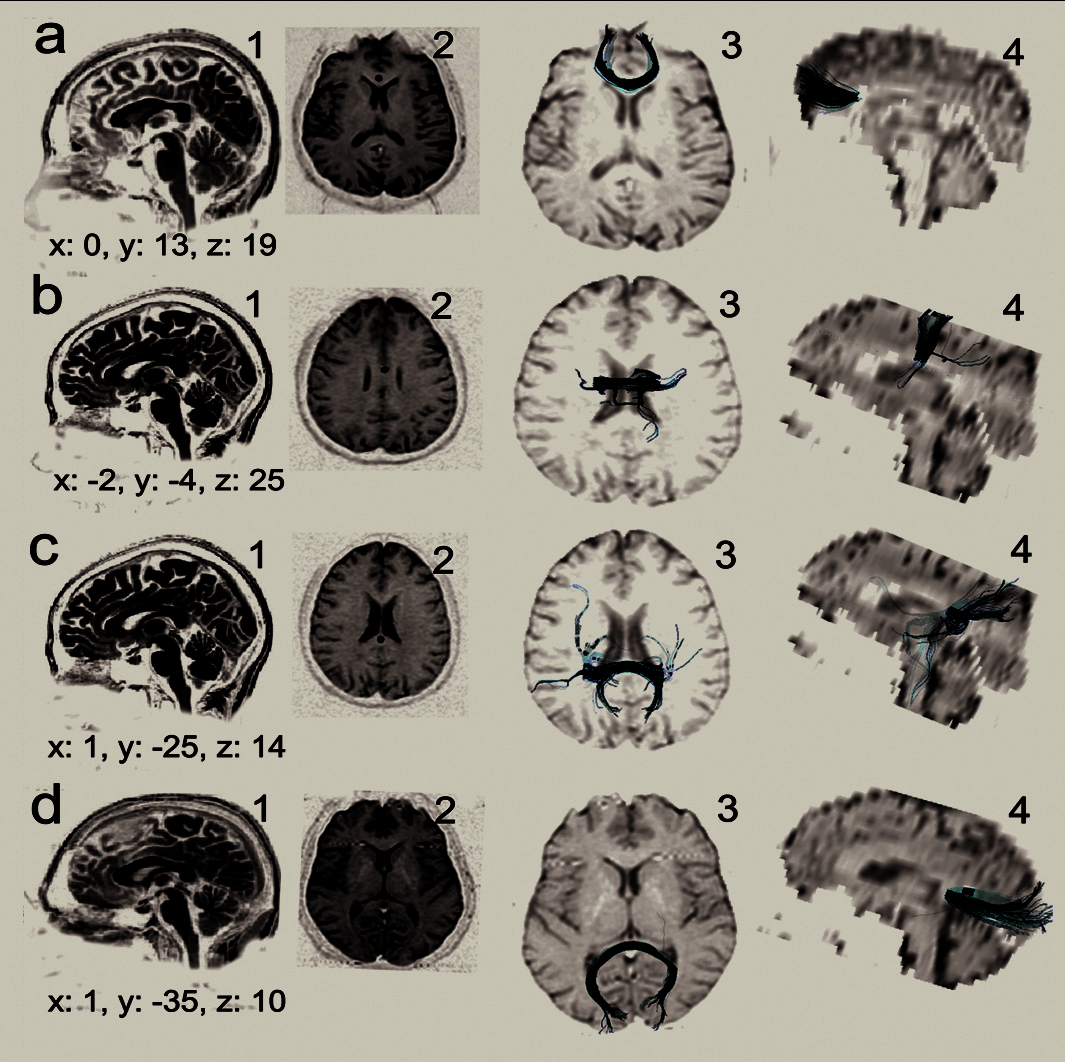
Fig. 7. — Correspondance entre la localisation des zones du CC activées par effet BOLD (colonne 1 et 2) et les zones de croisement des faisceaux identifiés par TTD (colonne 3 et 4) dans les 4 types de stimulation : a) gustative, b) tactile, c) motrice, d) visuelle.
Un tableau récapitulatif permet de mieux comprendre la répartition des résultats
Tableau no 1 no de témoins avec no de témoins avec no de stimulation f-IRM activation corticale / activation du CC/ témoins (38 sujets) no de sujets stimulés no de sujets stimulés avec DTI goût (14) foyer antérieur = 3/5 *
sucré = 5/5 foyer postérieur = 3/5 *
salé = 11/11 4/11 3 foyer antérieur 2/3 amer n = 3/3 foyer postérieur 2/3 main D&G =3/3 3/3 motricité (8) 5 main Dou G =5/5 4/5 foyer antérieur 8/14 **
4 main (14) 14/14 foyer postérieur 9/14 **
face (4) 4/4 4/4 2 foyer antérieur 4/4 *
— langue (4) 4/4 foyer postérieur 2/4 *
avant-bras (5) 5/5 3/5 2 tactile bras (3) 3/3 3/3 1 (21) épaule(5) 5/5 3/5 3 tronc(5) 5/5 4/5 1 cuisse (5) 5/5 5/5 2 jambe (4) 4/4 4/4 1 foyer antérieur 2/5 *
1 pied (5) 5/5 foyer postérieur 4/5 *
15/15 15/15 10 visuel (15) * 1 témoin montrait un foyer d’activation soit antérieur que postérieur ** 5 témoins montraient un foyer d’activation soit antérieur que postérieur CONCLUSIONS
Les résultats de notre recherche confirment, chez l’homme vivant, l’existence d’une cartographie fonctionnelle du CC ; pour la première fois in vivo chez l’homme nous avons démontré par IRM fonctionnelle que :
— la stimulation périphérique sensorielle et motrice peut évoquer un effet BOLD au niveau du CC ;
— les zones d’activation du CC sont détectées dans des régions différentes pour les différents types de stimulation, et correspondent au passage à travers du CC des faisceaux détectés par TTD qui connectent les régions corticales activées par la même stimulation périphérique sensorielle et/ou motrice appliquée ;
— la carte topographique du CC, que nous avons obtenue in vivo chez l’homme par intégration en IRM-f du résultats de l’effet BOLD et de la TTD, correspond aux résultats des études post-mortem chez l’homme [1], des études de patients porteurs de lésion du CC ou après chirurgie du CC [2, 9, 41-44 ; voir aussi revue 3 et 4] et des études eléctrophysiologiques et neuro-anatomiques chez des animaux [6, 7] ;
— les résultats de notre recherche démontrent la liaison entre les faisceaux de la substance blanche et la transmission inter-hémisphérique des stimulations.
On pourrait argumenter que l’effet BOLD décrit à l’intérieur du CC soit un artéfact ou un faux-positif. Mais la bonne correspondance entre la zone d’activation fonctionnelle dans le CC après stimulation périphérique et le point de passage des faisceaux provenant des régions corticales activées, autant que la relation étroite entre le type de stimulation et la siège de l’activation du CC, rendent cette hypothèse extrêmement improbable.
Applications neurochirurgicales possibles de la cartographie fonctionnelle du CC
Les premiers résultats de notre étude suggèrent la possibilité d’une cartographie du CC chez des malades atteints d’une maladie pour laquelle on envisage un traitement chirurgicale qui comporte l’atteinte du CC, de façon qu’on puisse planifier l’intervention chirurgicale pour réduire, si possible, les conséquences négatives postopératoire dues à la lésion chirurgicale du CC.
Dans les cas d’atteinte direct du CC par la maladie même (localisation tumorale intra-calleuse) on suggère la possibilité d’une cartographie du CC pour détecter l’engagement des zones d’activation et/ou des zones de croisement des faisceaux de fibres, ou leur refoulement possible par l’effet de masse.
La connaissance de l’organisation topographique fonctionnelle du CC chez l’homme pourrait entraîner des réflexions sur la callosotomie thérapeutique, et surtout la prévision des conséquences fonctionnelles de l’acte chirurgicale.
La neurochirurgie moderne exploite désormais ces données, quotidiennement : les renseignements pré-opératoires guident la décision et la main du neurochirurgien [45].
BIBLIOGRAPHIE [1] De Lacoste M., Kirkpatrick J.B., Ross E.D. — Topography of the human corpus callosum.
Journal of Neuropathology and Experimental Neurology 1985, 44 , 578-591.
[2] Caillé S., Sauerwein H.C., Schiavetto A., Villemure J.G., Lassonde M. — Sensory and motor interhemispheric integration after section of different portion of the anterior corpus callosum in nonepileptic patients. Neurosurgery 2005, 57 , 50-59.
[3] Berlucchi G. — Some effects of cortical and callosal damage on conscious and unconscious processing of visual information and other sensory inputs. Progress in Brain Research 2004, 144 , 79-93.
[4] Gazzaniga M.S. — Forty-five years of split-brain research and still going strong.
Nature
Reviews of Neuroscience 2005, 6 , 653-659.
[5] Fabri M., Del Pesce M., Paggi A., Polonara G., Bartolini M., Salvolini U., Manzoni T.
— Contribution of posterior corpus callosum to the interhemispheric transfer of tactile information. Cognitive Brain Research 2005, 24 , 73-80.
[6] Pandya D.N., Karol E.A., Heilbronn D. — The topographical distribution of interhemispheric projections in the corpus callosum of the rhesus monkey. Brain Research 1971, 32 , 31-43.
[7] Pandya D.N., Seltzer B. — The topography of commissural fibers. In
Two Hemispheres-One
Brain: Functions of the Corpus Callosum (Leporé F., Ptito M. and Jasper H.H. Edits, New York:
Alan Liss), 1986, 47-73.
[8] Funnell M.G., Corballis P.M., Gazzaniga M.S. — Cortical and subcortical interhemispheric interactions following partial and complete callosotomy. Archives of Neurology 2000, 57 , 185-189.
[9] Fabri M., Polonara G., Quattrini A., Salvolini U., Del Pesce M., Manzoni T. — Role of the corpus callosum in the somatosensory activation of the ipsilateral cerebral cortex: an fMRI study of callosotomized patients. European Journal of Neuroscience 1999, 11 , 3893-3994.
[10] Fabri M., Polonara G., Del Pesce M., Quattrini A., Salvolini U., Manzoni T. — Posterior corpus callosum and interhemispheric transfer of somatosensory information: an fMRI and neuropsychological study of a partially callosotomized patient. Journal of Cognitive Neuroscience 2001, 13 , 1071-1079.
[11] Polonara G., Fabri M., Manzoni T., Salvolini U. — Localization of the first (SI) and second (SII) somatic sensory areas in human cerebral cortex with fMRI. AJNR, American Journal of NeuroRadiology 1999, 20 , 199-205.
[12] Gazzaniga M.S., Freedman H. — Observations on visual processes after posterior callosal section. Neurology 1973, 23 , 1126-1130.
[13] Clarke S., Meader P., Meuli R., Staub F., Bellmann A., Regli L., Detribolet N., Assal G.
— Interhemispheric transfer of visual motion inforation after a posterior callosal lesion: a neuropsychological and fMRI study. Experimental Brain Research 2000, 132 , 127-133.
[14] Sugishita M., Otomo K., Yamazaki K., Shimizu H., Yoshioka M., Shinohara A. — Dichotic listening in patients with partial section of the corpus callosum. Brain 1995 , 118 , 417-427.
[15] Pollmann S., Maertens M., Von Cramon D.Y., Lepsien J., Hugdahl K. — Dichotic listening in patients with splenial and nonsplenial callosal lesions. Neuropsychology 2002, 16 , 56-64.
[16] Basser P.J., Pajevic S., Pierpaoli C., Duda J., Aldroubi A. — In vivo fiber tractography using DT-MRI data. Magnetic Resonance in Medicine 2000, 44 , 625-632.
[17] Le Bihan D. — Looking into the functional architecture of the brain with diffusion MRI.
Nature Reviews of Neuroscience 2003, 4 , 469-480.
[18] Brown R. — A brief account of microscopical observations made in the months of June, July and August, 1827, on the particles contained in the pollen of plants ; and on the general existence of active molecules in organic and inorganic bodies. Phil Mag. 1828, 4 , 161-173.
[19] Chenevert T.L., Brunberg J.A., Pipe J.G. — Anisotropic diffusion in human white matter:
demonstration with MR techniques in vivo . Radiology 1990, 177 , 401-405.
[20] Doran M., Hajnal J.V., Van Bruggen N., King M.D., Young I.R., Bydder G.M. — Normal and abnormal white matter tracts shown by MR imaging using directional diffusion weighted sequences. Journal of Computer Assisted Tomography 1990, 14 , 865-873.
[21] Poupon C., Clark C.A., Frouin V., Régis J., Bloch I., Le Bihan D., Mangin J. — Regularization of diffusion-based direction maps for the tracking of brain white matter fascicles. Neuroimage 2000, 12 , 184-195.
[22] Mori S. — In
Introduction to diffusion tensor imaging (Amsterdam, Elsevier Edit.), 2007.
[23] Pierpaoli C., Barnett A., Pajevic S., Chen R., Penix L.R., Virta A., Basser P. — Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture.
Neuroimage 2001, 13 , 1174-1185.
[24] Shimony J.S., Burton H., Epstein A.A., McLaren D.G., Sun S.W., Snyder A.Z. — Diffusion tensor imaging reveals white matter reorganization in early blind humans. Cerebral Cortex 2006, 16 , 1653-1661.
[25] Abe O., Masutani Y., Aoki S., Yamasue Y., Yamada H., Kasai K., Mori H., Hayashi N., Masumoto T., Ohtomo K. — Topography of the human corpus callosum using diffusion tensor tractography. Journal of Computer Assisted Tomography 2004, 28 , 533-539.
[26] Dougherty R.F., Ben-Shachar M., Bammer R., Brewer A.A., Wandell B.A. — Functional organization of human occipital-callosal fiber tracts. Proceeding of National Academy of Science USA 2005, 102 , 7350-7355.
[27] Huang H., Zhang J., Jiang H., Wakana S., Poetscher L., Miller M.I., Van Zijl P.C.M., Hillis A.E., Wytik R., Mori S. — DTI tractography based parcellation of white matter:
application to mid-sagittal morphology of corpus callosus. NeuroImage 2005, 26 , 195-205.
[28] Hofer S., Frahm J. — Topography of the human corpus callosum revisited. Comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. NeuroImage 2006, 32 , 989-994.
[29] Zarei M., Johansen-Berg H., Smith S., Ciccarelli O., Thompson A.J., Matthews P.M. — Functional anatomy of interhemispheric cortical connections in the human brain. Journal of Anatomy 2006, 209 , 311-320.
[30] Fabri M., Polonara G., Mascioli G., Tassinari G., Berlucchi G., Aglioti S., Salvolini U., Manzoni T. — Cortical representation and lateralization of taste in man. Proceedings of Physiological Societies 2005, 78P.
[31] Mosier K., Bereznaya I. — Parallel cortical networks for volitional control of swallowing in humans. Experimental Brain Research 2001, 140 , 280-289.
[32] Tettamanti M., Paulesu E., Scifo P., Maravita A., Fazio F., Perani D., Marzi C.A. — Interhemispheric transmission of visuomotor information in humans: fMRI evidence. Journal of Neurophysiology 2002, 88 , 1051-1058.
[33] Fabri M., Polonara G., Salvolini U., Manzoni T. — Bilateral cortical representation of trunk midline in human first somatic sensory area. Human Brain Mapping 2005, 25 , 287-296.
[34] Nardi B., Capecci I., Fabri M., Polonara G., Mascioli G., Cavola G.L., Di Nicolaï M., Laurenzi S., Rocchetti D., Brandoni M., Rocchetti G., Salvolini U., Manzoni T., Bellantuono C. — fMRI investigation of emotional activations during visual processing of other or own facial expressions in subjects with inward or outward personality. Rivista di Psichiatria 2008, 43 , 233-241.
[35] Talairach J., Tournoux P. — In
Co-Planar Stereotaxic Atlas of the Human Brain (Stuttgart,
Thieme Edit), 1988.
[36] Rossi D.J. — Another BOLD role for astrocytes: coupling blood flow to neural activity. Nature
Neuroscience 2006 , 9 , 159-161.
[37] Jakovcevic D., Harder D.R. — Role of astrocytes in matching blood flow to neuronal activity.
Current Top Development Biology 2007, 79 , 75-97.
[38] Rabi S., Madhavi C., Antonisamy B., Koshi R. — Quantitative analysis of the human corpus callosum under light microscopy. European Journal of Anatomy 2007, 11 , 95-100.
[39] Wahl M., Lauterbach-Soon B., Hattingen E., Jung P., Singer O., Volz S., Klein J.C., Steinmetz H., Ziemann U. — Human motor corpus callosum: topography, somatotopy, and link between microsctructure and function. Journal of Neuroscience 2007, 27 , 12132-12138.
[40] Polonara G., Mascioli G., Salvolini U., Manzoni T., Fabri M. — Cortical representation of cutaneous receptors in primary somatic sensory cortex of man: a functional imaging study.
In: Somatosensory Cortex: Roles, Interventions and Trauma (F. Columbus Edit., Nova Science
Publishers, Inc.), 2009, ISBN: 978-1-60741-876-4.
[41] Volpe B.T., Sidtis J.J., Holtzman J.D., Wilson D.H., Gazzaniga M. — Cortical mechanisms involved in praxis: observations following partial and complete section of the corpus callosum in man. Neurology 1982, 32 , 645-650.
[42] Bentin S., Sahar A., Moscovitch M. — Intermanual information transfer in patients with lesions in the trunk of the corpus callosum. Neuropsychologia 1984, 22 , 601-611.
[43] Risse G.L., Gates J., Lund G., Maxwell R.C., Rubens A. — Interhemispheric transfer in patients with incomplete section of the corpus callosum. Archives of Neurology 1989, 46 , 437-443.
[44] Levin H.S., Mattson A.J., Levander M., Lindquist C.E.H., Simard J.M., Guinto F.C., Lilly M.A., Eisenberg H.M. — Effects of transcallosal surgery on interhemispheric transfer of information. Surgical Neurology 1993, 40 , 65-74.
[45] Cabanis E.A., Iba-Zizen M.T., Habas C., Istoc A., Stievenart J.L., Yoshida M., Nguyen T.H., Goepel R. — Imagerie de l’encéphale, de la cellule à l’organe. Bull. Acad. Natle Méd.
2009, 193 , 837-847.
DISCUSSION
M. Georges SERRATRICE
Selon le type de stimulation (motrice, sensitive, sensorielle), peut-on distinguer une stimulation primaire accompagnée d’une information hétérolatérale ou d’une stimulation d’emblée bi-latérale ?
Selon le type de stimulation et/ou le siège d’application du stimulus, on peut détecter une activation corticale bilatérale (p.ex. = goût ou visuel centrale) ou une activation controlatérale par rapport au stimulus accompagnée par une activation moins intense homolatérale (p.ex.= tactile) M. Bernard LECHEVALIER
Comme vous l’avez montré, l’IRM fonctionnelle permet de constater les activations au niveau du cortex cérébral, évoquées par des stimuli physiologiques ou expérimentaux. Ce qui est nouveau dans votre présentation, c’est la mise en évidence (par l’IRM fonctionnelle) d’une activation sur la ligne médiane dans le corps calleux lui-même. Connaissez-vous d’autres travaux signalant des activations (vues à l’IRMf) dans la substance blanche du cerveau ? Comment les explique-t-on ?
L’activation de la substance blanche du cerveau a été signalée par plusieurs auteurs, surtout depuis 2006 et les explications sont différentes : une hypothèse c’est une réponse hémodynamique de la substance blanche mais différente de celle du cortex. On envisage des études à haut champ magnétique (3,0 T ou plus élevé) pour avoir des réponses avec une meilleure résolution spatiale et une analyse améliorée des données.
M. Emmanuel-Alain CABANIS
Ne s’agit-il pas d’une matérialisation du transport axonal que l’ophtalmologie nous a appris à observer sur les nerfs optiques, il y a déjà quelques années ? D’autre part, continuez-vous votre recherche pour les années à venir ? L’orientez-vous sur une fonction particulière choisie parmi d’autres ?
Nous n’avons pas de données concernant le transport axonal au niveau des faisceaux de la substance blanche : c’est une recherche possible et très intéressante. On continuera notre recherche sur le goût et sur l’olfaction, et aussi dans le domaine du langage, toujours en associant l’IRM-TD à l’IRM-f, et focalisée au niveau du CC.
M. Jacques BATTIN
Votre technique d’IRM fonctionnelle peut-elle apporter des précisions devant les découvertes in utero d’agénésie du corps calleux dont le tiers seulement s’accompagne de retard mental ?
Nous n’avons pas de données sur ce sujet, mais on connaît des recherches sur l’application de la IRM-TD pour l’étude des agénésies calleuses qui ont démontré des faisceaux de connexions homotopiques et hétérotopiques, absentes chez les sujets normaux, et en rapport avec la clinique.
M. Claude-Henri CHOUARD
Pourquoi n’emploie-t-on pas de stimulus auditif ? La parole seule ou combinée a son écriture visuelle ?
Pour le stimulus auditif on a des problèmes avec le bruit de l’IRM ; nous avons commencé à étudier le langage écouté, et nos premiers résultats ont démontré des foyers d’activation au niveau de la partie dorsale de l’isthme du CC.
M. Jacques PHILIPPON
A l’époque des callosotomies pour certaines épilepsies généralisées, les publications concluaient à l’absence de séquelles fonctionnelles, si la callosotomie était limitée à la partie antérieure. Etes-vous en accord avec cette affirmation ou ne peut-on imaginer que les moyens d’étude des séquelles n’étaient pas suffisamment précis chez des patients, par ailleurs épileptiques ?
La plupart des stimulations sensorielles donnent des foyers d’activation dans les deuxtiers postérieurs du CC : cela pourrait expliquer les absences de séquelles fonctionnelles évidentes ; le goût donne une activation de la partie antérieure du CC, mais il n’est pas évaluable sélectivement en latéralisation, sauf en conditions expérimentales particulières qui ne correspondent pas à la situation alimentaire normale.
Bull. Acad. Natle Méd., 2010, 194, no 3, 617-631, séance du 30 mars 2010