Résumé
La meilleure compréhension de l’histoire naturelle des gliomes diffus de bas grade (GDBG) et de leur relation étroite avec les mécanismes de plasticité cérébrale réactionnelle a débouché sur une attitude résolument interventionniste et non plus attentiste. De plus, les progrès des méthodes de cartographie fonctionnelle tant péri-opératoire (neuroimagerie) que per-opératoire (chirurgie éveillée) ont bouleversé la vision statique et localisationniste classique de l’organisation cérébrale, pour évoluer vers une vision hodotopique — i.e. en réseaux cortico-sous-corticaux parallèles distribués et dynamiques, capables de se compenser. De fait, la chirurgie d’exérèse, maximaliste et précoce est désormais considérée comme la première option thérapeutique dans les GDBG, puisqu’elle permet à la fois de retarder la transformation anaplasique et donc d’augmenter significativement les médianes de survie, mais aussi de préserver voire d’optimiser la qualité de vie, y compris pour les gliomes infiltrant les régions dites « éloquentes » jusqu’à lors considérées comme non opérables.
Summary
A better understanding of the natural history of diffuse low-grade gliomas (DLGG) and of their interaction with the mechanisms of reactive brain plasticity has led to a switch from a ‘‘ wait and see ’’ attitude to active therapeutic management. Advances in functional mapping techniques, both preoperatively (neuroimaging) and intraoperatively (awake surgery), have challenged the classical static and localizationist view of brain organization, in favor of a hodotopical model of parallel cortico-subcortical distributed and dynamic networks capable of compensating for one another. Early radical surgical resection is currently the first-line treatment for DLGG, because it delays anaplastic transformation and significantly increases median survival. It also preserves and may improve quality of life, even in patients whose gliomas involve eloquent areas, that were previously considered unresectable.
INTRODUCTION
Les gliomes diffus de bas grade (GDBG), à savoir les gliomes de grade II selon la classification de l’Organisation Mondiale de la Santé (OMS), correspondent à une tumeur cérébrale primitive précancéreuse, révélée le plus souvent par une crise d’épilepsie inaugurale qui survient chez des adultes jeunes (médiane d’âge aux alentours de 35 ans) menant une vie familiale et socio-professionnelle normale [1].
L’histoire naturelle des GDBG a été extensivement étudiée ces dernières années, notamment grâce à l’essor des techniques d’imagerie et des modèles biomathématiques, et a permis de déterminer un certains nombres d’invariants, dans un groupe de tumeurs pourtant hétérogènes.
Tout d’abord, contrairement aux idées reçues, il n’existe pas de GDBG stable ou « non-évolutif » (terminologie pourtant fréquemment utilisée dans la littérature).
En effet, il est désormais démontré via la réalisation d’imageries par résonance magnétique (IRM) répétées avant toute sanction thérapeutique, que ces tumeurs ont une croissance régulière et inéluctable, avec évolution linéaire de leur diamètre moyen de l’ordre de 4 mm/an [2]. Cette croissance a été objectivée non seulement dans la phase symptomatique de la pathologie, i.e. suite à la première crise menant au diagnostic, mais également lors de la découverte fortuite de GDBG lors d’IRMs effectuées pour d’autres causes indépendantes (par exemple un traumatisme crânien bénin) chez des patients asymptomatiques [3]. Qui plus est, cette cinétique évolutive représente en elle-même un facteur pronostique plus fiable que les sous-types histologiques OMS (astrocytomes, oligodendrogliomes, oligoastrocytomes) au sein du vaste groupe des GDBG [4]. De plus, au-delà de leur croissance locale, ces tumeurs infiltrantes migrent progressivement le long des faisceaux de substance blanche [5], ce qui peut déboucher sur une invasion plurilobaire au sein d’un hémisphère, mais aussi sur une extension contro-hémisphérique via le corps calleux.
Enfin, ces gliomes dits « de bas grade » (sous-entendu de malignité) ont une tendance quasiment irrépressible à se transformer en gliome de haut grade, à savoir une véritable tumeur anaplasique qui menacera le pronostic fonctionnel puis vital dans un délai de quelques années suite au premier symptôme [1].
Cette meilleure compréhension récente du comportement biologique des GDBG a engendré une modification radicale de la prise en charge thérapeutique, en évoluant d’une attitude attentiste dans les décennies précédentes vers une stratégie active et dynamique [6]. Le principe consiste à combiner voire répéter de façon séquentielle plusieurs traitements complémentaires type chirurgie(s), chimiothérapie(s) et radiothérapie, dans le but non pas de prétendre guérir cette pathologie diffuse du système nerveux central, mais afin de limiter le risque évolutif, d’invasion et surtout de transformation anaplasique — directement lié au volume tumoral [7] — et ainsi augmenter significativement les médianes de survie. Dans ce contexte actuel résolument interventionniste, la chirurgie a vu un regain majeur d’intérêt depuis une dizaine d’années dans la prise en charge des patients porteurs de GDBG, le dilemme restant toutefois de majorer les étendues des résections lésionnelles tout en préservant la qualité de vie [8]. De nouvelles avancées tant sur le plan méthodologique que conceptuel ont récemment vu le jour, permettant d’optimiser le ratio bénéfices/ risques de la chirurgie : ces développements vont faire l’objet de la présente revue en considérant à la fois les aspects oncologiques et fonctionnels.
L’impact oncologique de la chirurgie des GDBG
Le débat concernant l’impact de la résection chirurgicale sur l’histoire naturelle des GDBG a été source d’une importante controverse pendant plusieurs décennies.
Toutefois, une méta-analyse récente de la littérature (1990-2007) a montré que la chirurgie « maximaliste » majorait la survie globale de 29,4 mois (90,5 avec opération versus 61,1 mois sans opération) [9]. Qui plus est, l’impact réel de l’intervention est très certainement sous-estimé, en raison du fait que la vaste majorité des séries n’a pas objectivement évalué l’étendue de la résection via une IRM post-opératoire avec quantification du résidu tumoral. Ceci signifie en effet que de nombreuses exérèses ont été subjectivement qualifiées de « complètes » par le chirurgien malgré une infiltration péri-cavitaire, expliquant la ré-évolution tumorale et débouchant ainsi sur une interprétation erronée d’absence d’efficacité de la « résection totale ».
De fait, il est crucial de souligner qu’une plus grande rigueur méthodologique basée sur une mesure systématique du volume d’hypersignal FLAIR sur l’IRM post-chirurgicale a permis de retrouver une corrélation statistiquement significative entre l’étendue de la résection chirurgicale et la survie globale dans l’ensemble des séries avec quantification objective du pourcentage d’exérèse [6]. En conséquence, à la lueur de ces résultats désormais convergents dès lors que le protocole d’évaluation postopératoire a été homogénéisé entre les différentes équipes, la polémique est en train de prendre fin, comme en témoigne la publication récente des recommandations européennes concernant la prise en charge des GDBG : celle-ci stipule clairement que « la résection chirurgicale représente la première option thérapeutique, dans le but de réséquer maximalement la tumeur chaque fois que possible, tout en minimisant la morbidité postopératoire »[10].
Le principe de cyto-réduction chirurgicale ayant donc été avalisé, et ce malgré l’absence d’étude prospective randomisée de phase III actuellement devenue nonéthique compte-tenu de la robustesse ainsi que de la reproductibilité des résultats des séries rétrospectives et prospectives non randomisées, le but devient à l’heure actuelle d’opérer le plus largement et le plus précocement possible suite à la découverte d’un GDBG. Comme ces gliomes ne correspondent toutefois pas à une « masse tumorale » refoulant le parenchyme mais bien à une maladie cérébrale invasive (même si bien souvent loco-régionale, du moins dans la phase initiale de la pathologie), les concepts sous-tendant la chirurgie d’exérèse qui vise in fine à enlever une partie du système nerveux central envahi ont dû être radicalement revisités. La double problématique antagoniste est en effet de respecter la règle universelle « primum non nocere » selon ses deux éclairages, i.e. ne pas nuire du fait de l’intervention elle-même, tout particulièrement chez des patients jeunes profitant d’une vie active avant tout traitement, mais ne pas nuire non plus par inaction en laissant évoluer une pathologie qui reste d’un pronostic gravissime dès que la transformation anaplasique survient.
Préservation de la qualité de vie : le rôle de la chirurgie éveillée avec cartographie fonctionnelle
Alors que le principe d’une exérèse maximaliste semblerait être une priorité absolue selon les résultats oncologiques énoncés ci-dessus, la chirurgie étendue peut néanmoins être limitée en raison du fait que les GDBG infiltrent souvent les zones cérébrales fonctionnelles, au premier chef l’aire motrice supplémentaire ou le lobe insulaire, mais également les régions langagières et cognitives au sens large [11]. En conséquence, en tenant compte d’une importante variabilité anatomo-fonctionnelle interindividuelle largement démontrée par l’imagerie fonctionnelle, chez les sujets sains [12] et a fortiori chez les patients porteurs de tumeurs cérébrales [13], expliquant pourquoi les repères anatomiques sont certes cruciaux mais toutefois non suffisants pour une chirurgie cérébrale optimale, des techniques de cartographie péri- et per-opératoires ont été développées ces dernières années. Tout d’abord, l’imagerie fonctionnelle d’activation (IRM fonctionnelle) a rendu possible la détection des structures corticales dites « éloquentes » de façon non-invasive lors de la réalisation d’une tâche spécifique. Cependant, il faut insister sur le fait que cette méthode manque encore de fiabilité, tout particulièrement dans le cadre des gliomes, du fait d’un découplage neurovasculaire, avec une sensibilité seulement de l’ordre de 71 % pour la motricité et de 66 % pour le langage [14]. Par ailleurs, l’imagerie fonctionnelle est incapable de différencier les sites essentiels pour la fonction, donc à respecter impérativement durant l’intervention, de ceux activés car impliqués dans le réseau mais pourtant compensables — par conséquent pouvant être réséqués avec récupération fonctionnelle à la clé tout en optimisant l’ablation tumorale. Dans le même état d’esprit, l’essor récent de l’imagerie par tenseur de diffusion, permettant la tractographie des principaux faisceaux de substance blanche (et donc jouant un rôle majeur tant sur le plan didactique que pour la recherche en neurosciences) n’est cependant pas suffisamment fiable à l’heure actuelle à l’échelon individuel. Ceci est lié au fait que cette technique se base sur des reconstructions biomathématiques, et que les résultats peuvent dépendre du modèle utilisé, en particulier concernant les fibres impliquées dans le langage — fiabilité de l’ordre de 82 % [15]. De plus, il est important de rappeler que la tractographie ne donne qu’une image anatomique, mais en aucun cas ne renseigne sur le plan de la fonction des faisceaux de substance blanche.
Ces limitations actuelles de l’imagerie ont débouché sur le renouveau d’une méthode chirurgicale ancienne, initialement popularisée par Penfield dans les années 1930 [16] puis tombée en désuétude du fait des progrès de l’anesthésie, à savoir la résection de lésions cérébrales chez des patients opérés éveillés, dans le but de cartographier à l’aide de stimulations électriques les structures fonctionnelles cruciales à l’échelon individuel. Le principe est basé sur une inactivation transitoire des zones corticales et sous-corticales (substance blanche et noyaux gris centraux) essentielles pour la fonction, à savoir à l’origine d’une perturbation pendant quelques secondes des tâches effectuées en continu par le patient sur la table opératoire, lorsque ces zones sont stimulées par un train d’ondes électriques (60 Hz, 1 msec, 1 à 4 mA) mimant une véritable « lésion virtuelle » [17]. Les sites ainsi identifiés avant la corticectomie puis au fur et à mesure de l’ablation tumorale sont de fait préservés (même si éventuellement infiltrés par un résidu de GDBG) afin de ne pas altérer la qualité de vie du patient. Les résections sont, sur la base de ce nouveau concept, non plus effectuées selon des limites oncologiques et/ou anatomiques, mais bien selon des limites fonctionnelles cortico-sous-corticales individuelles. Ce principe implique soit de laisser du gliome envahissant des structures neuro-synaptiques fonctionnellement essentielles dans certains cas de tumeurs très diffuses, soit à l’inverse de continuer à enlever du parenchyme cérébral parfois au-delà des délimitations tumorales démontrées par l’imagerie (à savoir, tant que les aires « éloquentes » non pas été atteintes) lorsque les GDBG sont situés à côté voire à distance des zones fonctionnelles — débouchant alors sur la réalisation d’une résection « supracomplète », justifiée par le fait que des cellules gliales tumorales isolées existent dans une marge de 5 mm à 2 cm autour de l’hypersignal FLAIR montré par l’IRM [18].
La balance idéale entre les impératifs oncologiques et fonctionnels peut alors être trouvée pour chaque patient, optimisant le ratio bénéfices/risques de l’intervention [19], comme détaillé dans le paragraphe sur les résultats.
Le concept d’hodotopie
L’utilisation de ces techniques de cartographie fonctionnelle a par ailleurs rendu possible une meilleure compréhension des bases neurales sous-tendant les différentes fonctions neurologiques, connaissance cruciale tant pour les neurosciences cognitives que pour leur application clinique, en particulier concernant la neurochirurgie cérébrale. Ainsi, les résultats récents issus de ces recherches ont démontré que la vision « localisationniste » de l’organisation du système nerveux central, qui avait prévalu pendant plus d’un siècle, à savoir une aire correspondant à une fonction (par exemple la région de Broca correspondant la « l’aire de la production du langage oral ») n’était en aucun cas le reflet du fonctionnement cérébral réel, et qu’il était donc temps d’évoluer vers une vision « hodotopique » [20, 21]. Selon ce modèle (du grec, hodos = voies ; topos = localisation), le cerveau est en fait constitué de réseaux parallèles distribués, qui incluent à la fois des régions corticales susceptibles de travailler de façon synchrone, et interconnectées par des faisceaux cortico-corticaux (« connectivité horizontale »), mais également des structures sous-corticales modulatrices (notamment les noyaux gris centraux) connectées au cortex par une « connectivité verticale ». Dans ce concept hodotopique, même si des sites anatomiques parfaitement bien individualisés au sein d’un réseau complexe peuvent démontrer une certaine spécialisation (toutefois non absolue) pour différents aspects d’une fonction donnée, un seul domaine tel que le langage ou l’émotion peut être perturbé par une lésion d’une ou plusieurs aires appartenant à ce réseau. Qui plus est, une même aire peut être impliquée dans différents sous-réseaux, et donc différentes sous-fonctions [22].
Si de telles considérations pourraient de prime abord paraître ésotériques, il faut pourtant insister sur leur utilité très pratique au bloc opératoire, en particulier pour la chirurgie des GDBG [23]. Ainsi, à l’échelon cortical, il a dorénavant été démontré grâce aux stimulations per-opératoires que la région dite de « Broca » n’était pas « l’aire de la production de la parole », mais que cette fonction était en fait soustendue par un circuit plus complexe impliquant notamment le cortex prémoteur ventral (à savoir la partie latérale du gyrus précentral), le gyrus supramarginalis, la partie latérale du faisceau longitudinal supérieur (connectant ces deux aires corticales entre elles), l’insula antérieure et le putamen (reliés au cortex prémoteur ventral et supramarginal par des fibres verticales) [20, 24-27]. Au-delà des aspects articulatoires, les cartographies per-chirurgicales ont également étayé l’existence d’une double voie dans le langage, à savoir une voie dorsale impliquée dans le traitement phonologique et sous-tendue par la partie profonde du faisceau longitudinal supérieur (i.e. le faisceau arqué) [28] ainsi qu’une voie ventrale impliquée dans le traitement sémantique de l’information, et elle-même constituée par deux sousréseaux direct et indirect [20, 29]. La voie directe est sous-tendue par le faisceau occipito-frontal inférieur [30] tandis que la voie indirecte est représentée par le faisceau longitudinal inférieur, qui fait un relais au niveau du pôle temporal, pour ensuite se connecter aux régions orbito-frontales via le faisceau unciné [31]. De même, des réseaux distribués incluant le gyrus frontal inférieur gauche, la partie postérieure du gyrus temporal supérieur et le faisceau longitudinal supérieur ont été montrés comme supportant la faculté de changer volontairement de langue, par exemple de passer d’une langue maternelle à une langue étrangère [32]. De nouveaux faisceaux, possiblement impliqués dans le langage chez l’homme, ont été récemment décrits sur la base des stimulations sous-corticales, comme par exemple le faisceau longitudinal moyen [33]. Le rôle de l’hémisphère droit dans le langage a également été reconsidéré du fait des résultats des cartographies pendant les chirurgies éveillées portant sur des GDBG à droite, tant chez des patients gauchers ou ambidextres [34] que droitiers — des cas d’aphasie croisée ayant été observés en per-opératoire [35].
Il est à souligner que par delà le langage, incluant également la syntaxe [36] ou l’écriture [37], les mêmes observations concernant les autres fonctions neurologi- ques, à savoir sous-tendues par des circuits distribués, ont pu être reproduites et utilisées pendant les chirurgies cérébrales. Notamment, des réseaux complexes ont été identifiés comme à l’origine de la cognition spatiale (incluant en particulier le gyrus supramarginalis et une partie du faisceau longitudinal supérieur droit) [38], des fonctions sensorimotrices [39], de la vision [40], du calcul [41] et des fonctions exécutives telles que la mémoire de travail [25], le contrôle cognitif [27] ou encore l’intégration pluri-modale voire le jugement [42] — pour n’en citer que quelques unes. La question posée est désormais de savoir quels sont les tests à sélectionner pour la phase de cartographie per-chirurgicale pour chaque patient, afin de préserver sa qualité de vie conditionnée par son travail, ses passions, ses loisirs, etc, tout en ne négligeant pas les aspects émotionnels et comportementaux (empathie, théorie de l’esprit, cognition spatiale) mais tout en se donnant paradoxalement le maximum de chances d’enlever le plus possible de cerveau infiltré par le GDBG [43]. L’intégration récente du concept dynamique de plasticité cérébrale a joué un rôle majeur dans la résolution de ce dilemme poussant à choisir entre les médianes de survie d’un côté et la qualité de vie de l’autre, puisqu’il est désormais possible d’être plus ambitieux et d’améliorer les deux.
La neuroplasticité : une ouverture vers les chirurgies séquentielles
Il a longtemps été considéré que le système nerveux central était organisé de façon rigide (à savoir avec une région cérébrale spécifique correspondant à une fonction précise, cf supra), impliquant que la lésion de cette aire engendrait inéluctablement la perte de cette fonction, et ce définitivement. De récentes observations, en particulier basées sur des résections chirurgicales massives chez des patients porteurs de GDBG, ont démontré que le cerveau était capable de se réorganiser, certaines aires ou sous-réseaux pouvant être compensées par d’autres une fois endommagées, permettant une récupération fonctionnelle de qualité [44]. Il semblerait que ce potentiel de redistribution soit facilité par la lenteur évolutive des GDBG, expliquant pourquoi les améliorations sont spectaculaires en post-opératoire, contrairement à d’autres pathologies aigues où pour un même volume et une même localisation lésionnelle que les GDBG, les déficits neurologiques sont sévères, le cas échéant de façon permanente — notamment après les accidents vasculaires cérébraux [44, 45].
Ainsi, les études en imagerie fonctionnelle lors du diagnostic de GDBG à la suite de la première crise d’épilepsie ont montré que si certaines régions restaient « éloquentes » malgré leur infiltration tumorale, une compensation pouvait toutefois avoir déjà eu lieu avant tout traitement oncologique, via un recrutement de structures périlésionnelles et/ou à distance (au sein du même hémisphère ou en controhémisphérique) [13]. Qui plus est, en per-opératoire, la répétition de cartographies électriques corticales au fur à mesure de la résection tumorale a montré de possibles réarrangements des cartes fonctionnelles en 30 à 60 minutes à peine [39]. De même, l’utilisation de l’imagerie fonctionnelle après les opérations, une fois que le patient a complètement récupéré de son intervention, a objectivé des modifications des cartes d’activation fonctionnelles en comparaison par rapport à l’imagerie pré-chirurgicale. Par exemple, à la suite de résections de GDBG infiltrant l’aire motrice supplémentaire, il est fréquent de générer un syndrome typique après l’ablation lésionnelle, associant une akinésie voire un mutisme si la lésion intéresse l’hémisphère dit « dominant » pour le langage. Toutefois, ce déficit régresse généralement en quelques jours à quelques semaines, surtout moyennant une rééducation fonctionnelle adaptée. Si une imagerie fonctionnelle est alors réalisée après récupération, et comparée aux cartes pré-chirurgicales, il est possible de constater un recrutement de l’aire motrice supplémentaire et de l’aire prémotrice controlésionnelle, expliquant la reprise d’une vie normale par le patient [46].
En utilisant ce potentiel dit de « plasticité cérébrale » à un stade encore plus avancé, il a été proposé de réopérer les patients porteurs de GDBG qui n’avaient pas pu bénéficier d’une résection remnologiquement complète lors de la première intervention, en raison d’une infiltration tumorale au niveau de zones toujours « éloquentes ». En effet, le premier acte opératoire étant lui-même générateur de réarrangement des cartes cérébrales (comme mentionné ci-dessus), potentialisé par une rééducation fonctionnelle systématique en post-chirurgical, voire par la re-croissance lente mais régulière du résidu tumoral, il est parfois possible de réaliser une seconde résection sous anesthésie locale quelques années après la première — la réorganisation fonctionnelle survenue dans l’intervalle permettant de pousser plus avant l’ablation tumorale tout en préservant la qualité de vie [47]. L’incorporation de ces concepts de plasticité et hodotopie (le potentiel plastique étant en effet conditionné par l’organisation en réseaux parallèles distribués, susceptibles de se compenser les uns les autres, du moins dans une certaine limite [48]), a permis d’ouvrir la porte de chirurgies de GDBG dans des régions cérébrales classiquement réputées comme étant « inopérables », sans pour autant générer de séquelles, par exemple l’aire de Broca, la région de Wernicke, la région centrale ou encore le lobe insulaire [49] (Figure 1).
Résultats : optimisation du ratio bénéfices / risques de la chirurgie
L’utilisation de ces concepts de cartographie individuelle, d’organisation hodotopique et de plasticité du système nerveux central a permis de trouver l’équilibre idéal entre les impératifs oncologiques et fonctionnels dans la chirurgie des GDBG. En effet, la comparaison de séries de patients opérés d’un GDBG sans versus avec cartographie fonctionnelle per-opératoire a clairement objectivé que l’utilisation des stimulations électriques en condition éveillée permettait — une augmentation statistiquement significative des indications chirurgicales dans des régions cérébrales a priori considérées comme étant « éloquentes » et donc classiquement non opérées (par exemple l’aire de Broca ou le lobe insulaire) — pour autant une minimisation significative des risques de séquelles neurologiques, à l’heure actuelle réduite à moins de 2 % alors que de l’ordre de 15 à 25 % sans utilisation de technique de cartographie — une amélioration significative de la qualité de vie des patients grâce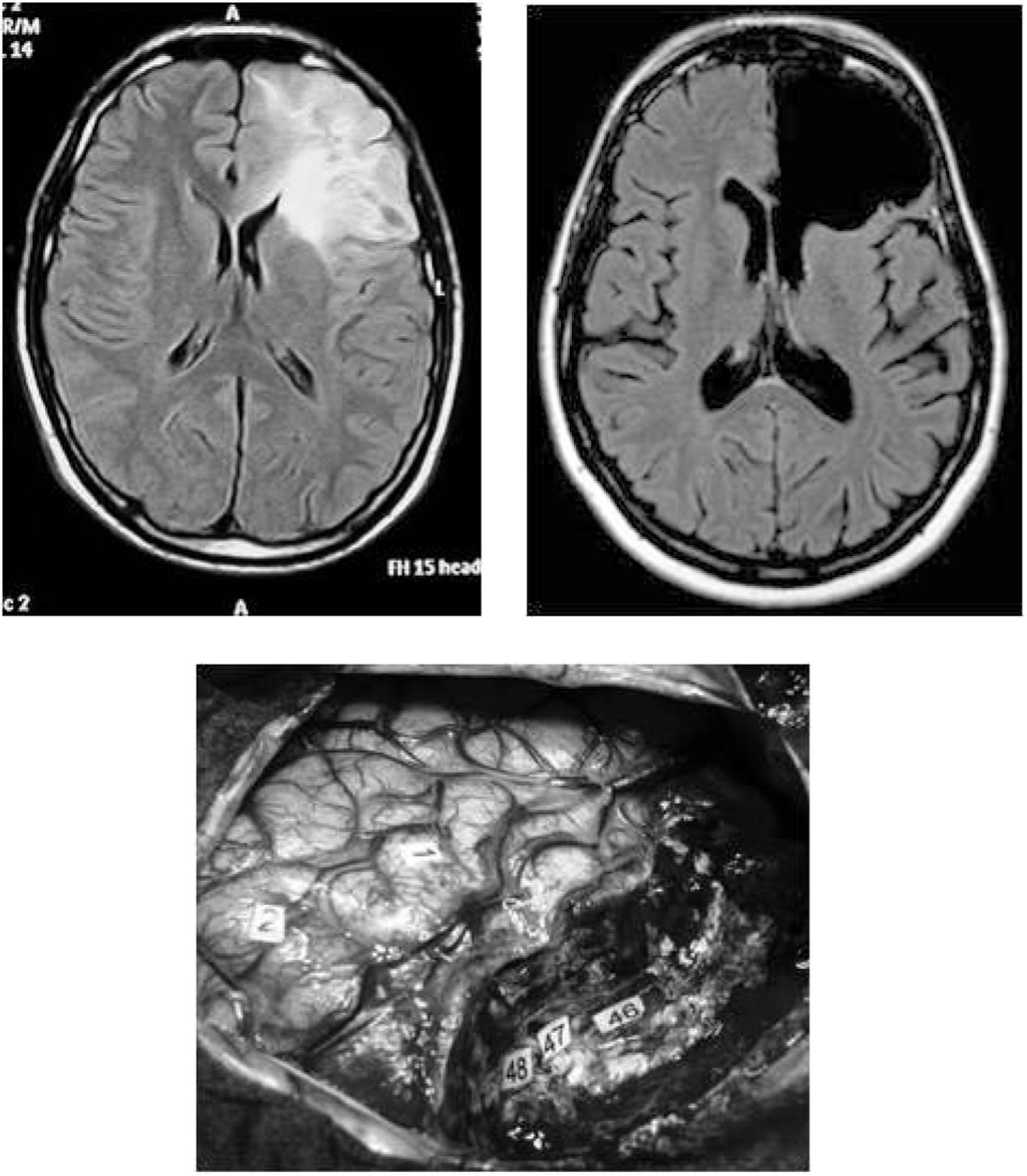
Fig. 1. — IRM pré-opératoire (dessus gauche) et post-opératoire (dessus droite) objectivant la résection complète d’après la séquence FLAIR d’un GDBG infiltrant l’ensemble du lobe frontal gauche chez un patient droitier, exérèse effectuée en condition éveillée selon des limites fonctionnelles (dessous). Le patient ne présente aucun déficit neurologique ni neuropsychologique, a repris une vie familiale, sociale et professionnelle à plein temps, malgré la lobectomie étendue.
à un contrôle de l’épilepsie dans approximativement 80 % des patients mais aussi du fait d’une rééducation fonctionnelle spécifique post-chirurgicale désormais systé- matique — et en parallèle une maximisation de l’étendue de la résection tumorale, significativement optimisée en appliquant le principe d’une ablation « selon des limites fonctionnelles cortico-sous-corticales » [19, 23, 26].
CONCLUSION
L’étude en parallèle de l’histoire naturelle d’une maladie (le GDBG) mais également des réactions que celle-ci génère au niveau de son hôte (le cerveau) a débouché sur une modification conceptuelle radicale de la neurochirurgie oncologique. Le but est dorénavant d’opérer non plus quand un déficit neurologique est apparu, mais au contraire tant que l’examen du patient est normal, donc le plus tôt possible dès que le diagnostic de GDBG est posé. Cette attitude permet de retarder la transformation anaplasique du gliome, et ainsi de majorer significativement les médianes de survie, tout en préservant la qualité de vie en utilisant le potentiel de plasticité sus-décrit.
Une telle stratégie n’est toutefois possible qu’en s’adaptant aux cartes fonctionnelles individuelles à la fois corticales et sous-corticales, via l’éveil des patients en peropératoire, dans le but de réaliser des résections maximalistes selon des limites fonctionnelles — et de préserver les sites fonctionnellement cruciaux au sein des réseaux. Il est aussi envisageable d’adopter une vision dynamique en réopérant les patients plusieurs années après la première chirurgie (parfois deux voire trois fois), certes avant la transformation anaplasique du résidu tumoral, mais après que les mécanismes de plasticité aient permis une réorganisation fonctionnelle substantielle (ce qui est vérifiable en renouvelant une imagerie fonctionnelle non invasive et en la comparant aux cartes initiales). Peu à peu, grâce à cette étroite interconnexion entre les neurosciences cognitives et la neurochirurgie cérébrale, il devient possible de poser les bases de ce qui pourrait être appelée une « neurooncologie fonctionnelle », visant à optimiser à la fois la durée mais également la qualité de vie des patients porteurs de gliomes. La prochaine étape sera d’utiliser les modèles biomathématiques pour tenter de prédire le potentiel de réorganisation fonctionnelle à l’échelon individuel — et donc adapter la stratégie thérapeutique dynamique en conséquence.
BIBLIOGRAPHIE [1] Baron M.H., Bauchet L., Bernier V. et al. — Gliome de grade II. E.M.C. Neurologie, 2008, 17-210-B-20.
[2] Mandonnet E., Pallud J., Clatz O. et al. — Computational modelling of the WHO grade II glioma dynamics: principles and applications to surgical strategy.
Neurosurg. Rev. , 2008, 31, 263-269.
[3] Pallud J., Fontaine D,. Duffau H. et al. — Natural history of incidental WHO grade II gliomas.
Ann. Neurol., 2010, 68, 727-733.
[4] Pallud J., Mandonnet E., Duffau H. et al. — Prognostic value of initial magnetic resonance imaging growth rates for World Health Organization grade II gliomas.
Ann. Neurol. , 2006, 60 , 380-383.
[5] Mandonnet E., Capelle L., Duffau H. — Extension of paralimbic low grade gliomas: toward an anatomical classification based on white matter invasion patterns. J. Neurooncol., 2006, 78, 179-185.
[6] Duffau H. — Surgery of low-grade gliomas: towards a ‘‘ functional neurooncology ’’.
Curr.
Opin. Oncol., 2009, 21, 543-549.
[7] Smith J.S., Chang E.F., Lamborn K.R. et al. — Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas.
J. Clin. Oncol., 2008, 26, 1338-1345.
[8] Duffau H. — New concepts in surgery of WHO grade II gliomas: functional brain mapping, connectionism and plasticity. A review. J. Neurooncol., 2006, 79 , 77-115.
[9] Sanai N., Berger M.S. — Glioma extent of resection and its impact on patient outcome.
Neurosurgery , 2008, 62 , 753-764.
[10] Soffietti R., Baumert B.G., Bello L. et al. — Guidelines on management of low-grade gliomas: report of an EFNS-EANO Task Force.
Eur. J. Neurol. 2010, 17, 1124-1133.
[11] Duffau H., Capelle L. — Preferential brain locations of low-grade gliomas: comparison with glioblastomas and review of hypothesis. Cancer, 2004, 100, 2622-2626.
[12] Vigneau M., Beaucousin V., Hervé P.Y. et al. — Meta-analysing left hemisphere language areas: phonology, semantics, and sentence processing.
Neuroimage , 2006, 30 , 1414-1432.
[13] Duffau H. — Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumour and brain plasticity. Lancet Neurol. , 2005, 4 , 476-486.
[14] Duffau H. — Brain mapping: from neural basis of cognition to surgical applications. Duffau H. (Ed), Springer Publisher, in press.
[15] Leclercq D., Duffau H., Delmaire C. et al. — Comparison of diffusion tensor imaging tractography of language tracts and intraoperative subcortical stimulations.
J. Neurosurg., 2010, 112 , 503-511.
[16] Penfield W., Bolchey E. — Somatic motor and sensory representation in the cerebral cortex of man as studied by electrical stimulation. Brain , 1937, 60, 389-443.
[17] Duffau H. — Contribution of cortical and subcortical electrostimulation in brain glioma surgery: methodological and functional considerations. Neurophysiol. Clin., 2007, 37, 373-382.
[18] Pallud J., Varlet P., Devaux B. et al. — Diffuse low-grade oligodendrogliomas extend beyond MRI-defined abnormalities.
Neurology, 2010, 74, 1724-1731.
[19] Duffau H., Lopes M., Arthuis F. et al. — Contribution of intraoperative electrical stimulations in surgery of low-grade gliomas: a comparative study between two series without (1985- 1996) and with (1996-2003) functional mapping in the same institution. J. Neurol. Neurosurg.
Psychiatry , 2005, 76, 845-851.
[20] Duffau H. — The anatomo-functional connectivity of language revisited: new insights provided by electrostimulation and tractography. Neuropsychologia , 2008, 4, 927-934.
[21] Duffau H. — Surgery of gliomas in eloquent areas: from brain hodotopy and plasticity to ‘‘ functional neurooncology ’’. Neurosurg. Focus., 2010, 28 , 2.
[22] Mesulam M.M. — Large-scale neurocognitive networks and distributed processing for attention, language, and memory. Ann. Neurol., 1990, 28, 597-613.
[23] De Benedictiss A., Moritz-Gasser S., Duffau H. — Awake mapping optimizes the extent of resection for low grade gliomas in eloquent areas. Neurosurgery , 2010, 66, 1074-1084.
[24] Duffau H., Capelle L., Denvil D. et al. — The role of dominant premotor cortex in language:
a study using intraoperative functional mapping in awake patients.
Neuroimage, 2003, 20 , 1903-1914.
[25] Duffau H., Gatignol P., Denvil D. et al. — The articulatory loop: study of the subcortical connectivity by electrostimulation.
Neuroreport, 2003, 14 , 2005-2008.
[26] Duffau H. — A personal consecutive series of 51 patients operated on for an insular WHO grade II glioma: advances and limitations. J. Neurosurg., 2009, 110, 696-708.
[27] Gil Robles S., Gatignol P., Capelle L. et al. — The role of dominant striatum in language:
a study using intraoperative electrical stimulations.
J. Neurol. Neurosurg. Psychiatry, 2005, 76, 940-946.
[28] Duffau H., Capelle L., Sichez N. et al. — Intraoperative mapping of the subcortical language pathways using direct stimulations. An anatomo-functional study.
Brain, 2002, 125 , 199-214.
[29] Duffau H., Gatignol P., Mangonnet E. et al. — Contribution of intraoperative subcortical stimulation mapping of language pathways: a consecutive series of 115 patients operated on for a WHO grade II glioma in the left dominant hemisphere. J. Neurosurg., 2008, 109, 461-471.
[30] Duffau H., Gatignol P., Mandonnet E. et al. — New insights into the anatomo-functional connectivity of the semantic system: a study using cortico-subcortical electrostimulations.
Brain , 2005, 128, 797-810.
[31] Mandonnet E., Nouet A., Gatignol P. et al. — Does the left inferior longitudinal fasciculus play a role in language? A brain stimulation study.
Brain, 2007, 130, 623-629.
[32] Moritz-Gasser S., Duffau H. — Evidence of a large-scale network underlying language switching: a brain stimulation study. J. Neurosurg., 2009, 111, 729-732.
[33] De Witt Hamer P., Moritz-Gasser S., Gatignol P. et al. — Is the human left middle longitudinal fascicle essential for language? A brain electrostimulation study.
Hum. Brain Mapp., in press.
[34] Duffau H., Leroy M., Gatignol P. — Cortico-subcortical organization of language networks in the right hemisphere: an electrostimulation study in left-handers. Neuropsychologia, 2008, 46 , 3197-209.
[35] Vassal M., Le Bars E., Moritz-Gasser S. et al. — Crossed aphasia elicited by cortical and subcortical stimulation in awake patients.
J. Neurosurg., in press.
[36] Garbizu Vidoretta, Garcia R., Moritz-Gasser S. et al. — Double dissociation between syntactic gender and picture naming processing: a brain stimulation mapping study.
Hum. Brain Mapp., in press [37] Scarone P., Gatignol P., Guillaume S, et al. — Agraphia following awake surgery for brain tumour: new insights into the anatomo-functional network of writing.
Surg. Neurol., 2009, 72, 223-241.
[38] Thibaut de Schotten M., Urbanski M., Duffau H. et al . — Direct evidence for a parietalfrontal pathway subserving spatial awareness in humans.
Science , 2005, 309 , 2226-2228.
[39] Duffau H. — Acute functional reorganisation of the human motor cortex during resection of central lesions: a study using intraoperative brain mapping. J. Neurol. Neurosurg. Psychiatry , 2001, 70, 506-513.
[40] Duffau H., Velut S., Mitchell M.C. et al. — Intraoperative mapping of the subcortical visual pathways using direct electrical stimulations.
Acta Neurochir (Wien), 2004, 146, 265-270.
[41] Duffau H., Denvil D., Lopes M. et al. — Intraoperative mapping of the cortical areas involved in multiplication and subtraction: an electrostimulation study in a patient with a left parietal glioma. J. Neurol. Neurosurg. Psychiatry, 2002, 73, 733-738.
[42] Plaza M., Gatignol P., Cohen H. et al. — A discrete area within the left dorsolateral prefrontal cortex involved in visual-verbal incongruence judgment.
Cereb. Cortex 2008, 18, 1253-1259.
[43] Duffau H. — Awake surgery for non-language mapping.
Neurosurgery, 2010, 66, 523-529.
[44] Desmurget M., Bonnetblanc F., Duffau H. — Contrasting acute and slow growing lesions:
a new door to brain plasticity. Brain, 2007, 130, 898-914.
[45] Keidel J.L., Welbourne S.R., Lambon Ralph M.A. — Role of the healthy hemisphere in recovery after resection of the supplementary motor area. Neurology , 2004, 62 , 1323-1332.
[46] Krainik A., Duffau H., Capelle L. et al. — Role of the healthy hemisphere in recovery after resection of the supplementary motor area.
Neurology , 2004, 62 , 1323-1332.
[47] Gil Robles S., Duffau H. — Surgical management of WHO grade II gliomas in eloquent areas: Is the preservation of a margin necessary around functional structures? Neurosurg. Focus , 2010, 28 : E8.
[48] Duffau H. — Does post-lesional subcortical plasticity exist in the human brain?
Neurosci. Res., 2009, 65, 131-135, 2009.
[49] Duffau H. — Brain plasticity and tumors.
Adv. Tech. Stand. Neurosurg., 2008, 33, 3-33.
DISCUSSION
M. Alain PRIVAT
Votre approche chirurgicale chez le patient éveillé permet-elle, ou pourra-t-elle permettre de différencier une plasticité fonctionnelle, détectable en per-opératoire, et une plasticité structurale plus tardive et à plus long terme ?
La plasticité fonctionnelle a en effet été objectivée en peropératoire par les stimulations électriques répétées au fur et à mesure des exérèses tumorales via l’observation de modifications des cartes corticales avant et après résection. Du fait du caractère aigu de ces réorganisations (quelques minutes), le mécanisme sous-jacent est probablement lié à un démasquage de redondances fonctionnelles du fait de la levée de l’inhibition intracorticale induite par l’acte opératoire, susceptible de générer une hyperexcitabilité loco-régionale.
La plasticité structurale plus tardive a, quant à elle, été illustrée par la réalisation d’imageries fonctionnelles longitudinales, en pré- et post-interventionnel, notamment à la suite de déficits neurologiques transitoires dans les suites immédiates de la chirurgie, avec récupé- ration au bout de quelques semaines (par exemple syndrome de l’aire motrice supplémentaire). L’imagerie postopératoire plusieurs mois après l’exérèse a ainsi démontré le recrutement d’aires homologues au niveau de l’hémisphère controlatéral, participant à la compensation fonctionnelle et expliquant l’absence de déficit neurologique permanent sur le long terme malgré l’ablation d’une aire cérébrale a priori considérée comme « éloquente » (levée d’inhibition transcalleuse). Les mécanismes sous-tendant une telle redistribution pourraient impliquer une « reconnectivité » au moins à l’échelon synaptique, avec un rôle potentiel des cellules souches rendant la neurogenèse possible y compris chez l’adulte. Ces cellules progénitrices pourraient également participer à la gliomagenèse, ce qui expliquerait pourquoi les gliomes sont souvent localisés en zones cérébrales fonctionnelles. Des études translationnelles visant à analyser la participation réelle de ces cellules pluripotentes à la fois dans la physiologie (plasticité) et la pathologie (tumeur cérébrale) sont actuellement en cours, afin de mieux comprendre la pathogénie des interactions dynamiques entre l’histoire naturelle des lésions du système nerveux central et le potentiel plastique réactionnel. Il s’agit notamment d’un des projets de recherche principaux dans le cadre de notre équipe Inserm « Plasticité cérébrale, cellules souches humaines et tumeurs gliales » (U1051, Institut des Neurosciences de Montpellier).
M. Jean-Jacques HAUW
La question a été posée de la signification de l’imagerie fonctionnelle en IRM : distinguet-elle bien les variations de la vascularisation cérébrale de celles du fonctionnement du tissu cérébral lui-même ? Qu’en pensez-vous à la lumière de vos observations per-opératoires ?
L’IRM fonctionnelle est basée sur les variations de débits sanguins cérébraux régionaux lors de la réalisation d’une tâche par rapport à un état dit « de repos » (qui reste à définir en terme de bases neurales). De fait, il ne s’agit que d’un reflet très indirect du fonctionnement neurono-synaptique, ce qui soulève plusieurs problèmes. Le premier est celui d’un possible découplage neuro-vasculaire, tout particulièrement dans le cadre de tumeurs gliales, le métabolisme de l’astrocyte jouant un rôle crucial dans l’interface entre l’activité neurono-synaptique et les réactions hémodynamiques. De plus, sur le plan méthodologique, le traitement des images peut déboucher sur des cartes fonctionnelles in fine différentes en fonction du modèle bio-mathématique utilisé. En ce sens, le choix du seuil statistique reste à l’heure actuelle objet de controverse. Enfin, l’IRM fonctionnelle est dans l’incapacité de différencier les structures essentielles pour la fonction, donc à préserver impérativement durant l’intervention chirurgicale pour éviter toute séquelle, de celles compensables et qui peuvent par conséquent être enlevées afin d’optimiser l’étendue de la résection (et donc les médianes de survie) tout en préservant la fonction. En d’autres termes, cette technique d’imagerie est fondamentale en neurosciences cognitives pour améliorer la compréhension des fondations neurales qui sous-tendent les principales fonctions cérébrales, ainsi que pour le suivi longitudinal du patient avant et après exérèse (notamment pour objectiver une éventuelle réorganisation fonctionnelle), mais ne permet en aucun cas de planifier de façon fiable une intervention chirurgicale à un instant donné chez un patient donné. C’est la raison pour laquelle une cartographie per-opératoire en temps-réel chez le patient éveillé se doit d’être impérativement réalisée si l’on souhaite optimiser le ratio bénéfice/risque de l’opération, tout particulièrement en zones cérébrales éloquentes. Les comparaisons entre l’imagerie fonctionnelle pré- chirurgicale et les résultats des stimulations électriques per-opératoires ont clairement démontré que l’IRM fonctionnelle n’avait actuellement qu’une fiabilité toute relative, de l’ordre uniquement de 70 % concernant les fonctions cognitives (par exemple le langage).
M. François-Bernard MICHEL
Si l’exploration fonctionnelle per-opératoire est systématique dans votre pratique ? Comment associez- vous, lors de l’exérèse, vos données de bilan pré-opératoire (imagerie) et les données fonctionnelles sur table ?
Du fait du manque de fiabilité des techniques d’imagerie fonctionnelle (cf réponse à la question précédente), je ne réalise à l’heure actuelle une imagerie pré-chirurgicale que pour pouvoir bénéficier d’une référence pour le suivi ultérieur, à savoir objectiver d’éventuels mécanismes de plasticité cérébrale via des IRM fonctionnelles non-invasives répétées à la suite de la première opération. En effet, de telles réorganisations peuvent le cas échéant ouvrir la porte d’une seconde chirurgie dans le but de maximiser la résection tumorale si d’aventure l’exérèse n’avait pas pu être complète lors de la première intervention du fait de l’infiltration de zones alors éloquentes. Toutefois, en per-opératoire, je n’utilise pas directement ces données, le principe étant d’effectuer une résection selon des limites fonctionnelles prodiguées en temps-réel par les résultats des cartographies électriques corticales et sous-corticales chez le patient éveillé. Le principe est basé sur l’induction d’une lésion virtuelle transitoire par les stimulations, le recueil des conséquences fonctionnelles potentielles étant assuré par un(e) orthophoniste et/ou neuropsychologue au bloc opératoire tout au long de l’exérèse. Cette méthode est très fiable, comme en témoigne l’amélioration significative des résultats à la fois fonctionnels et oncologiques depuis une dizaine d’années. Par ailleurs, elle sert de validation vis-à-vis des techniques d’imagerie (IRM fonctionnelle et tractographie par tenseur de diffusion), les corrélations entre les résultats pré- et per-opératoires n’étant dans mon expérience effectuées qu’à posteriori, une fois la chirurgie terminée.
M. Emmanuel-Alain CABANIS
Vous avez évoqué les voies visuelles à travers l’hémianopsie latérale homonyme dès son début. Puis, vous avez évoqué le faisceau longitudinal inférieur et occipito-frontal en fin d’exposé. Qu’en est-il des gliomes postérieurs, occipitaux, ou bilatéraux transcalleux ? Quel est le degré de plasticité visuelle vers les autres localisations, notamment cognitives ?
Tout d’abord, il faut préciser que pour une raison encore obscure, les gliomes (notamment dits de bas grade) sont très rares en région occipitale. Néanmoins, chez ces quelques patients, il nous a été possible de développer des tests per-opératoires permettant de détecter les voies visuelles, soit par excitation (induction de phosphènes), soit par inhibition (déficit transitoire du champ visuel) lors des stimulations des radiations optiques. De fait, il est désormais envisageable avec une fiabilité de l’ordre de 95 % de ne pas induire d’hémianopsie latérale homonyme en per-chirurgical, car nous savons que ce déficit campimétrique est définitif, sans compensation neurologique possible, débouchant sur des conséquences fonctionnelles et en particulier sociales non négligeable (par exemple l’impossibilité de conduire). Concernant les fonctions visuelles de plus haut niveau cognitif, tout particulièrement la lecture, nous avons démontré que la partie postérieure du faisceau longitudinal inférieur du côté « dominant » était cruciale pour véhiculer l’information visuelle du cortex occipital à l’aire visuelle de reconnaissance de la forme des objets et des mots (localisée au niveau de la jonction temporo-occipitale basale). Une lésion de ce faisceau génère inéluctablement une alexie assimilable à un véritable syndrome de dysconnexion, sans récupération possible. Par contre, savoir si en cas de lésion de l’aire corticale de reconnaissance des objets et mots, d’où partent à la fois le faisceau longitudinal supérieur (voie dorsale), une portion du faisceau occipito-frontal inférieur (voie ventrale directe) et la partie antérieure du faisceau longitudinal inférieur (voie ventrale indirecte), des mécanismes de plasticité permettraient une compensation grâce au recrutement de l’homologue cortical controlatéral via les voies transcalleuses reste sujet à débat.
Bull. Acad. Natle Méd., 2011, 195, no 1, 37-51, séance du 18 janvier 2011


