Résumé
L’allélotypage de cancers colorectaux et de métastases hépatiques est réalisé depuis 1996 au CHU de Strasbourg par une collaboration entre chirurgiens, anatomo-pathologistes et biologistes moléculaires. La caractérisation moléculaire des prélèvements tumoraux comparés au tissu sain à distance et aux leucocytes permet de proposer un profil à risque chez des patients dont la tumeur est classée A/B1 et de sélectionner des tumeurs pouvant permettre d’identifier les différentes voies de cancérisation. L’allélotypage de métastases hépatiques de cancers colorectaux montre la présence d’un nombre très élevé de régions chromosomiques remaniées. Des remaniements présents exclusivement soit dans la tumeur initiale soit dans une métastase hépatique démontrent l’existence de clones cellulaires tumoraux ayant évolué parallèlement. L’existence de remaniements affectant indépendamment l’un ou l’autre des chromosomes parentaux permet de proposer que des structures chromosomiques seraient sensibles aux mécanismes d’instabilité chromosomique. L’identification des régions très fréquemment simultanément réarrangées doit permettre de proposer un ensemble restreint de cibles thérapeutiques qui agiraient simultanément sur la grande majorité des tumeurs.
Summary
Systematic allelotyping of colorectal cancers and liver metastases is realized since 1996 in a close collaboration between the surgery, pathology departments and the molecular biology laboratory. Using amplification of 35 different microsatellites allelic imbalances and microsatellites instabilities were recorded. Beside the well documented increasing amount of genomic rearrangements we identified a subset of early stages tumors presenting a profile of rearrangement corresponding to high grades, and high grades cancers with a molecular profile corresponding to low grade. The comparison of synchrones liver metastases and colorectal tumors allowed us to propose for a more extensive studies the existence of sensitive structural chromosomic regions affecting separately both chromosomes and that it should be possible to identify a limited number of specific genes concerned by most of the advanced stages.
INTRODUCTION
Dans les pays occidentaux, le cancer du colon est la plus fréquente des affections malignes chez les non-fumeurs et la seconde cause de mortalité par cancer après le cancer du poumon. Les données d’incidence fournies par le réseau français des registres de cancer permettent d’estimer à 33 000 le nombre de nouveaux diagnostics de cancer colorectal par an et 16 000 décès par an sont attribués à cette maladie. Les chiffres des Etats-Unis sont de 135 000 nouveaux cas et 55 000 décès par an.
L’incidence est pratiquement égale dans les deux sexes, touchant la plupart du temps la personne âgée. Parce que seulement 37 % des cancers colorectaux sont détectés précocement (Astler Coller A ou B), près de 50 % des patients atteints d’un cancer colorectal en mourront dans une période de 5 ans. Les patients présentant un stade avancé (avec envahissement ganglionnaire Astler Coller C, ou métastase à distance Astler Coller D) sont de mauvais pronostic malgré la chirurgie et les protocoles de chimiothérapie. Les stades précoces sont de meilleur pronostic quoique 15-30 % des patients vont présenter des récidives et décèderont de ce cancer. Il est donc très important de pouvoir identifier les patients ne présentant pas cliniquement de forme métastasée mais qui présenteraient un haut risque de récidive. Une telle possibilité repose sur une meilleure connaissance des différents mécanismes impliqués dans le développement tumoral.
Les cancers colorectaux sont considérés comme sporadiques dans plus de 80 à 90 % des cas bien qu’il ne soit pas rare de noter plusieurs cas dans une même famille. C’est ainsi que différents facteurs de risque ont pu être identifiés sans que leur significativité ne soit encore bien déterminée : la présence de polypes du colon, le régime alimentaire, des antécédents personnels de pathologie cancéreuse, antécédents familiaux de cancers, les maladies inflammatoires du colon. D’autres facteurs sont discutés tels que le tabagisme qui provoquerait plus fréquemment le développement de polypes coliques ou l’exercice physique insuffisant.
Dans environ 3 à 5 % des cas, les cancers colorectaux sont d’origine familiale.
L’évolution naturelle du cancer colique est d’aboutir à l’envahissement des organes de voisinage par contiguïté et à la survenue de métastases dans près de 60 % des cas [1]. La dissémination métastatique atteint préférentiellement le foie (50 % des cas), qui est le premier organe rencontré par le flux veineux drainant le cancer primitif.
Sur le plan macroscopique, il s’agit généralement d’une tumeur ulcéro-bourgeonnante entraînant souvent une sténose surtout au niveau du colon gauche.
Sur le plan histologique, le cancer est d’ordinaire un épithélioma cylindrique plus ou moins différencié, parfois mucipare. L’anatomopathologie permet également de classer la tumeur.
La plus commune est la classification décrite par Dukes et modifiée par AstlerColler. La survie à 5 ans est directement corrélée à cette classification et varie de 95 % pour le stade A à 5 % pour le stade D.
Après le diagnostic précoce, un des objectifs est, si possible, d’identifier au moment du diagnostic, les patients pouvant bénéficier des nouvelles thérapies anticancéreuses et des progrès de la chirurgie hépatique. Ces deux buts ne seront accessibles que par le développement de nos connaissances sur les mécanismes de la cancérogenèse des tumeurs colorectales associant l’ensemble des différentes approches actuellement disponibles depuis les informations anatomocliniques, la cytogénétique et maintenant les approches systématiques de biologie moléculaire.
La cytométrie de flux, la cytogénétique et plus récemment l’hybridation in situ (CGH) ont permis de mettre en évidence la présence de pertes et amplifications de matériel chromosomique bien qu’à une faible résolution, difficilement réalisables systématiquement et d’un coût élevé. Ces études n’ont pas permis de dégager de profils caractéristiques informatifs utilisables en clinique. Différentes modifications génétiques ont été retrouvées dans les adénomes colorectaux ou dans les tumeurs évoluées. Ces réarrangements génomiques sont localisés principalement sur les chromosomes 1, 7, 8, 11, 13, 14, 17, 18 et 22 [2-9].
Plus récemment les approches moléculaires, issues des développements de la cartographie et du séquençage du génome humain, permettent d’amplifier et analyser les modifications de marqueurs balisant l’ensemble du génome comme la mise en évidence des mutations de gènes responsables de la cancérogenèse. L’accumulation de données provenant de nombreuses équipes et la fréquence des remaniements observée dans les cancers colorectaux, notamment dans des régions chromosomiques déjà identifiées par la cytogénétique, ont permis de proposer de nouvelles hypothèses pour la compréhension des mécanismes de la cancérogenèse et potentiellement des évolutions dans le temps des remaniements génomiques et de caractéristiques correspondantes aux différentes étapes de développement de la tumeur.
La formation et le développement des cancers colorectaux seraient dus à l’accumulation successive de plus de sept remaniements génétiques différents comme l’ont proposé deux équipes ayant des approches différentes. L’extrapolation statistique
des données logarithmiques d’âge d’apparition et de développement des tumeurs colorectales avait permis de proposer un modèle correspondant à une suite de six étapes singulières dans la cancérogenèse [10]. Expérimentalement, dès 1990 Eric Fearon et Bert Vogelstein ont proposé [11] une succession d’altérations impliquant l’apparition séquentielle de mutations dans des gènes connus ( APC, p53, K-ras puis DCC ) comme étant des gènes suppresseurs de tumeur (TSGs) ou des oncogènes [11].
Ces analyses moléculaires des cancers colorectaux ont été rapprochées des résultats de cytogénétique et ont permis de révéler des pertes fréquentes de certains segments chromosomiques au niveau du bras court du chromosome 17 (17p), du bras long du chromosome 18 (18q) et du bras long du chromosome 5 (5q). Dans ces régions chromosomiques se trouvent différents gènes impliqués dans l’apoptose et la prolifération cellulaire dont p53 sur le chromosome 17, BCL-2 sur le chromosome 18 et
APC sur le chromosome 5 [12]. Dans le cas des TSGs, la perte d’un allèle est très fréquemment associée, comme dans les cas des gènes APC et p53, à la mutation non fonctionnelle du deuxième allèle.
Ce modèle initial s’est progressivement enrichi de nombreuses études et hypothèses qui conduisent pour de nombreux cancers, en particulier l’ensemble des cancers colorectaux, aux concepts de cancérisation en champ et la polyclonalité des cancers.
Dans le premier cas, suite à l’action de cancérigènes, l’ensemble de la muqueuse présenterait des remaniements qui déboucheraient sur une sélection des clones les plus prolifératifs. Dans le deuxième cas, il y aurait présence de plusieurs clones qui évolueraient en parallèle par l’accumulation de remaniements génétiques « indépendants », le cancer étant constitué d’un ensemble de clones cellulaires dont l’importance varierait dans le temps en fonction de l’accumulation des insertions, délétions, mutations, amplifications.
Quatre formes familiales du cancer colorectal sont maintenant caractérisées.
— Le syndrome de LynchII ou HNPCC qui représente environ 2 % de l’ensemble des cancers colorectaux, maladie transmise sur le mode autosomique dominant.
Son diagnostic moléculaire correspond à la mise en évidence au niveau des cellules tumorales d’erreurs systématiques du nombre de répétitions de motifs mono ou dinucléotides tels que présents dans les microsatellites ou MIN instabilité de microsatellites. Au niveau somatique, on constate des mutations non fonctionnelles d’un des six gènes (hMLH1 3p21, hMSH2 2p22, hMSH3 5q11, hMSH6 2p16, hPMS1 2q31 et hPMS2 7p22), enzymes impliqués dans les mécanismes de réparation. Ces cancers coliques sont préférentiellement trouvés chez l’adulte jeune au niveau du colon droit et présentent un bon pronostic malgré une haute fréquence de récidive.
— La polypose adénomateuse familiale (FAP) (1 pour 10 000) caractérisée par l’existence de multiples polypes adénomateux en plaque chez l’adulte jeune dégénérant systématiquement. Ces patients (un tiers ne présentent pas de contexte familial) sont caractérisés par l’existence au niveau somatique de mutations du gène APC en 5q21. Des formes atténuées et de diagnostic difficile sont dues à des mutations distales de ce gène.
— La polypose familiale juvénile caractérisée par l’existence de 5 à 10 polypes pouvant affecter le sein, le tube digestif (le colon dans 98 % des cas) ou la thyroïde est due à une mutation du gène SMAD4 18q21.
— Le syndrome de Peutz-Jeghers représente environ un dixième des cas de polypose adénomateuse familiale et est dû à une mutation transmise du gène STK11 19p13.
Recherche de facteurs pronostiques moléculaires
Les mutations de Ki-ras surviendraient précocement dans le processus de cancérogenèse occasionnant la prolifération de clones cellulaires avant même la formation d’adénome [13]. Les mutations de TP53 sont plutôt impliquées dans la progression de l’adénome vers le cancer [14]. Ces événements mutationnels étant les moteurs de la cancérogenèse, l’hypothèse que la caractérisation de leur mutation permettrait de prédire l’évolution tumorale a été proposée. Depuis de nombreuses études ont été publiées mais avec des résultats très contradictoires.
Pour certains auteurs, les mutations de TP53 et de Ki-ras sont associées à un mauvais pronostic [15-16] alors que pour d’autres, ces mutations n’ont pas de valeur pronostique [17]. Au contraire, d’autres auteurs ont trouvé une corrélation positive entre l’hyperexpression de la protéine détectée par immunohistochimie et un meilleur pronostic [18]. Ces résultats discordants sont en partie expliqués par l’hétérogénéité des groupes étudiés mais aussi par le fait que chaque cancer résulterait d’une combinaison d’au moins six à sept remaniements successifs sans que l’on sache encore le nombre de combinaisons possibles et pour chacune l’importance de
l’ordre de chacune de ces modifications. Une telle hypothèse est étayée par l’observation qu’une même catégorie anatomoclinique est en fait très hétérogène sur le plan moléculaire [19].
Apport de l’alléllotypage systématique de tumeurs initiales
L’allélotypage correspond à l’amplification et la comparaison, entre tissu sain et cancéreux, de séquences de un à cinq nucléotides répétées plusieurs dizaines de fois et hautement polymorphes qui sont utilisées pour la cartographie du génome humain. En présence de prolifération de clones cellulaires tumoraux on observe soit la présence de pics supplémentaires (phénotype MSI, signant l’existence d’un mécanisme d’instabilité de ces microsatellites dû à un dysfonctionnement des mécanismes de réparation ou RER), soit la modification du rapport des deux pics caractérisant le caractère hétérozygote (phénotype AI ou déséquilibre allélique), signant soit la perte soit l’amplification de l’un des deux allèles. En cas de perte de l’un des deux allèles on parle de perte d’hétérozygotie (LOH). Cette technique rapide, peu onéreuse, automatisable a l’avantage de distinguer les évènements affectant l’un des deux allèles parentaux. Les cancers colorectaux de phénotype MSI ou RER représentent environ 15 % de l’ensemble des tumeurs et seraient associés à une meilleure survie quel que soit le stade de la tumeur. Ils sont moins enclins à l’apparition de métastases [20], mais le risque de développement d’une nouvelle tumeur colorectale ou d’une autre origine est augmenté.
La mise en œuvre systématique d’allélotypage de tumeurs colorectales et de métastases hépatiques en comparant plus de 35 microsatellites entre prélèvements tumoraux, tissu sain à distance et leucocytes sanguins a été mise en place par une collaboration avec les services de chirurgie générale et digestive (C. Meyer) et de chirurgie générale et endocrinienne (D. Jaeck) et le service d’anatomie-pathologique (J.P. Bellocq). Ces microsatellites ont été choisis par rapport aux régions les plus fréquemment remaniées et suivant les résultats obtenus auparavant par le groupe de G. Thomas et S. Olschwang [21]. Simultanément à l’identification du phénotype RER (ou MIN), nous avons pu ainsi progressivement accumuler des résultats sur le nombre et les associations de séquences remaniées sur environ 1 000 tumeurs colorectales caractérisées cliniquement et histologiquement.
MATÉRIEL ET MÉTHODE
Les tumeurs colorectales et métastases hépatiques opérées aux Hôpitaux Universitaires de Strasbourg ont été analysées au service d’Anatomie Pathologique Géné- rale.
Dans chaque cas, l’ADN a été extrait des cellules sanguines et de tissu sain à distance comme référence et de prélèvements tumoraux macro disséqués et contrôlés histologiquement [22]. Les 35 microsatellites amplifiés correspondent à un ensemble
informatif et initialement sélectionné par le groupe de G. Thomas [21] ciblant les chromosomes 1, 2, 3, 4, 5, 6, 8, 9, 10, 13, 15, 16, 17, 18, 20, 22.
Le protocole expérimental, la quantification et les seuils limites ont été publiés [22].
RÉSULTATS
Plus de 20 % des tumeurs colorectales A/B1 présentent un profil d’allélotypage très remanié.
Stade Astler-Coller Nombre de patients % patient % patient < 50 % AI > 50 % AI
A/B1 22 77 23
B2 24 66 33
C 27 56 44
D 25 40 60
Sur une série consécutive de 115 cancers colorectaux, nous avons identifié 17 cancers présentant le phénotype RER démontré par la présence de pics supplémentaires et donc d’une instabilité des microsatellites.
Quatre-vingt-dix-huit cancers ont présenté un phénotype LOH et le nombre des déséquilibres alléliques est résumé dans le tableau. Ces données montrent le pourcentage d’altérations observées dans les tumeurs colorectales étudiées en fonction de leur stade dans la classification d’Astler-Coller et réparties en tumeurs fortement réarrangées et tumeurs faiblement réarrangées avec cette valeur seuil fixée à 50 %.
De façon générale, nous avons observé une corrélation positive entre l’augmentation de la fréquence globale d’altérations et l’évolution tumorale du stade A au stade D d’Astler-Coller, comme attendu d’après la littérature (voir tableau ci-dessus).
Nous avons également remarqué que certaines tumeurs classées A ou B1 selon Astler-Coller, présentaient de forts taux de réarrangements. Avec notre panel de 35 microsatellites ciblant 17 chromosomes, plus de 20 % des tumeurs A/B1 présentaient plus de 50 % de réarrangements, les classant dans les tumeurs fortement remaniées.
L’identification de cette sous-population de patients présentant des cancers colorectaux précoces (A/B1) avec de forts taux de remaniements pose le problème de leur potentiel évolutif car ces tumeurs précoces présentent le même profil que les tumeurs plus avancées au potentiel évolutif plus agressif. Ces patients pourraient donc avoir un risque élevé de présenter une récidive locorégionale, la survenue de métastases ou éventuellement présenter des métastases hépatiques méconnues. Un suivi carcinologique plus rapproché et le recours à une chimiothérapie adjuvante pourraient être préconisés chez ces patients considérés par la seule classification d’Astler-Coller comme des patients au bon pronostic, ne nécessitant aucun traite-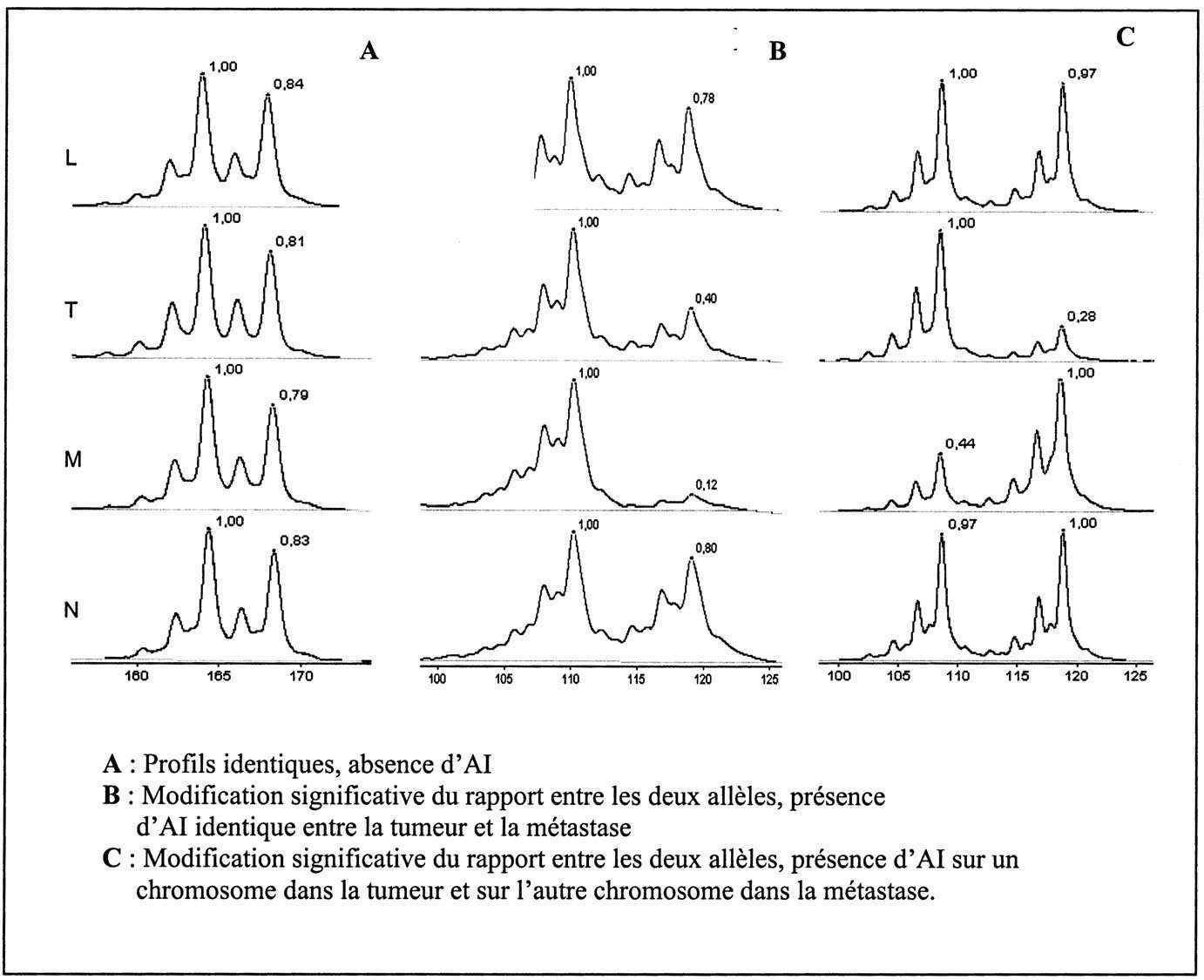 ment adjuvant. Toutefois dans cette étude, la cohorte de patients étant trop petite et le recul trop faible, aucune tendance statistique n’a pu encore être définitivement établie.
ment adjuvant. Toutefois dans cette étude, la cohorte de patients étant trop petite et le recul trop faible, aucune tendance statistique n’a pu encore être définitivement établie.
Cette étude a permis d’identifier des loci non encore impliqués dans le processus tumoral. Parmi ceux-ci, D1S305 est situé près du gène FGFR2 codant pour le récepteur décrit comme un récepteur trans-membranaire impliqué dans la croissance tumorale [23] et D2S138 situé près du gène WNT impliqué dans la régulation du gène APC [24].
Modification des 35 microsatellites dans des tumeurs colorectales et métastases hépatiques synchrones.
La comparaison des microsatellites des prélèvements de la tumeur initiale et des métastases hépatiques met en évidence l’existence de remaniements affectant un locus chromosomique (AI), le même locus mais sur l’autre allèle pouvant être réarrangé dans la métastase comme illustré ci-dessous.
Fig. 1. — Profils d’amplification de microsatellites.
Pour un même patient les profils d’électrophorèse obtenus à partir de leucocytes (L), de la tumeur (T), de la métastase hépatique (M), de tissu sain à distance (N).
Cette observation montre que les deux copies sont sensibles aux mécanismes de remaniement génétique et que chaque allèle à ce site peut être affecté indépendamment. De plus ce résultat illustre la polyclonalité de la tumeur initiale comprenant des évènements communs mais également différents pouvant toucher les mêmes régions génomiques. De tels évènements ne sont pas rares, comme le montre le Tableau 1.
L’existence de plusieurs clones cellulaires est renforcée par l’observation (fi et —/+) de déséquilibres observés soit dans la tumeur initiale soit dans les métastases hépatiques (tableau ci-dessus). Ce résultat implique également que les clones cellulaires prépondérants dans la tumeur initiale et dans la métastase peuvent évoluer indépendamment mais vraisemblablement suivant des voies identiques.
Enfin, il faut noter que certains sites comme 18q22, 16q24, 17q23,1p32, 8p23, 1q11, 8p12, 10p12, 6q14, 1p22 sont remaniés dans ces quatre cas. Cette observation permet de proposer qu’un nombre limité de sites peuvent être remaniés simultané- ment dans la plupart des cancers colorectaux métastatiques et représenteront donc des cibles privilégiées pour l’analyse de nouvelles combinaisons d’agent antitumoraux.
DISCUSSION
Existence de plusieurs voies, cibles thérapeutiques différentes
Cette étude porte sur des patients représentatifs des tumeurs colorectales primitives et des métastases hépatiques synchrones. Jusqu’à présent, elle a permis de déterminer trois types de comportement pour les métastases hépatiques synchrones. Dans un premier groupe, comme attendu d’après la littérature, la métastase présente plus d’altérations que la tumeur primitive.
Dans un second groupe, la métastase et la tumeur primitive ont accumulé une fréquence d’altérations sensiblement égale. Dans un dernier groupe, la métastase présente moins d’altérations que la tumeur primitive. L’étude de tumeurs représentatives de ces différents groupes devrait permettre d’étudier de façon plus précise les fonctions cellulaires altérées dans le processus métastatique et de déterminer quelle combinaison minimale d’altération est nécessaire pour le processus métastatique.
Nos premiers résultats suggèrent qu’il existerait des voies d’évolution du processus tumoral et donc de la dissémination métastatique différentes et qu’il existerait une corrélation statistiquement significative entre les altérations constatées au niveau de certains loci, tel D6S264 en 6q27, et le caractère local ou diffus de l’envahissement hépatique.
La présence de plusieurs clones cellulaires différemment réarrangés et dans des pourcentages variables conduit à proposer l’hypothèse de l’émergence tardive de clones préexistants au cours du temps. La validation d’une telle hypothèse implique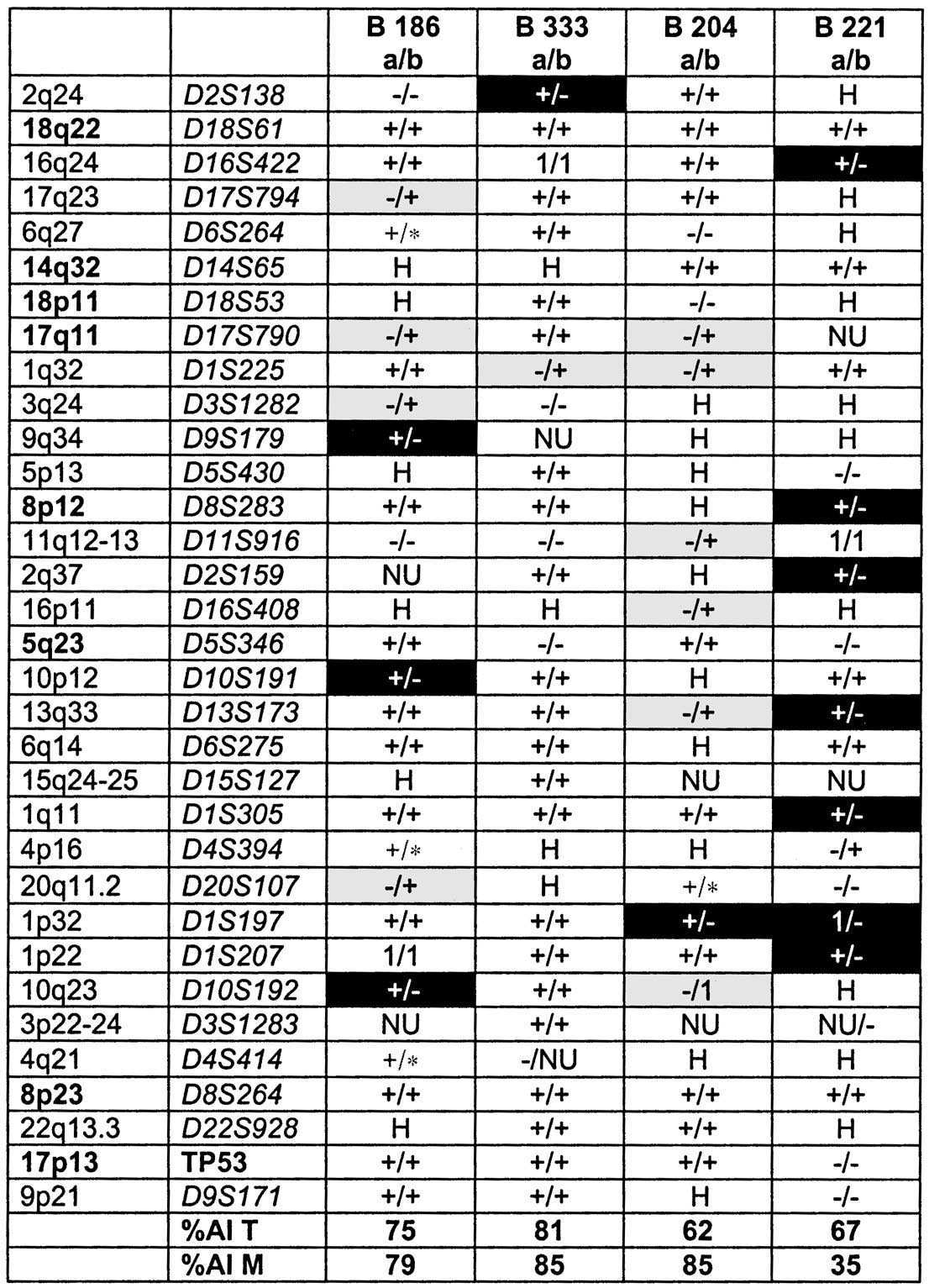
TABLEAU 1. — Allelotypage de quatre tumeurs colorectales et métastases synchrones.
– : absence de déséquilibre allélique + : présence de déséquilibre allélique (AI) * : présence de déséquilibre allélique affectant la deuxième allèle (AA) H : présence d’un seul pic, patient homozygote pour ce microsatellite 1 : présence de pics supplémentaires (MSI) a/b : a représente l’état dans la tumeur colorectale, b représente l’état du niveau de la métatstase synchrone NU : observation manquante, non utilisable
l’identification de marqueurs précoces et le suivi dans le temps de cas cliniques dans une approche systématique et multicentrique telle qu’elle est permise par la mise en place de tumorothèques et la mise au point de tests moléculaires identiques dans une collaboration multicentrique [25].
La puissance de l’allélotypage des cancers va pouvoir maintenant être amplifiée par des analyses plus ciblées mettant en jeu les plus récents outils de biologie moléculaire en développement utilisant les polymorphismes mononucléotidiques qui permettent d’approcher des évènements affectant des gènes cibles responsables de perte ou de gain de fonction comme le propose l’équipe de Bert Vogelstein [26].
L’identification de marqueurs moléculaires associés à l’existence de cancers colorectaux ou au caractère agressif de ces tumeurs est un objectif majeur car il est maintenant établi depuis les premiers travaux de P. Mandel et P. Métais en 1948 et rapportés dans une revue récente [27] qu’il est possible de mettre en évidence l’ADN tumoral dans la circulation sanguine.
La détection et la caractérisation de l’ADN tumoral dans le plasma sanguin utiliseront pleinement les résultats obtenus par l’analyse systématique de tumeurs tels que décrits ci-dessus, mais seront renforcées par l’identification de nouvelles séquences insérées dans le génome des cellules tumorales. En effet, il a été récemment montré que des séquences virales du polyomavirus humain JC étaient retrouvées dans les cancers colorectaux aneuploïdes. Ces séquences codent pour un antigène viral interagissant avec la bêta-caténine [28]. Il est raisonnable de proposer que de telles séquences étrangères puissent être détectées pour des équivalents d’une cellule parmi un million [29].
La poursuite de cette approche associant cliniciens, anatomo-pathologistes et biologistes moléculaires est nécessaire aussi bien pour identifier les marqueurs précoces que pour proposer un facteur de risque d’extension et évaluer l’efficacité des traitements mis en jeu sur un plus grand nombre de patients par :
— le recours à une étude prospective randomisée multicentrique avec un recul moyen supérieur à cinq années afin d’obtenir dès que possible des résultats statistiquement significatifs sur un plus grand nombre de patients. Une étude dans le cadre de protocoles coordonnés au niveau européen en collaboration avec l’EORTC est souhaitable, l’analyse des tumeurs initiales, extensions ganglionnaires et localisations hépatiques, est nécessaire.
— l’évolution du panel de microsatellites actuellement utilisé afin de réduire le nombre de ces derniers en vue de la diminution du coût de l’analyse et de la possibilité de mettre au point un test automatisé utilisable en routine permettant de caractériser les tumeurs colorectales et de déterminer leur potentiel évolutif.
En effet, dans notre panel, certains microsatellites sont apparemment peu altérés. Une étude statistique plus précise devrait permettre d’identifier un sous-groupe de microsatellites particulièrement informatifs.
— l’analyse systématique de l’ADN tumoral détecté dans le plasma des patients ouvre les perspectives aussi bien pour un diagnostic précoce de tumeurs non
directement accessibles comme le cancer de l’ovaire et les tumeurs colorectales que pour le suivi et la détection précoce de récidives.
— la détection de séquences virales insérées dans le génome des clones cellulaires tumoraux doit permettre la mise en évidence des sous populations cellulaires parmi de nombreuses cellules saines comme c’est actuellement le cas avec le virus du papillome dans les cancers du col de l’utérus. La détection de telles séquences dans l’ADN plasmatique mais également dans les selles ouvre ainsi de nouvelles perspectives pour le diagnostic et le suivi des cancers colorectaux.
CONCLUSION
Bien qu’informatives, les classifications anatomo-cliniques ont d’ores et déjà montré leurs limites. Cependant, elles ont le mérite de chercher à déterminer le potentiel évolutif des patients porteurs de tumeurs colorectales. L’approche moléculaire des cancers colorectaux métastatiques permet de mieux comprendre les discordances pouvant exister entre un traitement considéré à l’heure actuelle comme optimal et la survenue de récidives ou de métastases. L’hétérogénéité moléculaire des tumeurs colorectales au sein d’un même stade serait probablement à l’origine de cette disparité dans l’évolution des patients. Bien que de nombreuses études aient été réalisées, aucun marqueur moléculaire pronostique n’a été clairement identifié mais l’apport récent de la biologie moléculaire semble essentiel et informatif lorsque les cohortes analysées sont homogènes. Ainsi, seule une collaboration étroite des cliniciens et des chercheurs permettra de valider ces facteurs moléculaires pronostiques par le biais de l’organisation d’essais cliniques randomisés dans lesquels les cohortes de patients étudiés seront les plus comparables possibles et notamment dans la prise en charge postopératoire.
REMERCIEMENTS
Ce travail a été rendu possible par le soutien des Hôpitaux Universitaires de Strasbourg et l’aide généreuse de la Ligue Contre le Cancer (Comités du Haut-Rhin et du Bas-Rhin).
L’équipe de Biologie Moléculaire (S. Delacour, M. Desvernes, S. Hambert, I. Keller, V.
Kussaibi, E. Mengus, C. Meyer, E. Neuville, O. Nullans, M. Parmentier, S. Wagner) est chaleureusement remerciée pour sa haute compétence et son efficacité. La réalisation de ce manuscrit comme sa mise en forme n’auraient pas été possibles sans l’organisation, l’expertise, la disponibilité et la motivation de Madame Catherine Cuny.
Les services ayant directement participé à ces travaux sont très vivement remerciés :
— Laboratoire de Biochimie et de Biologie Moléculaire (U.F. 6442 : Docteur M.P.
Gaub), — Laboratoire d’Anatomie Pathologique Générale (Chef de Service : Professeur J.P.
Bellocq), — Service de Chirurgie Hépatique et Digestive et de Chirurgie Endocrinienne (Chef de Service : Professeur D. Jaeck), — Service de Chirurgie Générale et Digestive (Chef de Service : Professeur C. Meyer),
— Service d’Hépato-Gastro-Entérologie et d’Assistance Nutritive (Chef de Service : R.
Baumann), Hôpital de Hautepierre — Avenue Molière — 67098 Strasbourg cedex.
BIBLIOGRAPHIE [1] BELLOCQ J.P., MARCELIN L., CHENARD-NEU M.P. — Anatomie pathologique des métastases hépatiques des adénocarcinomes colorectaux. In : Nordlinger B., Jaeck D., editors. Traitement des métatarses hépatiques des cancers colorectaux. Paris.
Springer-Verlag, 1992, 11-25.
[2] LEISTER I., WEITH A., BRUDERLEIN S., CZIEPLUCH C., KANGWANPONG D., SCHLAG P., et al . —
Human colorectal cancer : high frequency of deletions at chromosome 1p35.
Cancer Res, 1990, 50 (22), 7232-7235.
[3] EMI M., FUJIWARA Y., NAKAJIMA T., TSUCHIYA E., TSUDA H., HIROHASHI S., et al . — Frequent loss of heterozygosity for loci on chromosome 8p in hepatocellular carcinoma, colorectal cancer, and lung cancer. Cancer Res, 1992, 52(19) , 5368-5372.
[4] FUJIWARA Y., EMI M., OHATA H., KATO Y., NAKAJIMA T., MORI T., et al . — Evidence for the presence of two tumor suppressor genes on chromosome 8p for colorectal carcinoma.
Cancer Res, 1993, 53(5), 1172-1174.
[5] OOKAWA K., SAKAMOTO M., HIROHASHI S., YOSHIDA Y., SUGIMURA T., TERADA M., et al . —
Concordant p53 and DCC alterations and allelic losses on chromosomes 13q and 14q associated with liver metastases of colorectal carcinoma. Int J Cancer, 1993, 53 (3), 382-387.
[6] GUSTAFSON C.E., YOUNG J., LEGGETT B., SEARLE J., CHENEVIX-TRENCH G. — Loss of heterozygosity on the long arm of chromosome 11 in colorectal tumors. Br J Cancer, 1994, 70 (3), 395-397.
[7] IINO H., FUKAYAMA M., MAEDA Y., KOIKE M., MORI T., TAKAHASHI T., et al . — Molecular genetics for clinical management of colorectal carcinoma. 17p, 18q, and 22q loss of heterozygosity and decreased DCC expression are correlated with the metastatic potential. Cancer, 1994, 73 (5), 1324-1331.
[8] YANA I., KURAHASHI H., NAKAMORI S., KAMEYAMA M., NAKAMURA T., TAKAMI M., et al . —
Frequent loss of heterozygosity at telomeric loci on 22q in sporadic colorectal cancers.
Int J Cancer, 1995, 60(2), 174-177.
[9] ZENKLUSEN J.C., THOMPSON J.C., KLEIN-SZANTO A.J., CONTI C.J. — Frequent loss of heterozygosity in human primary squamous cell and colon carcinomas at 7q31.1 : evidence for a broad range tumor suppressor gene. Cancer Res, 1995, 55 (6) , 1347-1350.
[10] ARMITAGE P., DOLL R. — A two-stage theory of carcinogenesis in relation to the age distribution of human cancer. Br J Cancer , 1957, 11 , 161-169.
[11] FEARON E.R., VOGELSTEIN B. — A genetic model for colorectal tumorigenesis.
Cell, 1990, 61 (5), 759-767.
[12] LENGAUER C., KINZLER K.W., VOGELSTEIN B. — Genetic instabilities in human cancers. Nature, 1998, 396(6712) , 643-649.
[13] BOS j.L. — ras oncogenes in human cancer : a review.
Cancer Res , 1989, 49(17), 4682-4689.
[14] FEARON E.R., HAMILTON S.R., VOGELSTEIN B. — Clonal analysis of human colorectal tumors.
Science, 1987, 238 (4824), 193-197.
[15] AHNEN D.J., FEIGL P., QUAN G., FENOGLIO-PREISER C., LOVATO L.C., BUNN P.A., JR., et al . —
Ki-ras mutation and p53 overexpression predict the clinical behavior of colorectal cancer : a Southwest Oncology Group study. Cancer Res, 1998, 58 (6), 1149-1158.
[16] ANDREYEV H.J., NORMAN A.R., CUNNINGHAM D., OATES J.R., CLARKE P.A. — Kirsten ras mutations in patients with colorectal cancer : the multicenter " ; RASCAL" ; study.
J Natl Cancer Inst, 1998, 90 (9), 675-684.
[17] ELSALEH H., SOONTRAPORNCHAI P., GRIEU F., JOSEPH D., IACOPETTA B. — P53 alterations have no prognostic or predictive significance in Dukes’ C rectal carcinomas. Int J Oncol, 1999, 15 (6), 1239-1243.
[18] DIX B.R., ROBBINS P., SOONG R., JENNER D., HOUSE A.K., IACOPETTA B.J. — The common molecular genetic alterations in Dukes’ B and C colorectal carcinomas are not short-term prognostic indicators of survival. Int J Cancer, 1994, 59 (6), 747-751.
[19] LINDFORSS U., FREDHOLM H., PAPADOGIANNAKIS N., GAD A., ZETTERQUIST H., OLIVECRONA H.
— Allelic loss is heterogeneous throughout the tumor in colorectal carcinoma. Cancer, 2000, 88 (12), 2661-2667.
[20] HALLING K.C., FRENCH A.J., MCDONNELL S.K., BURGART L.J., SCHAID D.J., PETERSON B.J., et al . — Microsatellite instability and 8p allelic imbalance in stage B2 and C colorectal cancers. J
Natl Cancer Inst, 1999, 91 (15), 1295-1303.
[21] OLSCHWANG S., HAMELIN R., LAURENT-PUIG P., THUILLE B., DE RYCKE Y., LI Y.J., MUZEAU F., GIRODET J., SALMON R.J. et THOMAS G. — Alternative genetic pathways in colorectal carcinogenesis. Proc Natl Acad Sci USA, 1997, 94 (22), 12122-12127.
[22] SCHNEIDER A., ROHR S., KELLY M.D., MITRY R., PIGNATELLI M., DORE C.J., et al. — Microsatellite instability and allelic imbalance in primary and secondary colorectal cancer. Aust N Z J Surg, 2000, 70 (8), 587-592.
[23] JAYSON G.C., VIVES C., PARASKEVA C., SCHOFIELD K., COUTTS J., FLEETWOOD A., et al. — Coordinated modulation of the fibroblast growth factor dual receptor mechanism during transformation from human colon adenoma to carcinoma. Int J Cancer, 1999, 82 (2), 298-304.
[24] BIENZ M., CLEVERS H. — Linking colorectal cancer to Wnt signaling.
Cell, 2000, 103(2), 311-320.
[25] HAYES R.B., REDING D., KOPP W., SUBAR A.F., BHAT N., ROTHMAN N., CAPORASO N., ZIEGLER R.G., JOHNSON C.C., WEISSFEL J.L., HOOVER R.N., HARTGE P., PALACE C., GOHAGAN J.K. — Etiologic and Early Marker Studies in the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Trial. Controlled Clinical Trials, 2000, 21, 349S-355 S.
[26] ZHOU W., GOODMAN S.N., GALIZIA G., LIETO E., FERRARACCIO F., PIGNATELLI C., PURDIE C.A., PIRIS J., MORRIS R., HARRISON D.J., PATY P.B., CULLIFORD A., ROMANS K.E., MONTGOMERY E.A., CHOTI M.A., KINZLER K.W., VOGELSTEIN B. — Counting alleles to predict recurrence of early-stage colorectal cancers. The Lancet, 2002, 359, 219-225.
[27] ZIEGLER A., ZANGEMEISTER-WITTKE U. et STAHEL R.A. — Circulating DNA : a new diagnostic gold mine ? Cancer Treatment Reviews, 2002, 28, 255-271.
[28] REPETITION MICROSATELLITE. CLONE CELLULAIRE.
ENAM S., DEL VALLE L., LARA C., GAN D.D., ORTIZ-HIDALGO C., PALAZZAO J.P. et KHALILI K.
— Association of Human Polyomavirus JCV with Colon Cancer : Evidence for Interaction of Viral T-Antigen and β— Catenin. Cancer Research, 2002, 62 , 7093-7101.
[29] SHADAN F.F., CUNNINGHAM C., BOLANDE C.R. — JC virus : a biomarker for colorectal cancer ?
Medical Hypotheses , 2002, 59(6) , 667-669.
DISCUSSION
M. Michel BOUREL
Quelle valeur pronostique aux marqueurs moléculaires du cancer colorectal ? Quelle place à l’ACE ?
A ce jour, seule la présence d’instabilité de microsatellite a pu être confirmée par plusieurs études comme présentant un facteur pronostique favorable. Les études multicentriques coordonnées n’ont pas encore été menées pour valider l’utilisation de ces nouveaux marqueurs. Les résultats de ces travaux devraient être connus dans quelques mois.
Les valeurs élevées du dosage de l’antigène carcino-embryonnaire (plus de 8 à 10 fois la valeur moyenne de référence) sont retrouvées dans moins de 50 % des formes avancées des cancers colorectaux. Comme pour la cytokératine 20, les valeurs sériques élevées ne sont pas constantes et peuvent varier dans le temps. Il y a donc complémentarité entre une carte moléculaire de la tumeur et la détection de marqueur circulant.
M. Jacques-Louis BINET
Avez-vous pu observer des relations entre les profils moléculaires, dans la tumeur ou dans la métastase, et la sensibilité à la chimiothérapie ou la médiane de survie ?
L’approche moléculaire est encore trop récente pour apporter de telles informations prospectives. Il est d’ores et déjà important de savoir que des profils différents peuvent être mis en évidence entre les formes d’emblée métastatiques et les formes localisées.
Des propositions de marqueurs moléculaires corrélés à la présence de métastases sont à l’étude, une évaluation multicentrique devrait les confirmer. La réalisation de profils moléculaires devrait donc être incluse dans les protocoles de chimiothérapie actuellement mis en place.
*(a) INSERM U184 parc d’innovation, 67400 Illkirch. * Laboratoire de Biochimie et de Biologie Moléculaire, ** Laboratoire d’Anatomie Pathologique Générale, *** Service de Chirurgie Hépatique et digestive et de chirurgie Endocrinienne, **** Service de Chirurgie Générale et Digestive Hôpital de Hautepierre — Avenue Molière — 67098 Strasbourg cedex (Hôpitaux Universitaire de Strasbourg). Tirés-à-part : Professeur Pierre OUDET, à l’adresse ci-dessus. Article reçu le 14 mars 2003, accepté le 7 avril 2003.
Bull. Acad. Natle Méd., 2003, 187, n° 5, 847-861, séance du 6 mai 2003


