Résumé
Nous rapportons une méthodologie qui permet la génération massive ex vivo de globules rouges (GR) humains matures ayant toutes les caractéristiques de GR natifs adultes, à partir de Cellule Souches Hématopoïétiques (CSH) de diverses origines : sang, moelle osseuse ou sang du cordon placentaire. Le protocole se décline en trois étapes : une première, en milieu liquide sans sérum, de prolifération cellulaire et d’induction de différenciation érythroïde en présence de stem cell factor (SCF), d’interleukine-3 (IL3) et d’érythropoïé- tine (Epo) ; une seconde, sur un modèle de reconstitution de microenvironnement médullaire, en présence d’Epo seule ; une troisième, en présence du seul microenvironnement, sans aucun facteur de croissance. Ce protocole permet à la fois l’expansion massive des CSH/progéniteurs et la différenciation complète jusqu’au stade de GR matures parfaitement fonctionnels qui survivent in vivo chez la souris NOD/SCID comme des GR natifs. Cette méthodologie est un outil pour l’analyse fondamentale des mécanismes de l’érythropoïèse terminale et de la synthèse de l’hémoglobine. Elle est également extrapolable à une approche transfusionnelle dont les débouchés sont considérables. C’est aussi un outil pour l’étude de certaines maladies infectieuses ou parasitaires dont les cibles sont les cellules érythroïdes.
Summary
We describe a technical approach permitting massive expansion of CD34+ stem cells (up to 1.95 × 106-fold) and their full ex vivo conversion into mature red blood cells (RBCs). This three-step protocol can be adapted to hematopoietic stem cells (HSC) of various origins. First, cell proliferation and erythroid differentiation are induced in serum-free media supplemented with stem cell factor, interleukin-3 and erythropoietin (Epo) for 8 days. The cells are then co-cultured with either the murine stromal cell line MS-5 or human mesenchymal cells for 3 days in the presence of Epo alone. Finally, all exogenous factors are withdrawn and the cells are incubated on a simple stroma for up to 10 days. The ex vivo microenvironment strongly influences both the terminal maturation of erythroid cells and hemoglobin (Hb) synthesis. Critically, in vitro -generated RBCs have all the characteristics of functional native adult RBCs in terms of their enzyme content, membrane deformability, and capacity to fix and release oxygen. In addition, their behavior in the murine NOD/SCID model mirrors that of native RBCs. This new concept of ‘‘ cultured RBCs ’’ (cRBC) has major implications for basic research on terminal erythropoiesis and for patient management. Currently, the potential yield of functional red cells is compatible with clinical requirements, as several units of packed RBCs can be produced from a single donation. Importantly, infused cRBC would all have a life-span of about 120 days, whereas the mean half-life of normal donor RBCs is only 28 days. This would help to minimize the transfusion exposure of patients requiring regular treatment, thereby reducing the risk of iron overload and allo-immunization. The use of autologous CD34+ cells isolated from leukapheresis samples could be beneficial for patients who no longer tolerate allogeneic RBCs. This new method should also prove useful for analyzing the mechanisms of terminal erythropoiesis, including hemoglobin synthesis. Finally, it could provide a tool for investigating the lifecycle of blood parasites such as Plasmodium, the agent of malaria.
Le globule rouge (GR) humain est la seule cellule à durée de vie prolongée (120 jours) malgré l’absence de noyau. Les mécanismes de l’énucléation sont soupçonnés [1-4] mais non formellement établis par défaut de conditions expérimentales permettant la génération massive ex vivo de GR. De telles conditions doivent en effet répondre à trois impératifs : — la mise en prolifération extrême des cellules souches hématopoïétiques (CSH) primitives, — l’induction contrôlée d’une différenciation exclusive vers la voie érythroïde, — l’achèvement d’une maturation terminale jusqu’au stade de cellule énucléée [5, 6].
S’il est relativement aisé d’obtenir une différenciation érythroïde quasi exclusive [7-10], les données de la littérature font cependant état, au terme des différentes modalités de culture proposées, soit d’une importante prolifération cellulaire sans maturation terminale [11, 12], soit de l’obtention de l’énucléation dans près de la moitié des cellules mais avec un niveau d’amplification réduit [13]. Aucune condition ex vivo n’a été à ce jour décrite qui permet de jumeler une prolifération massive et une énucléation de la totalité des érythroblastes.
Nous avons précédemment proposé [14] un protocole d’expansion de CSH issues de sang de cordon (SC) dans un milieu défini et sans stroma, reposant sur une l’addition séquentielle de facteurs de croissance. Partant d’une population enrichie en cellules souches et progéniteurs hématopoïétiques, le protocole permettait une production cellulaire importante (jusqu’à 200000 fois d’amplification) et pure de précurseurs érythroides (95 à 99 %). Nous avions montré que contrairement à nos observations ex vivo, ces progéniteurs/précurseurs injectés à la souris NOD-SCID étaient capables de continuer à proliférer in vivo et de se différencier en quatre jours
jusqu’au stade terminal de cellules énucléées, confirmant le rôle majeur du microenvironnement dans la différenciation terminale érythroïde.
L’hématopoïèse in vivo chez l’homme adulte est en effet obtenue grâce à un processus dynamique de fabrication situé dans la moelle osseuse (MO), à partir d’une minorité de CSH (<1 %) selon une hiérarchie cellulaire construite sur un modèle pyramidal (compartiment des cellules souches (CS), celui des progéniteurs et celui de la maturation) [15]. À l’état basal les CSH et progéniteurs ne circulent qu’en très faible quantité dans le sang (<0,1 %). Elles peuvent toutefois être mobilisées de la moelle osseuse vers le sang grâce à des facteurs de croissance comme le granocytegrowth factor (G-CSF). À la naissance les 60 à 120ml de sang du cordon ombilical contiennent entre deux et cinq millions de CSH/progéniteurs.
Dans la moelle osseuse cette population de CS/progéniteurs hématopoïétiques est en étroit contact avec le microenvironnement [16, 17, 18]. Ce microenvironnement stromal médullaire est constitué de macrophages et de différentes cellules (fibroblastes, adipocytes, cellules endothéliales) issues d’une population particulière de cellules souches tissulaires, les cellules souches mésenchymateuses (CSM) qui sont à l’origine des tissus conjonctifs du squelette. Ces cellules stromales jouent un rôle déterminant dans la sécrétion de facteurs solubles de régulation et des différents constituants de la matrice extracellulaire. Les contacts intercellulaires et les facteurs solubles, activateurs ou inhibiteurs, sont des éléments clés de la régulation de l’hématopoïèse [19].
Reproduire in vitro les conditions de l’énucléation
Les CSH et les progéniteurs peuvent être aisément identifiés et sélectionnés par des techniques immunomagnétiques grâce à la présence d’un marqueur de surface spécifique, le CD34. Les cellules stromales peuvent être générées in vitro soit à partir de lignées d’origine animale, comme la lignée murine MS5, soit par cultures primaires humaines de cellules souches mésenchymateuses. Les cellules stromales issues de ces CSM sont obtenues par culture in vitro et sélection sur leurs propriétés d’adhé- rence.
Sur la base de ces données, nous avons conçu un protocole d’expansion et de différenciation des cellules CD34+ d’origine sanguine, médullaire et de sang placentaire en trois étapes : une première en milieu liquide, de prolifération cellulaire et d’induction de différenciation érythroïde en présence de stem cell factor (SCF), d’interleukine-3 (IL3) et d’érytropoïétine (Epo ) ; une seconde sur un modèle de reconstitution de microenvironnement [(lignée stromale murine MS5 ou cellules dérivées des cellules souches humaines mésenchymateuses], en présence d’Epo seule ; une troisième en présence des seules cellules stromales, sans aucun facteur de croissance. Nous montrons que ce protocole, en milieu défini sans sérum, autorise à la fois l’expansion massive de CS/progéniteurs CD34+ et la différenciation complète jusqu’au stade de GR matures parfaitement fonctionnels.
Amplification massive de cellules érythroïdes
Ces conditions permettent d’obtenir au 15e jour un plateau d’amplification cellulaire moyenne de 16500 fois (9200 à 25500) pour des cellules CD34+ issues de la moelle osseuse ou du sang périphérique, de 29000 fois (23700 à 34000) pour celles issues de cytaphérèses mobilisées par G-CSF et 140000 fois (93000 à 277000) pour celles provenant de sang de cordon.
L’engagement vers la lignée érythroïde est morphologiquement évident dès J8 (95 à 98 % d’érythroblastes). La différenciation terminale est ensuite rapide avec un taux de cellules énucléées de 1-5 % à J11, 65-80 % à J15 (Fig. 1). À ce stade 98 fi 1 % d’entre elles sont des réticulocytes. La maturation en GR adultes se poursuit de J15 à J18 comme en témoigne la négativation progressive du CD71, récepteur de la transferrine, et du laser dye styryl (LDS, marqueur des acides nucléiques). À ce stade, 90 à 100 % des cellules sont énucléées. Le rendement cellulaire à J18 comparé à J15 est de 77 fi 5 % avec un taux moyen de réticulocytes de 18 fi 4 %.
Cette différenciation érythroïde pure et massive peut être certainement attribuée à l’induction ciblée de prolifération des progéniteurs érythroïdes (BFU-E et CFU-E) au détriment des progéniteurs granulo-macrophagiques (CFU-GM), tous disparaissant rapidement entre J8 et J11.
Ces conditions ont donc permis — pendant la première phase de huit jours en milieu liquide, d’initier fortement la mise en prolifération des CSH primitives grâce au SCF et à l’IL3 et l’induction dirigée d’une différenciation érythroïde exclusive grâce à l’Epo, — d’initier, durant la deuxième phase de trois jours la maturation terminale par l’effet conjoint du microenvironnement et de la seule Epo, tout en maintenant le fort niveau de prolifération, — d’achever la prolifération et l’énucléation terminale en présence du seul microenvironnement.
Nous avons observé que l’expansion cellulaire atteinte au cours de la première étape de culture est directement corrélée à sa durée. Ainsi, en la prolongeant de trois jours, les niveaux d’amplification cellulaire peuvent atteindre 1,95 × 106, 1,22 × 105 et 1,04 × 105 fois respectivement pour les cellules provenant du sang placentaire, de cytaphérèse et de moelle osseuse.
Des réticulocytes et des globules rouges fonctionnels
Ces réticulocytes et GR ont un contenu en glucose-6-phosphate-déhydrogenase et en pyruvate-kinase de 42 fi 1,4 et de 83 fi 1,8 unités/g d’Hb respectivement, ce qui correspond au caractère homogène et jeune des populations cellulaires produites [20]. Ceci témoigne de leur capacité à réduire le glutathion et à maintenir le taux d’ATP pour éviter l’accumulation de 2-3 diphosphoglycérate (2-3 DPG) qui produirait une baisse d’affinité de l’Hb pour son ligand.
La déformabilité de ces réticulocytes et GR générés ex vivo, évaluée par ektacytométrie est comparable à celle des GR natifs [21].
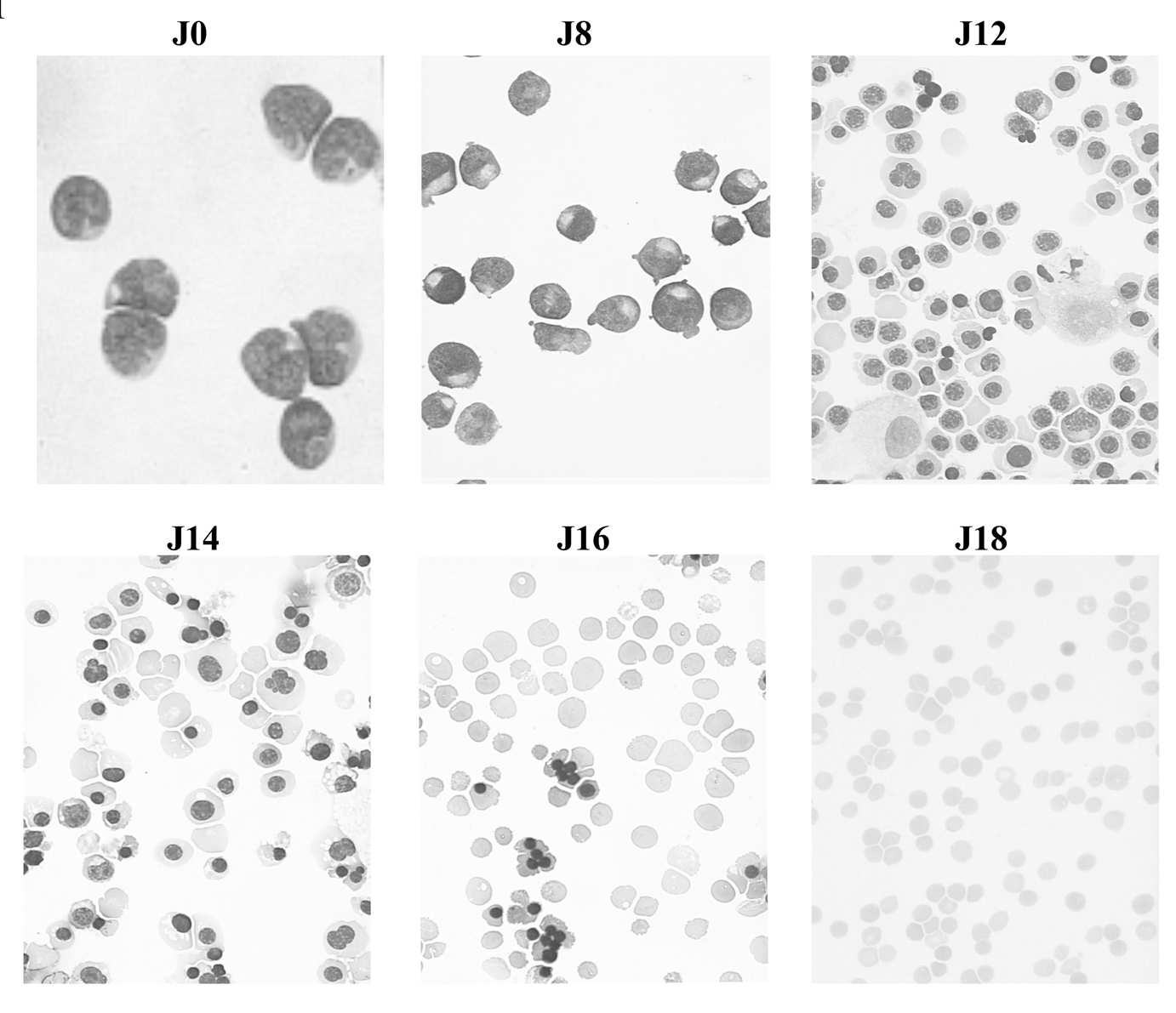
FIGURE 1. — Différenciation érythroïde in vitro des cellules CD34+. Coloration au May-Grunwald
Giemsa.
L’hémoglobine contenue dans ces GR est fonctionnelle. Elle se comporte comme une Hb tétramérique comme en témoigne la coopération entre les différentes sous-unités validant son comportement allostérique (étude par flashphotolyse) [22] .
Elle est capable de fixer et de relarguer l’oxygène avec une valeur log (P50) de 1,2 et un coefficient de Hill (N ) de 2,28 comme attendu d’une hémoglobine native dont 50 les valeurs normales sont respectivement de 1,3 et 2,29 (courbes à l’équilibre à 37° C par Hémox analyzer). Ces données sont confirmées par tonométrie réalisée à 25° C (Fig. 2).
Injectés à la souris NOD/SCID ces réticulocytes humains produits ex vivo mûrissent normalement en GR et sont détectés aussi longtemps que peuvent l’être des GR témoins (trois jours).
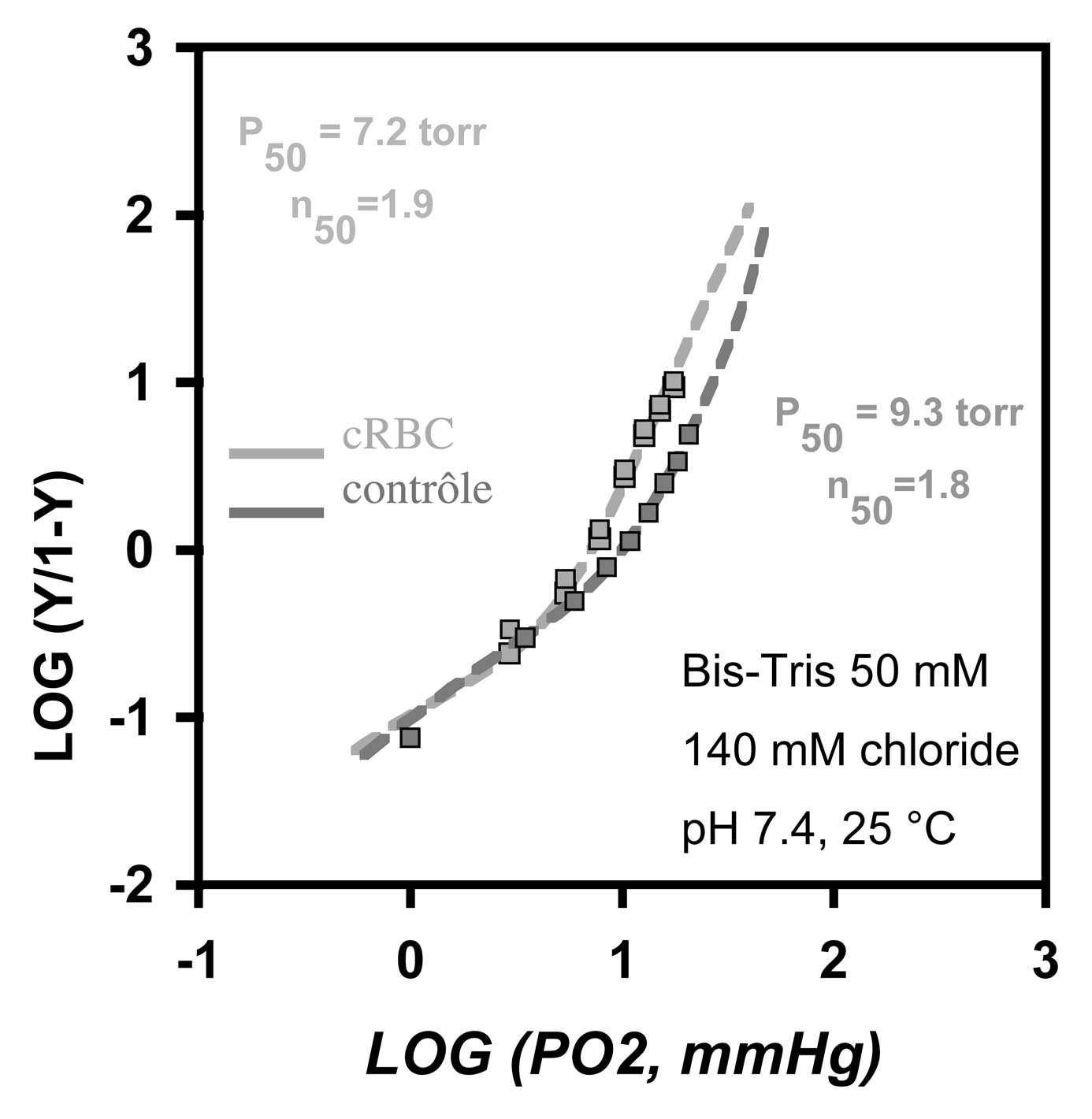
FIGURE 2. — Mesure à l’équilibre du taux de saturation en oxygène des GR générés in vitro et d’un sang contrôle. Évaluation par tonométrie à +25° C.
P50, détermine la pression partielle en O2 à laquelle coexistent 50 % des formes oxy et déoxygénées de l’Hb.
n50 : coefficient d’interaction de Hill, mesure la coopérativité des sous-unités.
Impact du microenvironnement reconstitué ex vivo sur la maturation terminale des cellules érythroïdes
En l’absence de microenvironnement et en présence des seuls facteurs de croissance, la capacité de prolifération cellulaire et de différenciation érythroïde n’est pas altérée (5.6 × 105 fois d’amplification à J15, 99 % de cellules érythroïdes). Toutefois il n’y a pratiquement pas d’énucléation (2 fi 1 %). De plus, le contact entre les cellules hématopoïétiques et les cellules adhérentes est indispensable à la phase d’énucléation [23-26] puisque l’interposition d’un tamis cellulaire de 0,45 µm entre les cellules adhérentes et non adhérentes interdit toute énucléation et induit une lyse cellulaire secondaire.
Si la lignée murine apporte les conditions de la maturation érythroïde terminale, elle ne reproduit toutefois pas la diversité cellulaire du microenvironnement chez l’homme. Nous avons pu reproduire ces résultats avec d’autres types cellulaires comme les cellules mésenchymateuses humaines tant en terme d’amplification qu’en terme de maturation terminale. La cinétique de production des progéniteurs (CFU-E, BFU-E) confirme que les conditions sans stroma ne favorisent pas la différenciation terminale puisqu’à J11 leur nombre est de 20 à 700 fois supérieur à celui obtenu en co-culture sur MS5.
Des applications multidisciplinaires
Nous avons ainsi décrit une méthodologie de culture reproduisant ex vivo les conditions du microenvironnement hématopoïétique, dans un milieu défini, qui permet la prolifération des CSH, leur engagement spécifique vers la ligné érythroïde et la maturation terminale complète jusqu’au stade de GR. Cette approche est applicable à plusieurs modèles.
Étude de l’hémoglobine . Ces conditions de culture offrent un modèle d’étude de la synthèse de l’Hb. En effet nous avons observé que la nature de l’Hb synthétisée dans ces GR de culture dépend à la fois de l’origine des cellules CD34+ et des conditions de culture. Les GR générés à partir de cellules CD34+ issues de moelle osseuse adulte ou de sang périphérique contiennent de l’HbA (respectivement 94 fi2 % et 95 fi 1 %) et de l’Hb fœtale (HbF) dont les rapports ; γA :γG sont respectivement 53 :47 et 52 :48. Les GR produits à partir de cellules CD34+ issues de SC contiennent essentiellement de l’Hb fœtale (64 fi 13 %) dont le rapport moyen des chaînes γA :γG est de 59 :41. Cette synthèse ex vivo d’HbF à partir de SC est bien liée aux conditions de culture puisque nous avions montré précédemment [14] que des progéniteurs/précurseurs érythroblastiques obtenus après dix jours de culture, en l’absence de microenvironnement, donnent naissance in vivo après transfusion chez la souris NOD/SCID à des GR matures contenant 96 % d’HbA fonctionnelle et 4 % d’HbF ayant un rapport γA :γG de 35 :65.
Notre modèle devient un outil pour identifier les mécanismes cellulaires et moléculaires de la synthèse des hémoglobines. D’une part on constate que le niveau d’expression de l’HbF varie selon l’origine des cellules. D’autre part certains travaux font état que des conditions de culture différentes peuvent modifier en partie le profil d’expression des Hb [27-30]. Il est donc raisonnable d’envisager, qu’à terme, la stimulation in vitro de l’expression de l’HbF dans les progéniteurs des sujets ayant une hémoglobinopathie sévère (drépanocytose) pourra aboutir et permettre ainsi une approche thérapeutique ex vivo.
Transfusion sanguine. Cette technologie qui autorise la génération massive ex vivo de
GR fonctionnels à partir de CSH rend leur production conceptuellement réalisable dans un but transfusionnel. La moelle osseuse a servi dans cette étude de référence.
La possibilité de recueillir facilement des CD34+ dans le sang périphérique après
mobilisation par G-CSF ou dans le sang du cordon à la naissance ouvre des perspectives thérapeutiques considérables. Les quantités potentiellement productibles sont en effet compatibles avec les exigences cliniques (un concentré globulaire standard contient environ 2 × 1012 GR). Si l’on considère d’une part qu’un SC contient de 2 à 5 × 106 CD34+ ou qu’une cytaphérèse mobilisée par un facteur de croissance comme le granulocyte-colony stimulating factor (G-CSF) permet de recueillir habituellement 4-8 × 106 CD34+ par Kg de poids, et que d’autre part les niveaux d’amplification sont respectivement de l’ordre 2 × 106 et 105 fois, c’est bien l’équivalent de plusieurs concentrés de GR qui peuvent être ainsi produits à partir d’un seul prélèvement. Au-delà de l’intérêt transfusionnel évident en terme d’approvisionnement et de sécurité infectieuse (plusieurs dons générés à partir d’un seul donneur et/ou transfusion autologue), c’est aussi en matière d’efficacité transfusionnelle que ce type de produit est prometteur. Il permettrait de transfuser une population homogène en âge, dont la durée de vie devrait être proche de 120 jours par comparaison aux 28 jours de demi-vie moyenne des GR prélevés chez un donneur en raison de la présence conjointe de GR d’âge variable. Ceci diminuerait le nombre de transfusions et allégerait l’inévitable surcharge martiale, complication majeure chez les sujets polytransfusés. L’adaptation de ce modèle à une application clinique implique l’établissement de conditions de production de grade clinique, notamment en privilégiant l’emploi de cellules stromales d’origine humaine.
Parasitologie. Ce modèle de différenciation érythroïde peut constituer un nouvel outil simple pour l’étude du cycle de reproduction de certains agents infectieux comme le plasmodium dans la malaria. Jusqu’à présent, la souris immunodéficiente constituait le seul modèle permettant l’étude du plasmodium dans le but de développer de nouvelles drogues ou de mettre au point des vaccins antipaludéens [31]. La durée de vie limitée des GR humains injectés à la souris SCID obligeait même à une lourde préparation du modèle receveur (splénectomie, irradiation, traitement médicamenteux…) [32-35]. D’autres équipes ont développé l’isolement de réticulocytes issus de la souris [36] ou de patients présentant des pathologies hématologiques [37].
Ce modèle in vitro , aisément accessible, contourne les lourdeurs du modèle in vivo .
Un nouveau vecteur médicamenteux. Par nature les GR ont une biodistribution idéale et ne se divisent plus. De telles propriétés pourraient être exploitées pour utiliser ces cellules comme vecteur thérapeutique d’un nouveau type. En effet, préalablement à l’induction de différenciation érythroïde, les progéniteurs pourraient être génétiquement manipulés afin de produire des protéines cytoplasmiques ou membranaires dont l’action serait volontairement limitée dans le temps, dans un but thérapeutique.
Perspectives. Les cellules souches embryonnaires humaines (huES), au potentiel prolifératif illimité, pourraient devenir dans les prochaines années une source alternative et attractive pour l’ingéniérie cellulaire. Déjà, des équipes relatent l’engagement des huES vers les cellules hématopoïétiques CD34+ à hauteur de 20 % [38].
La différenciation in vitro des cellules ES vers la lignée érythroïde pourrait ainsi permettre à terme la production de masse des GR [39].
CONCLUSION
Nous décrivons une méthodologie de production en grand nombre de globules rouges humains matures, à partir de cellule souches hématopoïétiques de diverses origines cultivées ex vivo.
Ce nouveau concept de « GR de culture » est utile à l’analyse fondamentale des mécanismes de l’érythropoïèse terminale, non encore complètement identifiés et à la compréhension de la synthèse de l’hémoglobine, encore mystérieuse.
Il est évidemment extrapolable à une approche transfusionnelle dans la mesure où les niveaux d’amplification atteints permettent raisonnablement d’envisager la production de l’équivalent de deux à six concentrés globulaires standard à partir d’un prélèvement classique de cytaphérèse.
Cette méthodologie peut constituer un outil simple pour l’étude du cycle de reproduction de certains parasites comme le plasmodium de la malaria. Ce GR de culture peut enfin servir de vecteur médicamenteux d’un nouveau genre.
Les applications de ce modèle sont donc potentiellement considérables.
REMERCIEMENTS
Aux co-auteurs de ce travail : Ladan Kobari (Laboratoire d’Hématologie EA1638, CHU Saint Antoine, Paris) — Hélène Lapillonne (Service d’Hématologie Biologique, Hôpital Armand Trousseau, Paris) — David Chalmers (EFS Bourgogne Franche Comte, Besançon) — Laurent Kiger (INSERM U473, Le Kremlin-Bicêtre) — Thérèse Cynober (Laboratoire d’Hématologie, Bicêtre, CHU du Kremlin-Bicêtre) — Michael C. Marden (INSERM U473, Le Kremlin-Bicêtre) — Henri Wajcman (INSERM U468, Hôpital Henri Mondor, Créteil) et au soutien financier de l’Association Recherche en Transfusion (ART), l’Association Combattre La Leucémie (CLL) et l’Établissement Français du Sang (EFS).
BIBLIOGRAPHIE [1] QIU L. B., DICKSON H., HAJIBAGHERI N., CROCKER P.R. — Extruded erythroblast nuclei are bound and phagocytosed by a novel macrophage receptor. Blood , 1995, 85 , 1630-1639.
[2] LICHTMAN M. A. — The ultrastructure of the hemopoietic environment of the marrow : a
Review. Exp . Hematol. , 1981, 9 , 391-410.
[3] BESSIS M. — Erythroblastic island, functional unity of bone marrow.
Rev. Hematol. , 1958, 13 , 8-11.
[4] CHEN C.Y., PAJAK L., TAMBURLIN J., BOFINGER D., KOURY S. T. — The effect of proteasome inhibitors on mammalian erythroid terminal differentiation. Exp. Hematol. , 2002, 30 , 634-639.
[5] GREGORY C.J., EAVES A.C. — Three stages of erythropoietic progenitor cell differentiation distinguished by a number of physical and biologic properties. Blood , 1978, 51 , 527-537.
[6] METCALF D. — Hematopoietic regulators : redundancy or subtlety ?
Blood , 1993, 82 , 3515- 3523.
[7] FREYSSINIER J.M., LECOQ-LAFON C., AMSELLEM S., PICARD F., DUCROCQ R. et al. — Purification, amplification and characterization of a population of human erythroid progenitors.
Br. J.
Haematol. , 1999, 106, 912-922.
[8] PANZENBOCK B., BARTUNEK P., MAPARA M.Y., ZENKE M. — Growth and differentiation of human stem cell factor/erythropoietin-dependent erythroid progenitor cells in vitro . Blood , 1998, 92 , 3658-3668.
[9] FIBACH E., MANOR D., OPPENHEIM A., RACHMILEWITZ E.A. — Proliferation and maturation of human erythroid progenitors in liquid culture. Blood , 1989, 73 , 100-103.
[10] WADA H., SUDA T., MIURA Y., KAJII E., IKEMOTO S. et al. — Expression of major blood group antigens on human erythroid cells in a two phase liquid culture system.
Blood, 1990, 75 , 505-511.
[11] VON LINDERN M., ZAUNER W., MELLITZER G., STEINLEIN P., FRITSCH G . et al. — The glucocorticoid receptor cooperates with the erythropoietin receptor and c-Kit to enhance and sustain proliferation of erythroid progenitors in vitro . Blood ,1999, 94 , 550-559.
[12] SUI X., TSUJI K., TAJIMA S., TANAKA R., MURAOKA K. et al. — Erythropoietin-independent erythrocyte production : signals through gp130 and c-kit dramatically promote erythropoiesis from human CD34+ cells. J. Exp. Med., 1996, 183 , 837-845.
[13] MALIK P., FISHER T.C., BARSKY L.L., ZENG L., IZADI P. et al. — An in vitro model of human red blood cell production from hematopoietic progenitor cells.
Blood , 1998, 91 , 2664-2671.
[14] NEILDEZ-NGUYEN T.M., WAJCMAN H., MARDEN M.C., BENSIDHOUM M., MONCOLLIN V. et al.
— Human erythroid cells produced ex vivo at large scale differentiate into red blood cells in vivo .
Nat. Biotechnol. , 2002, 20 , 467-472.
[15] OGAWA M. — Differentiation and proliferation of hematopoietic stem cells . Blood , 1993, 81 , 2844-2853.
[16] LEMISCHKA I. R. — Microenvironmental regulation of hematopoietic stem cells. Stem
Cells ,1997, 15 Suppl 1, 63-68.
[17] KOLLER M.R., OXENDER M., JENSEN T.C., GOLTRY K.L., SMITH A.K. — Direct contact between CD34+lin- cells and stroma induces a soluble activity that specifically increases primitive hematopoietic cell production. Exp. Hematol., 1999, 27 , 734-741.
[18] FRIEDENSTEIN A.J., DERIGLASOVA U.F., KULAGINA N.N., PANASUK A.F., RUDAKOWA S.F. et al.
— Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method. Exp. Hematol., 1974, 2 , 83-92.
[19] VERFAILLIE C.M. — Soluble factor(s) produced by human bone marrow stroma increase cytokine-induced proliferation and maturation of primitive hematopoietic progenitors while preventing their terminal differentiation. Blood, 1993, 82 , 2045-2053.
[20] JANSEN G., KOENDERMAN L., RIJKSEN G., CATS B.P., STAAL G.E. — Characteristics of hexokinase, pyruvate kinase, and glucose-6-phosphate dehydrogenase during adult and neonatal reticulocyte maturation. Am. J. Hematol., 1985, 20 , 203-215.
[21] CYNOBER T., MOHANDAS N., TCHERNIA G. — Red cell abnormalities in hereditary spherocytosis : relevance to diagnosis and understanding of the variable expression of clinical severity.
J. Lab. Clin. Med., 1996, 128 , 259-269.
[22] KISTER J., POYART C., EDELSTEIN S.J. — Oxygen-organophosphate linkage in hemoglobin A.
The double hump effect. Biophys. J., 1987, 52 , 527-535.
[23] OHNEDA O., BAUTCH V.L. — Murine endothelial cells support fetal liver erythropoiesis and myelopoiesis via distinct interactions. Br. J. Haematol., 1997, 98, 798-808.
[24] YANAI N., SATO Y., OBINATA M. — A new type-II membrane protein in erythropoietic organs enhances erythropoiesis. Leukemia, 1997, 11 Suppl 3, 484-485.
[25] HANSPAL M., HANSPAL J.S. — The association of erythroblasts with macrophages promotes erythroid proliferation and maturation : a 30-kD heparin-binding protein is involved in this contact. Blood, 1994, 84 , 3494-3504.
[26] HANSPAL M., SMOCKOVA Y., UONG Q. — Molecular identification and functional characterization of a novel protein that mediates the attachment of erythroblasts to macrophages. Blood, 1998, 92 , 2940-2950.
[27] GABBIANELLI M., TESTA U., MASSA A., PELOSI E., SPOSI N. M. et al. — Hemoglobin switching in unicellular erythroid culture of sibling erythroid burst-forming units : kit ligand induces a dose-dependent fetal hemoglobin reactivation potentiated by sodium butyrate. Blood , 2000, 95 , 3555-3561.
[28] WOJDA U., LEIGH K.R., NJOROGE J.M., JACKSON K.A., NATARAJAN B. et al. — Fetal hemoglobin modulation during human erythropoiesis : stem cell factor has ‘‘ late ’’ effects related to the expression pattern of CD117. Blood, 2003, 101 , 492-497.
[29] WOJDA U., NOEL P., MILLER J.L. — Fetal and adult hemoglobin production during adult erythropoiesis : coordinate expression correlates with cell proliferation. Blood, 2002, 99 , 3005- 3013.
[30] MIGLIACCIO A.R., MIGLIACCIO G., BRICE M., CONSTANTOULAKIS P., STAMATOYANNOPOULOS G.
et al. — Influence of recombinant hematopoietins and of fetal bovine serum on the globin synthetic pattern of human BFUe.
Blood , 1990, 76 , 1150-1157.
[31] BADELL E., PASQUETTO V., ELING W., THOMAS A., DRUILHE P. — Human Plasmodium liver stages in SCID mice : A feasible model ? Parasitol Today , 1995, 11 , 169-171.
[32] TSUJI M., ISHIHARA C., ARAI S., HIRATAI R., AZUMA I. — Establishment of a SCID mouse model having circulating human red blood cells and a possible growth of Plasmodium falciparum in the mouse. Vaccine , 1995, 1 3 , 1389-1392.
[33] ISHIHARA C., ZAMOTO A., TSUJI M., WEI Q., AZUMA I. et al. — Erythrocyte-replaced mouse model for Haemoparasite studies : comparison of NOD/shi-scid and C.B-17/Jcl-scid mouse upon acceptability of human erythrocytes. J. Vet. Med. Sci., 2003, 65 , 831-837.
[34] MOORE J.M., KUMAR N., SHULTZ L.D., RAJAN T.V. — Maintenance of the human malarial parasite, Plasmodium falciparum, in scid mice and transmission of gametocytes to mosquitoes.
J. Exp . Med. , 1995, 181 , 2265-2270.
[35] MORENO A., BADELL E., VAN ROOIJEN N., DRUILHE P. — Human malaria in immunocompromised mice : new in vivo model for chemotherapy studies. Antimicrob. Agents. Chemother., 2001, 45 , 1847-1853.
[36] ZHANG A.S., SHEFTEL A.D., PONKA P. — Intracellular kinetics of iron in reticulocytes : evidence for endosome involvement in iron targeting to mitochondria. Blood , 2005, 105, 368-375.
[37] GOLENDA C.F., ROSENBERG R. — Continuous in vitro propagation of the malaria parasite
Plasmodium vivax.
Proc. Natl. Acad. Sci., U S A, 1997, 94 , 6786-6791.
[38] VODYANIK M.A., BORK J.A., THOMSON J.A., SLUKVIN, II — Human embryonic stem cellderived CD34+ cells : efficient production in the coculture with OP9 stromal cells and analysis of lymphohematopoietic potential. Blood, 2005, 105 , 617-626.
[39] CAROTTA S., PILAT S., MAIRHOFER A., SCHMIDT U., DOLZNIG H. et al. — Directed differentiation and mass cultivation of pure erythroid progenitors from mouse embryonic stem cells.
Blood, 2004, 104 , 1873-1880.
DISCUSSION
M. Jacques Louis BINET
Comment expliquez-vous que, dans votre système, l’hémoglobine fœtale puisse devenir adulte alors qu’elle reste fœtale in vitro ? Êtes-vous sûr que les précurseurs, lors de dysmyélopoïèses, soient capables de produire des globules rouges puisque la maladie est une sorte d’avortement intramédullaire ? Faut-il appeler cette méthode thérapie cellulaire et non génique ?
Un des éléments en effet surprenant de notre travail est le contraste entre la production de globules rouges contenant de l’hémoglobine fœtale après maturation in vitro et des globules rouges contenant de l’hémoglobine adulte après maturation in vivo . Les données dont nous disposons aujourd’hui laissent penser que ceci est directement lié à l’état prolifératif des cellules CD34 en culture. En effet, en ralentissant le rythme prolifératif in vitro , nous sommes capables d’augmenter le taux d’hémoglobine A et de diminuer le taux d’hémoglobine F dans les globules rouges, attestant indirectement du fait que le meilleur système rencontré par les précurseurs érythroïdes est bien le micro-environnement médullaire. Nous avons étudié le comportement des cellules souches hématopoïétiques provenant de patients atteints de dysmyélopoïèse. Nous avons montré qu’ils sont dans la plupart des cas capables de générer in vitro des globules rouges matures. La problématique dans cette pathologie nous semble plus être de l’ordre du quantitatif, à savoir mobiliser suffisamment de cellules souches périphériques par injection de G-CSF pour pouvoir produire des quantités cliniquement intéressantes de globules rouges. Incontestablement cette méthode de production de globules rouges est tout à fait caractéristique de la thérapie cellulaire et non de la thérapie génique.
M. Michel BOUREL
Dans l’usage de ces globules rouges, dans les cas de myélodysplasie, pouvez-vous ‘‘ parer ’’ à l’émergence d’une surcharge en fer ? Quels sont les problèmes posés par la compatibilité dans le domaine des groupes sanguins ?
L’intérêt transfusionnel majeur que l’on peut voir dans ces globules rouges de culture réside dans le fait qu’une fois produits in vitro , ils ont tous devant eux la même espérance de durée de vie, de l’ordre de 120 jours. Ceci laisse espérer une meilleure efficacité transfusionnelle par comparaison à une transfusion de culots globulaires standards où la demi-vie est de 28 jours. C’est en diminuant le nombre de transfusions, grâce à une plus grande efficacité transfusionnelle, que l’on diminuera la surcharge martiale. Les globules rouges de culture expriment les mêmes antigènes de groupe sanguin que ceux du donneur.
M. Bernard PESSAC
Quel est le phénotype des cellules CD34+ qui deviennent ultérieurement des érythrocytes ?
L’enrichissement en cellules souches et progéniteurs hématopoïétiques a été réalisé par une sélection CD34+ globale. Nous n’avons pas cherché à sélectionner des sous-
populations de progéniteurs, soit plus primitives comme les CD34+/38-, soit déjà engagées dans la différenciation érythroïde. Ceci fera l’objet d’un travail ultérieur.
M. Roger NORDMANN
Vous mentionnez la prévention de la surcharge martiale liée aux polytransfusions lorsque ces transfusions sont réalisées avec des globules rouges générés in vitro . Quel est le mécanisme de cette prévention ? Avez-vous étudié le statut en fer de ces globules et diffère-t-il de celui des globules non produits in vitro ? Si ce statut est identique, attribuez-vous cette prévention de la surcharge martiale à l’espacement des transfusions réalisable avec les globules rouges générés in vitro du fait de leur homogénéité ?
Le statut en fer des globules rouges de culture est à priori strictement identique à celui des globules rouges standards dans la mesure où le contenu en hémoglobine n’est pas différent. Nous n’avons toutefois pas étudié dans le détail le contenu en fer de ces globules rouges de culture. En ce qui concerne la diminution de la surcharge martiale dans les syndromes myélodysplasiques, elle est liée au fait que les transfusions sanguines seront moins fréquentes pour la raison précisée précédemment.
M. Raymond ARDAILLOU
Avez-vous étudié les variations de volume des hématies en fonction de l’osmolalité du milieu et l’expression d’aquaporine 1 à leur surface ?
Nous avons étudié les variations de volume des hématies en fonction de l’osmolalité grâce à l’étude par ektacytométrie qui étudie leur déformabilité dans des solutions d’osmolalité croissante. Nous avons montré que la déformabilité des réticulocytes et des globules rouges ainsi générés est identique à celui des globules rouges natifs. Nous n’avons pas étudié l’expression de l’aquaporine 1 à leur surface.
M. André AURENGO
Quelles sont les propriétés rhéologiques des globules rouges dont vous présentez la culture, en dehors des propriétés de déformabilité dont vous avez parlé ? Le fait que tous les globules rouges aient le même âge ne peut-il pas présenter un inconvénient en cas de transfusion importante, au moment où, dans un intervalle de temps bref, tous ces globules arriveront en fin de vie ?
Les propriétés rhéologiques des globules rouges de culture ont été étudiées par ektacytométrie comme je l’ai précisé dans la question précédente. Il est évident que nous ne pourrons apporter toutes les réponses définitives quant au comportement normal in vivo de ces globules rouges de culture qu’après avoir étudié leur durée de vie après marquage au chrome 51 chez des receveurs sains. Votre deuxième question est juste mais le long délai d’efficacité de la transfusion permettra de programmer la transfusion suivante et de ne pas se retrouver dans une situation où tous les globules arriveront en fin de vie au même moment.
* UPRES EA1638, CHU St Antoine, Université Pierre et Marie Curie et Hôpital Trousseau, Paris. Tirés-à-part : Professeur Luc DOUAY, CHU St Antoine, 27, rue de Chaligny, 75571 Paris Cedex 12. Article reçu le 17 janvier 2005, accepté le 28 février 2005.
Bull. Acad. Natle Méd., 2005, 189, no 5, 903-915, séance du 10 mai 2005


