Résumé
Les différentes méthodes (notification spontanée ou utilisation de bases de données médicales) utilisées pour identifier et quantifier les effets indésirables médicamenteux souffrent de l’absence d’exhaustivité. La déclaration des effets indésirables médicamenteux aux centres régionaux de pharmacovigilance (CRPVs) pêche par la sous notification. La combinaison de plusieurs sources de données peut améliorer la connaissance de la fréquence de ces effets indésirables. Ce travail veut estimer l’incidence des effets indésirables graves au sein de l’hôpital universitaire de Toulouse, en utilisant deux sources indépendantes : d’une part, la base de données du programme de médicalisation des systèmes d’information (PMSI) et d’autre part, la base nationale de pharmacovigilance incluant les notifications spontanées aux CRPVs. La période de travail a été le premier semestre 2001. Nous avons relevé, au sein du PMSI, toutes les hospitalisations incluant un code de la dixième classification internationale des maladies, en rapport avec un effet indésirable potentiel. Au sein de la base nationale de pharmacovigilance, nous avons repéré tous les effets indésirables « graves » survenus durant la période d’étude et déclarés par les médecins travaillant au sein de l’hôpital universitaire de Toulouse. Après identification des cas communs aux deux bases de données, nous avons utilisé la méthode capture-recapture pour estimer le nombre réel d’effets indésirables survenus durant le premier semestre 2001 au sein de l’hôpital universitaire de Toulouse. Nous avons identifié dans le PMSI, 274 séjours hospitaliers différents, en rapport avec un effet indésirable médicamenteux. Parmi les 241 cas sélectionnés dans la base nationale de pharmacovigilance, nous en avons retenu 151 pour l’analyse. Cinquante-deux effets indésirables étaient communs aux deux bases de données. Ceci a permis d’estimer, par la méthode capture-recapture, un nombre d’effets indésirables médicamenteux ‘‘ graves ’’ de 796 [intervalle de confiance (IC) à 95 % : 638-954], correspondant à 2,9 % des hospitalisations [IC 95 % : 2,3-3,5] durant le premier semestre 2001. Cette étude rappelle le manque d’exhaustivité de la notification des effets indésirables médicamenteux, quelle que soit la source de données. Elle souligne l’intérêt de la méthode capture-recapture et de la combinaison de diverses bases de données pour améliorer l’évaluation des effets indésirables médicamenteux à l’hôpital.
Summary
There is evidence that the methods classically used to identify and quantify adverse drug reactions (ADRs), based on spontaneous reporting or computerized medical databases, are not exhaustive. Spontaneous notifications to regional pharmacovigilance centers suffer from under-reporting. Combining different sources could improve our knowledge of ADR frequency. The aim of this study was to estimate the incidence of serious ADRs handled in medical wards of a French university hospital, using data from the Programme de Medicalisation des Systemes d’Information (PMSI) and spontaneous reports recorded in the French PharmacoVigilance Database. The study period was the first 6 months of 2001. From the PMSI, we selected all hospitalization summaries that included an ICD-10 code related to a potential ADR. From the French PharmacoVigilance Database, we selected all serious ADRs that occurred during the study period and were reported by physicians working in the University Hospital. After identifying cases recorded in both sources, we applied the capture-recapture method in order to estimate the real number of ADRs. From the PMSI, we identified 274 different hospital stays involving an ADR. Out of 241 reports selected from the French PharmacoVigilance Database, we retained 151 ADRs for analysis. Fifty-two ADRs were found in both databases, giving an estimated total of 796 serious ADRs [95 % confidence interval (CI) 638, 954], corresponding to 2.9 % of inpatients (95 % CI 2.3, 3.5) during the first half of 2001. This study confirms the lack of exhaustiveness of ADR reporting, whatever the data source, and underlines the value of merging data from different databases.
Lors d’une précédente communication [1], nous avons souligné le manque d’exhaustivité des différents moyens (notification spontanée ou méthodes pharmacoépidé- miologiques utilisant les bases de données médicalisées) utilisées pour identifier et quantifier les effets indésirables médicamenteux. L’une des principales limites concerne la sous notification des effets indésirables médicamenteux aux centres régionaux de pharmacovigilance, empêchant la quantification réelle de l’impact des
effets indésirables médicamenteux en pratique quotidienne. Les études ayant évalué l’importance de cette sous-notification ont retrouvé des chiffres variant entre 92 et 96 % [1, 2]. Il s’avère donc nécessaire de développer d’autres méthodes permettant de quantifier l’importance de la sous notification des effets indésirables médicamenteux afin d’estimer le taux d’incidence des effets indésirables médicamenteux.
Parmi les méthodes épidémiologiques développées depuis une trentaine d’années, la méthode capture-recapture permet, en croisant plusieurs sources d’information, l’estimation du nombre total d’évènements ou encore de la taille totale d’une population. Cette méthode a été développée, à l’origine, en écologie, pour le comptage des populations sauvages : les animaux sont capturés, marqués, relâchés et sujets à une recapture [3, 4].
Dans ce travail, nous avons voulu estimer la fréquence réelle des effets indésirables médicamenteux « graves » dans un hôpital universitaire français, en utilisant cette méthode capture-recapture à partir de deux sources de données : la Base Nationale de PharmacoVigilance (BNPV) et le Programme de Médicalisation des Systèmes d’Information (PMSI).
MATÉRIEL ET MÉTHODES
L’étude a été conduite au centre hospitalier universitaire de Toulouse (2 818 lits, 160 000 admissions hospitalières annuelles par an, couvrant une population de plus de 900 000 habitants de la métropole toulousaine). Nous avons limité notre étude aux patients hospitalisés entre le 1er janvier et le 30 juin 2001.
Sources de données
Nous avons choisi, pour cette étude, deux sources de données possédant des informations sur les effets indésirables médicamenteux : la base nationale de pharmacovigilance et le PMSI.
La base nationale de pharmacovigilance enregistre toutes les notifications d’effets indésirables médicamenteux déclarées par les médecins et professionnels de santé.
Selon la loi, les professionnels de santé doivent déclarer aux centres régionaux de pharmacovigilance (CRPVs) tout effet indésirable ‘‘ grave ’’ ou encore ‘‘ inattendu ’’. On définit un effet indésirable ‘‘ grave ’’ comme un effet létal, nécessitant l’hospitalisation du patient ou prolongeant celle-ci ou entraînant une incapacité permanente ou encore mettant en jeu la vie du patient. Un effet indésirable ‘‘ inattendu ’’ n’est pas cité dans le résumé des caractéristiques du produit. Chaque notification spontanée est enregistrée, de façon anonyme, dans la base nationale de pharmacovigilance, avec les données suivantes : caractéristiques du patient, exposition médicamenteuse, évènements médicaux de façon anonyme. L’ensemble de ces données permet d’évaluer l’imputabilité médicamenteuse [1].
Le PMSI est le système français de classification des pathologies permettant la gestion hospitalière. À l’occasion de chaque séjour hospitalier, une fiche standardisée résume l’ensemble des données médicales. Elle contient des principales données administratives (nom, sexe, date de naissance, dates de début et de fin d’hospitalisation) et cliniques (diagnostic, procédure médicale et chirurgicale codée selon la classification de la dixième conférence internationale des maladies).
Définition des cas
Nous avons étudié les effets indésirables médicamenteux ‘‘ graves ’’, survenant ou diagnostiqués entre le 1er janvier et le 30 juin 2001, et pris en charge au sein du centre hospitalier universitaire de Toulouse. Nous avons exclu de cette étude les céphalées médicamenteuses puisqu’il n’est pas possible de connaître de façon précise la date de début de cet effet indésirable. Nous avons également éliminé les anémies survenant dans le contexte de transplantation de moelle, les évènements en rapport avec une utilisation inadéquate de médicaments (intoxication, surdosage intentionnel, pharmacodépendance), les complications de la radiothérapie ou encore tout acte médical technique (comme les ponctions veineuses ou intrarachidiennes) ainsi que les hospitalisations pour bilan d’allergie médicamenteuse. Nous avons inclus dans ce travail toutes les unités d’hospitalisation du centre hospitalier universitaire de Toulouse, sauf deux (une unité d’endocrinologie et une unité d’urgences) pour lesquelles les rapports d’hospitalisation n’étaient pas (à cette époque) systématiquement disponibles. Nous n’avons pas, non plus, pris en compte les unités psychiatriques et pédiatriques puisque les données médicales n’étaient pas recueillies de façon exhaustive au moment de ce travail, en raison de restructurations et de déménagements hospitaliers.
Sélection des cas et identification des cas communs
Nous avons sélectionné les codes de diagnostic de la dixième classification internationale des maladies décrivant un évènement possiblement d’origine médicamenteuse. À partir de la base de données du PMSI, nous avons relevé, durant la période de l’étude et parmi les unités d’hospitalisation participantes, tous les résumés de sortie incluant l’un des codes sélectionnés de la dixième classification internationale des maladies. Nous avons examiné tous les résumés de sortie correspondants pour vérifier la validité de l’effet indésirable médicamenteux, le critère de la définition des cas et pour identifier la nature et la gravité de l’effet indésirable médicamenteux ainsi que le médicament impliqué. Les effets indésirables médicamenteux ont été classés selon la terminologie des effets indésirables médicamenteux de l’Organisation Mondiale de la Santé (WHO-Art Classification). Au sein de la base nationale de pharmacovigilance, nous avons identifié tous les effets indésirables ‘‘ graves ’’, survenus ou diagnostiqués durant le premier trimestre 2001 et rapportés par un professionnel de santé du centre hospitalier universitaire de Toulouse durant l’année 2001 au centre Midi-Pyrénées de pharmacovigilance. Nous avons revu chacune des
notifications spontanées afin de vérifier la définition du cas et d’exclure les effets indésirables médicamenteux ne justifiant pas l’hospitalisation dans l’unité d’hospitalisation étudiée durant la période d’étude. Nous avons aussi enregistré les données démographiques sur le patient et les caractéristiques de l’effet indésirable pour identifier les cas communs entre les deux sources de données. Nous avons confirmé les périodes de séjours hospitaliers, en croisant les données avec les dates d’admissions et de sorties enregistrées dans la base de données du PMSI.
Les cas communs ont été identifiés entre les deux sources en utilisant les données démographiques (initiales du nom, du prénom, et date de naissance), les caractéristiques de l’effet indésirable, les médicaments impliqués et les dates de séjours hospitaliers.
La méthode capture-recapture
Cette méthode permet, en croisant plusieurs sources d’informations issues d’une même population, d’estimer le nombre de cas qui ne sont identifiés par aucune des sources, le nombre total de cas ainsi que l’exhaustivité de chaque source. Utilisée en zoologie ou en démographie, cette technique est appliquée à l’épidémiologie depuis une vingtaine d’années. En épidémiologie, elle consiste à combiner des données concernant la même population mais provenant de plusieurs sources. Après identification des doublons entre les sources, la méthode capture-recapture permet l’estimation du nombre de cas non identifiés par aucune des deux sources. Ainsi, on peut en déduire le nombre total des cas dans la population et la sensibilité de chaque source de données (figure 1). Si on fait l’hypothèse que N1 + C est le nombre d’effets indésirables médicamenteux rapportés à la première source d’information (ici le PMSI), N2 + C le nombre d’effets indésirables rapportés à la seconde source de données (ici la base nationale de pharmacovigilance), (avec C le nombre de cas communs entre les deux sources et X le nombre de cas non identifiés par aucune des sources), le nombre total de cas N peut être calculé selon l’équation N = N 1 N 2 [3, 4]. On estime la variance et l’intervalle de confiance à 95 % (IC 95 %)
C à l’aide des équations habituelles (figure 1).
On peut aussi calculer le taux d’exhaustivité de chaque source (égal au nombre de cas rapporté à une source divisé par le nombre total de cas N) ainsi que le taux d’exhaustivité de l’ensemble des deux sources (égal à (N1+N2)-C/N) [3, 4].
RÉSULTATS
À partir de la base de données PMSI, après avoir revu les rapports de sortie, nous avons exclu 22 hospitalisations en rapport avec des effets indésirables médicamenteux identifiés avant 2001, 141 concernant des effets indésirables médicamenteux non graves, 33 rapportant une anémie dans le cadre d’une transplantation de moelle,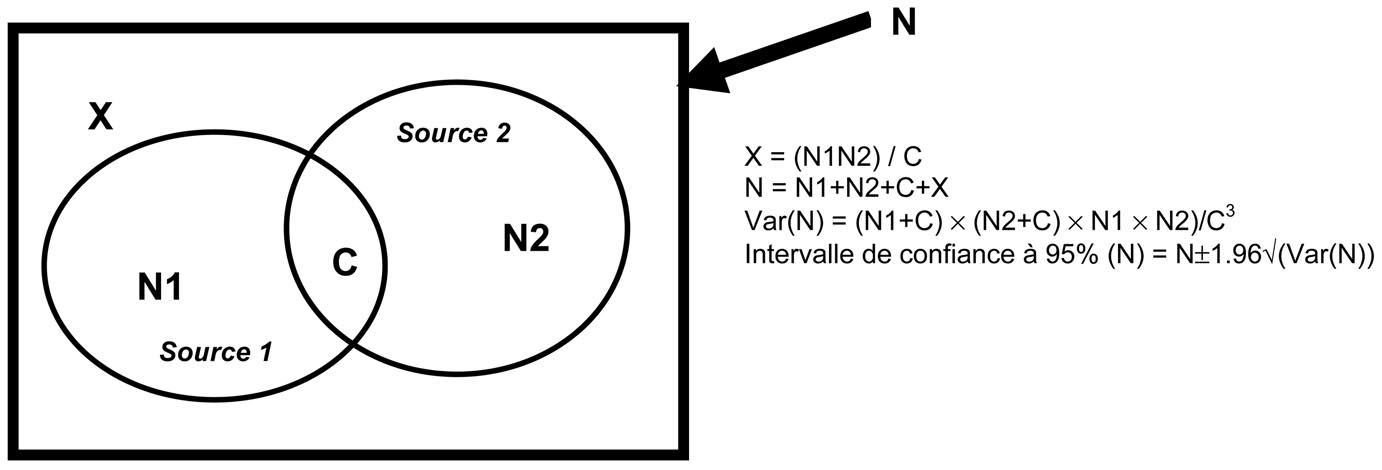
X = nombre de cas non identifiés par aucune des sources C = nombre de cas communs entre les deux sources N1+C = nombre d’effets indésirables médicamenteux rapportés à la source 1 N2+C = nombre d’effets indésirables médicamenteux rapportés à la source 2 N = nombre total de cas Var = variance FIGURE 1. — Présentation de la Méthode Capture-Recapture : distribution des cas dans deux sources de données et principes de calcul.
50 concernant un bilan d’allergie, 34 des céphalées, 12 correspondant à une utilisation inadéquate de médicaments, 28 pour lesquels les rapports n’étaient pas disponibles et 2 correspondant à des complications de la radiothérapie. Finalement, selon les critères d’inclusion, nous avons retenu 274 effets indésirables médicamenteux différents, correspondant à 261 patients (certains malades ont présenté deux ou plus effets indésirables graves différents durant cette période de six mois).
Au sein de la base nationale de pharmacovigilance, nous avons retrouvé deux cent quarante et un effets indésirables ‘‘ graves ’’, identifiés durant le premier semestre 2001 et rapportés par les médecins du centre hospitalier universitaire de Toulouse au centre régional de pharmacovigilance. Nous avons exclu cinquante-trois notifications en rapport à des unités d’hospitalisation non incluses dans l’étude ou à des périodes d’hospitalisations non adéquates. Nous avons également éliminé quatorze déclarations ne nécessitant pas d’hospitalisation et trois rapportant des utilisations inadéquates des médicaments ou des complications de techniques médicales. Pour treize notifications, nous avons retrouvé des erreurs dans la transcription des données (effets indésirables médicamenteux survenus avant 2001 ou non rapportés par le centre hospitalier universitaire de Toulouse). Trois effets indésirables médicamenteux ont été enregistrés deux fois et pour quatre autres, l’information sur l’hospitalisation n’était pas disponible. Finalement, nous avons retenu cent cinquante et un effets indésirables médicamenteux au sein de la base nationale de pharmacovigilance.
La figure 2 présente la distribution des effets indésirables médicamenteux par organes cibles et selon la classification de l’OMS. Un effet indésirable médicamenteux peut concerner plusieurs systèmes. On retrouve des différences dans le type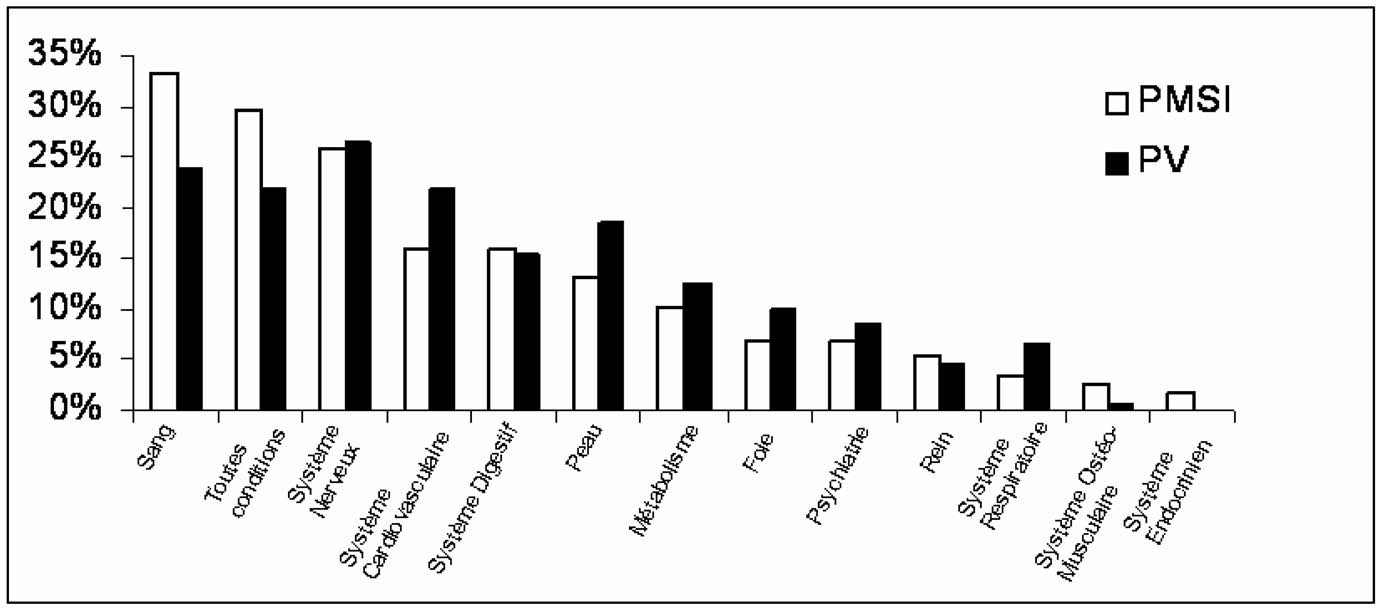
FIGURE 2. — Comparaison de la distribution des effets indésirables médicamenteux dans les bases de données du PMSI et de la PharmacoVigilance (PV) par organes cibles (selon la classification OMS).
d’effet indésirable identifié dans chaque source. Les médecins ont tendance à ne pas rapporter les effets indésirables ‘‘ attendus ’’ au centre régional de pharmacovigilance : ainsi, les réactions hématologiques aux médicaments anticancéreux sont signalés dans la base de données du PMSI et rarement notifiés au système national de pharmacovigilance.
Après avoir regroupé les effets indésirables des deux bases de données, nous avons identifié cinquante-deux doublons (cas présents dans les deux bases de données) (C).
En utilisant la méthode capture-recapture, le nombre total d’effets indésirables médicamenteux « graves », survenus au premier trimestre 2001 au sein des hôpitaux universitaires de Toulouse, a été estimé à 274 x 151 soit 796 [IC 95 % : 638-954].
52 Ainsi, le taux d’exhaustivité de la base PMSI peut être estimé à 274/796, soit 34 %, et celui de la base nationale de PharmacoVigilance à 151/796, soit 19 %. L’exhaustivité estimée des deux sources est donc de 47 % [(274 + 151) – 52].
796 Durant le premier semestre 2001, 27 426 patients ont été hospitalisés au moins une fois dans les unités d’hospitalisation incluses dans cette étude et le nombre total d’admissions à l’Hôpital a été de 39 441. La fréquence des effets indésirables parmi les patients a donc été de 2,9 % (IC 95 % : 2,3-3,5) correspondant à 2,0 % des admissions (IC 95 % : 1,6-2,4).
DISCUSSION
À la suite des écologistes et des démographes, les épidémiologistes ont utilisé la méthode capture-recapture pour estimer la prévalence ou l’incidence des maladies chez l’homme [4, 5]. Cette méthode s’avère utile pour estimer la fréquence d’un évènement lorsque plusieurs sources d’informations sont disponibles et peuvent être croisées. Sa mise en œuvre apparait comme relativement simple.
Largement utilisée par ailleurs, cette méthode n’a trouvé, de façon surprenante, que peu d’applications en matière de PharmacoVigilance [3]. Cependant, son applicabilité à la PharmacoVigilance et à la pharmacoépidémiologie doit être discutée. Six conditions d’application doivent être remplies pour son utilisation [5] : tous les cas identifiés doivent être de vrais cas ; tous les cas identifiés doivent survenir pendant la période et dans la zone géographique étudiée ; la population étudiée doit être close, c’est-à-dire sans aucun mouvement de population ; tous les vrais cas communs et seulement les vrais cas communs doivent être identifiés ; les sources doivent être indépendantes entre elles ; enfin, tous les cas de la population étudiée ont la même probabilité d’être identifiés par une même source, c’est à dire qu’il existe une homogénéité de capture des cas.
La première condition implique que tous les cas soient réels, c’est-à-dire des effets indésirables « graves » authentiquement vérifiés. La revue détaillée des cas dans les deux sources de données nous a permis de valider l’ensemble de ces effets indésirables médicamenteux, leur « gravité » en particulier. Cependant, dans certaines observations du PMSI, nous avons eu parfois quelques difficultés pour préciser la date de survenue et/ou la « gravité » de l’effet indésirable.
L’identification des cas en deux étapes successives (résumé informatisé puis retour à l’observation papier au sein du centre régional de pharmacovigilance) nous a permis de vérifier la seconde condition d’applicabilité : unicité de la période et du lieu de survenue. Nous avons notamment interrogé la base nationale de pharmacovigilance sur toute l’année 2001 pour repérer éventuellement des effets indésirables survenus durant le premier semestre 2001, mais déclarés plus tardivement.
Au sein des deux bases de données (anonymes et closes), nous avons identifié sans aucune difficulté et de façon exhaustive les doublons (ou cas communs) à partir des caractéristiques des patients, de l’effet indésirable, du médicament imputé et de la période d’hospitalisation.
La condition d’indépendance des deux sources de données utilisées dans cette étude (PMSI et base nationale de pharmacovigilance) doit être discutée. Lorsqu’on fait appel à deux sources de données, leur dépendance peut s’évaluer que qualitativement, c’est-à-dire en analysant les modes de recrutement des deux sources [5]. Dans ce travail, malgré différentes méthodes de collection de données, on peut penser que les effets indésirables sont souvent notifiés à la pharmacovigilance par le médecin qui remplit en fin d’hospitalisation le dossier PMSI. Ce n’est cependant pas
systématiquement le cas puisque les effets indésirables médicamenteux sont souvent signalés au sein des hôpitaux de Toulouse par du personnel soignant non médical (infirmiers…) et que les différents types d’effets indésirables retrouvés dans les deux sources ne sont pas comparables (comme le montre la figure 2).
Le dernier critère (homogénéité de la capture des cas) permet de discuter de la plus grande fréquence de certains effets indésirables dans l’une des deux sources. Par exemple, les effets indésirables d’un nouveau médicament, les effets « inattendus » ont plus de probabilité d’être notifiés (en raison de la loi) à la pharmacovigilance. À l’inverse, nous avons trouvé que les réactions hématologiques aux médicaments anticancéreux sont plus fréquemment signalées dans la base de données du PMSI qu’au système national de pharmacovigilance (puisqu’il s’agit d’un effet indésirable attendu ). Ces différences concernant l’homogénéité des sources peuvent conduire à une surestimation du nombre total estimé des effets indésirables médicamenteux.
Malgré ses limites obligatoires, notre travail s’accorde avec les données d’autres études du même type publiées antérieurement [6-8]. Par exemple, le réseau français des centres régionaux de pharmacovigilance a estimé la prévalence des effets indé- sirables chez les patients hospitalisés à 10,3 % (avec un effet indésirable « grave » dans 33 % des cas) [7] et le pourcentage de patients hospitalisés pour effet indésirable médicamenteux à 3,19 % (IC 95 % : 2,37 %-4,01 %) [8]. Notre étude retrouvant une valeur de 2,9 % confirme ces données et permet donc de valider l’application de la méthode capture-recapture à la pharmacovigilance et la pharmacoépidémiologie.
En conclusion, cette étude rappelle le manque d’exhaustivité de la notification des effets indésirables médicamenteux, quelle que soit la source de données. Elle montre la complémentarité, en matière de pharmacovigilance, du PMSI et de la base nationale de pharmacovigilance. Elle souligne finalement l’intérêt de la méthode capture-recapture et de la combinaison de diverses bases de données pour quantifier réellement l’impact des effets indésirables médicamenteux à l’hôpital.
REMERCIEMENTS
Les auteurs remercient Madame Emmanuelle Roussel pour la préparation soigneuse du manuscrit.
BIBLIOGRAPHIE [1] MONTASTRUC J.L., BAGHERI H., LACROIX I., OLIVIER P., DURRIEU G., DAMASE-MICHEL C., LAPEYRE-MESTRE M. — Nouvelles méthodes du risque médicamenteux : l’expérience du Centre Midi-Pyrénées de PharmacoVigilance. Bull. Acad. Natle Méd., 2005 , 189, 493-505.
[2] BEGAUD B., MARTIN K., HARAMBURU F., MOORE N. — Rates of spontaneous reporting of adverse drug reactions in France. JAMA, 2002 , 288, 1588.
[3] JONVILLE-BERA A.P., AUTRET E. — Est-il possible d’évaluer la sous-notification des effets indésirables médicamenteux par la méthode capture-recapture ?. Thérapie, 1996 , 51, 169-175.
[4] MARTYN C.N. — Capture-recapture methods in surveys of diseases of the nervous system.
J
Neurol Neurosurg Psychiatry, 1998, 64, 2-3.
[5] GALLAY A., NARDONEL A., VAILLANT V., DESENCLOS J.C. — La méthode capture-recapture appliqué à l’épidémiologie. Principes, limites et applications. Rev. Epidemiol. Santé publique, 2002 , 50, 219-232 .
[6] LAZAROU J., POMERANZ BH., COREY PN. — Incidence of adverse drug reactions in hospitalized patients : a meta-analysis of prospective studies. JAMA , 1998 , 279, 1200-5.
[7] IMBS JL., POUYANNE P., HARAMBURU F., WELSCH M., DECKER N., BLAYAC JP., BEGAUD B.
—Iatrogenic medication : estimation of its prevalence in French public Hospitals. Regional PharmacoVigilance Centers. Thérapie, 1999 , 54, 21-7.
[8] POUYANNE P., HARAMBURU F., IMBS J.L., BEGAUD B. — For the French PharmacoVigilance Centres — Admissions to hospital caused by adverse drug reactions : cross sectional incidence study. French PharmacoVigilance Centres. Br. Med. J., 2000 , 320, 1036.
DISCUSSION
M. Jean-Paul GIROUD
Deux, neuf pour cent des hospitalisations en France ont des effets indésirables graves. Qu’en est-il dans les autres pays de la CE ? Quel est le pourcentage des effets indésirables liés à l’utilisation de médicaments de prescription facultative ? Par ailleurs, le PMSI pourrait-il remplacer la base nationale de pharmacovigilance ?
On dispose de quelques études descriptives et intensives issues des autres pays européens : elles retrouvent des chiffres analogues. Il convient cependant de rappeler que le nombre de déclarations d’effets indésirables médicamenteux aux structures de pharmacovigilance s’avère nettement plus élevé en France que dans les autres pays européens. On ne connaît pas le pourcentage réel des effets indésirables liés à l’utilisation de médicaments de prescription facultative. Cependant, une étude réalisée par notre équipe entre 1993 et 1996 a montré que 2 % des effets indésirables déclarés à notre centre régional de pharmacovigilance concernait les médicaments dits d’ « automédication ». Enfin, nous devons souligner les difficultés de recherche et caractérisation des effets indésirables médicamenteux dans le PMSI. Celui-ci contient notamment, à propos des prescriptions médicamenteuses, de nombreuses informations incomplètes : l’exploitation des données du PMSI dans cette enquête a nécessité un énorme travail de validation avec retour aux dossiers papiers. Le PMSI est une base de gestion administrative : elle ne pourra bien sûr jamais remplacer la base nationale de pharmacovigilance qui s’avère bien adaptée dans tous ses items à la caractérisation des différents effets indésirables médicamenteux.
M. Patrice QUENEAU
La méthode de capture-recapture que vous avez présentée a l’indiscutable mérite d’améliorer l’identification des effets indésirables médicamenteux. Malgré ce progrès, je crains que
vos données chiffrées restent encore fortement sous-évaluées par le fait que ces deux méthodes de recueil sont elles-mêmes empreintes de sous-notifications importantes : vous avez dit vous-même que la base PMSI n’était que peu appropriée pour repérer des effets indésirables médicamenteux et vous avez souligné également la grande déperdition de la base nationale de Pharmacovigilance. Malgré l’intérêt de la méthode que vous avez utilisée, la prévalence que vous avez relevée est probablement très inférieure à la réalité. Qu’en pensez-vous ? D’autre part, quelle méthode d’imputabilité avez-vous utilisée pour évaluer la fréquence des effets indésirables médicamenteux dans la base PMSI ? Enfin, lorsque vous avez repris les dossiers de la base PMSI, quel a été le pourcentage d’augmentation de votre détection d’effets indésirables par rapport à ceux spontanément déclarés par les services hospitaliers ?
Je partage votre avis sur la sous notification des effets indésirables et sur le fait que le chiffre trouvé dans cette étude s’avère, très vraisemblablement, sous-évalué. Je veux simplement rappeler que notre travail concerne les effets indésirables « graves ». Nous avons utilisé, dans ce travail, la méthode française d’imputabilité. Enfin, nous n’avons pas d’idée précise du nombre de nouveaux cas détectés directement dans les dossiers cliniques par rapport à ceux qui étaient spontanément signalés au PMSI. Notre étude n’avait pas prévu ceci. Ce pourcentage semble cependant faible.
M. Georges DAVID
Quel était le mode de distribution des médicaments dans les établissements couverts par votre étude ? D’autre part, la prescription et la délivrance relevaient-elles d’un système informatique permettant par l’accès, aux données du patient, de la pharmacie centrale, de réduire la pourcentage des accidents médicamenteux ? Vos données sont-elles en concordance avec celles de l’enquête ENEIS ?
Seul un petit nombre de services disposait, au moment de notre étude, d’une automatisation de la prescription et de la délivrance. Nos données complètent les résultats de l’enquête ENEIS qui, je veux le rappeler, concernait les évènements indésirables liés aux soins et non spécifiquement les effets indésirables des médicaments.
M. Alain Abbas SAFAVIAN
Le but de toute étude sur l’iatrogenèse étant d’objectiver les méfaits provoqués par nos thérapeutiques, quels critères avez-vous utilisés pour définir la ‘‘ gravité ’’ de ces effets indésirables ? Le fait de mettre le pronostic vital en jeu, bien sûr, mais les effets ayant nécessité en eux-mêmes une hospitalisation ne sont-ils pas graves ?
Notre travail concerne les effets indésirables « graves », définis selon la classification de l’OMS comme des effets « entraînant la mort ou mettant en jeu la vie du patient ou déterminant une anomalie ou une malformation congénitale ou une invalidité ou une incapacité importante ou durables ou enfin déterminant ou prolongeant une hospitalisation ».
* Laboratoire de pharmacologie médicale et clinique, Unité de pharmacoépidémiologie, EA 3696, Faculté de médecine, 37 allées Jules-Guesde, 31000 Toulouse, e-mail : montastruc@cict.fr ** Pharmacologie clinique, Centre Midi-Pyrénées de pharmacovigilance, de pharmacoépidémiologie et d’informations sur le médicament, CHU de Toulouse. *** Fédération d’informatique médicale et d’évaluation, CHU de Toulouse. Tirés-à-part : Professeur Jean-Louis MONTASTRUC, même adresse. Article reçu le 26 mars 2007, accepté le 21 mai 2007.
Bull. Acad. Natle Méd., 2008, 192, no 2, 421-431, séance du 5 février 2008


