Résumé
A l’occasion de l’épizootie de fièvre aphteuse sévissant depuis février 2001 en Europe occidentale, l’auteur décrit l’évolution de la situation épidémiologique de la maladie, ses principales caractéristiques épidémiologiques, les stratégies possibles de lutte et le danger potentiel pour l’homme.
Summary
The author describes the evolution of the epidemiological situation of foot-and-mouth disease in European Union since February 2001, its main epidemiological aspects, the ways to fight against it and the potential risk for man.
INTRODUCTION
Depuis le 20 février 2001, la fièvre aphteuse a remplacé l’encéphalopathie spongiforme bovine ou maladie de la vache folle dans les médias. Cette dernière, maladie nouvelle et comportant encore de nombreuses inconnues, était devenue une préoccupation de santé importante et presque bien connue du grand public.
A l’inverse, la fièvre aphteuse, maladie connue depuis des siècles [4] mais absente d’Europe de l’ouest depuis 1981, a dû être « redécouverte », d’une part par les
médias, d’autre part par les consommateurs, inquiets d’un nouveau danger pouvant les menacer. Danger apparaissant d’autant plus redoutable que les images de bûchers ont envahi les écrans de télévision pendant des semaines et que des mesures de lutte spectaculaires étaient annoncées et appliquées.
Les lignes qui suivent ont pour objectif de faire brièvement le point, en utilisant les informations récentes, sur :
— l’évolution de la situation épidémiologique de la fièvre aphteuse en Europe au cours de ces dernières semaines ;
— les principales caractéristiques épidémiologiques de cette maladie ;
— les stratégies de lutte que l’on peut appliquer ;
— le danger potentiel pour l’homme.
ÉVOLUTION DE LA SITUATION ÉPIDÉMIOLOGIQUE
Au Royaume-Uni
Le Royaume-Uni était un pays indemne de fièvre aphteuse depuis 1968 (il avait connu une épizootie meurtrière en 1967-1968), touché en 1981 par un seul foyer apparu sur l’Ile de Wight, certainement à cause d’un transport éolien de virus au-dessus de la Manche, à partir de la Bretagne où sévissait la dernière miniépizootie française du XXème siècle.
En début 2001, le Royaume-Uni était distant de plusieurs milliers de kilomètres du foyer le plus proche de fièvre aphteuse [11]. Aussi, l’annonce de la constatation de la maladie sur des porcs attendant d’être abattus dans un abattoir du sud du pays a fait l’effet d’une bombe ; elle est tombée sur un pays ne se doutant pas que le virus avait diffusé de façon silencieuse aux quatre coins du royaume au cours des jours précédents. Les informations disponibles au cours des semaines suivantes ont permis de mieux comprendre les mécanismes d’apparition du premier foyer et de dispersion de nombreux foyers secondaires.
La situation actuelle peut être illustrée par deux figures : la Figure 1 présente la distribution géographique des foyers à la date du 30 avril 2001 et la Figure 2, l’évolution du nombre quotidien de nouveaux foyers.
Le premier facteur a été l’importation d’aliments contaminés par la souche Pan Asia de virus aphteux de type O à partir d’un pays (non déterminé pour l’instant) où elle sévit. La nature du circuit d’importation a fait l’objet d’hypothèses successives :
plateaux repas d’avions assurant des vols intercontinentaux, restaurants chinois de la ville voisine du foyer initial, cantines scolaires et, plus récemment, ravitaillement utilisé par l’armée. L’enquête en cours permettra peut-être d’arriver à des conclusions précises.
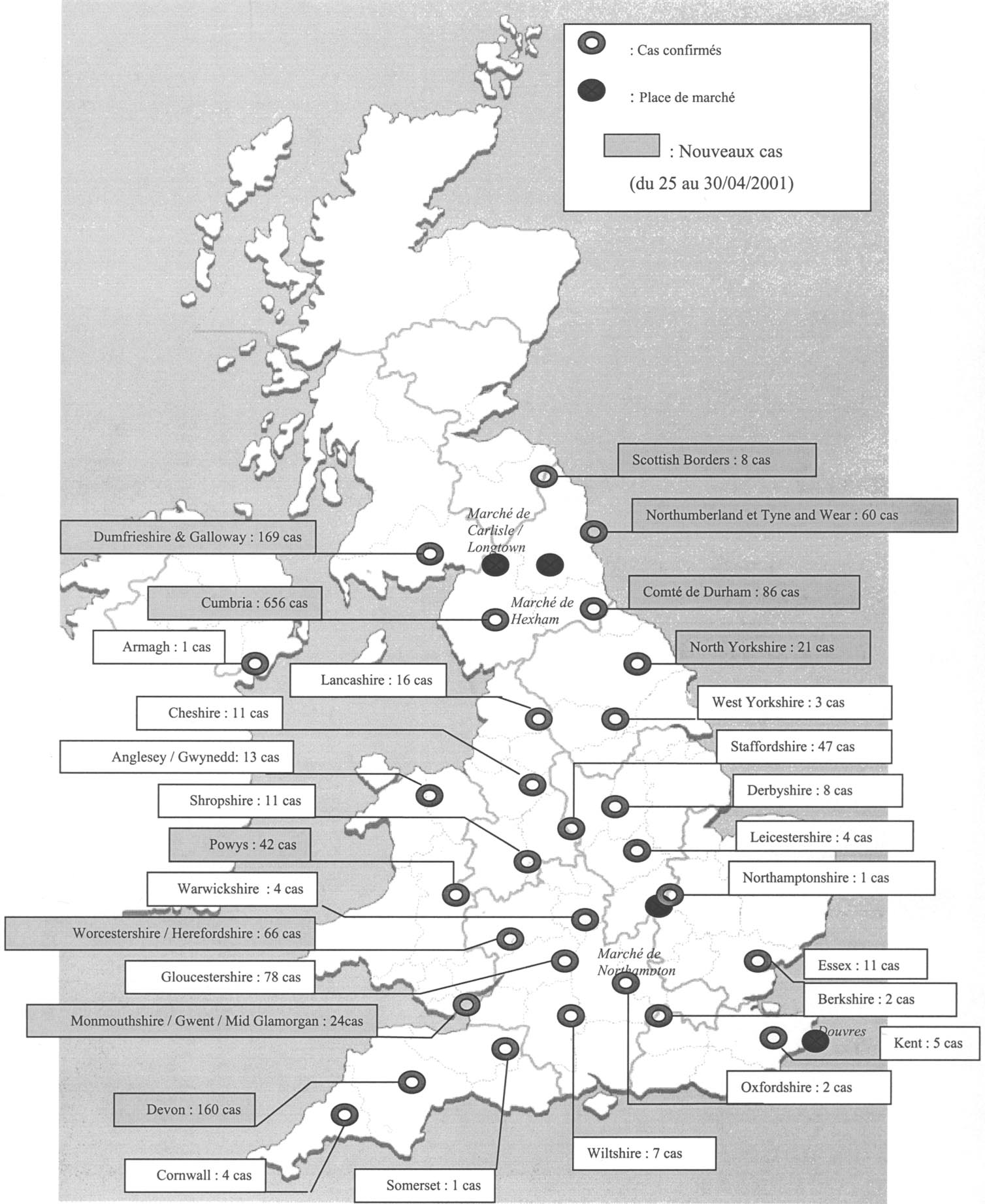
FIG. 1. — Zones de distribution cumulée des foyers de fièvre aphteuse au Royaume-Uni au 30 avril 2001.
FIG. 2. — Distribution du nombre quotidien et du nombre cumulé de foyers de fièvre aphteuse enregistrés au Royaume-Uni du 20 février au 30 avril 2001 (MAFF).
Le deuxième facteur a été l’utilisation d’eaux grasses, contenant l’un ou l’autre de ces résidus de restauration contaminés, insuffisamment chauffés, pour l’alimentation des porcs.
Le troisième facteur a été l’insuffisance de surveillance et de vigilance dans la porcherie constituant le foyer initial puisqu’il est considéré que la maladie a dû y sévir pendant près de deux semaines avant d’être détectée… à l’abattoir où étaient envoyés les porcs. Ce délai a permis la contamination d’élevages ovins et bovins environnants, compte tenu de la forte excrétion du virus aphteux par les porcins atteints et de sa diffusion par voie aérienne dans l’environnement.
Le quatrième facteur tient à la particularité de cette souche qui n’entraîne des symptômes chez le mouton que chez environ 5 % des animaux. Associé aux nombreux mouvements de moutons vers et à partir de marchés à cette époque de l’année, ce portage inapparent a participé à une large diffusion du virus dans de nombreuses régions du Royaume-Uni (Fig. 1).
L’effet de surprise, complété par les nombreuses difficultés pour l’abattage des animaux et la destruction des carcasses dans des foyers en nombre croissant sur un mode exponentiel et dispersés, a rendu la situation très difficile fin février et pendant tout le mois de mars. Au point que le recours à la vaccination, arme ultime, encore jamais employée pour lutter contre la fièvre aphteuse dans ces régions privilégiées par leur situation insulaire a été envisagé, l’autorisation demandée à la Commission européenne et obtenue ; son emploi a toutefois été différé jusqu’à présent. Au cours du mois d’avril, la situation s’est lentement améliorée grâce à l’atteinte progressive des objectifs de l’action sanitaire que l’on peut résumer ainsi :
— délai maximal de 24 heures entre l’identification d’un foyer et l’abattage de tous les animaux des espèces sensibles présents dans ce foyer ;
— délai maximal de 48 heures pour l’abattage des animaux des exploitations voisines du foyer ou en relation épidémiologique avec lui.
Des prévisions sont faites quant à l’évolution probable de cette épizootie qui a déjà conduit à l’abattage et à la destruction de plus de deux millions d’animaux : avec ou plus probablement d’ailleurs sans vaccination, des foyers devraient continuer à apparaître au cours des prochains mois, de façon décroissante, avec un risque de réactivation passagère.
L’un des dangers (apparemment déjà survenu), est la contamination de la faune sauvage, notamment des chevreuils, sur laquelle les moyens de lutte sont d’efficacité limitée, avec pour corollaire le risque de recontamination accidentelle des animaux domestiques.
En Europe
A partir du Royaume-Uni, la fièvre aphteuse a atteint la République d’Irlande (un foyer), la France (deux foyers) et les Pays-Bas (26 foyers).
Cette limitation de l’extension de la fièvre aphteuse en dehors du Royaume-Uni est due aux mesures de prévention mises en place dès la déclaration initiale de la maladie (embargo sur tous les animaux des espèces sensibles et des produits d’origine animale en provenance du Royaume-Uni) ainsi qu’aux mesures prises par les différents pays d’Europe continentale pour rechercher les animaux importés depuis le 1er février et les abattre, de même que les animaux ayant été en contact avec eux.
Ainsi, c’est grâce à l’abattage « préventif » de près de 60 000 animaux (et à toute une série d’autres mesures comme l’interdiction du transport des animaux des espèces sensibles, voire des chevaux) que la France a pu éviter une catastrophe sanitaire analogue à celle qui frappe le Royaume-Uni.
ÉPIDÉMIOLOGIE DE LA FIÈVRE APHTEUSE
Il s’agit de la maladie animale la plus contagieuse. Ceci est lié à la fois à une incubation courte (quelques jours), qui rend un animal producteur d’une quantité importante de virus peu de temps après sa contamination, à la localisation superficielle, extérieure, du virus, favorisant son excrétion dans le milieu ambiant, et à la grande résistance du virus.
Ainsi, le virus peut être transmis de manière directe ou indirecte par les supports les plus divers (aliments, véhicules, personnes, animaux réfractaires, vent…).
Les points les plus importants sont :
— la production intense de virus par les animaux malades, avec pour corollaire l’intérêt d’essayer d’empêcher que des animaux atteignent ce stade et produisent
des quantités considérables de virus. Le porc, en particulier, est un producteur et excréteur redoutable de virus aphteux par voie aérienne : en une minute, un porc atteint de fièvre aphteuse peut excréter suffisamment de virus pour entraîner la contamination de 70 000 bovins ;
— l’excrétion présymptomatique du virus par les animaux en fin d’incubation. Ces deux éléments justifient pleinement le concept relativement nouveau dans la lutte contre la fièvre aphteuse qui consiste à abattre, non seulement les animaux dans les foyers identifiés où la maladie s’est déclarée cliniquement, mais également ceux des élevages voisins de tout foyer, qu’ils soient déjà contaminés ou non ;
— la transmission possible du virus à grande distance (100 à 200 kilomètres) par voie aérienne, au-dessus de l’eau lorsque certaines conditions sont réunies :
atteinte du porc, vent modéré, régulier, humidité relative élevée, etc.
En résumé, compte tenu de l’extraordinaire potentiel de transmission directe et indirecte de ce virus, il est nécessaire d’adapter parfaitement les stratégies de lutte à chaque situation en tenant compte à la fois de données épidémiologiques et de données économiques.
LES STRATÉGIES DE LUTTE
Ces stratégies sont variables dans le temps et dans l’espace.
En France (et dans bien d’autres pays), pendant la première moitié du XXème siècle, l’absence ou l’insuffisance de vaccins contre la fièvre aphteuse a conduit à accepter la maladie, à limiter les déplacements des animaux et à utiliser différents moyens de fortune pour tenter d’en atténuer l’expression clinique ou les séquelles. Aussi surprenant que cela puisse paraître, en ce début du XXIème siècle, des voix s’élèvent pour recommander de retourner à cette politique, arguant du fait que le danger est très faible pour l’homme (ce qui est vrai) et que la maladie guérit le plus souvent (ce qui est également vrai). Mais ces voix négligent le fait qu’une telle attitude conduirait à empêcher les exportations d’animaux et de produits d’origine animale à partir de tels pays. Il n’est pas inutile de rappeler que les exportations de viande bovine et de reproducteurs bovins ont rapporté à la France, en 1996, la somme de 17 milliards de francs français, celles de produits laitiers, 22 milliards [12].
La disponibilité de vaccins aphteux en quantité et qualité croissantes après la Seconde Guerre mondiale a permis l’augmentation de leur emploi et, par suite, conduit à une diminution progressive du nombre annuel de foyers en France. A partir des années 1960, la vaccination est devenue obligatoire pour tous les bovins de plus de 6 mois, ce qui a rendu possible de lui associer un abattage des animaux dans les foyers résiduels. Cette stratégie de prophylaxie médico-sanitaire appliquée pendant trente ans a permis l’éradication de la maladie et le passage à la phase ultime de prophylaxie exclusivement sanitaire appliquée dans l’Union européenne depuis
1991. Compte tenu de l’hécatombe appliquée au Royaume-Uni et dans des pays de l’Union européenne, des voix, assez nombreuses, s’élèvent pour réclamer le retour à la vaccination, sans forcément en préciser les caractéristiques.
L’Union européenne n’échappera pas, dans les mois qui viennent, à une réflexion approfondie et à des débats animés entre les tenants de la vaccination et ceux qui n’y sont pas favorables.
Les éléments qu’il faut avoir en mémoire avant d’évoquer les stratégies possibles de recours à la vaccination aphteuse sont les suivants :
— il existe sept types antigéniques de virus aphteux, avec de nombreux sous-types [10] ; l’immunité croisée est nulle entre types différents et limitée entre sous-types ;
— les animaux des espèces sensibles sont très nombreux, domestiques (bovins, ovins, caprins, porcins) et sauvages. Pour l’Europe, il s’agit de l’ordre de 300 millions d’animaux domestiques ;
— l’immunité homologue est excellente. Elle protège parfaitement contre la maladie ; toutefois, comme pour de nombreuses viroses atteignant les muqueuses, elle n’empêche pas pour autant la multiplication et l’excrétion du virus sauvage en cas de contamination d’un animal vacciné (même si l’excrétion est sans commune mesure avec celle d’un animal infecté, non vacciné). Un animal vacciné, puis contaminé par une souche sauvage, peut donc en être porteur et excréteur pendant quelques semaines à quelques mois. Ce danger potentiel explique la méfiance des pays indemnes vis-à-vis des animaux des pays qui vaccinent contre la fièvre aphteuse ;
— pour l’instant, on ne dispose pas de vaccin ou de technique sérologique de dépistage permettant de distinguer de manière sûre un animal vacciné et indemne d’un animal vacciné et infecté [3, 13] ;
— enfin, l’installation de l’immunité après la vaccination nécessite de 10 à 15 jours, même si des délais plus courts ont été annoncés.
Compte tenu de ces données, on peut envisager la vaccination selon l’une des trois modalités suivantes :
Vaccination libre, facultative
Cette modalité n’aurait aucun intérêt au plan collectif, car laissant une majorité d’animaux sensibles non protégés.
Vaccination obligatoire
Plusieurs questions se posent immédiatement :
— contre quel(s) type(s) de virus ? Car aujourd’hui le virus O circule largement dans le monde, mais d’autres types peuvent également être « importés » ;
— de quelle(s) espèce(s) animale(s) ?
• s’il s’agit, comme par le passé en France, des seuls bovins, cette stratégie se révèlerait peu intéressante et, notamment, elle n’aurait guère modifié la catastrophe sanitaire actuelle du Royaume-Uni (foyer initial : porc ; espèce la plus touchée : mouton) ;
• s’il s’agit de l’ensemble des quatre espèces domestiques, cela entraîne deux conséquences importantes, tout d’abord le coût, qui devient élevé (et que l’on peut facilement estimer), mais surtout, dans l’état actuel de la réglementation sanitaire internationale, l’embargo sur toutes les exportations d’animaux sensibles et de leurs produits.
Pour un pays comme la France, cette situation serait génératrice de pertes considérables. Ainsi, Mahul et Durand [12] ont estimé à 370 millions de francs français le coût d’une semaine d’interdiction des exportations.
— pendant combien de temps ?
Cette stratégie ne peut guère être proposée pour l’Union européenne.
Vaccination périfocale
Son emploi est possible dans l’Union européenne. D’ailleurs, les Pays-Bas l’appliquent. A l’inverse, le Royaume-Uni a jusqu’à présent refusé de l’appliquer.
En fait, il s’agit d’une solution dont l’intérêt est limité par plusieurs facteurs et ne devient évident qu’en cas d’impossibilité de maîtriser la situation à l’aide des seules mesures sanitaires :
— compte tenu du délai nécessaire d’installation de l’immunité, la vaccination périfocale n’est pas efficace sur des animaux d’exploitations déjà contaminées par le foyer voisin. Elle ne l’est que sur la génération suivante de foyers ;
— par ailleurs, si le pays désire conserver le statut de pays indemne ne pratiquant pas la vaccination, tous les animaux vaccinés doivent ensuite être abattus, ce qui conduit à limiter la zone périfocale sur laquelle réaliser la vaccination.
La vaccination périfocale est donc à envisager avec prudence, essentiellement lorsque l’épizootie touche des porcheries, ce qui constitue un danger important de diffusion du virus par voie aérienne.
Différentes simulations réalisées montrent qu’au plan économique (nombre de foyers, durée de l’épizootie, période d’embargo, etc.), la stratégie de prophylaxie sanitaire exclusive, avec abattage préventif, est la plus intéressante dans les pays d’Europe de l’ouest et devance pratiquement, dans tous les cas, la stratégie de vaccination périfocale [6, 12,16].
L’importance de l’abattage le plus rapide possible de tous les animaux sensibles dans les foyers de fièvre aphteuse, en vue de réduire la quantité de virus produit, est aisée à comprendre. Elle a fait l’objet d’études comparatives et de simulations [7, 8].
A ce concept bien connu de la rapidité d’abattage dans les foyers comme facteur déterminant du succès pour la maîtrise d’une épizootie de fièvre aphteuse est venu s’ajouter, plus récemment, celui de l’abattage préventif : il consiste à déterminer, à partir d’un foyer connu de fièvre aphteuse, les exploitations « pouvant être contaminées par ce foyer », soit par diffusion aérienne, soit par voisinage, soit enfin par relation épidémiologique (mouvements d’animaux ou autres…). Ce concept a déjà été utilisé avec succès pour l’éradication de l’épizootie de peste porcine classique aux Pays-Bas en 1997-1998. Il l’a été par tous les pays d’Europe continentale pour les animaux importés du Royaume-Uni entre le 1er et le 21 février 2001. Il l’a été aussi en France lors de la constatation des deux foyers récents, et le demeure aux Pays-Bas encore aux prises avec la maladie et au Royaume-Uni.
Ceci dit, compte tenu de la pression exercée par des groupes très différents en faveur de la vaccination (en général, sans politique précisément définie), il sera sans doute nécessaire que des études comparatives avantages/coût des différents modes de lutte soient actualisées et rendues publiques.
LA FIÈVRE APHTEUSE CHEZ L’HOMME
Sur ce point, les avis convergent, même si une publication récente d’auteurs hollandais a soulevé la question : « La fièvre aphteuse est-elle une zoonose ? » [14].
Dans la littérature scientifique, on trouve d’assez nombreuses publications portant sur cette maladie chez l’homme [1, 9, 15, 18]. En fait, ne peuvent être réellement prises en compte que celles qui comportent, en plus d’une description clinique, des résultats de laboratoire démontrant soit l’isolement du virus à partir de lésions, soit une conversion sérologique spécifique. En effet, au plan clinique, d’autres maladies et en particulier le syndrome mains, pieds, bouche (dû au virus Coxsackie A16 ou à l’entérovirus 71) se traduisent par un tableau semblable et peuvent être aisément confondues avec la fièvre aphteuse.
Des publication récentes [2, 5, 11] confirment que seuls quelques dizaines de cas peuvent être considérés comme d’authentiques cas de fièvre aphteuse humaine au sein de l’ensemble des cas publiés.
Sur les quinze suspicions cliniques enregistrées au cours des dernières semaines sur des personnes participant aux opérations d’abattage et de destruction des cadavres au Royaume-Uni, aucune n’a été confirmée par les examens de laboratoire [17], ce qui illustre bien la résistance spontanée de l’homme vis-à-vis de ce virus.
Ainsi, la fièvre aphteuse, contrairement à l’encéphalopathie spongiforme bovine, ne constitue pas un réel danger pour l’homme. En revanche, son extrême contagiosité, sa large distribution géographique, la plasticité de son virus en font une source de pertes économiques considérables pour l’élevage dans de nombreuses régions du monde et un danger permanent pour les pays indemnes. L’épizootie européenne actuelle l’illustre de manière spectaculaire. On peut craindre que la mondialisation
du commerce des animaux et des aliments d’origine animale soit un facteur de risque croissant et qu’il faille prendre des dispositions adéquates pour affronter de nouvelles incursions de ce virus en Europe.
BIBLIOGRAPHIE [1] ARMSTRONG R., DAVIE J., HEDGER R.S. — Foot-and-mouth Disease in Man.
Brit. Med. J. , 1967, 4 , 529-530.
[2] BAUER K. — Foot-and-mouth disease as zoonosis.
Arch. Virol. , 1997, Sup. 13 , 95-97.
[3] BERGMANN I.E., MALIRAT V., NEITZERT E., BECK E., PANIZZUTTI N., SANCHEZ C., FALCZUK A.
— Improvement or a serodiagnostic strategy for foot-and-mouth disease virus surveillance in cattle under systematic vaccination : a combined system of an indirect Elisa – 3ABC with an enzyme-linked immunoelectrotransfer blot assay. Arch. Virol ., 2000, 145 , 473-489 .
[4] BLANCOU J. — Histoire de la surveillance et du contrôle des maladies animales transmissibles.
OIE éd. , 2000, 366 p.
[5] DONALDSON A., KNOWLES N. — Foot-and-mouth disease in man.
Vet. Rec. , 10 march 2001, 319.
[6] DURAND B., MAHUL O. — An extended state-transition model for foot-and-mouth disease epidemics in France. Prev. Vet. Med. , 2000, 47, 121-139.
[7] FERGUSON N., DONNELLY C., ANDERSON R. — http : //www.maff.gov.uk/animalh/diseases/fond/ default.htm, consulté le 2 mai 2001.
[8] HOWARD S.C., DONNELLY C.A. — The importance of immediate destruction in epidemics of foot and mouth disease. Research in Veterinary Science , 2000, 69, 189-196.
[9] JOUBERT L., MACKOWIAK C. — La fièvre aphteuse.
Ed. Fondation Mérieux Expansion scientifi- que , 1968, 3 vol.
[10] KIM Y.J., REMOND M. — Le virus de la fièvre aphteuse.
Virologie , 2000, 4, 393-404.
[11] KNOWLES N.J., SAMUEL A.R., DAVIES P.R., KITCHING R.P., DONALDSON A.I. — Outbreak of foot-and-mouth disease virus serotype O in the UK caused by a pandemic strain. Veterinary Record , 2001, 148, 258-259.
[12] MAHUL O., DURAND B. — Simulated economic consequences of foot-and-mouth disease epidemics and their public control in France. Prev. Vet. Med., 2000, 47 , 23-38.
[13] REMOND M., KAISER C., LEBRETON F., MOUTOU F., CRUCIERE C. — Residual foot-and-mouth disease virus antibodies in French cattle and sheep six years after the vaccination ban. Vet. Res. , 2001, 32 , 81-86.
[14] SCHRIJVER R.S., VAN OIRSCHOT J.T., DEKKER A., SCHNEIDER M.M.E., Van KNAPEN F., KIMMAN T.G. — Mond-en Klauwzeer is geen zoonose. Tijdschr. Diergeneeskd , 1998, Dec 15, 123 [24], 750.
[15] SELLERS R.F., DONALDSON A.I., HERNIMAN K.A.J. — Inhalation, persistence and dispersal of foot-and-mouth disease virus by man. J. Hyg. Camb. , 1970, 68 , 565-573.
[16] STOUGAARD E. — La lutte contre la fièvre aphteuse au Danemark. Conséquences économiques des différentes méthodes. Rev. Sci. Tech. Off. Int. Epiz. , 1985, 4 [1], 207-211.
[17] TURBITT D. — Foot-and-mouth disease, human, suspected. UK : not [2]. ProMED-mail post, http : //www.promedmail.org, 4 mai 2001.
[18] VERGE J., DHENNIN L. — La fièvre aphteuse animale : ses rapports avec l’aphtose humaine.
Revue Path. Comp. , 1960, 60 , 83-102.
* Ecole nationale vétérinaire d’Alfort — 94700 Maisons-Alfort. Tirés-à-part : Professeur Bernard TOMA, à l’adresse ci-dessus. Accepté le 23 avril 2001.
Bull. Acad. Natle Méd., 2001, 185, no 5, 917-926, séance du 15 mai 2001


