Résumé
Le virus de l’hépatite C (VHC) pose un problème de santé publique majeur. Près de 1cent soixante-dix millions de personnes sont chroniquement infectées dans le monde. Les traitements antiviraux actuellement utilisés, basés sur l’association de l’interféron pégylé (IFN∝ ) et de la ribavirine, sont souvent mal tolérés et leur efficacité n’est pas satisfaisante. A ce jour, il n’y a pas de vaccin disponible contre le VHC. Les complications de l’hépatite C chronique, la cirrhose et le carcinome hépatocellulaire, représentent près de la moitié des indications de transplantation hépatique (TH). Malheureusement, la récurrence de l’infection par le VHC sur le greffon est systématique et évolue vers une cirrhose en moins de cinq ans chez une proportion importante de patients. A l’heure actuelle, il n’y a pas de moyen d’empêcher la réinfection du greffon par le VHC dans la phase précoce qui suit la transplantation. Les premiers événements de l’infection sont l’attachement du virus par ses glycoprotéines d’enveloppe E1-E2 et son entrée dans l’hépatocyte. Ils surviennent malgré la présence d’anticorps neutralisants anti E1-E2. En utilisant le modèle des pseudoparticules virales (VHCpp), nous avons démontré que les variants sélectionnés après la greffe sont très infectieux et échappent aux anticorps neutralisants. Une meilleure connaissance de ces étapes précoces et des mécanismes d’échappement à la neutralisation du VHC après la greffe pourrait permettre de développer des molécules capables d’inhiber l’entrée du virus et de définir les épitopes ciblés par les anticorps neutralisants afin d’associer une immunisation passive à la stratégie préventive comme cela a été réalisé avec succès pour l’hépatite B.
Summary
Hepatitis C virus (HCV) is a major cause of chronic liver disease. About 170 million people worldwide are chronically infected. No preventive or therapeutic vaccine is available. Current antiviral combinations based on pegylated interferon alpha (IFN∝ ) and ribavirin have limited efficacy, poor tolerability and high cost. End-stage liver disease due to chronic HCV infection is a leading indication for liver transplantation (LT). However, re-infection of the liver graft is inevitable, with a high risk of cirrhosis within 5 years. To infect the graft, circulating virions need to attach to and enter hepatocytes, via viral envelope glycoproteins E1-E2. E1-E2 can react with cell receptors despite the presence of neutralizing antibodies. Using the HCV pseudoparticle model system, we found that viral strains selected after liver transplantation are characterized by high infectivity and that they are poorly neutralized by autologous post-transplant serum. A better understanding of the early steps of viral attachment and escape from neutralizing antibodies could lead to novel antiviral strategies.
Le virus de l’hépatite C (VHC) infecte près de 170 millions de personnes dans le monde. L’infection devient chronique chez 50 à 80 % des sujets. L’hépatite chronique évolue vers une cirrhose dans 20 % des cas en une dizaine d’années avec un risque d’hépatocarcinome de 1 à 5 % sur une période de 20 à 30 ans.
Il n’y a pas de vaccin contre l’hépatite C et le traitement antiviral basé sur l’association d’IFN-∝ et de ribavirine n’est efficace que dans 50 % des cas et souvent mal toléré. Ainsi, le VHC est responsable d’environ 250 à 350000 décès par an, essentiellement liés à la décompensation d’une cirrhose ou au cancer du foie. L’infection par le VHC est devenue une indication majeure de TH en Europe et aux USA.
Malheureusement, après la TH le VHC circulant réinfecte le greffon et la récurrence de l’hépatite est quasi systématique.
Afin de développer des stratégies préventives comme cela a été réalisé avec succès pour l’hépatite B, nous nous sommes intéressés à la physiopathologie de la réinfection du greffon hépatique. Aussi nous étudions deux aspects de cette réinfection :
d’une part, nous analysons les propriétés des virus sélectionnés au moment de la réinfection du nouveau foie et, d’autre part, nous essayons d’élucider les mécanismes de leur échappement aux anticorps. Grâce aux avancées récentes dans les connaissances des premières étapes de l’infection des hépatocytes et de la réponse immunitaire de l’hôte au cours de l’infection naturelle, nous avons pu montrer que l’entrée du virus dans l’hépatocyte et son échappement aux anticorps neutralisants jouent un rôle primordial dans la réinfection du greffon.
Des progrès impressionnants ont été réalisés au cours des 5 dernières années dans la connaissance des premières étapes de l’infection de la cellule cible.
Le VHC, découvert en 1989, est classé dans le genre hépacivirus de la famille des Flaviviridae. C’est un virus enveloppé dont le génome est constitué d’une molécule d’ARN qui code une polyprotéine précurseur, d’environ 3000 acides aminés, qui est clivée, par des protéases virales et cellulaires en protéines structurales (core, glycoprotéines d’enveloppe E1 et E2) et non structurales (p7, NS2-3, NS3, NS4A et NS4B, et NS5A et NS5B). Le VHC est caractérisé par une extrême variabilité liée aux erreurs de son enzyme de réplication, l’ARN polymérase, qui n’a pas d’activité exonucléasique correctrice. Cette variabilité est responsable de la présence du virus dans l’organisme sous forme d’une population appelée « quasi-espèces » constituée de variants viraux différents mais proches génétiquement. Les isolats du VHC provenant de régions géographiques différentes ont été classés en 6 génotypes majeurs et plusieurs centaines de sous-types.
L’absence de système de culture efficace a amené plusieurs groupes à développer des modèles permettant d’étudier les étapes spécifiques de l’infection des cellules par le VHC : les VHCpp et les virus recombinant infectieux en culture cellulaire. Les VHCpp permettent d’étudier les étapes précoces de l’infection. Ce sont des virus chimères infectieux obtenus par incorporation des glycoprotéines E1-E2 d’un isolat du VHC, sous leur forme native, à la surface de particules rétrovirales. Les VHCpp sont générées en transfectant des cellules embryonnaires de rein humain avec des vecteurs d’expression codant les glycoprotéines E1-E2 d’un isolat du VHC, la protéine de capside d’un rétrovirus et un gène marqueur de transfert qui permettra d’évaluer leur pouvoir infectieux [3, 4]. Les VHCpp infectent certaines lignées hépatocytaires, en particulier les HuH7, et les hépatocytes humains primaires. Ils ont permis de montrer que les glycoprotéines d’enveloppe E1-E2, interagissent avec différents récepteurs cellulaires tels que les glycosaminoglycanes qui permettent l’attachement du virus aux cellules [5], le SR-BI, la tétraspanine CD81 [6], et claudin-1 [7]. Les VHCpp permettent également d’étudier les anticorps neutralisants et de caractériser les mécanismes moléculaires du processus de neutralisation [4, 8]. En effet, les VHCpp possèdent des propriétés antigéniques similaires à celles du VHC natif. Une étude a montré que la neutralisation des VHCpp in vitro est très bien corrélée à la neutralisation du virus natif dans le modèle murin UPA-SCID in vivo [9].
En 2005, trois laboratoires ont réussi à produire du virus recombinant infectieux en culture cellulaire (VHCcc) à partir d’un clone unique capable de se répliquer en culture cellulaire sans nécessiter la présence de mutations adaptatives. Ce clone correspond à un variant de génotype 2a, dénommé JFH-1 [10-12], isolé chez un patient qui a développé une hépatite fulminante C. La production de VHCcc de génotypes différents est maintenant possible par l’utilisation de clones chimères [13].
Le modèle VHCcc permet l’étude in vitro du cycle viral complet. Il a été validé sur des cultures de lignées hépatocytaires HuH7 in vitro et sur des chimpanzés in vivo .
Ces derniers ont pu être infectés par une inoculation de VHCcc JFH-1 ou du clone chimérique J6/JFH-1 produits in vitro [11, 12]. L’infection par le VHCcc est neutralisée par les anticorps anti-VHC présents dans le sérum humain [12] et par des anticorps polyclonaux anti-enveloppe [14, 15].
Les modèles d’infection in vitro ont aussi permis d’analyser la réponse immunitaire au cours de l’infection chez l’homme.
Après la primo-infection, le VHC persiste dans l’organisme dans près de 70 % des cas, malgré la présence d’une réponse immunitaire cellulaire et humorale vis-à-vis du virus C. Plusieurs études ont montré que la réponse lymphocytaire T CD4 et CD8 doit être forte et prolongée pour contrôler l’infection [16]. Tout récemment, des études utilisant des VHCpp exprimant les glycoprotéines d’enveloppe des isolats de patients, ont permis d’évaluer plus précisément le rôle des anticorps neutralisants dans le contrôle de l’infection par le VHC [8,17,18]. Ainsi, Pestka et al. [8] ont montré que des anticorps neutralisants produits pendant la phase précoce de l’infection VHC jouent un rôle important. Chez une cohorte de femmes infectées accidentellement par une même souche de VHC et suivies pendant 17 ans, ces auteurs ont étudié la corrélation entre le taux d’anticorps neutralisants et la charge virale VHC sur deux périodes, la phase précoce (1 à 6 mois après la primo-infection) et la phase tardive (10 à 17 ans après). Ils ont montré que chez les femmes guéries spontanément de leur hépatite C, l’élimination du VHC était associée à la production d’anticorps neutralisants au cours de la phase précoce de l’infection, le titre de ces anticorps diminuant puis se négativant pendant la phase tardive. En revanche, une infection chronique était associée à un taux faible, voire à l’absence d’anticorps neutralisants pendant la phase précoce, le titre de ces anticorps augmentant très tardivement (10 à 17 ans après la primo-infection). La persistance du VHC serait donc favorisée par l’incapacité de produire très précocement des anticorps neutralisants. Ainsi, l’ensemble des travaux publiés à ce jour suggèrent qu’une réponse humorale forte et multispécifique précoce associée à la réponse immunitaire cellulaire permet de contrôler l’infection de manière efficace.
Les patients chroniquement infectés développent des taux élevés d’anticorps neutralisants [8,19-22]. Paradoxalement, ces anticorps sont incapables de contrôler le virus. L’échappement du virus aux anticorps neutralisants chez ces patients, peut s’expliquer par différents mécanismes : — dans le modèle chimpanzé, il a été confirmé que la grande variabilité du VHC au cours du temps induisait des variations au niveau des épitopes normalement reconnus par les anticorps et favorisait l’échappement viral [20] ; — l’interaction entre les glycoprotéines d’enveloppe, les lipoprotéines de haute densité (HDL) et le SR-BI a été décrite comme un moyen de protection du virus contre les anticorps neutralisants. En effet, deux études ont montré que les anticorps neutralisants peuvent ne pas être détectés ou voir leur effet atténué par l’interaction de la région HVR1 avec le SRB-1 et les HDL [17, 23] ; — L’interaction physique entre le VHC et les lipoprotéines de basse densité au cours des étapes précoces de l’infection pourrait elle aussi atténuer l’effet des anticorps neutralisants [24] et — comme pour d’autres virus tel le VIH, l’échappement du virus peut être multifactoriel : mutations ponctuelles, insertions/délétions, ou changements de sites de glycosylation [25] ou de conformation qui masqueraient les sites de fixation sur les glycoprotéines d’enveloppe [26, 27] et empêcheraient la fixation des anticorps neutralisants [28]. Récemment, des VHCpp exprimant les glycoprotéines d’isolats du patient H77 ont été produites par Von Hahn et al. [22] pour étudier l’échappement aux anticorps neutralisants durant l’infection chronique. En utilisant des prélèvements séquentiels allant de 3 semaines jusqu’à 26 ans après l’infection, ces auteurs ont mis en évidence des mutations successives entraînant la perte de reconnaissance des glycoprotéines du VHC par les anticorps et l’échappement à la neutralisation médiée par les anticorps. Ces données suggèrent qu’au cours de l’hépatite chronique C, les glycoprotéines d’enveloppe des quasiespèces évoluent sous la pression de l’immunité humorale. Von Hahn et al. soulignent que toutes les VHCpp construites à partir des isolats du patient H77 étaient neutralisées par les anticorps de deux autres individus infectés par le VHC confirmant que les glycoprotéines autologues sont résistantes à la neutralisation médiée par les anticorps produits par leur propre hôte mais pas par un autre. Ces résultats sont cruciaux dans le contexte de la TH et montrent la faisabilité d’une immunothérapie passive.
Une analyse des épitopes reconnus par les anticorps : étape indispensable pour développer des stratégies préventives thérapeutiques ou vaccinales.
Par analogie avec d’autres infections virales, les anticorps neutralisants anti-VHC peuvent cibler les différentes étapes de l’infection [29]. La fixation des anticorps sur les virions peut bloquer l’attachement à la cellule cible ou gêner le changement conformationnel nécessaire au processus de fusion de l’enveloppe virale avec la membrane cellulaire. De plus, les anticorps neutralisants peuvent aussi empêcher la décapsidation du virus et les premières étapes de la réplication virale. Plusieurs anticorps monoclonaux ou polyclonaux ciblant des épitopes linéaires ou conformationnels des glycoprotéines d’enveloppe E1-E2, et inhibant l’entrée des VHCpp ou l’infection des VHCcc [3, 4, 10, 12, 30-33] ont été décrits. Plusieurs épitopes cibles des anticorps neutralisants ont été identifiés durant ces dernières années : les épitopes situés dans HVR1 de E2 (384-410 aa) [4, 17], deux épitopes adjacents à la région N-terminale de HVR1 (408-422 aa et 412-419 aa) [19, 34, 35], la région de fixation de CD81 dans E2 (474-494 aa et 551-522 aa) [4, 34, 36, 37], et les épitopes conformationnels de E2 [38-40]. Plus récemment, au moins trois épitopes (270-284, 416-430, 600-620 aa) jouant un rôle dans le processus de fusion membranaire ont été identifiés au niveau des glycoprotéines d’enveloppe E1 et E2 [41]. Tous ces épitopes représentent des cibles potentielles pour une immunoprophylaxie passive.
Les caractéristiques de la réinfection du greffon après transplantation.
La réinfection du greffon par le VHC se produit chez pratiquement tous les patients après transplantation et évolue vers une infection persistante qui conduit à une hépatite chronique et une cirrhose dans une proportion importante de patients [1].
Elle est caractérisée par : — sa précocité : elle survient dans les heures qui suivent la re-perfusion du greffon, — son développement malgré la présence de titre élevé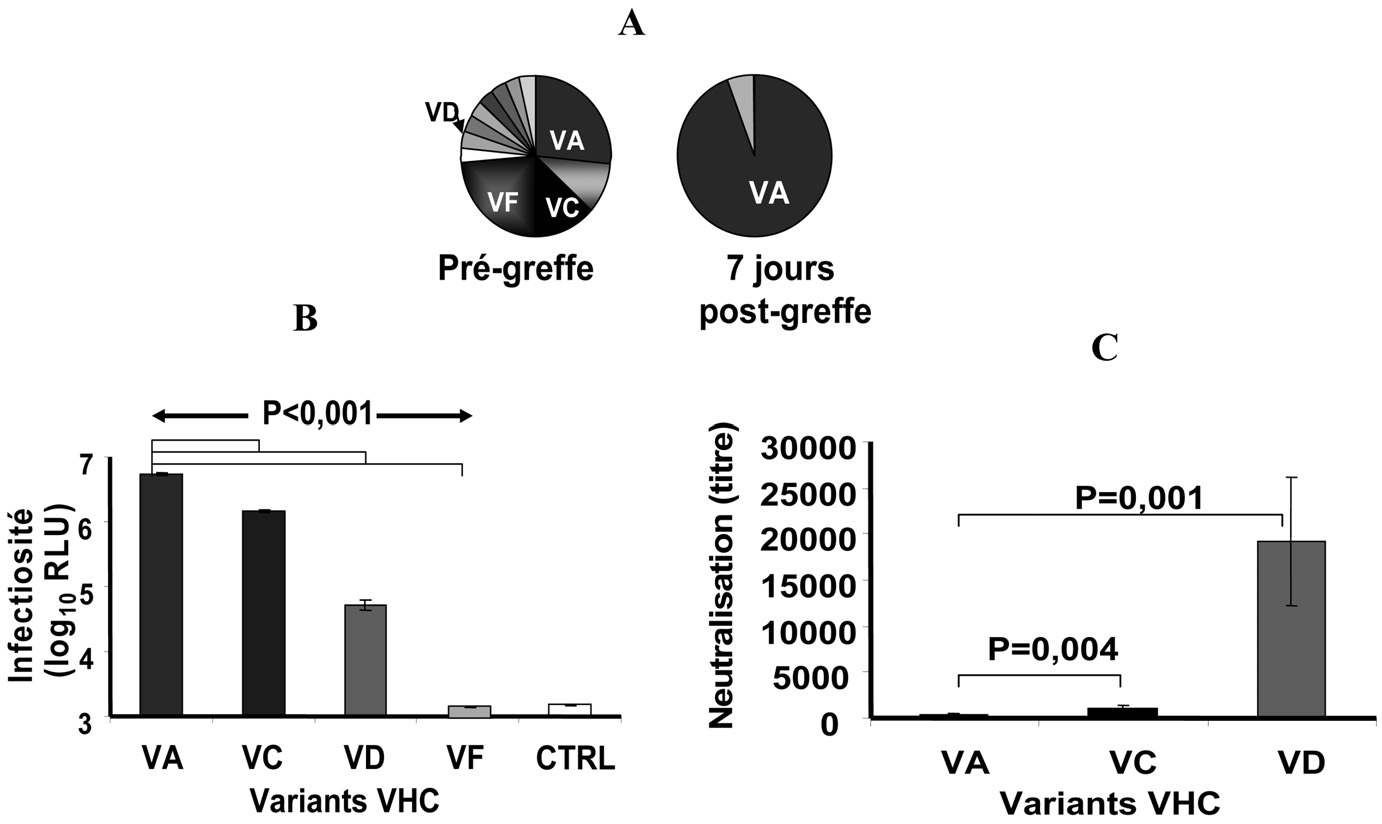
Fig. 1. —
Sélection de variants du VHC très infectieux et échappant aux anticorps neutralisants au moment de la TH . Des échantillons de plasma ont été prélevés chez un patient transplanté infecté par un génotype 1b avant et 7 jours après la transplantation. Les variants majoritaires et minoritaires des quasi-espèces ont été définis par clonage et séquençage de la région HVR1 du gène de la glycoprotéine E2 de l’enveloppe. Des VHCpp ont été construites avec les gènes E1E2 du variant sélectionné (VA) et avec les gènes E1E2 des variants non sélectionnés (VC, VF, VD).
A.Distribution, basée sur les séquences en amino-acides de HVR1 (30 clones par temps), des variants de la quasi-espèce présents avant et 7j après la TH. Les variants viraux sont indiqués par une couleur différente et une lettre capitale. Le variant sélectionné après la greffe VA est indiqué en bleu, les variants non sélectionnés en noir et en gris.
B.Infectiosité des VHCpp exprimant les protéines d’enveloppe de variants sélectionnés et non sélectionnés. Les VHCpp ont été incubées avec des cellules Huh7 et l’infection analysée par l’expression du gène reporter de la luciférase 72h après l’infection. Le contrôle négatif est une VHCpp sans protéine d’enveloppe du VHC. Les moyennes fi SD de 3 expériences indépendantes sont présentées. Les VHCpp contenant les glycoprotéines d’enveloppe du variant majoritaire (VA) sélectionné durant l’infection du greffon sont caractérisées par une plus forte infectiosité que celle des VHCpp dérivées de variants non sélectionnés (VD, VF, VC).
C. Neutralisation des VHCpp par le sérum autologue du patient. Les VHCpp sont incubées avec du sérum autologue anti-VHC positif ou avec un sérum contrôle anti-VHC négatif à dilutions croissantes pendant 1 heure à 37°C. Les complexes VHCpp-anticorps sont alors ajoutés aux cellules et l’infection est analysée comme décrit dans le panneau B. Les VHCpp dérivées du variant réinfectant le greffon (VA) sont moins bien neutralisées que les VHCpp dérivées des variants non sélectionnés (VC, VD).
Abréviations : VA, VC, VD, VF : variants viraux ; RLU : relative light units ; CTRL : contrôle négatif.
d’anticorps anti-VHC détectables chez le receveur infecté et — son association à une virémie qui est en générale dix fois supérieure à celle observée avant la TH. Ces deux caractéristiques indiquent une forte capacité du virus à s’adapter à son nouvel environnement [43]. Plusieurs travaux ont rapporté la diminution de la diversité des quasi-espèces dans les jours qui suivent la TH : ce « bottleneck effect » traduit la sélection d’une fraction de variants au moment de la réinfection [43, 44]. A l’heure actuelle, il n’y a pas de moyen de prévention de la réinfection du greffon par le VHC dans la phase précoce qui suit la transplantation [2]. Le traitement avec l’IFN-∝ et la ribavirine peut être débuté uniquement à un stade tardif lorsque la charge virale est déjà élevée.
Les étapes précoces de la réinfection du greffon, telles que l’entrée du virus dans l’hépatocyte et son échappement aux anticorps neutralisant présents au moment de la greffe sont déterminantes.
Une collaboration étroite avec les cliniciens nous a permis de constituer une cohorte de 19 patients transplantés hépatiques pour une cirrhose associée au VHC suivis pendant cinq ans. Nous avons pu montrer, avec le modèle des VHCpp exprimant les glycoprotéines d’enveloppe E1-E2 du VHC du patient, qu’avant la greffe le virus circule dans le sang sous forme d’une population de variants très différents dans leur pouvoir infectieux et dans leur sensibilité aux anticorps neutralisants (Figure 1 ; Pré- sentation orale 43rd EASL Milan 2008 : Fafi-Kremer S. et al. , Abstract J. Hepatol.
48(Supl. 2):563). Après la greffe, seule une fraction de la population virale est capable de réinfecter immédiatement le greffon [43]. Cette fraction est constituée uniquement de variants hautement infectieux. De plus, les tests de neutralisation réalisés avec les sérums autologues ont montré que les variants sélectionnés sont moins bien neutralisés que ceux qui ne sont pas sélectionnés après la greffe (Figure 1). L’ensemble de ces résultats suggère que l’entrée du virus et l’échappement à la neutralisation sont des étapes clé de la réinfection du greffon.
Les nouvelles stratégies de prévention pourraient être basées sur l’association de molé- cules inhibitrices de l’entrée du virus et d’anticorps capables de reconnaître des épitopes très conservés entre les différents isolats (cross-neutralisants).
Des molécules inhibitrices de l’entrée du virus dans sa cellule cible ont déjà été identifiées pour d’autres virus comme le VIH. L’Enfuvirtide qui inhibe la fusion de l’enveloppe du VIH avec la membrane cellulaire est la première molécule de cette catégorie à être utilisée en clinique. Certaines molécules capables d’inhiber l’entrée du VHC dans sa cellule cible ont été identifiées. Ainsi la cyanovirin-N (CV-N) [27] interagit avec les glycoprotéines de l’enveloppe du VHC qui sont très glycosylées et contiennent des oligomannoses glycanes. De la même façon il a été montré que l’héparine inhibe la fixation des VHCcc aux cellules hépatocytaires [6]. Enfin, l’arbidol, utilisé en clinique en Russie pour la grippe A et B, inhibe la fusion de l’enveloppe des VHCpp avec la membrane cellulaire [45]. Ces molécules sont à l’étude pour être développées en clinique.
Le problème majeur de l’immunothérapie passive est l’extrême variabilité du virus.
Cependant des travaux récents montrent que certains épitopes de l’enveloppe virale E2 sont capables d’induire des anticorps neutralisants plusieurs génotypes (crossneutralisants) [46, 47] de même que certains épitopes de E1 [48]. Tout récemment, une équipe a pu produire un anticorps monoclonal contre un épitope conformationnel situé sur E2 capable de protéger des souris contre une inoculation d’épreuve avec un virus hétérologue [9]. Cependant des concentrations très fortes d’anticorps monoclonaux ont été nécessaires et il faudra probablement utiliser des combinaisons d’anticorps monoclonaux cross neutralisants pour éviter la réinfection du greffon hépatique.
CONCLUSION
Le délai entre la contamination et la survenue des complications hépatiques nécessitant une TH suggère que le pic de l’impact social et économique de l’épidémie du VHC surviendra probablement dans les dix à vingt prochaines années [49]. Il est urgent de progresser dans la mise au point d’une stratégie préventive de la réinfection du greffon. Nous disposons de tous les outils nécessaires pour faire avancer la recherche et les premiers résultats que nous présentons dans cet article confirment qu’il est légitime de proposer l’utilisation très précoce de molécules antivirales en association avec une immunothérapie passive pour empêcher la réinfection du greffon.
BIBLIOGRAPHIE [1] McCaughan G.W., Zekry A. — Impact of immunosuppression on immunopathogenesis of liver damage in hepatitis C virus-infected recipients following liver transplantation. Liver Transpl.., 2003, 9 , S21-S27.
[2] Zeisel M.B., Fafi-Kremer S., Fofana I. et al. — Neutralizing antibodies in hepatitis C virus infection.
World J. Gastroenterol., 2007, 13 , 4824-30.
[3] Bartosch B., Dubuisson J., Cosset F.L. — Infectious hepatitis C virus pseudo-particles containing functional E1-E2 envelope protein complexes. J. Exp. Med., 2003, 197 , 633-42.
[4] Hsu M., Zhang J., Flint M. et al. — Hepatitis C virus glycoproteins mediate pH-dependent cell entry of pseudotyped retroviral particles.
Proc. Natl. Acad. Sci. U S A, 2003, 100 , 7271-6.
[5] Barth H., Schafer C., Adah M.I. et al. — Cellular binding of hepatitis C virus envelope glycoprotein E2 requires cell surface heparan sulfate.
J. Biol. Chem., 2003, 278 , 41003-12.
[6] Barth H., Schnober E.K., Zhang F. et al. — Viral and Cellular Determinants of Hepatitis C
Virus Envelope-Heparan Sulfate Interaction.
J. Virol ., 2006, 80 , 10579-90.
[7] Evans M.J., Von H.T., Tscherne D.M. et al. — Claudin-1 is a hepatitis C virus co-receptor required for a late step in entry.
Nature, 2007, 446 , 801-5.
[8] Pestka J.M., Zeisel M.B., Blaser E. et al. — Rapid induction of virus-neutralizing antibodies and viral clearance in a single-source outbreak of hepatitis C.
Proc. Natl. Acad. Sci. U S A, 2007, 104 , 6025-30.
[9] Law M., Maruyama T., Lewis J. et al. — Broadly neutralizing antibodies protect against hepatitis C virus quasispecies challenge.
Nat. Med., 2008, 14 , 25-7.
[10] Zhong J., Gastaminza P., Cheng G. et al. — Robust hepatitis C virus infection in vitro . Proc.
Natl. Acad. Sci. U S A, 2005, 102 , 9294-9.
[11] Lindenbach B.D., Meuleman P., Ploss A. et al. — Cell culture-grown hepatitis C virus is infectious in vivo and can be recultured in vitro . Proc. Natl. Acad. Sci. U S A, 2006, 103 , 3805-9.
[12] Wakita T., Pietzschmann T., Kato T. et al. — Production of infectious hepatitis C virus in tissue culture from a cloned viral genome.
Nat. Med., 2005, 11 , 791-6.
[13] Yi M., Villanueva R.A., Thomas D.L., Wakita T., Lemon S.M. — Production of infectious genotype 1a hepatitis C virus (Hutchinson strain) in cultured human hepatoma cells. Proc. Natl.
Acad. Sci. U S A, 2006, 103 , 2310-5.
[14] Pietschmann T., Kaul A., Koutsoudakis G. et al. — Construction and characterization of infectious intragenotypic and intergenotypic hepatitis C virus chimeras.
Proc. Natl. Acad. Sci. U S A , 2006, 103 , 7408-13.
[15] Koutsoudakis G., Kaul A., Steinmann E. et al. — Characterization of the early steps of hepatitis C virus infection by using luciferase reporter viruses.
J. Virol., 2006, 80 , 5308-20.
[16] Bowen D.G., Walker C.M. — Adaptive immune responses in acute and chronic hepatitis C virus infection. Nature, 2005, 436 , 946-52.
[17] Bartosch B., Verney G., Dreux M. et al. — An interplay between hypervariable region 1 of the hepatitis C virus E2 glycoprotein, the scavenger receptor BI, and high-density lipoprotein promotes both enhancement of infection and protection against neutralizing antibodies. J.
Virol., 2005, 79 , 8217-29.
[18] Lavillette D., Morice Y., Germanidis G. et al. — Human serum facilitates hepatitis C virus infection, and neutralizing responses inversely correlate with viral replication kinetics at the acute phase of hepatitis C virus infection. J. Virol., 2005, 79 , 6023-34.
[19] Steinmann D., Barth H., Gissler B. et al. — Inhibition of hepatitis C virus-like particle binding to target cells by antiviral antibodies in acute and chronic hepatitis C.
J. Virol., 2004, 78 , 9030-40.
[20] Bartosch B., Bukh J., Meunier J.C. et al. — In vitro assay for neutralizing antibody to hepatitis C virus: evidence for broadly conserved neutralization epitopes.
Proc. Natl. Acad. Sci.
U S A, 2003, 100 , 14199-204.
[21] Logvinoff C., Major M.E., Oldach D. et al. — Neutralizing antibody response during acute and chronic hepatitis C virus infection.
Proc. Natl. Acad. Sci. U S A, 2004, 101 , 10149-54.
[22] Von Hahn T., Yoon J.C., Alter H. et al. — Hepatitis C virus continuously escapes from neutralizing antibody and T-cell responses during chronic infection in vivo . Gastroenterology, 2007, 132 , 667-78.
[23] Dreux M., Pietschmann T., Granier C. et al. — High density lipoprotein inhibits hepatitis C virus-neutralizing antibodies by stimulating cell entry via activation of the scavenger receptor BI. J. Biol. Chem., 2006, 281 , 18285-95.
[24] Molina S., Castet V., Fournier-Wirth C. et al. — The low-density lipoprotein receptor plays a role in the infection of primary human hepatocytes by hepatitis C virus.
J. Hepatol., 2007, 46 , 411-9.
[25] Falkowska E., Kajumo F., Garcia E., Reinus J., Dragic T. — Hepatitis C virus envelope glycoprotein E2 glycans modulate entry, CD81 binding, and neutralization. J. Virol., 2007, 81 , 8072-9.
[26] Kwong P.D., Doyle M.L., Casper D.J. et al. — HIV-1 evades antibody-mediated neutralization through conformational masking of receptor-binding sites.
Nature, 2002, 420 , 678-82.
[27] Helle F., Wychowski C., Vu-Dac N. et al. — Cyanovirin-N inhibits hepatitis C virus entry by binding to envelope protein glycans.
J. Biol. Chem., 2006, 281 , 25177-83.
[28] Srivastava I.K., Ulmer J.B., Barnett S.W. — Role of neutralizing antibodies in protective immunity against HIV. Hum. Vaccin, 2005, 1 , 45-60.
[29] Klasse P.J., Sattentau Q.J. — Occupancy and mechanism in antibody-mediated neutralization of animal viruses. J. Gen. Virol., 2002, 83 , 2091-108.
[30] Baumert T.F., Ito S., Wong D.T., Liang T.J. — Hepatitis C virus structural proteins assemble into viruslike particles in insect cells. J. Virol., 1998, 72 , 3827-36.
[31] Lindenbach B.D., Evans M.J., Syder A.J. et al. — Complete replication of hepatitis C virus in cell culture.
Science, 2005, 309 , 623-6.
[32] Barth H., Cerino R., Arcuri M. et al. — Scavenger receptor class B type I and hepatitis C virus infection of primary tupaia hepatocytes.
J. Virol., 2005, 79 , 5774-85.
[33] Wellnitz S., Klumpp B., Barth H. et al. — Binding of hepatitis C virus-like particles derived from infectious clone H77C to defined human cell lines.
J. Virol., 2002, 76 , 1181-93.
[34] Owsianka A., Tarr A.W., Juttla V.S. et al. — Monoclonal antibody AP33 defines a broadly neutralizing epitope on the hepatitis C virus E2 envelope glycoprotein.
J. Virol., 2005, 79 , 11095-104.
[35] Zhang P., Wu C.G., Mihalik K. et al. — Hepatitis C virus epitope-specific neutralizing antibodies in Igs prepared from human plasma.
Proc. Natl. Acad. Sci. U S A, 2007, 104 , 8449-54.
[36] Owsianka A.M., Timms J.M., Tarr A.W. et al. — Identification of conserved residues in the E2 envelope glycoprotein of the hepatitis C virus that are critical for CD81 binding.
J. Virol., 2006, 80 , 8695-704.
[37] Zhang J., Randall G., Higginbottom A. et al. — CD81 is required for hepatitis C virus glycoprotein-mediated viral infection.
J. Virol., 2004, 78 , 1448-55.
[38] Habersetzer F., Fournillier A., Dubuisson J. et al. — Characterization of human monoclonal antibodies specific to the hepatitis C virus glycoprotein E2 with in vitro binding neutralization properties.
Virology, 1998, 249 , 32-41.
[39] Op D.B., Voisset C., Bartosch B. et al. — Characterization of functional hepatitis C virus envelope glycoproteins.
J. Virol., 2004, 78 , 2994-3002.
[40] Schofield D.J., Bartosch B., Shimizu Y.K. et al. — Human monoclonal antibodies that react with the E2 glycoprotein of hepatitis C virus and possess neutralizing activity.
Hepatology, 2005, 42 , 1055-62.
[41] Lavillette D., Pecheur E.I., Donot P. et al. — Characterization of fusion determinants points to the involvement of three discrete regions of both E1 and E2 glycoproteins in the membrane fusion process of hepatitis C virus. J. Virol., 2007, 81 , 8752-65.
[42] Tarr A.W., Owsianka A.M., Timms J.M. et al. — Characterization of the hepatitis C virus E2 epitope defined by the broadly neutralizing monoclonal antibody AP33.
Hepatology, 2006, 43 , 592-601.
[43] Schvoerer E., Soulier E., Royer C. et al. — Early evolution of hepatitis C virus (HCV) quasispecies after liver transplant for HCV-related disease.
J. Infect. Dis., 2007, 196 , 528-36.
[44] Hughes M.G., JR., Chong T.W., Smith R.L. et al. — HCV infection of the transplanted liver:
changing CD81 and HVR1 variants immediately after liver transplantation.
Am. J. Transplant.
2005, 5 , 2504-13.
[45] Pecheur E.I., Lavillette D., Alcaras F. et al. — Biochemical mechanism of hepatitis C virus inhibition by the broad-spectrum antiviral arbidol.
Biochemistry, 2007, 46 , 6050-9.
[46] Owsianka A.M., Tarr A.W., Keck Z.Y. et al. — Broadly neutralizing human monoclonal antibodies to the hepatitis C virus E2 glycoprotein.
J. Gen. Virol., 2008, 89 , 653-9.
[47] Perotti M., Manccini N., Diotti R.A. et al. — Identification of a broadly cross-reacting and neutralizing human monoclonal antibody directed against the hepatitis C virus E2 protein.
J.
Virol., 2008, 82 , 1047-52.
[48] Meunier J.C., Russell R.S., Goossens V. et al. — Isolation and characterization of broadly neutralizing human monoclonal antibodies to the e1 glycoprotein of hepatitis C virus.
J. Virol.
2008, 82, 966-73.
[49] Griffiths J., Nix B. — Modeling the hepatitis C virus epidemic in France using the temporal pattern of hepatocellular carcinoma deaths. Hepatology , 2002, 35 , 709-15.
DISCUSSION
M. Bernard CHARPENTIER
À l’instar de ce qui peut se faire dans la défense immunitaire anti-CMV et anti-EBV, est-ce possible d’imaginer la possibilité d’expandre des lignées de lymphocytes T autologues ‘‘ in vitro ’’ avec des cellules présentatrices de l’antigène HCV avec réinfection ultérieure ‘‘ in vivo ’’, en particulier pendant la phase d’anhépatie ?
Notre approche a pour but de neutraliser le virus qui circule dans le sang. Les lymphocytes T « autologues » stimulés par des cellules présentatrices d’antigènes sont des lymphocytes cytotoxiques dirigés contre les cellules infectées. Des données de la littérature suggèrent que les lymphocytes T spécifiques du VHC sont fonctionnellement déficients. Lorsque les mécanismes de cette déficience fonctionnelle seront clairement élucidés, cette approche pourrait effectivement être complémentaire de celle que nous proposons qui cible les virus circulants.
M. Claude DREUX
Existe-t-il des modèles expérimentaux sur lesquels vous pourriez étudier l’effet de votre importante découverte sur un modèle cellulaire ?
Le chimpanzé est le seul modèle animal pour étudier l’infection par le VHC et son utilisation est très limitée. Des modèles de souris transgéniques sont disponibles. Il s’agit de souris SCID/Alb-uPA : ces souris transgéniques immunodéficitaires présentent une cytolyse hépatique chronique liée à l’expression constitutive du gène de l’urokinase dans le foie. Des hépatocytes humains primaires injectés à la souris peuvent remplacer les hépatocytes murins et être infectés par le VHC in vivo .
M. Louis HOLLENDER
A quel moment proposez-vous d’administrer les anticorps monoclonaux que vous préconisez à titre préventif ? Faut-il les donner avant, pendant ou après la greffe et, dans cette dernière éventualité, combien de temps après, à quelle posologie et à quel rythme ?
Les anticorps seraient administrés pendant la transplantation hépatique, comme cela est déjà réalisé pour l’hépatite B. La posologie et le rythme des injections ultérieures seront à adapter à leur efficacité.
M. Daniel COUTURIER
Pouvez-vous nous donner quelques indications sur les étapes à franchir avant de pouvoir tirer parti de vos résultats dans le domaine thérapeutique chez l’homme ?
La première étape consiste à produire un anticorps monoclonal humain possédant un pouvoir neutralisant les différents génotypes du VHC. Ensuite il faudra valider son efficacité sur les modèles murins SCID/Alb-uPA avant de débuter les essais cliniques.
M. Jean-Yves LE GALL
Quels sont les réservoirs tissulaires de virus à partir desquels s’effectue la réinfestation du greffon ?
Les lignées lymphoïdes pourraient constituer un réservoir extra-hépatique à partir duquel le greffon pourrait être réinfecté. En effet, de nombreuses études montrent que le VHC infecte les cellules mononucléées sanguines même si la multiplication ne semble pas très importante dans ces cellules : dans notre laboratoire nous avons montré que les cellules mononucléées sanguines et les cellules dendritiques peuvent être infectées in vitro et nous avons observé chez cinq patients transplantés une augmentation de la compartimentation du VHC dans les leucocytes. Même si la multiplication virale n’est pas très importante dans ces cellules, elles peuvent servir de réservoir extra-hépatique. Des travaux récents de l’équipe de J.A. McKeating ont montré que le VHC s’associe aux lymphocytes B et qu’il peut être transmis à des lignées hépatocytaires. In vivo , le VHC pourrait être véhiculé par les lymphocytes B et infecter les hépatocytes.
Bull. Acad. Natle Méd., 2008, 192, no 8, 1657-1668, séance du 25 novembre 2008


