Résumé
La transdifférenciation se définit par le fait que des cellules différenciées perdent leurs épitopes normaux et acquièrent de nouveaux épitopes et de nouvelles fonctions. Les podocytes sont des cellules épithéliales différenciées particulières qui s’insèrent sur la face externe de la membrane basale des capillaires glomérulaires et forment avec elle l’essentiel du filtre glomérulaire. Nous avons montré que dans certaines glomérulonéphrites humaines les podocytes « dérégulés » se multiplient, changent de forme, se détachent de la membrane basale glomérulaire et se transdifférencient. En effet, ils perdent leurs épitopes originaux et acquièrent de novo des antigènes macrophagiques.
Summary
Transdifferentiation is characterized by a loss of normal epitopes by differentiated cells, accompanied by the acquisition of new epitopes and new functions. Podocytes are differentiated epithelial cells that cover and adhere to the outer surface of the glomerular basement membrane (GBM). The podocyte/GBM complex contributes to the selective filter function of the glomerular tuft. We have shown that, in various human glomerulonephritides, ‘‘ dysregulated ’’ podocytes acquire the potential to proliferate and multiply, undergo profound morphologic changes, detach from the GBM, and show phenotypic changes indicative of transdifferentiation. In the course of these events they lose their original epitopes and acquire macrophagic markers.
PODOCYTOSE ET TRANSDIFFÉRENCIATION DES PODOCYTES EN CELLULES MACROPHAGIQUES DANS DES GLOMÉRULONÉPHRITES HUMAINES
INTRODUCTION Les podocytes forment l’épithélium viscéral des glomérules. Ils ont un corps cellulaire prolongé par des pieds d’où naissent à angle droit de nombreux prolongements cytoplasmiques, les pédicelles, qui s’insèrent sur la face externe de la membrane basale glomérulaire (MBG). Les podocytes sont des cellules épithéliales uniques. Ils ne sont pas liés entre eux par des jonctions apicales serrées mais par une structure membranaire, le diaphragme de fente, tendue entre les pédicelles voisins le long de la MBG. Leurs filaments de taille intermédiaire ne contiennent pas de cytokératine comme les autres cellules épithéliales mais de la vimentine propre aux cellules mésenchymateuses. Les podocytes, les diaphragmes de fente avec la MBG et le glycocalyx de la lame fenêtrée de la cellule endothéliale forment le filtre glomérulaire [1]. Le diaphragme de fente est la barrière ultime qui s’oppose au passage des protéines plasmatiques dans l’urine ultrafiltrée.
Au stade fœtal, les podocytes matures deviennent des cellules terminales qui ne se divisent plus. Leurs noyaux expriment les cyclin dependent kinase inhibitors (CKI) p27 et p57 qui empêchent les podocytes de parcourir le cycle cellulaire. À l’inverse leurs noyaux n’expriment pas les marqueurs de prolifération comme le proliferation cell nuclear antigen (PCNA) ou le Ki67. La détection immunocytochimique de protéines spécifiques de la membrane plasmique, du cytosol ou des noyaux des podocytes permet de les identifier. La podocalyxine est une sialoprotéine du domaine apical de la membrane plasmique des pédicelles. La glomerular epithelial protein I (GLEPP-1) est une phosphatase qui a la même localisation que la podocalyxine. Le complexe formé par la nephrine, la podocine et la
CD2-associated protein (CD2AP) contribue à former le diaphragme de fente. La nephrine est une protéine transmembranaire de la famille des immunoglobulines dont une partie est intracytoplasmique et la plus grande partie extracytoplasmique. Les molécules de néphrine extracytoplasmique forment un réseau tortueux limitant des pores dont la taille est identique ou inférieure à celle des molécules d’albumine [2]. La podocine est une molécule protéique « en épingle à cheveux » dont la boucle est extracytoplasmique et les extrémités N et C terminales sont intracytoplasmiques. La CD2AP,
située dans la partie sous-membranaire du cytoplasme, lie la néphrine à l’actine du cytosquelette des pédicelles. La synaptopodine et l’α-actinine-4 sont intracytoplasmiques et associées aux filaments d’actine du cytosquelette des pédicelles. Le facteur de transcription suppresseur des tumeurs de Wilms (WT-1) est un facteur de transcription restreint aux noyaux des podocytes normaux matures.
La podocytose est caractérisée par plusieurs phénomènes [3-8] : les podocytes prolifèrent, changent de forme, perdent leur cohésion, se détachent de la MBG, perdent leurs marqueurs de maturité et acquièrent de nouveaux marqueurs. Ces deux derniers phénomènes définissent la transdifférenciation cellulaire.
L’expression des gènes dans les cellules différenciées n’est pas un phénomène irréversible. En effet, le même capital génétique, existe, quoique largement réprimé, dans toutes les cellules d’un organisme et l’état différencié d’une cellule dépend de molécules régulatrices spécifiques [9]. Ainsi certaines cellules deviennent capables de se transdifférencier. Elles perdent leurs épitopes naturels, acquièrent de nouveaux épitopes et possiblement de nouvelles fonctions [10]. En dehors de l’organogenèse, du développement des cellules malignes et de la progression des tumeurs, la transdifférenciation la plus documentée est la transdifférenciation des cellules épithéliales en cellules fibroblastiques. Cette transdifférenciation contribue à la fibrose de nombreux organes, y compris le rein [11, 12]. Nous avons décrit un autre type de transdifférenciation, la transdifférenciation des podocytes en cellules macrophagiques [3,6,7,8].
Le but de ce travail est d’étudier la podocytose et la transdifférenciation des podocytes dans trois types de glomérulonéphrites (GN) primitives humaines, les GN avec collapsus des flocculus, les hyalinoses segmentaires et focales (HSF) des glomérules récidivant dans le rein transplanté et les glomérulonéphrites extracapillaires immunes.
MATÉRIEL ET MÉTHODES Patients. Prélèvements rénaux
Huit cas de GN avec collapsus des flocculus, sans infection par le virus de l’immunodéficience humaine acquise (VIH) ont eu une biopsie rénale. Dix huit prélèvements rénaux ont été faits dans six cas de hyalinose segmentaire et focale (HSF) ayant récidivé précocement dans le transplant rénal. Ces récidives précoces sont une occasion quasi expérimentale pour suivre, par des prélèvements rénaux successifs, l’histoire naturelle des lésions. Vingt six patients avaient une GN extracapillaire immune. Douze de ceux-ci avaient une GN par anticorps anti-MBG et quatorze une GN proliférative diffuse lupique (classe IV de l’International Society of Nephrology et de la Renal Pathology Society , 2004).
Tous les patients avaient une protéinurie importante, souvent avec syndrome néphrotique et une insuffisance rénale rapidement progressive.
Les prélèvements ont été fixés dans le Bouin alcoolique et inclus dans la paraffine pour l’étude en microscopie optique courante et pour l’étude immunocytochimique.
Une partie des prélèvements a été congelée pour l’immunofluorescence de routine.
Immunocytochimie — Les cytokératines, qui sont exprimées par les cellules épithéliales tubulaires et celles de la capsule de Bowman mais non par les podocytes normaux, ont été marquées par les anticorps (Ac) monoclonaux C2562, AE1/AE3, CK22 ou AEL-KS2.
— Les podocytes ont été identifiés par des Ac monoclonaux dirigés contre le CR1 (récepteur pour le fragment C3b du complément),la podocalyxine, la synaptopodine, l’α-actinine-4 et par des Ac polyclonaux dirigés contre la podocine et le WT-1. Les Ac monoclonaux anti-néphrine et anti-CD2AP ne sont pas utilisables sur du matériel fixé par le Bouin.
— Un Ac monoclonal anti-vimentine a été utilisé pour identifier les cellules mésenchymateuses et les podocytes.
— Les épitopes CD68 et HAM56 exprimés par les monocytes et les macrophages, la protéine 86 KD (25F9) exprimé par les macrophages matures mais non par les monocytes, HLA-DR et CD 16 exprimés par les cellules macrophagiques activées ont été marqués par des Ac monoclonaux.
— Les podocytes normaux non proliférants ont été identifiés par un Ac monoclonal anti-CKI p57 et les podocytes proliférants par des Ac monoclonaux antiPCNA et Ki67.
Immunofluorescence et microscopie confocale au laser
Cette technique appliquée à des coupes fixées au Bouin a permis de colocaliser plusieurs épitopes dans la même cellule. Un Ac monoclonal anti-podocalyxine et un Ac monoclonal anti CD68 ont été couplés pour repérer les cellules exprimant à la fois un épitope podocytaire et un épitope macrophagique.
Témoins
Des parties normales de huit reins retirés pour cancer ont servi de témoins. Les patients n’étaient pas protéinuriques et avaient une fonction rénale normale.

RÉSULTATS Glomérulonéphrites avec collapsus des flocculus
Microscopique optique
Les glomérules avaient pour la plupart un collapsus segmentaire ou global des capillaires et une prolifération des podocytes. Ces podocytes hypertrophiques, vacuolisés, souvent multinucléés formaient autour des flocculus des « pseudocroissants » séparés de la capsule de Bowman par l’espace urinaire. De nombreux podocytes détachés de la MBG se répandaient dans l’espace urinaire. De nombreux tubes étaient dilatés, microkystiques, avec des cylindres protéiques.
Immunofluorescence
Aucun marquage n’était constaté avec les anticorps usuels.
Immunohistochimie
Dans les glomérules les moins lésés, les podocytes attachés à la MBG exprimaient les marqueurs podocytaires utilisés (podocalyxine, CR1, vimentine). En revanche, les podocytes proliférés ou détachés de la MBG avaient perdu leurs marqueurs podocytaires (Fig. 1a) et acquis le marqueur macrophagique CD68 (Fig. 1b). Les tubes pseudokystiques contenaient de grosses cellules CD68 positives analogues à celles observées dans l’espace urinaire de Bowman.
FIGURES 1a et b — Glomérulonéphrite avec collapsus du flocculus. 1a : perte d’expression du marqueur podocytaire podocalyxine dans les podocytes couvrant le flocculus (flèches). Noter que cette perte d’expression phénotypique s’accompagne de modifications morphologiques des podocytes qui sont plus nombreux et plus gros (hyperplasie et hypertrophie) ; 1b : ces podocytes modifiés dont certains se détachent du flocculus ont acquis l’expression d’un marqueur (flèches), le CD68, qui est un marqueur de type macrophagique. 1a et b : coupes sériées marquées par immunohistochimie anti-podocalyxine et anti-CD68 respectivement. X500.
Récidive des hyalinoses segmentaires et focales (HSF) dans le rein transplanté
Microscopie optique
Les lésions glomérulaires étaient cellulaires ou cicatricielles. Les lésions cellulaires, le plus souvent segmentaires, étaient particulièrement observées dans les biopsies les plus précoces. Les podocytes étaient hypertrophiques, hyperplasiques, vacuolisés, arrondis, parfois multinucléés et formaient des pseudocroissants autour du flocculus. Certains podocytes détachés flottaient dans l’espace urinaire. Dans les glomé- rules où les lésions podocytaires étaient globales l’aspect réalisé était analogue à celui observé dans les GN avec collapsus des flocculus. Les lésions glomérulaires cicatricielles formaient des zones de sclérose contenant parfois de gros dépôts protéiques oblitérant des lumières de capillaire. Ces zones scléreuses adhéraient à la capsule de Bowman ou étaient entourées par un alignement de petites cellules épithéliales cubiques.
Immunofluorescence
Les glomérules étaient le plus souvent négatifs avec les anticorps usuels. Un marquage segmentaire par les anticorps anti-IgM et anti-C3 était parfois observé.
Immunohistochimie :
— Certains podocytes exprimant leurs épitopes normaux, étaient détachés du flocculus et libres dans l’espace urinaire.
— Dans les lésions cellulaires, la plupart des podocytes avaient perdu leurs épitopes spécifiques (podocalyxine, synaptopodine, GLEPP-1, WT-1, CR1, vimentine).
Dans les lésions cicatricielles aucun marquage podocytaire n’était constaté.
— Des podocytes avaient acquis l’expression de cytokératines (AE1/AE3, C2562, CK22, AEL-KS2) jamais observés dans les podocytes normaux.
— De nombreuses cellules localisées à la périphérie du flocculus (Fig. 2a) ou libres dans l’espace de Bowman et dans les lumières tubulaires exprimaient des épitopes macrophagiques (CD68, HAM56) et des épitopes macrophagiques de maturité (25F9) et d’activation (HLA-DR, CD16).
— En microscopie confocale, certains podocytes coexprimaient le marqueur podocytaire et le marqueur macrophagique CD68 (Fig. 2b).
GN extracapillaire
Microscopie optique
Les lésions glomérulaires étaient identiques dans les GN par anticorps anti-MBG et dans les GN lupiques. Les espaces urinaires de la majorité des glomérules étaient occupés par des cellules proliférées organisées en « vrais » et en « pseudocroissants ». Dans les vrais croissants, la couche épithéliale de la capsule de Bowman était remplacée par plusieurs couches de cellules cuboïdes ou fusiformes oblitérant parfois l’espace urinaire. Les cellules des pseudocroissants proliféraient à partir des
FIGURES 2a et b — Hyalinose segmentaire et focale récidivant sur un greffon rénal. 2a : les podocytes modifiés ont acquis l’expression de CD68 (flèche). Immunohistochimie anti-CD68. X 250 ; 2b :
certains podocytes modifiés (flèche) co-expriment le marqueur podocytaire podocalyxine et le marqueur macrophagique donnant une fluorescence jaune (flèche). Cette colocalisation montre que ce sont bien des podocytes qui ont acquis l’expression de CD68. Double marquage en immunofluorescence anti-podocalyxine révélé par la cyanine 3 (émission dans le rouge) et anti-CD68 révélé par la cyanine 2 (émission dans le vert) observé en microscopie confocale.
X900.
flocculus. Arrondies, hypertrophiques, vacuolisées, parfois multinucléées, ces cellules étaient encore attachées à la MBG ou détachées dans l’espace urinaire. Les cellules des pseudocroissants contrairement à celles des vrais croissants n’étaient pas entourés de matrice extracellulaire. D’autre part, dans le flocculus était constatée une prolifération des cellules endocapillaires, une infiltration par des monocytes et/ou par des polynucléaires et des zones de nécrose.
Immunofluorescence
Les cas de maladie par anticorps anti-MBG étaient caractérisés par une fixation linéaire d’IgG le long des MBG et la présence de fibrinogène dans les espaces urinaires. Dans les GN lupiques, les dépôts glomérulaires immuns contenaient de l’IgG, du C3, du C1q et parfois de l’IgA, de l’IgM et souvent du fibrinogène dans les espaces urinaires.
Immunohistochimie
Les marqueurs podocytaires utilisés (synaptopodine, GLEPP-1, podocalyxine, podocine, α-actinine-4) ont donné des résultats similaires.
La plupart des cellules des vrais et des pseudocroissants, de même que certains podocytes hors des croissants n’étaient pas marqués. Néanmoins, des podocytes marqués ont été trouvés dans les vrais et les pseudocroissants (Fig. 3a).
Les cytokératines (C2562) étaient exprimées par des cellules de la capsule de Bowman mais aussi par des podocytes isolés ou groupés.
Des cellules adhérant à la MBG, dans une localisation podocytaire exprimant l’épitope macrophagique CD68. Le phénomène était particulièrement marqué dans les glomérules avec collapsus des flocculus. Autour de ces flocculus collabés de grandes cellules rondes CD68 positives flottaient dans l’espace urinaire et se déversaient dans les lumières tubulaires.
CKIp57 n’était pas exprimé par les noyaux dans les vrais et les pseudocroissants.
De nombreuses cellules exprimaient les marqueurs de prolifération, PCNA et Ki67 dans les vrais et les pseudocroissants (Fig. 3b). Ces marqueurs étaient aussi exprimés par des podocytes clairement identifiables en dehors des croissants. Certains podocytes coexprimaient synaptopodine et PCNA.
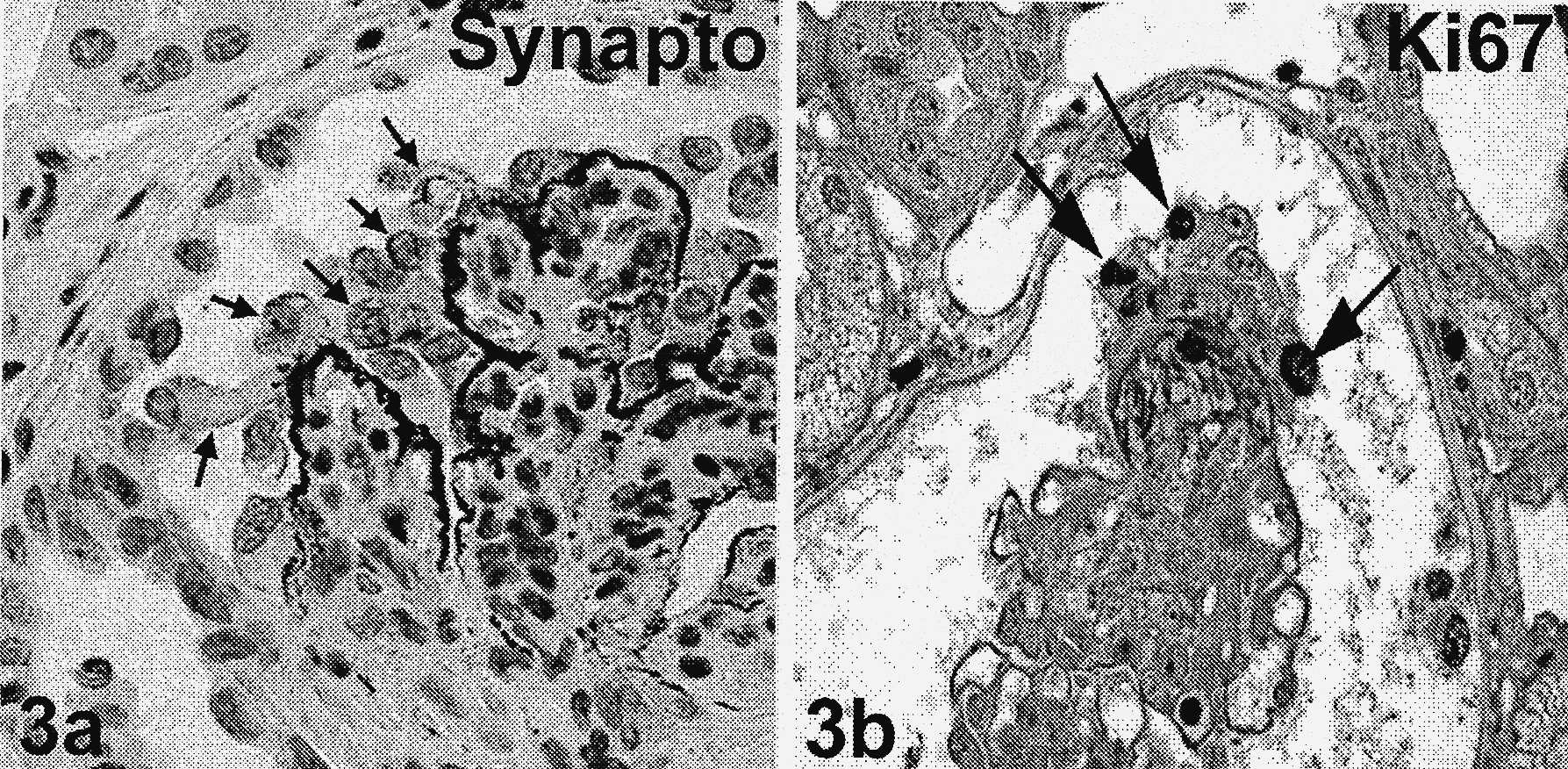
FIGURES 3a et b — Glomérulonéphrite extracapillaire immune au cours d’une néphropathie lupique classe IV de l’OMS. Les cellules qui prolifèrent forment des croissants et des pseudocroissants.
Les pseudocroissants sont caractérisés par plusieurs couches de cellules disposées sur le flocculus avec une chambre urinaire libre. 3a : parmi les cellules constituant le pseudocroissant, certains (flèches) expriment le marqueur podocytaire synaptopodine, démontrant que les podocytes dérégulés participent à la constitution du croissant ; 3b : ces podocytes dérégulés dans le pseudocroissant sont capables de proliférer, car ils expriment le marqueur de prolifération Ki 67 (flèches). Immunohistochimie anti-synaptopodine (3a) et anti-Ki 67 (3b). X500.
DISCUSSION Des lésions identiques de podocytose et de transdifférenciation des podocytes ont été observées dans trois types de GN. Dans les GN avec un collapsus des flocculus ces lésions podocytaires sont globales et diffuses. Dans les HSF récidivant dans le transplant rénal les lésions podocytaires segmentaires et focales initiales évoluent en lésions cicatricielles scléreuses. Dans les GN extracapillaires immunes les lésions podocytaires sont responsables de pseudocroissants coiffant les flocculus et participent à la composition des vrais croissants. Elles sont associées à des lésions prolifé- ratives endocapillaires et à des lésions nécrotiques des flocculus.
À l’état normal, les podocytes matures sont des cellules à prolongements nombreux, attachés à MBG et cohérentes entre elles. Les filaments intermédiaires de leur cytosquelette sont faits de vimentine. Ils possèdent plusieurs protéines spécifiques qui appartiennent à la membrane plasmatique (podocalyxine, GLEPP-1), aux diaphragmes de fente (néphrine, podocine), au cytosquelette (α-actinine-4, synaptopodine) ou au noyau (WT-1). Incapables de proliférer, ils ne possèdent pas de marqueurs de prolifération (PCNA, Ki67) et expriment l’inhibiteur de division cellulaire CKIp57.
Au cours de la podocytose les podocytes dérégulés sont profondément modifiés [3-8, 12]. Ils sont capables de proliférer. Ils expriment les marqueurs de prolifération PCNA et Ki67 et perdent l’expression de CKIp57 qui inhibent la progression des podocytes normaux dans le cycle cellulaire. Ils changent de forme, s’arrondissent, se vacuolisent, perdent leur cohésion et se détachent de la MBG. La plupart des podocytes dérégulés perdent leurs protéines spécifiques. Ils n’expriment plus le facteur de transcription WT-1 mais le facteur de transcription PAX-2 (13, observations personnelles).
Néanmoins, des podocytes dérégulés peuvent conserver certains de leurs marqueurs ce qui permet de les identifier. Les podocytes dérégulés forment souvent des pseudocroissants autour des flocculus et nous avons montré qu’ils participaient à la formation des vrais croissants dans les GN extracapillaires [8].
Les podocytes dérégulés sont capables de se transdifférencier. Ils perdent leurs épitopes de maturité et acquièrent d’autres épitopes. Leurs filaments intermédiaires réexpriment la cytokératine que possèdaient les podocytes fœtaux immatures. Les podocytes dérégulés hyperplasiques sont capables d’acquérir les épitopes macrophagiques comme CD68 associés aux phénomènes de phagocytose et/ou d’autophagie. Ces cellules ne sont pas devenues pour autant des macrophages stricto sensu, c’est-à-dire des cellules dérivées de la moelle. Néanmoins, nous avons montré que :
— ces cellules devenues CD68 positives exprimaient aussi 25F9 marqueurs des macrophages matures et HLA-DR et CD16 marqueurs des macrophages activés ;
— que certains podocytes en voie de transdifférenciation coexprimaient en microscopie confocale encore un marqueur podocytaire (podocalyxine) et déjà un marqueur macrophagique (CD68). Nos résultats sont corroborés par des études effectuées sur des podocytes de rats cultivés qui acquièrent des caractères macrophagiques [14, 15].
La podocytose est un phénomène fréquent, irréversible, longtemps ignoré. Les processus qui l’induisent sont inconnus. Elle s’accompagne de protéinurie importante, de syndrome néphrotique et d’insuffisance rénale évolutive. Ceci est facilement expliqué par le rôle de barrière joué par les podocytes dans l’ultrafiltration.
CONCLUSION La podocytose est une lésion probablement sans spécificité, longtemps méconnue dans laquelle les podocytes dérégulés perdent leurs caractères et leurs fonctions. Les podocytes dérégulés sont susceptibles de se transdifférencier, singulièrement en cellules macrophagiques. La podocytose est une lésion irréversible et grave. Elle s’accompagne de protéinurie et d’insuffisance rénale. Les causes et les mécanismes de la podocytose sont à élucider.
BIBLIOGRAPHIE [1] DEEN W.M. — What determines glomerular capillary permeability ?
J. Clin. Invest., 2004 , 114, 1412-1414.
[2] WARTIOVAARA J., OFVERSTEDT L.G., KHOSHNOODI J. et al. — Nephrin strands contribute to a porous slit diaphragm scaffold as revealed by electron tomography.
J. Clin. Invest., 2004, 114, 1475-1483.
[3] BARIETY J., NOCHY D., MANDET C., JACQUOT C., GLOTZ D., MEYRIER A. — Podocytes undergo phenotypic changes and express macrophagic-associated markers in idiopathic collapsing glomerulopathy. Kidney Int., 1998, 53 , 918-925.
[4] BARISONI L., KRIZ W., MUNDEL P., D’AGATI V. — The dysregulated podocyte phenotype : A novel concept in the pathogenesis of collapsing idiopathic focal segmental glomerulonephritis and HIV-associated nephropathy. J. Am. Soc. Nephrol ., 1999, 10 , 51-61.
[5] BARISONI L., MOKRYCKI M., SABLAY L., NAGATA M., YAMASE H., MUNDEL P. — Podocyte cell cycle regulation and prolifertaion in collapsing glomerulopathies. Kidney Int., 2000, 58 , 137- 143.
[6] BARIETY J., BRUNEVAL P., HILL G.S., IRINOPOULOU T., MANDET C., MEYRIER A. — Posttransplantation relapse of FSGS is characterized by glomerular epithelial cell transdifferentiation. J.
Am. Soc.Nephrol ., 2001, 12 , 261-274.
[7] BARIETY J., BRUNEVAL P., HILL G.S., MANDET C., JACQUOT C., MEYRIER A. — Transdifferentiation of epithelial glomerular cells. J. Am. Soc. Nephrol., 2003, 14 , S42-S47.
[8] BARIETY J., BRUNEVAL P., MEYRIER A. et al. — Podocyte ivolvment in human crescentic glomerulonephritis.
J. Am. Soc. Nephrol ., 2004, 15 , 505A.
[9] STRUTZ F., MULLER G.A., NEILSON E.G. — Transdifferentiation. A new angle on renal fibrosis.
Exp.Nephrol., 1996, 4 , 267-270.
[10] EGUCHI G., KODAMA R. — Transdifferentiation.
Curr Opin. Cell Biol., 1993, 5 , 1023-1028.
[11] NG Y.Y., HUANG T.P., YANG W.C. et al. — Tubular epithelial-myofibroblast transdifferentiation in progressive tubulointerstitial fibrosis in 5/6 nephrectomized rats.
Kidney Int., 1998, 53 , 864-876.
[12] BARIETY J., HILL G.S., MANDET C. et al. — Glomerular epithelial-mesenchymal transdifferentiation in pauci-immune crescentic glomerulonephritis.
Nephrol. Dial. Transplant., 2003, 18 , 1777-1784.
[13] OHTAKA A, OOTAKA T, SATO H, ITO S. — Phenotypic change of glomerular podocytes in primary focal segmental glomerulosclerosis : developmental paradigm ? Nephrol. Dial. Transplant., 2002, 17 (suppl 9) , 11-15.
[14] MENDRICK D.L., KELLY D.M., RENNKE H.G. — ANTIGEN PROCESSING AND PRESENTATION BY GLOMERULAR VISCERAL EPITHELIUM in vitro . Kidney Int., 1991, 39, 71-78.
[15] ORIKASA M., IWANAGA T., TAKAHISHI H. et al. — Macrophagic cells outgrowth from normal rat glomerular culture : Possible metaplastic change from podocytes.
Lab. Invest., 1996, 75, 719-733.
DISCUSSION
M. Michel BOUREL
Quelle est la place de la culture cellulaire dans la compréhension de la physiologie des podocytes ? Quelle place occupent les podocytes dans la dynamique de la fibrose rénale entre progression et régression ?
Les cultures cellulaires ont permis de saisir plusieurs aspects de la physiologie des podocytes : récepteurs, mécanismes de signalisation, conséquences mécaniques de l’étirement, facteurs de nuisance, possibilité de présenter l’antigène. Les cultures de podocytes ont néanmoins des limites. Les podocytes matures fonctionnels sont des cellules hautement différenciées, incapables de se reproduire. Les podocytes cultivés ne reproduisent pas tous les caractères des podocytes in vivo . Ils ne permettent pas d’étudier la perméabilité spécifique du filtre glomérulaire. De nouveaux podocytes différenciés fonctionnels ne peuvent pas remplacer les podocytes détruits ou les podocytes dérégulés proliférés et détachés de la podocytose. La perte et la dérégulation des podocytes induit donc une fibrose et une destruction glomérulaire irréversibles.
M. Raymond ARDAILLOU
La « transdifférenciation » des podocytes en macrophages peut-elle résulter de la fusion de macrophages circulants avec les podocytes ?
La fusion de macrophages circulants avec des podocytes est une hypothèse non démontrée.
M. Gabriel RICHET
Dans quel autre organe avez-vous observé des modifications qui vous permettent de parler de processus ubiquitaire ?
Le terme « sans spécificité » doit remplacer le terme « ubiquitaire ». Le podocyte n’existant pas dans les glomérules, il ne peut pas y avoir de podocytose en dehors des glomérules.
M. Jean-Daniel SRAER
Quel est le rôle de la capsule de Bowman dans la formation de « croissants ». Podocytes et HIV. Enzymes et détachement des cellules podocytaires de la membrane basale glomérulaire ?
La capsule de Bowman peut intervenir de plusieurs façons dans la formation de « croissants ». Les cellules épithéliales de la capsule de Bowman peuvent proliférer et même se transdifférencier en cellules fibroblastiques. Les podocytes pariétaux ou migrés depuis le flocculus dans la capsule de Bowman peuvent proliférer. La rupture de la capsule de Bowman permet l’invasion de l’espace urinaire par des cellules venues de l’interstitium (fibrobastes, macrophages). Les cellules constituant les croissants sont souvent difficiles à identifier. En effet, les cellules épithéliales de la capsule de Bowman n’expriment souvent pas leur épitope habituel : la cytokératine. Les podocytes dérégulés, proliférés n’expriment souvent plus leurs épitopes mais peuvent exprimer de novo la cytokératine.
Le VIH est responsable de podocytose chez l’homme et chez des souris transgéniques par un mécanisme encore inconnu. Les enzymes susceptibles in vivo de détacher les podocytes de la membrane basale glomérulaire ne sont pas connues.
M. Pierre RONCO
Quelle est la spécificité des marqueurs macrophagiques utilisés, et en particulier du CD68 ?
Peut-on induire le CD68 ou d’autres marqueurs des cellules macrophagiques dans les cellules épithéliales podocytaires ou tubulaires en culture ? Quelle est la fonction des cellules transdifférenciées ? Plusieurs travaux, notamment japonais, suggèrent qu’elles peuvent être retrouvées dans les urines, ce qui est en accord avec leur présence dans les lumières tubulaires. Les cellules transdifférenciées pourraient être recueillies dans les urines et étudiées pour leur capacité à accomplir des fonctions macrophagiques spécifiques : présentation des antigènes au système immunitaire, phagocytose, production de cytokines proinflammatoires et pro-fibrotiques. Ces travaux ont-ils déjà été effectués ? Quelles corrélations peuvent être établies entre le pourcentage de cellules transdifférenciées et la sévérité de la maladie glomérulaire et sa réponse aux corticoïdes, en particulier dans le cadre des hyalinoses segmentaires et focales ?
Les marqueurs macrophagiques utilisés reconnaissent aussi certaines cellules qui n’appartiennent pas à la lignée des monocytes-macrophages d’origine médullaire. Aussi CD68 peut être exprimé par des cellules douées, comme les macrophages, d’un potentiel élevé de phagocytose ou d’autophagie. HLA-DR qui est exprimé par les macrophages activés l’est aussi par d’autres cellules capables de présenter l’antigène. La transdifférenciation des podocytes ne se fait pas en macrophages stricto sensu mais en cellules « macrophagiques » partageant avec les macrophages plusieurs épitopes. La fonction des cellules transdifférenciées n’est pas connue. À notre connaissance, la possibilité d’induire CD68 dans des podocytes ou des cellules épithéliales tubulaires en culture n’est pas documentée. Les podocytes de rat cultivés sont capables comme les macrophages de présenter l’antigène (D.L. Mendrick et al. Kidney Int 1991, 39, 71-78). Dans les cultures de glomérules de rat, les podocytes se transforment en cellules macrophagiques (M.
Orikasa et al. Lab Invest 1996, 75, 719-733). Des études de cellules transdifférenciées recueillies dans les urines émises n’ont pas encore été publiées. Elles seraient d’un intérêt considérable. Aucune corrélation n’a été faite entre le pourcentage des cellules transdifférenciées et la sévérité de la maladie glomérulaire. Néanmoins, dans notre expérience, la podocytose et la transdifférenciation des podocytoses ont été observées dans des cas graves insensibles aux corticoïdes.
* INSERM U 430, Immunopathologie rénale. ** Association pour l’usage du Rein Artificiel. Service de Néphrologie. *** Hôpital européen Georges Pompidou, service d’Anatomie Pathologique 20, rue Leblanc, 75908 Paris Cedex 15. Tirés-à-part : Professeur Jean BARIETY, à l’adresse ci-dessus. Article reçu le 12 juillet 2004, accepté le 21 février 2005.
Bull. Acad. Natle Méd., 2005, 189, no 3, 535-546, séance du 22 mars 2005


