Résumé
Certains stéroïdes, appelés neurostéroïdes, sont synthétisés par des neurones et des cellules gliales dans les systèmes nerveux central et périphérique. L’étude de la synthèse, du métabolisme, du mode d’action et des effets des neurostéroïdes est un domaine de recherche dont les applications cliniques commencent à émerger. Alors que la synthèse des neurosté- roïdes dans le cerveau et les nerfs périphériques est maintenant bien établie, sa régulation est mal connue et reste à explorer. Plusieurs études récentes montrent que l’expression et l’activité des enzymes qui interviennent dans la formation des neurostéroïdes sont régulées par des interactions cellulaires, mais les molécules impliquées ne sont pas encore identifiées (par exemple le facteur neuronal qui induit la synthèse de la progestérone dans les cellules de Schwann). Les mécanismes impliqués mettent en jeu des récepteurs intranucléaires de type classique, des récepteurs membranaires, en particulier ceux de plusieurs neurotransmetteurs dont les neurostéroïdes sont des modulateurs du fonctionnement, et, observation toute récente, une protéine des microtubules. Les effets psychopharmacologiques ont été étudiés surtout chez l’animal, en particulier sur la mémoire, l’anxiété et le sommeil, et des activités neurotrophiques mises en évidence dans des processus de régénération nerveuse. Par exemple, le sulfate de prégnènolone a une activité promnésiante chez le rat âgé permettant d’annuler le déficit mnésique (spatial) du vieillissement, la progestérone favorise la formation réparatrice de gaines de myéline après lésion du nerf sciatique, et la prégnènolone stimule la polymérisation de microtubules neuronaux et donc potentiellement la plasticité du système nerveux. Ces résultats permettent d’envisager l’utilisation de neurostéroïdes pour la meilleure compréhension et le traitement de certaines lésions et déficits du système nerveux.
Summary
Some steroids, named neurosteroids, can be synthesized in the central and peripheral nervous system by neurons and glial cells. The study of their synthesis, metabolism, mechanisms of action and effects represents an expanding area of research and important progress has been made over the past few years. Although the synthesis of neurosteroids in the brain and in peripheral nerves is now well established, its regulation has not been explored very much. A few recent studies show that the expression and the activity of enzymes involved in neurosteroid synthesis are regulated by cellular interactions, but the molecules which are involved remain to be identified (as for instance a neuronal factor inducing the synthesis of progesterone in Schwann cells). Research is now turning towards the functions of neurosteroids. Their mechanisms of action involve nuclear receptors, membrane receptors (particularly those affecting the function of neurotransmitters), and a recently discovered direct activity on microtubule-associated protein and tubulin polymerisation. Several recent studies have described psychopharmacological effects of neurosteroids, in particular on memory, anxiety and sleep as well as their role in regeneration. Thus, pregnenolone stimulates polymerisation of neuronal microtubules, pregnenolone sulfate has promnesic effects and progesterone promotes the formation of new myelin sheaths. Neurosteroid and analogues may therefore become useful to treat diseases and lesions of the nervous system.
INTRODUCTION
Le terme « neurostéroïdes » a été proposé, pour désigner les stéroïdes qui peuvent être synthétisés dans le système nerveux à partir du cholestérol [1]. Au départ, l’hypothèse d’une biosynthèse locale de stéroïdes dans les tissus nerveux fut basée sur l’observation que la déhydroépiandrostérone (DHEA) et la prégnènolone (PREG), sous leurs formes libres ou ester sulfates, restaient présentes dans le cerveau de rat à des concentrations élevées après suppression de leurs sources classiques potentielles, gonades et surrénales [2-3]. Il a fallu plusieurs années pour démontrer que les enzymes impliquées dans la synthèse des neurostéroïdes sont présentes et actives dans le cerveau et les nerfs périphériques [4]. Le terme « neurostéroïdes » ne réfère pas à une catégorie chimique particulière de stéroïdes, mais seulement à leur lieu de synthèse, le système nerveux. Par exemple, la progestérone (PROG) peut être considérée comme un neurostéroïde lorsqu’elle est synthétisée dans le cerveau ou les nerfs périphériques, alors que c’est une hormone sexuelle lorsqu’elle est produite par les ovaires ou le placenta.
Le concept de neurostéroïdes n’a vraiment émergé que récemment [revues dans 5]. Il y a plusieurs explications à l’évolution lente des recherches :
— bien qu’ils puissent être présents dans le cerveau à des concentrations supérieures à celles du plasma, permettant leur évaluation dans de larges fractions du
FIG. 1. —
Voies principales de la biosynthèse et du métabolisme des stéroïdes dans le système nerveux .
Tous les stéroïdes sont des dérivés du cholestérol. Le cytochrome P450scc (scc pour side chain cleavage ) coupe la chaîne latérale de 6 carbones du cholestérol et la prégnènolone ainsi formée est le précurseur de toutes les hormones stéroïdes. La présence dans le système nerveux du cytochrome P450c17, qui peut convertir la prégnènolone en déhydroépiandrostérone et la progesté- rone en androstènedione est toujours sujet à controverse (3β-HSD : 3β-hydroxystéroïde déshydrogénase ; 3α-HSOR : 3α-hydroxystéroïde oxydoréductase ; 17β-HSOR : 17β-hydroxystéroïde oxydoréductase). Les symboles négatifs (—) indiquent une annulation de la fonction enzymatique correspondante par le produit indiqué. La figure résume de nombreuses transformations métaboliques qui ne sont pas toutes décrites dans le texte.
tissu nerveux par des méthodes radio-immunologiques conventionnelles, les neurostéroïdes sont difficiles à identifier et à mesurer dans les régions discrètes où ils sont censés agir. Une nouvelle méthodologie, basée sur la spectrométrie de masse, permet maintenant d’analyser et de quantifier des stéroïdes dans des régions précises du cerveau [6-7] ;
— les stéroïdes présents dans le système nerveux peuvent provenir d’une synthèse locale ou de la circulation sanguine. En effet, la majorité des stéroïdes sécrétés par les glandes endocrines, à l’exception des esters-sulfates, traversent facilement la barrière hémato-encéphalique. Il est alors difficile de distinguer entre les fonctions des neurostéroïdes synthétisés localement et celles des composés sté- roïdes circulant ;
— une fois qu’une « étiquette » a été attribuée à une molécule, il est difficile d’en changer. Les stéroïdes étaient considérés comme des hormones sexuelles (androgènes, oestrogènes et progestogènes) ou d’adaptation de l’organisme au stress (glucocorticostéroïdes), il fallait admettre qu’ils puissent avoir in situ un rôle important dans le fonctionnement du système nerveux [8].
BIOSYNTHÈSE DES NEUROSTÉROÏDES
Synthèse de la prégnènolone (PREG) et de la progestérone (PROG)
La première étape dans la biosynthèse des stéroïdes correspond à la formation de PREG à partir du cholestérol. Elle est catalysée par une enzyme située au niveau de la membrane interne de la mitochondrie, le cytochrome P450scc, qui, associé à l’adrénodoxine et l’adrénodoxine réductase coupe la chaîne latérale de 6 carbones du cholestérol (Fig. 1). La présence du P450scc, caractéristique de toutes les cellules stéroïdogènes, a été démontrée dans le système nerveux de différentes classes de vertébrés : amphibiens [9], oiseaux [10] et mammifères, y compris l’homme [4, 11].
Elle est exprimée et active dans les principaux types cellulaires du système nerveux, incluant les oligodendrocytes, les cellules de Schwann, des astrocytes de type 1 et des neurones [12, 13].
La PREG est ensuite convertie en PROG dans le réticulum endoplasmique par la 3β-hydroxystéroïde déshydrogénase (3β-HSD) [13-17]. Pour certains auteurs, un complexe P450scc — 3β-HSD peut exister dans la mitochondrie [13, 14, 18]. Si on bloque la conversion de la PREG en PROG en injectant un inhibiteur de la 3β-HSD, le trilostane, on observe une accumulation de la PREG dans le cerveau et dans les nerfs périphériques des animaux [19, 20]. La PROG peut être métabolisée en 5α-dihydroprogestérone (5α-DH PROG) par la 5α-réductase et en 3α,5α-tétrahydroprogestérone (3α,5α-TH PROG), connue également sous le nom d’alloprégnanolone, par la 3α-hydroxystéroïde oxydoréductase (3α-HSOR). L’activité de cette dernière semble restreinte aux cellules gliales [17, 21].
FIG. 2. —
Récepteur périphérique des benzodiazépines (MBR, mitochondrial benzodiazepin receptor au lieu de PBR, peripheral benzodiazepin receptor employé souvent par les pharmacologistes et dans le texte) et synthèse de la prégnènolone . Le MBR permet le passage du cholestérol à l’intérieur de la mitochondrie, où est localisé le cytochrome P450scc au niveau de la membrane interne. Cette enzyme catalyse la conversion du cholestérol en prégnènolone. Des agonistes du MBR augmentent le transport du cholestérol et par conséquent la biosynthèse de la prégnènolone. Cette figure schématise trois types d’activités de la prégnènolone : 1/ via la formation de progestérone et le récepteur de celle-ci pour un effet de réparation de la myéline ; 2/ via la transformation de sulfate de prégnènolone qui module le fonctionnement des récepteurs du GABA et NMDA avec effet sur la mémoire ; 3/ apparemment direct par interaction avec MAP2 (voir le texte), agissant sur la polymérisation de la tubuline.
Synthèse de la déhydroépiandrostérone (DHEA)
La mise en évidence d’une conversion de la PREG en DHEA dans le système nerveux et de l’enzyme correspondante, le cytochrome P450c17 (Fig. 1), a posé de nombreux problèmes, paradoxalement puisque la DHEA avait été le premier sté- roïde dont l’accumulation dans le cerveau en absence de glandes stéroïdogènes avait été démontrée [2, 22]. Plusieurs études récentes proposent une issue à cette impasse.
L’une invoque une voie distincte de celle présente dans les glandes endocrines, ne nécessitant pas la présence du P450c17, mais suggérant une réaction chimique faisant intervenir la formation d’hydroperoxydes [23]. Deux autres rapportent la présence d’ARNm codant pour le P450c17 dans le cerveau de rongeurs et dans
plusieurs types cellulaires y compris au cours du développement [24-26]. Une autre étude montre la synthèse à partir de la PREG de DHEA par les astrocytes et les neurones de cortex en culture en l’absence de microglie [27].
Autres voies métaboliques
D’autres dérivés neurostéroïdiens ont été démontrés, 7α-hydroxylés [28-30] et acylesters [31], de fonction inconnue. La formation de sulfates (S) est catalysée par une hydroxystéroïde sulfotransférase, décrite en particulier chez l’amphibien [32, 33], ainsi que leur hydrolyse par une sulfatase.
RÉGULATION DE LA BIOSYNTHÈSE DES NEUROSTÉROÏDES
Récepteur périphérique des benzodiazépines
Une étape limitante de la stéroïdogenèse se situe au niveau du passage du cholestérol à l’intérieur de la mitochondrie. Une protéine de la membrane mitochondriale externe a été impliquée dans son transport, il s’agit du récepteur périphérique des benzodiazépines (PBR pour peripheral benzodiazepine receptor). Celui-ci est distinct du récepteur central des benzodiazépines, car il n’est pas associé aux récepteurs GABA et reconnaît des ligands sélectifs différents ; il semble fonctionner comme A un canal à cholestérol [35]. Dans les cellules de gliome C6 de rat, il a été montré que des agonistes du PBR, comme le Ro5-4864, stimulent la biosynthèse de la PREG [35] (Fig. 2). Un rôle du PBR dans la synthèse des neurostéroïdes a également pu être démontré in vivo : après injection intraveineuse d’un agoniste du PBR à des rats castrés et surrénalectomisés, les concentrations cérébrales de PREG augmentant de 70-100 % en quelques minutes seulement [36].
Les endozépines sont des ligands endogènes du PBR et sont produites en quantités importantes dans le système nerveux. Le terme désigne le diazepam-binding inhibitor (DBI) et les peptides dérivés de son clivage, en particulier le triakontatétraneuropeptide (TTN) et l’octadécaneuropeptide (ODN). Plusieurs laboratoires tentent d’identifier d’autres protéines du système nerveux qui lient le PBR, et l’une est appelée peripheral benzodiazepine receptor-associated protein 1 (PRAX-1), exprimée dans le cerveau, abondamment dans la sous-région CA1 de l’hippocampe [37].
Comme les neurostéroïdes exercent des effets protecteurs et trophiques dans le système nerveux, l’augmentation de leur biosynthèse via l’activation du PBR pourrait favoriser les processus de régénération après lésion ou au cours de maladies.
Dans les nerfs périphériques, le PBR et les peptides dérivés du DBI sont présents dans les cellules de Schwann [38]. Après lésion, le nombre de sites PBR et les taux d’endozépines sont augmentés dans le nerf sciatique du rat et retournent à des valeurs normales lorsque le processus de régénération est terminé [21]. L’expression du PBR est également augmentée de façon importante dans le cerveau des souris
dysmyéliniques Jimpy et Shiverer au niveau des astrocytes réactifs. Ceci pourrait expliquer les concentrations élevées de PROG chez ces mutants [39]. Il est intéressant de noter que la liaison du [3H]PK11195 aux sites PBR est également augmentée au niveau des lésions démyélinisantes au cours de la sclérose en plaques [40].
Protéine StAR
Une deuxième protéine, qui joue un rôle important dans le transport du cholestérol à l’intérieur de la mitochondrie des cellules stéroïdogènes, est la protéine StAR ( Steroidogenic Acute Regulatory Protein ). Elle joue un rôle dans la synthèse des hormones stéroïdes [41], probablement au niveau de la membrane externe de la mitochondrie [42], et on a montré par hybridation in situ que les messagers de StAR et du P450scc sont colocalisés dans plusieurs régions du cerveau, en particulier dans l’hippocampe et le cervelet [43].
Interactions cellulaires
Plusieurs études montrent que des interactions entre cellules influencent la synthèse et le métabolisme des neurostéroïdes : les astrocytes convertissent la [14C]DHEA en [14C]∆4androstènedione uniquement lorsqu’ils sont cultivés à faible densité, alors que la formation de [14C]7α-hydroxy-DHEA varie peu en fonction de la densité cellulaire [15] ; comme déjà mentionné, la microglie semble inhiber la production de DHEA à partir de la PREG par les astrocytes [27] ; les neurones stimulent la production de métabolites 5α-réduits à partir de la PROG par les cellules gliales [44] ; l’expression et l’activité de la 3β-HSD sont fortement augmentées dans les cellules de Schwann par un signal diffusible provenant des neurones sensoriels [45].
Les facteurs impliqués dans la régulation de la synthèse des neurostéroïdes restent à identifier. Les neurotransmetteurs sont de bons candidats. Ainsi, le muscimol, un agoniste des récepteurs GABA , et le clonazépam, un agoniste des sites centraux A des benzodiazépines, permettent tous les deux de stimuler la synthèse de la PREG par les cellules ganglionnaires de la rétine [46].
MODES D’ACTION DES NEUROSTÉROÏDES
Activités auto/paracrines
Comme les neurostéroïdes ne représentent pas une classe chimique particulière de stéroïdes, on pourrait s’attendre à ce que leurs modes d’action ne diffèrent pas de ceux des hormones stéroïdes circulantes. Pourtant, il existe une différence majeure entre les deux : alors que les stéroïdes produits par les glandes endocrines sont dilués dans la circulation générale et atteignent le cerveau ou les nerfs à des concentrations relativement faibles (mode d’action endocrine), les stéroïdes produits dans les cellules gliales ou neurones agissent localement par des actions auto/paracrines. Il
est donc possible que les neurostéroïdes agissent à des concentrations supérieures à celles considérées comme « physiologiques » pour les hormones circulantes (géné- ralement nanomolaires). En conséquence, les observations pharmacologiques montrant que des récepteurs de neurotransmetteurs sont modulés par des concentrations submicromolaires ou micromolaires de neurostéroïdes pourraient correspondre à une réalité biologique. Ceci reste cependant difficile à prouver, car on ne sait pas mesurer la concentration d’un stéroïde dans un micro-environnement comme l’espace synaptique.
Actions génomiques
Le mécanisme d’action des stéroïdes au niveau des récepteurs intranucléaires est généralement qualifié de « génomique » ou de « classique » [revues 47, 48]. Cependant, très peu d’études détaillées de biologie moléculaire concernent les récepteurs nucléaires des hormones stéroïdes dans le système nerveux : et jusqu’à présent, ce n’est que dans quelques rares cas que l’action directe d’un stéroïde sur un gène cible a été réellement démontrée. Certains récepteurs des stéroïdes, comme celui de la PROG, peuvent être activés par phosphorylation même en absence de ligand [49, 50]. De telles interactions entre récepteurs des stéroïdes et voies de phosphorylation pourraient jouer un rôle particulièrement important dans le cerveau [51].
Actions membranaires
Les effets membranaires des stéroïdes sont souvent qualifiés de « non-génomiques ». Il est cependant préférable d’éviter ce terme car, tout en agissant au niveau de la membrane cellulaire, les stéroïdes peuvent réguler l’expression de gènes par l’intermédiaire de voies de signalisation intracellulaires. Depuis de nombreuses années, des effets membranaires rapides des stéroïdes ont été décrits, en particulier des modifications de l’excitabilité des cellules nerveuses [52, 53]. Il est donc surprenant qu’aucun récepteur membranaire original n’ait été cloné jusqu’à présent.
Cependant les activités de plusieurs récepteurs de neurotransmetteurs peuvent être modulées par des neurostéroïdes, qui ont de ce fait été qualifiés de « neuroactifs » [54]. L’exemple le mieux étudié est la modulation des récepteurs GABA par PREG A S, DHEA S et 3α,5α-TH PROG, le GABA étant le neurotransmetteur inhibiteur principal dans le système nerveux central. A des concentrations qui sont compatibles avec celles mesurées dans le cerveau, PREG S et DHEA S inhibent tandis que la 3α,5α-TH PROG potentialise les effets du GABA [55]. Comme pour d’autres récepteurs-canaux, il existe de nombreuses isoformes du récepteur GABA , comA posées de différentes sous-unités [56]. Alors qu’on a suggéré que les stéroïdes se fixent sur des sites allostériques des récepteurs GABA , jusqu’à présent aucune A séquence d’acides aminés impliquée dans la liaison des stéroïdes n’a pu être identifiée. De plus, les nombreuses études d’interactions entre stéroïdes et récepteurs GABA recombinants n’ont pas permis de localiser un site de fixation des stéroïdes, A
même si certaines combinaisons de sous-unités ont plus d’affinité pour les stéroïdes que d’autres [57]. La présence d’une sous-unité δ inhibe la modulation des récepteurs GABA par les stéroïdes [58]. En tout cas, si des sites de fixation pour les A stéroïdes existent sur les récepteurs GABA , ce qu’évoquent fortement les actions A sélectives de leurs énantiomères [57, 59], ils devraient être distincts pour les stéroïdes inhibiteurs et activateurs. En effet, les liaisons de DHEA S et de 3α,5α-TH PROG au niveau de récepteurs GABA recombinants ne sont pas compétitives [60]. Une A nouvelle famille de récepteurs-canaux GABA, appelés récepteurs GABA , a été C récemment décrite dans la rétine. Constitués de sous-unités rho, les récepteurs GABA sont insensibles aux effets des benzodiazépines et des barbituriques [61], C mais ils peuvent être modulés de façon positive ou négative par des neurostéroïdes [62].
Des expériences d’électrophysiologie et de pharmacologie ont également indiqué des effets des neurostéroïdes sur les récepteurs glutamiques à l’acide N-méthyl-Daspartique (NMDA), cholinergiques, nicotiniques et sigma de type 1 (s1) [revues dans 5, 63-66].
Activité au niveau des microtubules
Un mécanisme supplémentaire d’action des stéroïdes vient d’être mis en évidence [67]. La PREG se lie avec une affinité élevée à une protéine principalement observée dans les dendrites, qui est associée aux microtubules ( Microtubule Associated Protein 2 , MAP2) et joue un rôle dans la polymérisation de la tubuline. Nous avons montré que cette interaction provoquait une augmentation de la vitesse et de l’importance de la polymérisation obtenue in vitro en utilisant des protéines purifiées qui forment des microtubules apparemment normaux au microscope électronique.
La PROG et PREGS se lient également à MAP2, mais s’opposent à l’activité de la PREG (Fig. 3). Dans des neurones en culture, la PREG augmente spécifiquement le marquage obtenu avec un anticorps monoclonal anti-MAP2 et son extension dans les neurites. Ce mécanisme nouveau pourrait jouer un rôle dans la régulation de la formation et de la dynamique des microtubules, que l’on sait altérées au cours du vieillissement cérébral, et de plusieurs affections traumatiques ou neurodégéné- ratives.
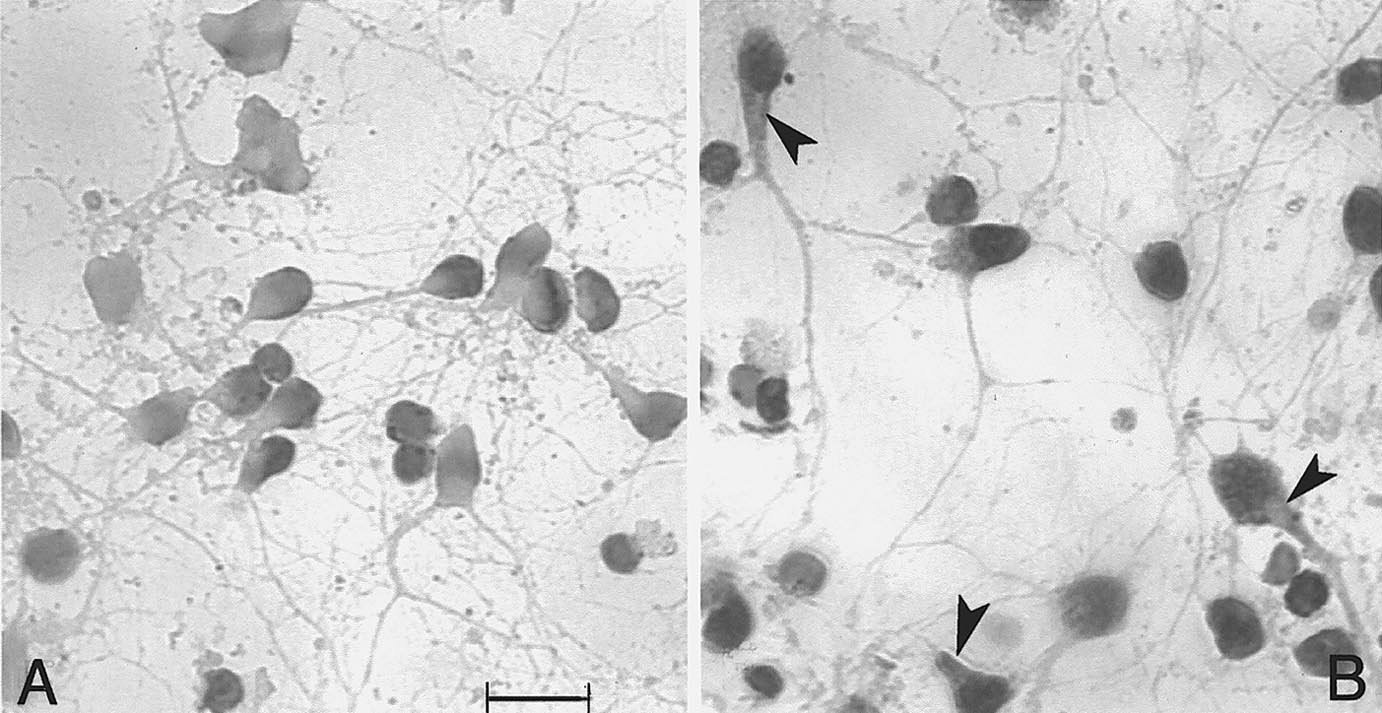
FIG. 3. —
Stéroïdes et assemblage des microtubules . A/ la prégnènolone stimule la polymérisation de la tubuline en présence de MAP2, ce qu’indique l’augmentation de l’absorbance dans cette étude in vitro avec des protéines pures. La progestérone et l’oestradiol sont inefficaces par elles-mêmes, mais la progestérone (au contraire de l’oestradiol) est antagoniste de la prégnènolone. B/ la révélation immunohistochimique de MAP2 par un anticorps monoclonal indique, dans la figure de droite, l’effet de la prégnènolone (flèches) avec expansion dans les neurites [67].
ACTIVITÉS DES NEUROSTÉROÏDES
Actions psychopharmacologiques
La modulation de la neurotransmission par les neurostéroïdes peut expliquer certains de leurs effets psychopharmacologiques. Par exemple, c’est en activant les récepteurs GABA que la 3α,5α-TH PROG exerce ses effets anxiolytiques, antidé- A presseurs, anesthésiques, anticonvulsivants, qu’elle influence les phases du sommeil et qu’elle diminue les capacités mnésiques. La littérature, concernant les effets psychopharmacologiques des neurostéroïdes, est vaste [5, 65]. Nous ne traitons ici que des effets du PREG-S et de la 3α,5α-TH PROG sur la mémoire.
Les effets mnésiques des neurostéroïdes ont été étudiés dans différentes épreuves comportementales, notamment des tests d’évitement actif ou passif et des tests qui mettent en jeu la mémoire spatiale (différents types de labyrinthes). L’action promnésiante du PREG-S a été montrée chez la souris en administrant une dose très faible de ce neurostéroïde directement dans l’hippocampe, une région du cerveau jouant un rôle clé dans certains processus mnésiques [68, 69]. La mise en évidence d’une corrélation entre taux endogènes de PREG-S dans l’hippocampe et performances mnésiques a permis d’établir un rôle physiologique du neurostéroïde dans la mémoire (Fig. 4). Chez des rats âgés présentant des déficits mnésiques, les taux de PREG-S sont sélectivement réduits dans l’hippocampe et l’injection d’une faible dose de PREG-S dans cette structure permettait d’améliorer de façon transitoire leurs performances de mémoire spatiale [69]. L’administration d’une dose promné- siante de PREG-S stimule la libération d’acétylcholine dans la zone de projection des fibres cholinergiques [69-71]. Ainsi peut-on suppléer le déficit d’un composé physiologique chez un animal âgé apparemment normal, cette réversibilité d’un déficit de l’âge étant de bon augure pour la mise au point de molécules efficaces sur les pertes de mémoire associées au vieillissement. En revanche, l’injection de 3α,5α-TH PROG dans le noyau basal magnocellulaire inhibe la mémoire spatiale [72]. Ces observations sont en accord avec un modèle qui propose que le PREG-S et la 3α,5α-TH PROG influencent l’activité des neurones cholinergiques en modulant leurs afférences GABAergiques. En effet, les neurones cholinergiques du cerveau antérieur reçoivent de nombreuses terminaisons GABAergiques et il est bien connu que le GABA et les benzodiazépines inhibent les performances mnésiques. Toutes ces expériences faisaient appel à des traitements aigus avec des neurostéroïdes. Une étude récente a permis de montrer que l’infusion continue pendant plusieurs jours de PREG S dans le troisième ventricule (10 ng/heure) avait également des effets promnésiants chez la souris. En revanche, l’administration continue de 3α,5α-TH PROG diminuait les performances mnésiques [73].
Ce sont les esters sulfates de PREG et de DHEA (PREG S et DHEA S) qui modulent l’activité des récepteurs GABA . Cependant, comme les formes libres et A estérifiées de ces deux neurostéroïdes sont interconvertibles, il est difficile de
FIG. 4. —
Mémoire et sulfate de prégnènolone . A/ la concentration de sulfate de prégnènolone dans l’hippocampe de rat âgé (approx. 2 ans) est inversement proportionnelle à la diminution de la mémoire spatiale (mesurée par la distance plus grande parcourue pour atteindre une plateforme dans la « piscine » du test de Morris). B/ chez les animaux déficitaires, le sulfate de prégnènolone restaure la mémoire spatiale, comme l’indique le test du labyrinthe en Y [69].
démontrer expérimentalement un rôle de la sulfatation dans leurs effets promné- siants. C’est seulement au cours des dernières années que plusieurs inhibiteurs de la sulfatase des stéroïdes, comme l’oestrone-3-O-sulfamate et la p-O-sulfamoyl-Ntetradecanoyl tyramine (DU-14), ont été développés. Ils ont permis de confirmer l’hypothèse d’un rôle important direct des esters sulfates de la PREG et de la DHEA. Ainsi, l’administration d’oestrone-3-O-sulfamate augmente les performances mnésiques des souris et renforce les effets promnésiants du DHEA S dans un test d’évitement passif [74]. L’administration du DU-14 bloque l’amnésie induite par la scopolamine chez des rats et provoque une augmentation des taux de l’acétylcholine au niveau de l’hippocampe [75].
On a montré que les récepteurs s1 jouent également un rôle majeur dans les effets mnésiques des neurostéroïdes [63, 76, 77]. Des études de la potentialisation à long terme (LTP pour long-term potentiation ), considérée comme un mécanisme synaptique mis en jeu dans certaines formes de mémoire [78], indique aussi des effets du DHEA S [79-81].
Actions trophiques
Des effets neurotrophiques ou neuroprotecteurs ont été décrits pour la PREG, la DHEA et la PROG par des expériences in vivo et in vitro . Chez le rat, l’injection de
PREG immédiatement après une lésion par compression de la moelle épinière, diminue les modifications histologiques du tissu nerveux, préserve le tissu de traumatismes secondaires et facilite la récupération des fonctions motrices [82]. Il reste à déterminer si la PREG agit directement ou par l’intermédiaire d’un de ses métabolites comme la PROG. L’administration de celle-ci réduit en effet la formation d’œdème, la dégénérescence neuronale secondaire, et favorise la récupération des fonctions cognitives après une lésion par contusion du cortex frontal de rat [83].
Cette observation pourrait permettre d’expliquer pourquoi, après un traumatisme cérébral, les femelles ont moins d’œdème que les mâles et ne développent pratiquement pas d’œdème lors de la gestation, lorsque les taux de PROG sont élevés. Il a été montré que la PROG favorise la survie des motoneurones après section du nerf facial [84].
Des concentrations nanomolaires de DHEA-S ou de DHEA favorisent la survie et la différenciation des neurones de souris embryonnaires en culture [85]. Récemment la DHEA ou son sulfate ont pu protéger les neurones de l’hippocampe [86] contre les effets cytotoxiques du glutamate et de la protéine β-amyloïde, et il a été proposé que la diminution des taux de DHEA observée au cours du vieillissement pourrait contribuer à une augmentation de la vulnérabilité des cellules nerveuses [87]. En revanche, le PREG-S augmente la mort des neurones de l’hippocampe induite par le NMDA et pourrait donc aggraver les altérations excitotoxiques suite à une lésion [88]. Dans des cultures primaires de neurones de cortex d’embryons de souris, DHEA et DHEA-S favorisent la croissance des neurites. Tandis que la DHEA augmente la longueur des axones, le DHEA-S stimule la croissance des dendrites
[89]. Ces résultats sont en accord avec un rôle de la sulfoconjugaison dans la spécificité de l’action de la DHEA.
Les neurostéroïdes agissent également sur les astrocytes en culture et affectent leur plasticité [90, 91]. Les cellules gliales myélinisantes, oligodendrocytes et cellules de Schwann, sont une autre cible des neurostéroïdes. Dans des cultures d’explants de ganglions spinaux de rats embryonnaires, contenant des neurones sensoriels et des cellules de Schwann, une faible concentration de PROG permet d’augmenter de façon importante le nombre des neurites myélinisés. Dans ces conditions expérimentales, la PROG agit sur le processus de myélinisation, car elle augmente le nombre de segments myélinisés sans affecter le nombre de cellules de Schwann et la longueur des neurites [92]. On a montré par la suite que la PROG accélère l’initiation de la myélinisation dans des co-cultures de neurones et de cellules de Schwann, avec augmentation de l’ARNm du cytochrome P450scc et de la 3β-HSD au moment de la formation des gaines de myéline [93]. La PROG synthétisée dans les nerfs périphériques est impliquée dans la formation de nouvelles gaines de myéline dans le nerf sciatique de la souris en régénération (Fig. 5) [92]. Si on bloque la synthèse ou l’action locale de la PROG, en appliquant sur le nerf en régénération du trilostane ou du RU486 respectivement, on inhibe la remyélinisation des axones régénérés. Le concept d’une formation et action locale de la progestérone est renforcé par la mise en évidence d’un récepteur intracellulaire pour ce neurostéroïde [94], et de l’activation par la PROG dans les cellules de Schwann, de l’expression de gènes codant pour les protéines de la myéline [95]. Notons que chez le rat âgé, l’administration prolongée de 5α-DH PROG permet de rétablir les taux d’expression des gènes de la myéline observés chez des animaux jeunes au niveau du nerf sciatique [96]. Les effets de PREG détectés au niveau des microtubules font actuellement l’objet d’études sur leur importance pour la plasticité neuronale, compte tenu de l’altération du cytosquelette au cours des altérations traumatiques ou neurodégénératives du cerveau.
CONCLUSIONS
La formation des neurostéroïdes dans le cerveau et dans les nerfs périphériques est maintenant bien établie. Cependant, l’étude de leurs voies biosynthétiques est loin d’être achevée. Jusqu’à présent, seules la DHEA, la PREG et leurs esters sulfates, la PROG et plusieurs de ses métabolites réduits sont considérés comme des neurosté- roïdes bona fide , qui restent présents dans le cerveau et dans les nerfs en absence de glandes endocrines et dont la biosynthèse dans le système nerveux peut être démontrée. Ceci les distingue des hormones stéroïdes sexuelles, androgènes et oestrogènes, qui ne sont plus détectables dans les tissus nerveux après castration et surrénalectomie, alors qu’on a pu mettre en évidence les enzymes qui pourraient catalyser leur formation (i.e. aromatase) (Fig. 1). D’ailleurs, la synthèse de stéroïdes dits « sexuels » dans le cerveau serait en contradiction avec une observation fondamentale en neuroendocrinologie : les fonctions reproductrices et les comportements sexuels disparaissent après castration, et ne sont réactivés qu’après administration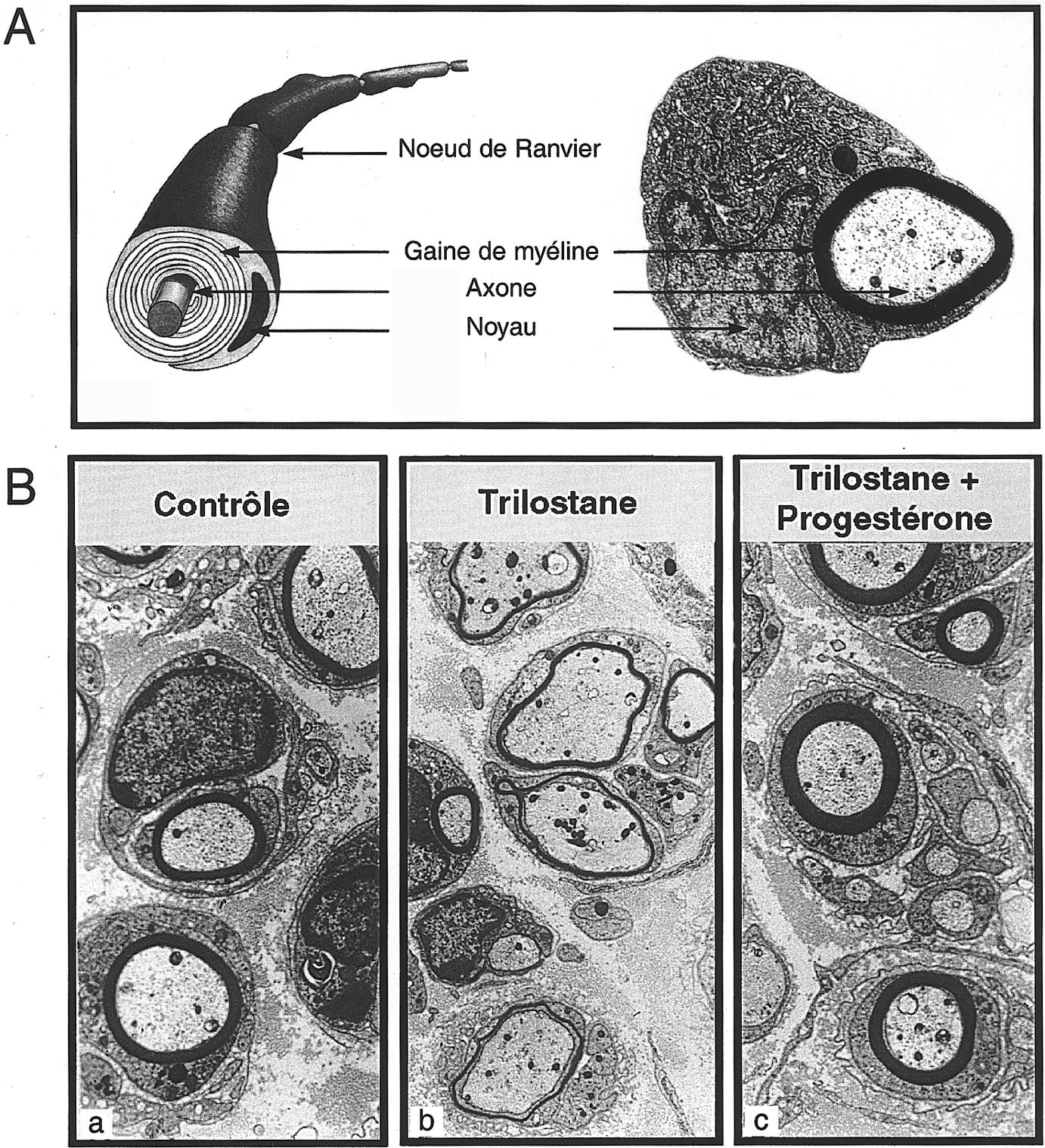
FIG. 5. —
Rôle de la synthèse locale de progestérone dans la myélinisation . (A) Dans les nerfs périphériques, les cellules de Schwann forment les gaines de myéline en synthétisant une large couche de membrane plasmique qui s’enroule en spirale autour de l’axone. A droite : photographie au microscope électronique d’un axone myélinisé du nerf sciatique de souris. (B) Photographie au microscope électronique montrant la formation de nouvelles gaines de myéline autour des axones régénérés dans le nerf sciatique de souris 15 jours après une lésion par congélation.
— régénération spontanée ;
— effet de l’administration locale de trilostane, un inhibiteur de la synthèse de la progestérone ;
— l’effet inhibiteur du trilostane est bloqué par l’administration simultanée de progestérone.
Le RU 486, antagoniste de la progestérone au niveau du récepteur, donne les mêmes résultats que le trilostane qui bloque la formation de la progestérone. Des résultats semblables peuvent être obtenus in vitro , dans des cultures de neurites de ganglion de la racine postérieure (DRG) [92].
d’hormones exogènes. Il s’agit donc de déterminer si toutes ces voies enzymatiques sont réellement fonctionnelles dans le système nerveux, si leurs activités sont quantitativement signifiantes, si leur présence est éventuellement restreinte à certaines régions du cerveau, à certaines populations de cellules et si elle dépend de conditions physiologiques précises. C’est pourquoi nous attachons beaucoup de valeur à des expériences comme celles qui démontrent l’activité physiologique de stéroïdes endogènes comme le PREG-S dans la mémoire et celles de PROG dans la remyénilisation. Au plan physio-pharmacologique, les effets expérimentaux de ces stéroïdes ouvrent la voie à de nouvelles recherches thérapeutiques. Des observations toutes récentes suggèrent la possibilité de concevoir des dérivés administrés par voie générale et actifs, spécifiquement dans le système nerveux.
REMERCIEMENTS
Je remercie particulièrement Michael Schumacher et Paul Robel, pour leur aide éditoriale et, plus important encore à l’évidence, leurs contributions scientifiques. Les noms de nos collaborateurs apparaissent au niveau des références. Je remercie aussi Dominique Diop pour son aide au niveau du manuscrit. Les travaux ont été principalement soutenus par l’INSERM, les Fondations F. Gould et G. H. et L. Mathers (New-York) et le Collège de France.
BIBLIOGRAPHIE [1] BAULIEU E.E.. — Steroid hormones in the brain : several mechanisms ?
In : Steroid hormone regulation of the brain (Fuxe K., Gustafsson J.A., Wetterberg L. eds), Oxford : Pergamon Press, 1981, pp 3-14.
[2] CORPÉCHOT C., ROBEL P., AXELSON M., SJÖVALL J, BAULIEU E.E. — Characterization and measurement of dehydroepiandrosterone sulfate in the rat brain. Proc Natl Acad Sci USA, 1981, 78, 4704-4707, [3] CORPÉCHOT C., SYNGUELAKIS M., TALHA S., AXELSON M., SJÖVALL J., VIHKO R., BAULIEU E.E., ROBEL P. — Pregnenolone and its sulfate ester in the rat brain. Brain Res, 1983, 270 , 119-125.
[4] ROBEL P., SCHUMACHER M., BAULIEU E.E. — Neurosteroids : From definition and biochemistry to physiopathologic function. In : Neurosteroids. A new regulatory function in the nervous system. (Baulieu E.E., Robel P., Schumacher M. eds), Totowa, New Jersey : Humana Press, 1999, 1-25.
[5] BAULIEU E.E., ROBEL P., SCHUMACHER M. — Neurosteroids. A new regulatory function in the nervous system. Totowa, New Jersey : Humana Press, 1999.
[6] CHENEY D.L., UZUNOV D., COSTA E., GUIDOTTI A. — Gas chromatographic-mass fragmentographic quantification of 3a-hydroxy-5a-pregnan-20-one (allopregnanolone) and its precursors in blood and brain of adrenalectomized and castrated rats. J Neurosci, 1995, 15 , 4641-4650.
[7] LIERE P., AKWA Y., WEILL-ENGERER S., EYCHENNE B., PIANOS A., ROBEL P., SJÖVALL J., SCHUMACHER M., BAULIEU E. — alidation of an analytical procedure to measure trace amounts of neurosteroids by Gas Chromatography — Mass Spectrometry. J Chromatogr. B ., 2000, 739 , 301-312.
[8] BOCK G.R., GOODE J.A. — Non-reproductive actions of sex steroids. Chichester : John Wiley and Sons, 1995.
[9] TAKASE M., UKENA K., YAMAZAKI T., KOMINAMI S., TSUTSUI K. — Pregnenolone, pregnenolone sulfate, and cytochrome P450 side-chain cleavage enzyme in the amphibian brain and their seasonal changes. Endocrinology, 1999, 140 , 1936-1944.
[10] TSUTSUI K., YAMAZAKI T. — Avian neurosteroids. I. Pregnenolone biosynthesis in the quail brain. Brain Res, 1995, 678 , 1-9.
[11] LE GOASCOGNE C., ROBEL P., GOUÉZOU M., SANANÈS N., BAULIEU E.E., WATERMAN M. — Neurosteroids : cytochrome P450scc in rat brain. Science , 1987, 237 , 1212-1215.
[12] SCHUMACHER M., ROBERT F., BAULIEU E.E. — Neurostéroïdes : effets trophiques dans le système nerveux. J Soc Biol , 1999, 193 , 285-292.
[13] ZWAIN I. H., YEN S.S.C. — Neurosteroidogenesis in astrocytes, oligodendrocytes, and neurons of cerebral cortex of rat brain. Endocrinology, 1999, 140 , 3843-3852.
[14] JUNG-TESTAS I., HU Z.Y., ROBEL P., BAULIEU E.E. — Biosynthesis of pregnenolone and progesterone in primary cultures of rat glial cells. Endocrinology , 1989, 124 , 2083-2091.
[15] AKWA Y., SANANÉS N.G., ROBEL P., BAULIEU E.E., LE GOASCOGNE C. — Astrocytes and neurosteroids : metabolism of pregnenolone and dehydroepiandrosterone. Regulation by cell density. J Cell Biol , 1993, 121 , 135-143.
[16] GUENNOUN R., FIDDES R.J., GOUÉZOU M., LOMBÈS M., BAULIEU E.E. — A key enzyme in the biosynthesis of neurosteroids, 3β-hydroxysteroid dehydrogenase/Delta5-Delta4-isomerase (3β- HSD), is expressed in rat brain. Mol Brain Res, 1995, 30 , 287-300.
[17] GUENNOUN R., SCHUMACHER M., ROBERT F., DELESPIERRE B., GOUÉZOU M., EYCHENNE B., AKWA Y., ROBEL P., BAULIEU E.E. — Neurosteroids : expression of functional 3b-hydroxysteroid dehydrogenase by rat sensory neurons and Schwann cells. Eur J Neurosci , 1997, 9 , 2236-2247.
[18] CHERRADI N., CHAMBAZ E.M., DEFAYE G. — Organization of 3 beta-hydroxysteroid dehydrogenase/isomerase and cytochrome P450scc into a catalytically active molecular complex in bovine adrenocortical mitochondria. J Steroid Biochem Mol Biol, 1995, 55 , 507-514.
[19] YOUNG J., CORPÉCHOT C., PERCHE M., HAUG M., BAULIEU E.E., ROBEL P. — Neurosteroids :
pharmacological effects of a 3 β-hydroxy-steroid dehydrogenase inhibitor. Endocrine J, 1994, 2 , 505-509.
[20] LACOR P., GANDOLFO P., TONON M.C., BRAULT E., DALIBERT I., SCHUMACHER M., BENAVIDES J., FERZAZ B. — Regulation of the expression of peripheral benzodiazepine receptors and their endogenous ligands during rat sciatic nerve degeneration and regeneration : a role for PBR in neurosteroidogenesis. Brain Res, 1999, 815 , 70-80.
[21] KRIEGER N.R., SCOTT R.G. — Nonneuronal localization for steroid converting enzyme : 3a — hydroxysteroid oxidoreductase in olfactory tubercle of rat brain. J Neurochem, 1989, 52 , 1866-1870.
[22] ROBEL P., AKWA ., CORPECHOT C., HU Z.Y., JUNG-TESTAS I., KABBADJ., LE GOASCOGNE C., MORFIN R., VOURC’H C., YOUNG I., BAULIEU E.E. — Neurosteroids : biosynthesis and function of pregnenolone and dehydroepiandrosterone in the brain. In : Brain Endocrinology (Motta M.
ed.), New York : Raven Press, 1991, pp. 105-132.
[23] CASCIO C., PRASAD V.V.K., LIN Y.Y., LIEBERMAN S., PAPADOPOULOS V. — Detection of P450c17-independent pathways for dehydroepiandrosterone (DHEA) biosynthesis in brain glial tumor cells. Proc Natl Acad Sci USA , 1998, 95, 2862-2867.
[24] STRÖMSTEDT M., WATERMAN M.R. — Messenger RNAs encoding steroidogenic enzymes are expressed in rodent brain . Brain Res Mol Brain Res, 1995, 34, 75-88.
[25] COMPAGNONE N.A., BULFONE A., RUBENSTEIN J.L., MELLON S.H. — Steroidogenic enzyme P450c17 is expressed in the embryonic central nervous system. Endocrinology, 1995, 136, 5212-5223.
[26] KOHCHI C., UKENA K., TSUTSUI K. — Age — and region-specific expressions of the messenger RNAs encoding for steroidogenic enzymes P450scc, P450c17 and 3beta-HSD in the postnatal rat brain. Brain Res , 1998, 801 , 233-238.
[27] ZWAIN I. H., YEN S.S.C — Dehydroepiandrosterone (DHEA) : biosynthesis and metabolism in the brain. Endocrinology , 1999, 140 , 880-887.
[28] AKWA Y., MORFIN R.F., ROBEL P., BAULIEU E.E. — Neurosteroid metabolism.
7a-hydroxylation of dehydroepiandrosterone and pregnenolone by rat brain microsomes. Biochem J , 1992, 288 , 959-964.
[29] STAPLETON G., STEEL M., RICHARDSON M., MASON J.O., ROSE K.A., MORRIS R.G., LATHE R. — A novel cytochrome P450 expressed primarily in brain. J Biol Chem, 1995, 270 , 29739-29745.
[30] ROSE K.A., STAPLETON G., DOTT K., KIENY M.P., BEST R., SCHWARZ M., RUSSELL D.W., BJÖRKHEM I., SECKL J., LATHE R. — Cyp7b, a novel brain cytochrome P450, catalyzes the synthesis of neurosteroids 7alpha-hydroxy dehydroepiandrosterone and 7alpha-hydroxy pregnenolone. Proc Natl Acad Sci USA, 1997, 94, 4925-4930.
[31] JO D.H., AIT ABDALLAH M., YOUNG J., BAULIEU E.E., ROBEL P. — Pregnenolone, dehydroepiandrosterone, and their sulfate and fatty acid esters in the rat brain. Steroids , 1989, 54 , 287-297.
[32] RAJKOWSKI K., ROBEL P., BAULIEU E.E. — Hydroxysteroid sulfotransferase activity in the rat brain and liver as a function of age and sex. Steroids, 1997, 62 , 427-436.
[33] BEAUJEAN D., MENSAH-NYAGAN A.G., DO-REGO J.L., VAN LUU-THE, PELLETIER G., VAUDRY H. — Immunocytochemical localization and biological activity of hydroxysteroid sulfotransferase in the frog brain . J Neurochem, 1999, 72 , 848-857.
[34] COMPAGNONE N.A., SALIDO E., SHAPIRO L.J., MELLON S.H. — Expression of steroid sulfatase during embryogenesis. Endocrinology, 1997, 138 , 4768-4773.
[35] CULTY M., LI H., BOUJRAD N., AMRI H., VIDIC B., BERNASSAU J.M., REVERSAT J.L., PAPADOPOULOS V. — In vitro studies on the role of the peripheral-type benzodiazepine receptor in steroidogenesis. J Ster Biochem Mol Biol, 1999, 69 , 123-130.
[36] KORNEYEV A., PAN B.S., POLO A., ROMEO E., GUIDOTTI A., COSTA E. — Stimulation of brain pregnenolone synthesis by mitochondrial diazepam binding inhibitor receptor ligands in vivo . J
Neurochem, 1993, 61 , 1515-1524.
[37] GALIÈGUE S., BILO O., COMBES T., BRIBES E., CARAYON P., LE FUR G., CASELLAS P. — Cloning and characterization of PRAX-1. A new protein that specifically interacts with the peripheral benzodiazepine receptor. J Biol Chem, 1999, 274 , 2938-2952.
[38] LACOR P., BENAVIDES J., FERZAZ B. — Enhanced expression of the peripheral benzodiazepine receptor (PBR) and its endogenous ligand octadecaneuropeptide (ODN) in the regenerating adult rat sciatic nerve. Neurosci Lett , 1996, 220 , 61-65.
[39] LE GOASCOGNE C., EYCHENNE B., TONON M-C., LACHAPELLE F., BAUMANN N., ROBEL P. — Neurosteroid progesterone is up-regulated in the brain of Jimpy and shiverer mice. Glia, 2000, 29, 14-24.
[40] VOWINCKEL E., REUTENS D., BECHER B., VERGE G., EVANS A., OWENS T., ANTEL J.P. — PK1195 binding to the peripheral benzodiazepine receptor as a marker of microglia activation in multiple sclerosis and experimental autoimmune encephalomyelitis . J Neurosc Re s, 1997, 50 , 345-353.
[41] STOCCO D.M. — A Star search : implications in controlling steroidogenesis. Biol Reprod, 1997, 56 , 328-336.
[42] MILLER W.L., STRAUSS J.F. — III Molecular pathology and mechanism of action of the steroidogenic acute regulatory protein, StAR. J Ster Biochem Mol Biol, 1999, 69 , 131-141.
[43] FURUKAWA A., MIYATAKE A., OHNISHI T., ICHIKAWA Y. — Steroidogenic acute regulatory protein (Star) transcripts constitutively expressed in the adult rat central nervous system :
colocalization of Star, Cytochrome P-450 (CYP XIA1), and 3β-hydroxysteroid dehydrogescc nase in the rat brain. J Neurochem,, 1998 , 71, 2231-2238.
[44] MELCANGI R.C., CAVARRETTA I., MAGNAGHI V., BALLABIO M., MARTINI L., MOTTA M. — Crosstalk between normal and tumoral brain cells. Effect on sex steroid metabolism. Endocrin, 1998, 8 , 65-71.
[45] ROBERT F., GUENNOUN R., DÉSARNAUD F., DO THI A.N., BENMESSAHEL Y., BAULIEU E.E., SCHUMACHER M. — Synthesis of progesterone in Schwann cells : regulation by neurons. Soumis pour publication.
[46] GUARNERI P., GUARNERI R., CASCIO C., PICCOLI F., PAPADOPOULOS V. — GammaAminobutyric acid type A/benzodiazepine receptors regulate rat retina neurosteroidogenesis.
Brain Res, 1995, 683, 65-72.
[47] EVANS R.M. — The steroid thyroid hormone receptor superfamily.
Science, 1988, 240 , 889-895.
[48] TRUSS M., BEATO M. — Steroid hormone receptors : Interaction with deoxyribonucleic acid and transcription factors. Endocr Rev, 1993, 14, 459-479.
[49] SCHUMACHER M., ROBERT F., EL-ETR M. — Actions de la progestérone dans le cerveau :
comportement reproducteur et libération de l’hormone lutéinisante. Reprod Hum Horm, 1999, 22 , 277-294.
[50] POWER R.F., CONNEELY O.M., O’ MALLEY B.W. — New Insights into Activation of the Steroid Hormone Receptor Superfamily. Trends Pharmacol Sci, 1992, 13 , 318-323.
[51] APOSTOLAKIS E.M., GARAI J., FOX C., SMITH C.L., WATSON S.J., CLARK J.H., O’MALLEY B.W.
— Dopaminergic regulation of progesterone receptors : brain D5 dopamine receptors mediate induction of lordosis by D1-like agonists in rats. J Neurosci, 1996 , 16, 4823-4834.
[52] SCHUMACHER M. — Rapid membrane effects of steroid hormones : an emerging concept in neuroendocrinology. Trends Neurosci, 1990, 13, 359-362.
[53] WEHLING M. — Specific, nongenomic actions of steroid hormones.
Annu Rev Physiol , 1997, 59 , 365-393.
[54] PAUL S.M., PURDY R.H. — Neuroactive Steroids. FASEB J , 1992, 6 , 2311-2322.
[55] MAJEWSKA M.D. — Neurosteroids : Endogenous bimodal modulators of the GABA receptor.
A Mechanism of action and physiological significance. Prog. Neurobiol ., 1992, 38 , 379-395.
[56] SMITH G.B., OLSEN R.W. — Functional domains of GABA receptors.
Trends Pharmacol Sci,
A 1995, 16 , 162-167.
[57] LAMBERT J.J., BELLELI D., SHEPHERD S.E., PISTIS M., PETERS J.A. — The selective interaction of neurosteroids with the GABA receptor. In : Neurosteroids. A new regulatory function in the
A nervous system (Baulieu E.E., Robel P., Schumacher M eds), Totowa, New Jersey : Humana Press, 1999, 125-142.
[58] ZHU W.J., WANG J.F., KRUEGER K.E., VICINI S. — Delta subunit inhibits neurosteroid modulation of GABA receptors. J Neurosci, 1996 , 16 , 6648-6656.
A [59] PURDY R.H., PAUL S.M. — Potentiation of GABAergic neurotransmission by steroids. In :
Neurosteroids. A new regulatory function in the nervous system (Baulieu E.E., Robel P., Schumacher M. eds), Totowa, New Jersey : Humana Press., 1999, 143-153.
[60] PARK-CHUNG M., MALAYEV A., PURDY R.H., GIBBS T.T., FARB D.H. — Sulfated and unsulfated steroids modulate gamma-aminobutyric acidA receptor function through distinct sites.
Brain Re s, 1999, 830, 72-87.
[61] JOHNSTON G.A. — GABA receptors : Relatively simple transmitter-gated ion channels ?
Trends c Pharmacol Exp Ther, 1996, 17, 319-323.
[62] MORRIS K.D.W., MOOREFIELD C., AMIN J. — Differential modulation of the γ-aminobutyric acid type C receptor by neuroactive steroids. Mol Pharmacol, 1999, 56 , 752-759.
[63] MONNET F.P., MAHÉ V., ROBEL P., BAULIEU E.E. — Neurosteroids via 6 receptors, modulate the [3H]norepinephrine relase evoked by N-methyl-D-aspartate in the rat hippocampus. Proc Natl Acad Sci USA, 1995 , 92 , 3774-3778.
[64] BASTIANETTO S., MONNET F., JUNIEN J.L., QUIRION R. — Steroidal modulation of sigma receptor function. In : Neurosteroids. A new regulatory function in the nervous system (Baulieu
E.E., Robel P., Schumacher M. eds), Totowa, New Jersey : Humana Press, 1999, 191-205.
[65] RUPPRECHT R., HOLSBOER F. — Neuroactive steroids : mechanisms of action and neuropsychopharmacological perspectives. Trends Neurosci, 1999, 2 2, 410-416.
[66] PHAN V.L., SU T.P., PRIVAT A., MAURICE T. — Modulation of steroidal levels by adrenalectomy/castration and inhibition of neurosteroid synthesis enzymes affect signal receptor-mediated behaviour in mice. Eur J Neurosci, 1999, 11 , 2385-2396.
[67] MURAKAMI K., FELLOUS A., BAULIEU E.E., ROBEL P. — Pregnenolone binds to microtubuleassociated protein 2 and stimulates microtubule assembly. Proc Natl Acad Sci USA, 2000, 97 , 3579-3584.
[68] FLOOD J.F., MORLEY J.E., ROBERTS E. — Pregnenolone sulfate enhances post-training memory processes when injected in very low doses into limbic system structures : the amygdala is by far the most sensitive. Proc Natl Acad Sci USA , 1995 , 92 , 10806-10810.
[69] VALLÉE M., MAYO W., DARNAUDERY M.C.C., YOUNG J., KOEHL M.L.M.M., BAULIEU E.E., ROBEL P., SIMON H. — Neurosteroids : deficient cognitive performance in aged rats depends on low pregnenolone sulfate levels in hippocampus. Proc Natl Acad Sci.USA , 1997, 94 , 14865- 14870.
[70] PALLARÉS M., DARNAUDÉRY M., DAY J., LE MOAL M., MAYO W. — The neurosteroid pregnenolone sulfate infused into the nucleus basalis increases both acetylcholine release in the frontal cortex or amygdala and spatial memory. Neuroscience , 1998 , 87 , 551-558.
[71] DARNAUDÉRY M., KOEHL M., PALLARÉS M., LE MOAL M., MAYO W. — The neurosteroid pregnenolone sulfate increases cortical acetylcholine release : a microdialysis study in freely moving rats. J Neurochem , 1998, 71, 2018-2022.
[72] MAYO W., DELLU F., ROBEL P., CHERKAOUI J, LE MOAL M., BAULIEU E.E., SIMON H. — Infusion of neurosteroids into the nucleus basalis magnocellularis affects cognitive processes in the rat. Brain Res, 1993, 607, 324-328.
[73] LADURELLE N., EYCHENNE B., DENTON D., BLAIR-WEST J., SCHUMACHER M., ROBEL P., BAULIEU E.E. — Prolonged intracerebroventricular infusion of neurosteroids affects cognitive performances in the mouse. Brain Res, 2000, 858 , 371-379.
[74] LI P.K., RHODES M.E., JAGANNATHAN S., JOHNSON D.A — Reversal of scopolamine induced amnesia in rats by the steroid sulfatase inhibitor estrone-3-O-sulfamate. Brain Res Cogn Brain Res , 1995, 2 , 251-254.
[75] RHODES M.E., PUI-KAI L., BURKE A.M., JOHNSON D.A. — Enhanced plasma DHEAS, brain acetylcholine and memory mediated by steroid sulfatase inhibition. Brain Res, 1997, 773 , 28-32.
[76] MAURICE T., SU T.P., PRIVAT A. — Sigma 1 receptor agonists and neurosteroids attenuate B25-35-amyloid peptide-induced amnesia in mice through a common mechanism. Neuroscience , 1998, 83 , 413-428.
[77] URANI A., PRIVAT A., MAURICE T. — The modulation by neurosteroids of the scopolamineinduced learning impairment in mice involves an interaction with sigma 1 receptors. Brain Res, 1998, 799, 64-77.
[78] BLISS T.V.P., COLLINGRIDGE G.L. — A synaptic model of memory : long-term potentiation in the hippocampus. Nature, 1993, 361, 31-39.
[79] YOO A., HARRIS J., DUBROVSKY B. — Dose-response study of dehydroepiandrosterone sulfate on dentate gyrus long-term potentiation. Exp Neurol , 1996, 137 , 151-156.
[80] PAVLIDES C., OGAWA S., KIMURA A., MCEWEN B.S. — Role of adrenal steroid mineralocorticoid and glucocorticoid receptors in long-term potentiation in the CA1 field of hippocampal slices. Brain Res, 1996, 738 , 229-235.
[81] ITO K., SKINKLE K.L., HICKS T.P. — Age-dependent, steroid-specific effects of oestrogen on long-term potentiation in rat hippocampal slices. J Physiol (Lond) , 1999 , 515 , 209-220.
[82] GUTH L., ZHANG Z., ROBERTS E. — Key role for pregnenolone in combination therapy promotes recovery after spinal cord injury. Proc Natl Acad Sci USA, 1994 , 91 , 12308-12312.
[83] STEIN D.G., FULOP Z.L. — Progesterone and recovery after traumatic brain injury : an overview. The Neuroscientist, 1998 , 4 , 435-442.
[84] YU W.H. — Survival of motoneurons following axotomy is enhanced by lactation or by progesterone treatment. Brain Res, 1989, 491 , 379-382.
[85] BOLOGA L., SHARMA J., ROBERTS E. — Dehydroepiandrosterone and its sulfated derivative reduce neuronal death and enhance astrocytic differentiation in brain cell cultures. J Neurosci ,
Res , 1987, 17 , 225-234.
[86] KIMONIDES V.G., KHATIBI N.H., SVENDSEN C.N., SOFRONIEW M.V., HERBERT J. — Dehydroepiandrosterone (DHEA) and DHEA-sulfate (DHEAS) protect hippocampal neurons against excitatory amino acid-induced neurotoxicity. Proc Natl Acad Sci USA, 1998, 95 , 1852-1857.
[87] CARDOUNEL A., REGELSON W., KALIMI M. — Dehydroepiandrosterone protects hippocampal neurons against neurotoxin-induced cell death : mechanism of action. Soc Exp Biol Med, 1999, 222, 145-149.
[88] WEAVER C.E.J., WU F.S., GIBBS T.T., FARB D.H. — Pregnenolone sulfate exacerbates NMDAinduced death of hippocampal neurons. Brain Res, 1998 , 803 , 129-136.
[89] COMPAGNONE N.A., MELLON S.H. — Dehydroepiandrosterone : a potential signalling molecule for neocortical organization during development. Proc Natl Acad Sci USA , 1998, 95 , 4678- 4683.
[90] DEL CERRO S., GARCIA-ESTRADA J., GARCIA-SEGURA L.M. — Neuroactive steroids regulate astroglia morphology in hippocampal cultures from adult rats. Glia, 1995, 14 , 65-71.
[91] GARCIA-ESTRADA J., DEL RIO J.A., LUQUIN S., SORIANO E., GARCIA-SEGURA L.M. — Gonadal hormones down-regulate reactive gliosis and astrocyte proliferation after penetrating brain injury. Brain Res, 1998, 628, 271-278.
[92] KOENIG H., SCHUMACHER M., FERZAZ B., DO THI A.N., RESSOUCHES A., GUENNOUN R., JUNG-TESTASOBEL I., ROBEL P., AKWA Y., BAULIEU E.E. — Progesterone synthesis and myelin formation by Schwann cells. Science , 1995, 268 , 1500-1503.
[93] CHAN J.R., PHILLIPS L.J., GLASER M. — Glucocorticoids and progestins signal the initiation and enhance the rate of myelin formation. Proc Natl Acad Sci USA, 1998, 95, 10459-10464.
[94] JUNG-TESTAS I., SCHUMACHER M., ROBEL P., BAULIEU E.E. — Demonstration of progesterone receptors in rat Schwann cells. J Steroid Biochem Mol Biol, 1996, 58, 77-82.
[95] DÉSARNAUD F., DO THI A.N., BROWN A., LEMKE G., SUTER U., BAULIEU, E.E., SCHUMACHER M. — 6 Progesterone stimulates the activity of the promoters of peripheral myelin protein-22 and P0 genes in Schwann cells. J Neurochem , 1998, 71 , 1765-1768.
[96] MELCANGI R.C., MAGNAGHI V., CAVARRETTA L., MARTIN, L., PIVA F. — Age-induced decrease of glycoprotein P0 and myelin basic protein gene expression in the rat sciatic nerve. Repair by steroid derivatives. Neuroscience, 1998, 85 , 569-578.
DISCUSSION
M. René MORNEX
La découverte des neurostéroïdes qui a été faite par Etienne Baulieu et ses collaborateurs a des implications très importantes et garde encore des zones mystérieuses. À côté des localisations dans le noyau caudé, dans le cervelet et l’hippocampe qui ont été citées, a t-on réalisé une cartographie dans l’encéphale des stéroïdes et de l’enzyme contrôlant leur synthèse ? La deuxième question est suscitée par les images montrant la polymérisation des microtubules et le développement des neurites sous l’effet de la prégnènolone. Cela rappelle l’influence des hormones thyroïdiennes au cours du processus de maturation postnatal du système nerveux.
A-t-on des informations sur l’ontogenèse de la production des neurostéroïdes ?
Nous finissons actuellement la cartographie des stéroïdes dans le cerveau de souris et de rats, et avons entrepris un travail sur le cerveau humain dont on conçoit qu’il progressera plus lentement. La cartographie de certains enzymes indique, chez le rat et l’homme, la présence majoritaire du Cytochrome P450 dans la substance blanche et précisément les scc oligodendrocytes. Nous n’avons pas encore d’information sur l’ontogenèse des neurostéroïdes si ce n’est une belle corrélation avec la myélinogenèse de la production de prégnènolone, précurseur de la progestérone qui a des propriétés myélinisantes.
M. Raymond ARDAILLOU
Comment sont régulées l’expression et l’activité de l’enzyme transformant le cholestérol en prégnènolone dans le cerveau ? La structure des récepteurs de la progestérone dans le cerveau est-elle la même ou différente de celle des récepteurs périphériques ?
On ne connaît pas la régulation du Cytochrome P450 dans le cerveau. Nous avons scc détecté « un récepteur » de la progestérone dans les cellules gliales, qui pourrait être un isoforme du récepteur « sexuel ». Les clonages de contrôle sont en cours.
M. Claude JAFFIOL
La présence de neurostéroïdes dans le SNC et leurs implications physiologiques s’observentelles dans l’évolution phylogénétique ? Quelle peut être l’implication des neurostéroïdes dans la régulation du sommeil ? Parmi les mécanismes régulateurs, que sait-on de l’action des hormones thyroïdiennes et de l’insuline ?
Il y a des neurostéroïdes chez les amphibiens et les oiseaux, avec des essais concluants sur le comportement de ces derniers. L’administration de DHEA entraîne une augmentation du sommeil paradoxal. Je ne sais rien de l’action des hormones thyroïdiennes et de l’insuline sur la neurostéroïdogenèse.
M. Roger NORDMANN
Vous avez décrit le rôle essentiel probable des neurostéroïdes dans la régénération neuronale. Étant donné que, chez l’homme adulte, un renouvellement se poursuit activement au niveau des neurones impliqués dans l’olfaction, contrairement à la plupart des autres neurones, avez-vous étudié comparativement l’importance de la synthèse de la prégnènolone au niveau du bulbe olfactif et d’autres régions cérébrales ? Une synthèse plus importante au niveau olfactif représenterait, me semble-t-il, un argument de poids en faveur du rôle évoqué des neurostéroïdes dans la plasticité neuronale. D’autre part, pourriez-vous préciser les caractéristiques du cytochrome P450 impliqué dans la biosynthèse de la prégnènolone au point de vue de sa régulation, de sa spécificité et de son éventuelle inductibilité ?
Oui, il y a relativement beaucoup de prégnènolone au niveau du bulbe olfactif chez les rongeurs. A ma connaissance, on n’a pas séquencé ou cloné ou étudié la régulation du Cytochrome 450 cérébral.
M. Jacques POLONOVSKI
Est-il possible de distinguer un effet paracrine de l’effet autocrine de ces stéroïdes ? Y a t-il un système de transport de ces neurostéroïdes, des proteïnes transporteuses ?
A présent, on ne sait pas distinguer expérimentalement un effet paracrine d’un effet autocrine. Je ne connais pas de protéines de transport des neurostéroïdes.
M. Georges DAVID
Vous avez eu l’occasion, dans une réponse à M. Mornex, d’envisager les effets des neurostéroïdes avant la naissance. Qu’en est-il de leurs effets après la naissance, sachant que le processus de la myélinisation se poursuit encore très activement après la naissance ?
Certainement, la myélinogenèse postnatale chez le rongeur est en partie sous le contrôle des neurostéroïdes, progestérone en particulier.
M. Bernard HILLEMAND
Les troubles mnésiques de l’alcoolisme pourraient-ils être liés à des perturbations de la genèse des neurostéroïdes ?
Nous avons observé, après administration « aiguë » d’éthanol, une chute transitoire de la DHEA cérébrale chez le rat. On n’en sait pas plus.
M. Jean-Luc de GENNES
A t-on étudié l’effet des inhibiteurs de la synthèse de la prégnènolone sur les effets imputés à cette hormone que vous avez présentée ?
Nous avons bloqué la synthèse de la prégnènolone dans le système de remyélinisation du nerf sciatique décrit dans l’exposé. Le résultat confirma le concept de synthèse locale des neurostéroïdes à partir du cholestérol et de son implication dans la réparation de la myéline.
M. Gabriel BLANCHER
Ces neurostéroïdes diffusent-ils hors du système nerveux ?
Peut-être diffusent-ils, mais leur faible abondance ne modifie pas les taux circulants des stéroïdes correspondants.
* U488 Inserm et Collège de France. 80, rue du Général Leclerc — 94276 Kremlin-Bicêtre. Tel : 01 49 59 18 82 — Fax : 01 45 21 19 40 — Email : baulieu@kb.inserm.fr. Tirés-à-part : Professeur Étienne-Émile BAULIEU, à l’adresse ci-dessus. Article reçu le 7 août 2000, accepté le 2 octobre 2000.
Bull. Acad. Natle Méd., 2001, 185, no 2, 349-372, séance du 20 février 2001


