Résumé
Deux nouvelles classes d’anticoagulants, les anti-facteurs Xa et IIa (antithrombines directes), actuellement développées, devraient modifier dans un futur proche nos stratégies pour la prévention et le traitement des événements thromboemboliques veineux (ETEV). Parmi les anti-facteurs Xa, les pentasaccharides débutent leur utilisation clinique. Fondaparinux (Arixtra®) est la forme synthétique du pentasaccharide naturel. Il est plus actif que le traitement de référence dans la prévention en chirurgie orthopédique et le traitement des ETEV et il semble prometteur (d’après l’étude de recherche dose déjà réalisée) dans les accidents thrombotiques coronaires. Une forme modifiée (idraparinux) permettant une seule administration par semaine apparaît avoir le même degré d’efficacité. Parmi les molécules à activité antithrombine directe, après l’hirudine et ses dérivés développés au cours de la dernière décade, des formes synthétiques, permettant une administration orale, sont développées : la plus avancée est le ximelagatran (Exanta®). Les essais cliniques actuels montrent une efficacité de l’ordre ou supérieure au comparateur (selon le temps de première administration) dans la prévention et dans la prévention au long cours des récidives après traitement d’un ETEV. Les essais sont en cours pour le traitement des ETEV, des thromboses coronaires et la prévention des accidents thromboemboliques artériels sur fibrillation auriculaire. Ces nouvelles antithrombines directes orales devraient permettre (si les essais cliniques le confirment) un traitement entièrement oral des ETEV et bouleverser la prise en charge des fibrillations auriculaires. D’autres molécules dirigées contre de « nouvelles » cibles thérapeutiques devraient entrer en développement. Parmi ces nouvelles classes moléculaires, les plus avancées sont celles des inhibiteurs directs du facteur Xa et celles des inhibiteurs de la phase initiale d’activation de la coagulation (la phase d’activation de facteur VII par le facteur tissulaire) mais d’autres stratégies sont aussi testées comme celle de la stimulation de la fibrinolyse. Ces nouvelles molécules, bientôt à notre disposition, devraient complètement modifier notre prise en charge des ETEV.
Summary
Two new classes of anticoagulants are actually developed which would change in the near future our strategies for the prevention and the treatment of venous thromboembolic events. These two classes are the anti-factor Xa and anti-factor IIa (direct antithrombin) agents. Among the anti factor Xa, the pentasaccharides are initiating their clinical use. Fondaparinux is a synthetic form of the natural pentasaccharide, its pharmacokinetics allows one s.c. administration / 24 hours. It is active in prevention and treatment of venous thromboembolic and coronary thrombotic events. A modified form (idraparinux) whose pharmacokinetics allows one administration only once a week should have the same type of efficacy. Among direct antithrombin agents, hirudin and derivatives have been developed in the past decade with a limited use due to several drawback. More recently synthetic direct antithrombins modified to allow oral route have been developed, the most advanced in development, melagatran, is active in the prevention and treatment of venous thromboembolic and coronary thrombotic events. It could allow (if confirmed by clinical trials) a complete oral treatment of deep vein thrombosis without any biological monitoring. Melagatran is also active in the prevention of arterial thromboembolic events on atrial fibrillation. But other molecular forms of synthetic orally active direct antithrombin are also in development. Besides these important changes in our therapeutics which should appear in a near future, molecules aimed at other target are also tested : the most advanced are those antagonizing the initial phase of tissue factor activation of factor VII but other strategies are being tested such as stimulation of fibrinolysis.These new drugs at our disposal to treat venous thromboembolism should modify completely our handling of the patients. But additionally the numerous clinical trials necessary to prove the efficacy of the drugs, modify our understanding in the implication of the coagulation and in the physiopathogeny of thrombotic events.
INTRODUCTION
Le traitement actuel des thromboses veineuses profondes associe — le traitement anticoagulant : administration immédiate d’héparine (de plus en plus fréquemment une héparine de bas poids moléculaire, HBPM) relayée aussi précocement que possible par une antivitamine K, — à une contention élastique adaptée. Ce traitement physique par contention élastique restera d’actualité, mais le traitement anticoagulant risque d’être bouleversé par l’arrivée de nouvelles classes thérapeutiques. Il y a 20 ans, le développement des HBPM a été fondé sur l’hypothèse de privilégier l’activité anti-facteur X activé (anti-Xa) par rapport à l’activité antithrombine (anti-IIa) dans le but de favoriser l’efficacité antithrombotique et de limiter le risque hémorragique. Le risque hémorragique des HBPM (qui privilégient
l’activité anti-Xa) a été récemment rappelé par l’AFSSAPS devant le rapport par la pharmacovigilance d’une incidence accrue d’accidents hémorragiques survenus avec les HBPM essentiellement, mais il s’agit de conditions de mésusage (patients très âgés et/ou à fonction rénale altérée, association à des médicaments ou des conditions hémorragipares, non-respect des posologies en particulier de l’adaptation au poids). Dans cette dualité, au moins théorique, entre activité anti-Xa (activité antithrombotique) et activité anti-IIa (risque pro-hémorragique), apparaissent deux classes moléculaires nouvelles. La première initiée par la forme synthétique de la séquence pentasaccharidique de liaison de l’héparine à l’antithrombine (fondaparinux, Arixtra®) ne potentialise que l’activité anti-Xa de l’antithrombine. La seconde classe est celle des antithrombines directes (anti-IIa) avec initialement les molécules naturelles (hirudine et dérivés) puis plus récemment les formes synthétiques comme le mélagatran actif par voie injectable mais surtout sa forme orale, le ximélagatran (Exanta®).
Le développement clinique du pentasaccharide en est au stade de la commercialisation dans la prévention des événements thromboemboliques veineux (ETEV) en chirurgie orthopédique, et les résultats (très positifs) des essais de phase III pour le traitement des thromboses veineuses profondes et des embolies pulmonaires viennent d’être présentés au congrès de l’ASH. Les essais de prévention en chirurgie digestive et carcinologique sont en cours.
L’Exanta® est développé (du fait de sa forme orale) dans un éventail d’indications plus large. En effet, il est en cours d’essais de phase III dans une indication numériquement plus large : la prévention au long cours des accidents emboliques (artériels) chez les patients en fibrillation auriculaire.
LES ANTI-Xa
Le fondaparinux (Tableau 1)
Pour le fondaparinux (pentasaccharide), une recherche de dose exemplaire (étude Penthatlon a permis de définir que la dose de 2,5 mg en une injection sous-cutanée par jour puisque sa demi-vie est de 17 heures, avait le meilleur rapport efficacité/tolérance pour la prévention des accidents thromboemboliques en chirurgie orthopédique. Quatre études de phase III ont été conduites pour comparer le fondaparinux à l’enoxaparine tant en Europe qu’en Amérique du Nord dans la prévention des accidents thromboemboliques, en chirurgie orthopédique (chirurgie majeure du genou [2], fracture de hanche [4-5]). L’ensemble de ces études regroupait 7 344 patients avec le même schéma d’administration du fondaparinux (première injection sous cutanée 6 heures (fi2) après la fin de l’intervention). Le schéma d’administration de l’enoxaparine pour les patients des groupes contrôles dans les études européennes [3-4] était 40 mg une fois par jour commencé (au moins théoriquement) 12 heures avant l’intervention alors que dans les études conduites en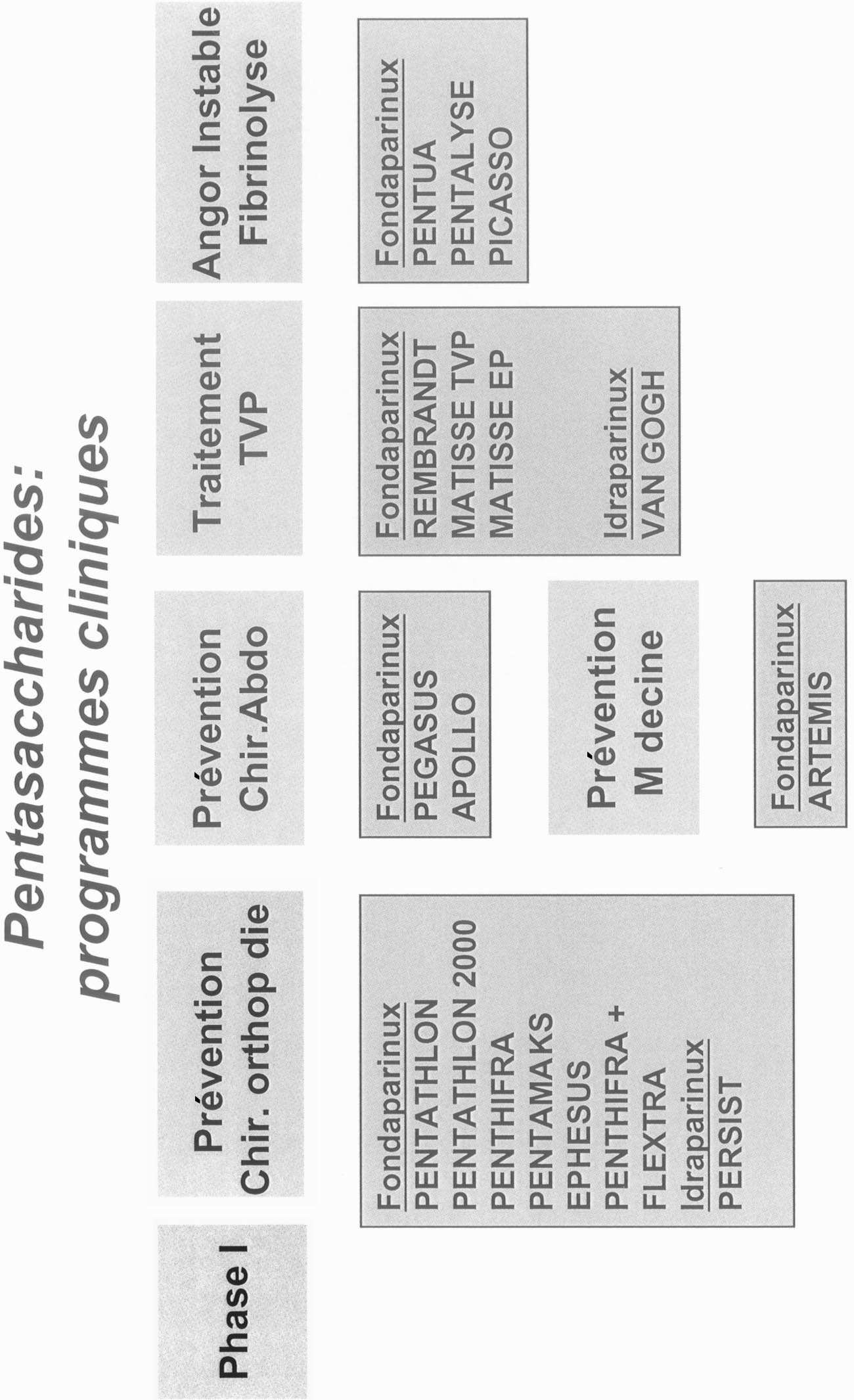 1.
1.
ABLEAU T
Amérique du Nord [2-5], l’enoxaparine était administrée à raison de 30 mg deux fois par jour avec la première injection (au moins théoriquement) 12 heures après l’intervention. La méta analyse [6] de ces quatre études montre une réduction de 55 % des ETEV par le fondaparinux, par comparaison à l’enoxaparine, sur le critère mixte principal d’efficacité commun à toutes ces études. Individuellement 3 études sur 4 démontrent une efficacité significative sur le critère « thromboses proximales », pour la quatrième étude ce n’est qu’une tendance. Le critère d’efficacité basé sur un examen phlébographique pose le problème de fond de significativité clinique des événements iconographiques [7]. En effet alors que la supériorité d’efficacité phlébographique est très significative, il n’existe pas de différence significative sur les événements thrombotiques cliniques ni sur la mortalité. Ce choix d’un critère d’imagerie, qui répond aux recommandations européennes et américaines pour l’enregistrement des antithrombotiques, permet d’obtenir des différences significatives en incluant des effectifs de patients dans les essais moins importants que s’il fallait arriver à des différences cliniques. Ceci est dû au fait que les accidents phlébographiques sont beaucoup plus fréquents que les accidents cliniques. Ce choix est néanmoins justifié puisque le critère phlébographique est bien corrélé aux ETEV cliniques, à la mortalité et à l’incidence de maladies post-phlébitiques.
Une évaluation post-hoc de l’heure à laquelle a véritablement débuté l’administration du fondaparinux après l’intervention montre que les administrations trop précoces, en particulier moins de 4 heures après la fin de l’intervention, s’accompagnent d’une augmentation significative des hémorragies au site chirurgical [8]. Cet excès d’hémorragies disparaît pour les administrations entre 6 et 8 heures. En revanche, l’efficacité antithrombotique est à peu près indépendante du temps d’administration du fondaparinux (pendant ce créneau jusqu’à la 9e heure postopé- ratoire), suggérant donc qu’il y aurait un intérêt a privilégier le créneau 6 à 8 heures pour la première administration. Cette notion de délai postopératoire pour la première injection est en cours d’évaluation par un essai spécifique aux Etats-Unis où les habitudes de prescription de l’anticoagulation vont jusqu’à 24 heures postopératoire.
La question suivante, qui est actuellement étudiée, est de savoir combien de temps le traitement prophylactique doit être poursuivi dans plusieurs indications et en particulier en chirurgie orthopédique où se discute l’intérêt d’un traitement beaucoup plus prolongé. Les résultats de l’essai de prévention prolongée (1 mois) en chirurgie orthopédique (PENTHIFRA+) (présentés au congrès de Sicot en août 2002) démontrent une forte activité de cette administration prolongée (par rapport à l’arrêt thérapeutique à 10 jours).
En utilisation curative des ETEV, les études de phase II ont montré contre HBPM pour la pathologie thromboembolique veineuse et contre HNF pour l’embolie pulmonaire que la dose de pentasaccharide de 7,5 mg/jour à la période aiguë, était efficace. Efficacité confirmée par les essais de phase III (MATISSE) qui viennent d’être présentés au congrès de l’ASH. L’essai de recherche de dose avec une forme modifiée (idraparinux) de pharmacocinétique beaucoup plus longue (permettant
une seule injection une fois par semaine) déjà présenté montre que la plus faible dose testée (2,5 mg) induit moins d’accidents hémorragiques que le traitement « classique » par AVK avec une efficacité antithrombotique au moins égale.
Les essais de recherche de dose du pentasaccharide dans les syndromes coronaires aigus et dans l’infarctus du myocarde sont aussi terminés et montrent que la même dose que celle efficace en prévention orthopédique de 2,5 mg en une injection par jour est au moins aussi efficace que l’HBPM de référence.
Notre panoplie thérapeutique commence donc à s’accroître avec l’Arixtra® (pentasaccharide) qui a déjà obtenu son autorisation de mise sur le marché dans le traitement préventif des ETEV en chirurgie orthopédique depuis un an en Amérique du Nord par la Food and Drug Administration et depuis quelques mois par l’EMEA (agence du médicament européenne). S’ajoutant à son efficacité, plusieurs points sont en faveur de l’utilisation de cette molécule :
— la sécurité : c’est une molécule synthétique (donc sans risque de contamination) alors que les héparines sont d’extraction porcine ; un récent rappel de lots d’extraits pancréatiques porcins par l’AFFSAPS pour contamination par un parvovirus porcin rappelle à cette vigilance, — l’absence de risque de pénurie possible avec les héparines qui consomment une grande partie des disponibilités planétaires et peuvent être réduites en cas d’épidémie animale comme nous venons de l’évoquer ou de problèmes d’élevage, — le caractère pratique : l’absence de contrôle biologique confère au prescripteur une facilité d’utilisation.
Dans la mesure ou ce produit serait utilisé sans contrôle biologique, l’absence de thrombopénie devrait être confirmée dans le cadre de la pharmacovigilance après commercialisation. En revanche, il faudrait préconiser la surveillance de l’activité anti-facteur Xa dans le plasma par un test spécifique. En effet, le pentasaccharide est éliminé par le rein et peut donc s’accumuler chez les insuffisants rénaux et les sujets âgés dont la fonction rénale peut être dégradée.
Les anti-facteurs Xa directs
Dans la classe des anti-facteurs Xa, l’efficacité démontrée du fondaparinux a stimulé le développement des anti-facteurs Xa directs qui, étant synthétiques, peuvent être administrées par voie orale. La molécule plus anciennement développée est le DX 9065a, mais plusieurs suivent. Cependant le développement de ces molécules est à un horizon plus lointain.
LES ANTITHROMBINES DIRECTES
Les hirudines
Le développement de la molécule qui a été plus novateur et qui non seulement a certifié l’efficacité mais qui a amené des idées physiopathologiques novatrices est le
développement de Revasc®. Revasc® ou désirudine est une hirudine recombinante donc une molécule à activité antithrombine directe, qui a démontré son efficacité antithrombotique en prévention, des ETEV en chirurgie orthopédique et en particulier la chirurgie de prothèse totale de hanche ou l’incidence des ETEV est particulièrement élevée. La recherche de doses, bien faite pour le développement de cette molécule, a montré qu’une dose inférieure à celle entraînant une anticoagulation périphérique forte avait un effet antithrombotique significatif. Cette hirudine, comme toutes les anti-thrombines directes, agit en empêchant :
— la transformation du fibrinogène en fibrine, — l’activation par la thrombine des plaquettes — et surtout la rétro-activation par la thrombine de la cascade d’activation de la coagulation.
De plus, la petite taille de cette molécule lui permet de diffuser facilement, et sa très forte affinité pour la thrombine guide cette diffusion pour aller inhiber la thrombine liée au caillot. Les thrombus croissent par la concentration de facteurs de coagulation et en particulier de thrombine dans le thrombus lui-même et dans son environnement proche. Cette concentration n’est pas dispersée si le thrombus est inclus dans un segment vasculaire en condition de stase, expliquant le rôle déterminant majeur des conditions hémodynamiques. Cette efficacité illustre le fait que la thrombose se développe surtout par un phénomène de propagation locale dans lequel le thrombus est par lui-même thrombogène. Cette hirudine bien qu’à dose modérée, donc n’inhibant que modérément la coagulation circulante, va cibler, du fait de sa haute spécificité et affinité, la thrombine liée sur le caillot, l’inhiber, bloquant ainsi l’évolution thrombotique de ce caillot et empêchant sa manifestation clinique. La faible activité anticoagulante circulante explique aussi le rapport risque/bénéfice favorable d’une telle molécule à une telle posologie. Ces données physiopathogéniques sont confortées par l’étude en sous-groupes des thromboses homolatérales et des thromboses controlatérales. C’est la thrombose homolatérale, thrombose formée par la lésion locale et se développant progressivement, qui est relativement la mieux inhibée par la désirudine à dose modérée par rapport au comparateur Enoxaparine alors que la thrombose controlatérale qui est davantage une thrombose de stase et d’hypercoagulabilité n’est pas mieux et peut être relativement légèrement moins bien protégée par le Revasc® à cette dose modérée par rapport au comparateur Enoxaparine. On arrive donc à une meilleure compréhension de la formation des thromboses avec, pour l’exemple de la chirurgie orthopédique de hanche, trois mécanismes physiopathogéniques proposés : pour la thrombose homolatérale fémorale haute : c’est une thrombose essentiellement de lésion locale aggravée accessoirement par la stase et l’hypercoagulabilité, évoluant par accrétion progressive sur ce thrombus thrombogène, la thrombose controlatérale et la thrombose distale sont des thromboses essentiellement de stase et d’hypercoagulabilité.
Au final le fait que le patient développe ou ne développe pas de thrombose cliniquement manifeste, va dépendre de deux mécanismes : l’activité thrombogène du
thrombus (et en particulier l’importance de cette activité par rapport au système inhibiteur naturel potentialisé par les thérapeutiques) et l’activité fibrinolytique pariétale qui elle, tend à détruire le réseau de fibrine ainsi formé. Sur ces nouvelles données physiopathogéniques, il est intéressant d’étudier comment de nouvelles molécules anticoagulantes, en cours de développement, vont se positionner.
Le Ximelagatran (Tableau 2)
Premier de la classe des antithrombines directes par voie orale, le ximélagatran a pour ambition de se substituer aux anticoagulants à la fois hépariniques à la période aiguë et aux anti-vitamines K utilisées en prévention secondaire. Son développement s’effectue donc dans quatre grandes directions :
— la prévention et le traitement des ETEV, — la prévention du risque thromboembolique dans la fibrillation auriculaire, — le traitement antithrombotique des syndromes coronaires aigus.
Les premiers essais de prévention ont eu lieu en chirurgie orthopédique [11]. L’étude de recherche de dose avec une première administration préopératoire a montré une telle efficacité qu’il a été décidé de faire l’étude de confirmation en supprimant la première administration immédiatement préopératoire et avec une première administration du Mélagatran en postopératoire. Cette séquence d’administration ne montre pas la supériorité espérée de cette molécule comparée à l’Enoxaparine mais « seulement » une équivalence en particulier pour les ETEV après prothèse totale de genou. En conséquence, un nouvel essai (EXPRESS) a été réalisé avec « rétablissement » d’une première administration préopératoire de la molécule qui retrouve la supériorité anti-thrombotique attendue mais au prix d’une incidence accrue d’accidents hémorragiques. Dans le traitement de la maladie thromboembolique ce sont les études THRIVE [12], études de recherches de dose, qui ont montré la bonne tolérance et l’efficacité d’une prise orale de ximélagatran 36 mg 2 fois par jour. Les études de phase III (THRIVE 2 et THRIVE 5) sont en cours. Ces études incluent des patients avec des thromboses veineuses avec ou sans embolie pulmonaire et comparent un traitement de 6 mois au traitement habituel Enoxaparine relayé précocement par la Warfarine. Dans l’attente de ces résultats une étude (THRIVE 3) de dessin différent et original soulève un fort intérêt : 250 patients après qu’ils aient reçu leur traitement théorique habituel de 6 mois d’anti-vitamines K pour un ETEV, ont été randomisés pour recevoir 18 mois supplémentaires de ximélagatran 24 mg 2 fois par jour, par comparaison à l’abstention thérapeutique habituelle, les résultats qui viennent d’être présentés au congrès de l’ASH démontrent l’efficacité de cette molécule dans cette indication avec une absence de majoration du risque hémorragique et donc soulèvent (à nouveau) la question de la durée idéale du traitement anticoagulant en particulier avec une attitude thérapeutique à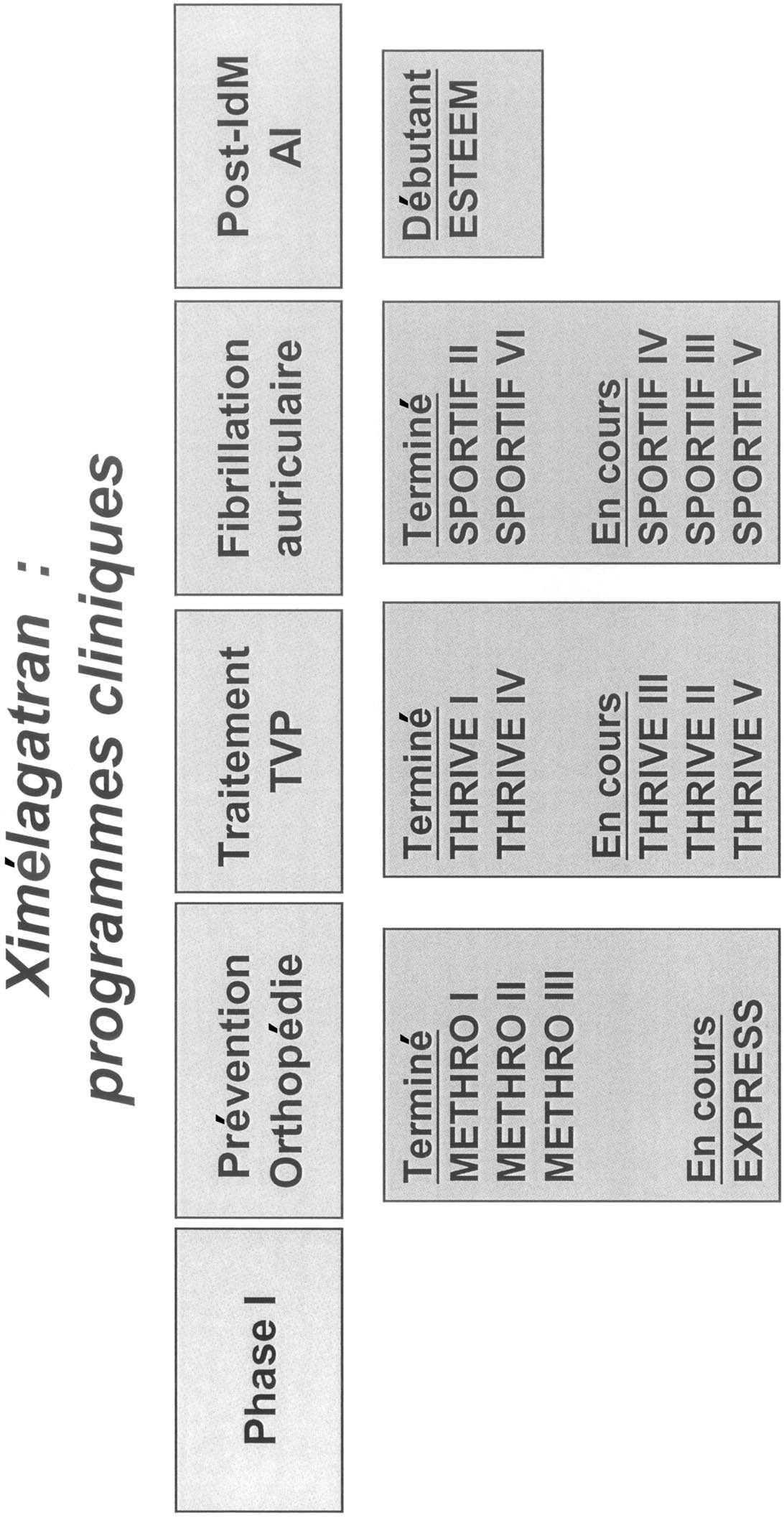 2.
2.
ABLEAU T
rapport bénéfice/risque aussi fort. Les études dans la fibrillation auriculaire (les essais Sportif) évaluent dans cette indication l’efficacité du ximélagatran 36 mg 2 fois par jour, et sont en cours. Les études dans la prévention des complications thrombotiques à pathologie coronaire aiguë sont en préparation.
Là encore le développement est prévu sans suivi biologique. L’absence de suivi sur les plaquettes se comprend car aucune toxicité n’est à craindre dans ce domaine, les molécules et le mode d’action n’ayant aucun point commun avec l’héparine. En revanche, les réserves faites plus haut pour le pentasaccharide peuvent être émises quant à la surveillance de l’activité, pour le même type de raisons : ce sont de petites molécules à élimination essentiellement rénale, avec un point supplémentaire : il s’agit d’une antithrombine directe. Pour ces molécules les tests dont on dispose en routine sont mal adaptés : le temps de thrombine est beaucoup trop sensible, le TCA est sensible surtout pour les faibles doses alors qu’aux fortes doses cette sensibilité s’effondre. Il faut donc des tests spécifiques (pas encore en place dans les laboratoires de routine) comme le temps de coagulation à l’écarine. Là encore des habitudes clinico-biologiques nouvelles sont à mettre en place pour que l’on se rende compte si l’activité attendue est bien obtenue et donc le rapport risque/efficacité favorable des essais, retrouvé.
Au total ce sont les rapports efficacité antithrombotique/risque hémorragique qui justifieront le bien-fondé des cibles thérapeutiques anti-IIa et anti-Xa spécifiques.
Ces molécules nouvelles de haute technologie, qui présentent en commun d’un point de vue pharmacocinétique une élimination purement rénale et qui toutes les deux ont été développées en évitant le contrôle biologique, nécessiteront une attention particulière chez les patients en insuffisance rénale ou chez les sujets âgés dont on connaît l’altération de la fonction rénale, patients qui sont aussi la cible des thérapeutiques antithrombotiques.
LES HORIZONS THÉRAPEUTIQUES PLUS LOINTAINS
A côté de ces molécules dont on devrait disposer dans un avenir proche, il faut envisager :
— celles qui vont « dupliquer » les deux nouveautés que nous venons d’évoquer. En particulier plusieurs molécules synthétiques à activité antithrombine directe (du type Mélagatran). Ces molécules se différencient par leur pharmacocinétique et leur affinité pour la thrombine est en cours d’évaluation. La plus avancée d’entre elles (BIBR 1048 de chez Boehringer Ingelheim Pharma KG) débute l’essai de phase III dans la prévention des ETEV en chirurgie orthopédique ;
— celles dirigées contre de nouvelles cibles thérapeutiques ;
— les plus avancées (dans le développement) sont les molécules qui visent à inhiber la phase initiale de la coagulation (la phase de facteur tissulaire). Les deux voies choisies passent par des molécules de haute biotechnologie :
• un facteur VII humain obtenu par recombinaison génétique sous une forme activée (pour optimiser son affinité pour le facteur tissulaire) et irréversiblement inactivé (pour qu’il bloque la voie) :
[Asis developpé par NovoNordisk], • le NAPc2 qui est le recombinant génétique d’un facteur anticoagulant naturellement produit par un nématode, — les molécules dirigées contre d’autres mécanismes : sont en particulier à l’étude les molécules visant à stimuler l’activité fibrinolytique (pour faire se dissoudre les thromboses qui pourraient se constituer).
CONCLUSION
Le monde de l’anticoagulation est en pleine évolution et cette évolution a deux facettes. Une est évidente : ces essais avec de nouvelles molécules ouvrent de nouvelles possibilités thérapeutiques. Notre panoplie thérapeutique nous permettra peut-être de mieux cibler la molécule (ou les associations moléculaires) au type exact de maladie dont souffrent individuellement les patients que nous prenons en charge au quotidien.
Mais la seconde moins évidente est non moins importante : la multiplication de ces essais avec des cibles moléculaires différentes, des degrés d’inhibition différents, des temps d’administration différents nous fait mieux comprendre la physiopathogénie (on devrait dire les physiopathogénies) des thromboses qui nous intéressent, ici les thromboses veineuses.
BIBLIOGRAPHIE [1] TURPIE A.G., GALLUS A.S., HOEK J.A. — A synthetic pentasaccharide for the prevention of deep-vein thrombosis after total hip replacement. N Engl J Med , 2001, 344, 619-625.
[2] BAUER K.A., ERIKSSON B.I., LASSEN M.R., TURPIE A.G. — Fondaparinux compared with enoxaparin for the prevention of venous thromboembolism after elective major knee surgery.
N.Engl.J.Med. , 2001, 345, 1305-1310.
[3] ERIKSSON B.I., BAUER K.A., LASSEN M.R., TURPIE A.G. — Fondaparinux compared with enoxaparin for the prevention of venous thromboembolism after hip-fracture surgery. N.Engl.J.Med. , 2001, 345, 1298-1304.
[4] LASSEN M.R., BAUER K.A., ERIKSSON B.I., TURPIE A.G. — Postoperative fondaparinux versus preoperative enoxaparin for prevention of venous thromboembolism in elective hipreplacement surgery : a randomised double-blind comparison. Lancet , 2002, 359, 1715-1720.
[5] TURPIE A.G., BAUER K.A., ERIKSSON B.I., LASSEN M.R. — Postoperative fondaparinux versus postoperative enoxaparin for prevention of venous thromboembolism after elective hipreplacement surgery : a randomised double-blind trial. Lancet , 2002, 359, 1721-1726.
[6] TURPIE A.G., BAUER K.A., ERIKSSON B.I., LASSEN M.R. — Fondaparinux vs Enoxaparin for the Prevention of Venous Thromboembolism in Major Orthopedic Surgery : A Meta-analysis of 4 Randomized Double-blind Studies. Arch.Intern.Med , 2002, 162, 1833-1840.
[7] BARRÉ J., SAMAMA C.M., MISMETTI P. — La thrombose asymptomatique en orthopédie : outil méthodologique ou critère intermédiaire ? Sang, Thrombose, Vaisseaux , 2002, 14, 341-346.
[8] GALLUS A.S., COGHLAN D.W. — Heparin pentasaccharide.
Curr.Opin.Hematol. , 2002, 9, 422- 429.
[9] BULLER H.R. — Fondaparinux and synthetic pentasaccharides in clinical practice. Oral presentation — 48th Annual SSC Meeting, Boston, MA, July 18-20, 2002.
[10] ERIKSSON B.I., ARFWIDSSON A.C., FRISON L., ERIKSSON U.G., BYLOCK A., KALEBO P., FAGER G., GUSTAFSSON D. — A dose-ranging study of the oral direct thrombin inhibitor, ximelagatran, and its subcutaneous form, melagatran, compared with dalteparin in the prophylaxis of thromboembolism after hip or knee replacement : METHRO I. Melagatran for THRombin inhibition in Orthopaedic surgery. Thromb Haemost , 2002, 87, 231-237.
[11] ERIKSSON B.I., BERGQVIST D., KALEBO P., DAHL O.E., LINDBRATT S., BYLOCK A., FRISON L., ERIKSSON U.G., WELIN L., GUSTAFSSON D. — Ximelagatran and melagatran compared with dalteparin for prevention of venous thromboembolism after total hip or knee replacement : the METHRO II randomised trial. Lancet , 2002, 360, 1441-1447.
[12] ERIKSSON B.I., WAHLANDER K., GUSTAFSSON D., WELIN L., FRISON L., SCHULMAN S. — Efficacy and tolerability of the novel, oral direct thrombin inhibitor ximelagatran (pINN, formerly H 376/95), compared with standard therapy for the treatment of acute deep vein thrombosis.
XVIII ISTH Thromb Haemost , 2001, 86 (suppl), Abstract OC2348-
DISCUSSION
M. Pierre BÉGUÉ
Que sait-on aujourd’hui de l’hémostase au cours des complications vasculaires de la drépanocytose ? Existe t-il une place pour les anticoagulants modernes ? Des travaux permettraient-il d’aborder les rôles respectifs de la membrane globulaire et de la cellule endothéliale, séparément des altérations des facteurs de la coagulation ?
Les occlusions veineuses de la drépanocytose sont associées aux crises occlusives microvasculaires et à des thromboses des gros troncs, en particulier veineux. Les accidents occlusifs micro-vasculaires d’origine hémorhéologique ; ils sont majorés par une hypercoagulation due à une consommation des inhibiteurs (en particulier de la protéine S) pendant les crises occlusives et l’exposition intra-vasculaire à différentes substances et structures hyper-coagulantes provenant de la paroi vasculaire (endothélium) et des érythrocytes. Une de leurs caractéristiques est de présenter des récidives alors qu’ils sont sous traitement anti-vitamine K, apparemment bien conduit et équilibré. Il semble que les héparines de bas poids moléculaire soient plus efficaces. Il est évident que les nouvelles molécules n’ont pas été étudiées dans cette indication. Mais leur cible d’action leur vaudra d’être évaluées dans cette indication.
M. Pierre GODEAU
Les médications qui limitent l’extension du thrombus ont-elles un rôle préventif de la maladie post-thrombotique et des séquelles locales des thromboses veineuses périphériques ?
La maladie post-phlébitique est une complication de la pathologie thrombotique veineuse. Pour savoir si ces nouvelles classes thérapeutiques peuvent limiter la survenue de ces accidents à long terme, il faudra beaucoup plus de recul.
M. André VACHERON
Comment surveiller biologiquement le traitement par Ximelagatran ?
Le Ximelagatran a été développé pour être utilisé sans contrôle biologique. Mais c’est une petite molécule à élimination rénale qui risque de s’accumuler chez les insuffisants rénaux. La population des patients développant une thrombose est une population de sujets âgés à fonction rénale plus ou moins altérée. L’utilisation de cette molécule dans cette population pourra conduire à instituer une surveillance biologique. Pour les antithrombines directes comme le Ximelagatran il faut un test spécifique qui n’est pas utilisé actuellement en routine : le test d’écarine.
M. Alain LARCAN
Que faut-il penser du risque des associations : thrombolytiques, héparines — antiagrégants (ayant souvent différents mécanismes d’action) ? Rookam et Jacques ont montré depuis longtemps que le traumatisme vasculaire, les antiagrégants (aspirine) et les anticoagulants (anti-vitamines K), n’entraînaient pas isolément de saignement important mais que l’association des 2 et ( a fortiori de 3 facteurs) multipliait par 5 et par 10 le risque de saignement.
Ne faut-il pas être plus raisonnable et plus prudent dans ces associations, en particulier lors des accidents coronaires aigus ?
La bonne efficacité antithrombotique clinique de l’aspirine pour une activité antihémostatique relativement modérée démontre que l’on n’a pas besoin d’être énormément « anticoagulant » pour être efficace. Lors de l’infarctus du myocarde, le patient est souvent au long cours sous aspirine, le traitement du processus thrombotique aigu est la thrombolyse mais pour éviter que la coagulation ne reprenne à l’arrêt de thrombolyse on associe un anticoagulant. De plus, bien souvent le patient subit très rapidement une exploration coronaire souvent complétée par une angioplastie requérant une protection anticoagulante et bien souvent une association antiplaquettaire. Deux points sont à retenir : les hémorragies les plus fréquentes sont des hémorragies mineures : l’hémorragie la plus grave et la plus redoutée est l’hémorragie cérébrale qui est essentiellement liée aux thrombolytiques.
M. Iradj GANDJBAKHCH
Pour tester l’efficacité de nombreux médicaments antithrombotiques, pourquoi n’utilise t-on pas la circulation extracorporelle qui nécessite une action anti-thrombotique absolue ?
Il est vrai que les circulations extracorporelles (CEC) sont des conditions artificielles très thrombogènes nécessitant une anticoagulation puissante, cette situation n’est pas repré- sentative d’autres situations thrombotiques.
* Service d’Angio-Hématologie, Hôpital Lariboisière, 2 rue A. Paré — 75010 Paris. ludovic.drouet@lrb.ap-hop-paris.fr Tirés-à-part : Professeur Ludovic DROUET, à l’adresse ci-dessus. Article reçu le 19 novembre 2002, accepté le 2 décembre 2002
Bull. Acad. Natle Méd., 2003, 187, n° 1, 85-97, séance du 14 janvier 2003


