Résumé
Le sommeil paradoxal (SP) ou sommeil REM caractérisé par une activation corticale associée à une atonie musculaire et des mouvements rapides des yeux a été découvert à la fin des années 50 par Michel Jouvet et William C. Dement. Les travaux des vingt années suivantes ont abouti à l’hypothèse que le déclenchement et le maintien du SP étaient dûs à une interaction inhibitrice réciproque entre des neurones inhibiteurs du SP de nature monoaminergique et des neurones exécutifs de nature cholinergique localisés dans un noyau de la formation réticulée pontique, le noyau sublatérodorsal. Nos travaux récents indiquent que ces neurones seraient respectivement de type GABAergique et glutamatergique. Ils suggèrent également un rôle inattendu inducteur de SP de neurones GABAergiques et d’un peptide hypothalamique, l’hormone de mélanoconcentration (MCH).
Summary
Paradoxical or REM sleep, characterized by cortical activation combined with muscle atonia and rapid eye movements, was discovered at the end of the 1950s by Michel Jouvet and William C. Dement. Studies over the next twenty years suggested that the onset and maintenance of paradoxical sleep was due to a reciprocal inhibitory interaction between monoaminergic neurons inhibiting PS and cholinergic neurons generating PS located in a small part of the pontine reticular formation called the sublaterodorsal tegmental nucleus. Our recent studies rather indicate that these neurons are respectively GABAergic and glutamatergic. Further, they suggest that three populations of GABAergic neurons and a population of hypothalamic neurons expressing melanin concentrating hormone, a peptide, play a important role in PS control.
INTRODUCTION
L’étude physiologique systématique du sommeil a réellement débuté après la mise au point de l’électroencéphalographie par Berger en 1929 et la mise en évidence d’ondes lentes au cours du sommeil. C’est ensuite seulement à la fin des années 50 qu’il a été découvert que le sommeil des mammifères est composé de deux états très différents, le sommeil à onde lente (ou non-REM) et le sommeil paradoxal (ou sommeil REM). Cette découverte a ouvert la voie à l’étude des mécanismes céré- braux à l’origine du sommeil et à l’identification de sa fonction.
Dans cette revue, nous rappellerons la phénoménologie du sommeil paradoxal, puis nous décrirons les réseaux neuronaux contrôlant cet état.
La découverte du sommeil paradoxal
En 1953, Aserinsky et Kleitmann [1] observent, chez l’enfant pendant la sieste, la survenue de mouvements oculaires rapides. Cet état correspond au sommeil REM décrit par Dement en 1957 [2] chez l’animal mais aussi chez l’Homme. En 1959, Michel Jouvet observe chez un chat « dit pontique » auquel il a enlevé la partie antérieure du cerveau l’apparition périodique d’une période de quelques minutes d’atonie musculaire. Il démontre ensuite chez l’animal entier que ces périodes d’atonie musculaire sont associées à une activation corticale similaire à celle de l’éveil et des mouvements oculaires rapides [3]. Il nomme ce troisième état du cerveau sommeil paradoxal du fait du paradoxe de l’association d’un cortex activé à une atonie musculaire. Il est ensuite montré que les dormeurs réveillés au cours du sommeil paradoxal mais pas au cours du sommeil lent rapportent des récits des rêves.
Michel Jouvet démontre également à cette époque que le sommeil paradoxal est pré- sent chez de nombreuses espèces de mammifères excepté les cétacés. La découverte de la présence de sommeil paradoxal chez des chats ou seul le tronc cérébral est présent a également permis de montrer que le sommeil paradoxal est généré par des structures restreintes au tronc cérébral différentes de celles générant le sommeil lent. L’identification des structures responsables a été poursuivi jusqu’aux années 80 chez le chat puis plus récemment essentiellement chez le rat et la souris du fait des problèmes d’éthique et de coût et du développement de modèles transgéniques [4].
La phénoménologie du sommeil paradoxal (SP)
Le sommeil paradoxal survient toujours après une période de sommeil lent. Il est caractérisé par des phénomènes toniques , c’est-à-dire persistant pendant toute la durée de cet état, et des phénomènes phasiques , isolés ou groupés. C’est un sommeil profond que seul un stimulus important peut interrompre. Pendant le sommeil paradoxal, l’EEG est rapide, de bas voltage, voisin de celui de l’éveil. Une activité rythmique, régulière, de fréquence de 5 à 9 Hz, dite thêta est enregistrée dans l’hippocampe chez le chat et le rat mais pas chez l’homme [5].
Les muscles squelettiques posturaux sont atoniques du fait d’une inhibition active des motoneurones spinaux.
Le sommeil paradoxal est également caractérisé par la présence de mouvements rapides des globes oculaires (REM), de petites secousses des muscles faciaux (vibrisses et oreilles chez le rat et le chat) et des extrémités des membres, ainsi que par une irrégularité cardio-respiratoire. La tension artérielle diminue avec de brusques à-coups hyper ou hypotensifs. Il a été montré uniquement chez le chat que ces phénomènes phasiques sont concomitants avec des pointes rapides, de grande amplitude (100ms, 250 μV), enregistrées principalement dans le tronc cérébral (pont de Varole), le noyau thalamique genouillé latéral et le cortex visuel, d’où leur nom de pointes ‘‘ ponto-géniculo-occipitales ’’ ou PGO [6]. Elles apparaissent isolées ou groupées en bouffées et sont caractéristiques du sommeil paradoxal du chat. Elles n’ont toutefois pas été observées chez le rat ou l’homme.
L’association d’une activité corticale électrique et de mouvements oculaires rapides (signes d’éveil) et de l’atonie musculaire (signe de sommeil profond), apparemment contradictoire, a fait nommer cet état sommeil paradoxal (SP) par Michel Jouvet.
Cet état de sommeil est également appelé sommeil activé et sommeil avec mouvements rapides des yeux soit en anglais Rapid Eye Movement (REM) sleep .
Le sommeil paradoxal se caractérise également, de la naissance à l’extrême vieillesse, par une érection pénienne chez l’homme et une vasodilatation vaginale chez la femme et ce quel que soit le contenu des rêves. Des érections ont également été enregistrées chez le rat [7].
Les épisodes de sommeil lent et de sommeil paradoxal se succèdent au cours de la période de repos et constituent un cycle de sommeil. La durée d’un cycle varie selon l’espèce animale, rat 12 mn, chat 30 mn, homme 90 mn. La durée des cycles est également dénommée rythme ultradien de sommeil. Chez l’homme, trois à cinq cycles de sommeil lent-sommeil paradoxal composent la nuit de sommeil. Le début de nuit est caractérisé par la prédominance de sommeil lent profond et peu de sommeil paradoxal et la fin de nuit par un sommeil plus léger et une prédominance de sommeil paradoxal. Les épisodes de sommeil paradoxal sont toujours interrompus par un éveil très court pendant la nuit (micro éveil) et définitif au réveil le matin.
C’est seulement dans ce dernier cas que le dormeur se souvient de ses rêves.
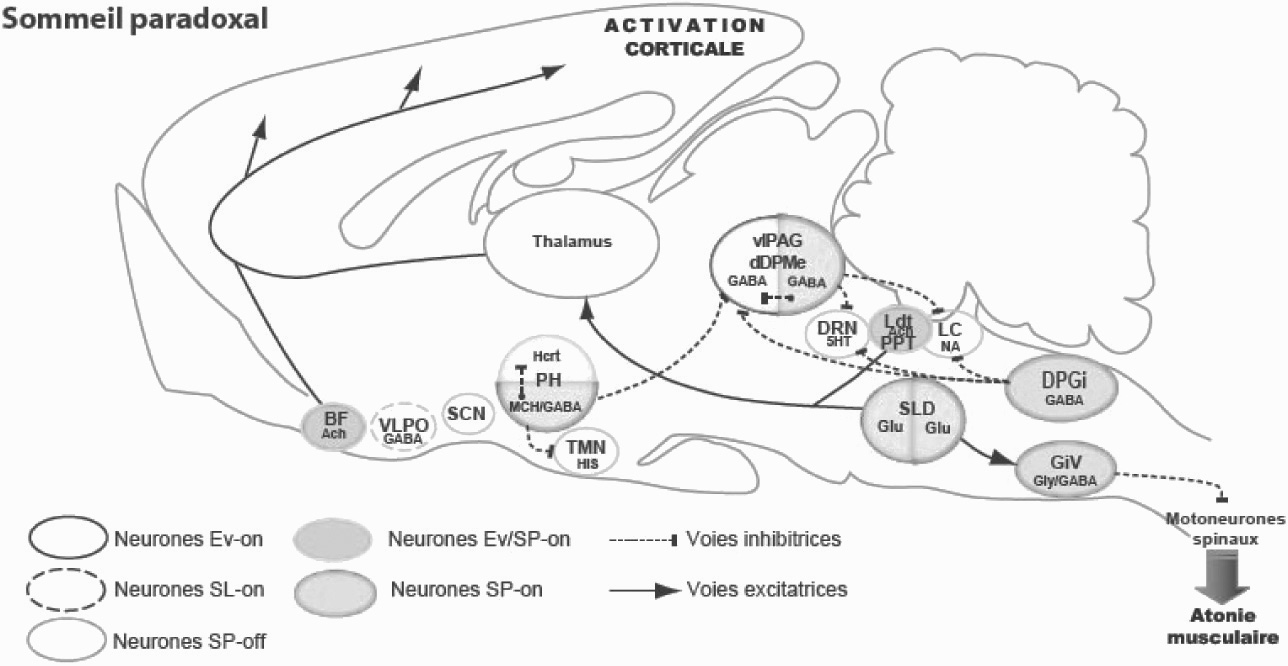
Le réseau de neurones contrôlant le sommeil paradoxal (Figure 1)
La persistance de sommeil paradoxal chez le chat dont la partie antérieure du cerveau a été enlevé ou en arrière d’une section entre les tubercules quadrijumeaux a permis à Michel Jouvet de démontrer dès les années 60 que les structures nécessaires et suffisantes à la genèse du sommeil paradoxal se localisent dans le tronc cérébral. Chez le chat dit « pontique » qui peut être maintenu en vie pendant plusieurs jours, le sommeil paradoxal (caractérisé par la présence d’atonie musculaire, de mouvements oculaires, et de PGO pontiques) survient très régulièrement et occupe 10 % du temps comme chez le chat intact [8].
Les neurones déclenchant le sommeil paradoxal
À l’aide de lésions électrolytiques bilatérales couvrant la plupart des structures pontiques, Michel Jouvet et ses collaborateurs ont ensuite montré que les neurones responsables du déclenchement et du maintien du sommeil paradoxal se localisent dans la partie dorso-médiane de la formation réticulée pontique située ventralement par rapport au locus coeruleus noradrénergique. Un consensus s’est récemment dégagé pour nommer cette région noyau sublatérodorsal (SLD). Les lésions extensives du SLD induisent une disparition du sommeil paradoxal alors que les lésions plus restreintes induisent un état dissocié où l’animal présente tous les signes du sommeil paradoxal excepté l’atonie musculaire [8]. Cet état dissocié a ensuite été retrouvé dans une pathologie humaine nommée trouble du comportement en sommeil paradoxal. Il a été récemment montré que la plupart des malades développe au bout de quelques années un Parkinson.
Chez les animaux lésés, l’éveil et le SL ne sont pas modifiés. L’animal n’étant plus paralysé pendant le sommeil paradoxal, il redresse la tête, se lève et accomplit un certain nombre de comportements caractéristiques de l’espèce. Le chat se met à l’affût devant une proie imaginaire, fait le gros dos, le poil hérissé, souffle comme s’il était devant un ennemi, fait sa toilette, joue avec une balle ou une souris invisible. La durée (5-6 minutes) de ces périodes oniriques (par analogie au rêve humain) est identique à celles des phases de SP observées avant la lésion [9]. Par la suite, des enregistrements de l’activité unitaire au cours du cycle veille-sommeil ont permis de démontrer la pré- sence dans le SLD de neurones avec une activité tonique uniquement pendant le sommeil paradoxal. Ces neurones ont été dénommés neurones SP-ON. Ils se diviseraient en deux sous-populations. Une population descendante responsable de l’atonie musculaire et une ascendante responsable de l’activation corticale [10].
Dès les années 60, il a été suggéré que les neurones du SLD seraient cholinergiques.
En effet, l’injection bilatérale dans le SLD chez le chat de carbachol, un agoniste cholinergique induit une augmentation dramatique des quantités de SP. Nos travaux récents chez le rat vont à l’encontre de cette hypothèse. Ils indiquent en effet sans ambiguïté que les neurones du SLD sont de nature glutamatergique [11]. Nous avons également démontré au cours des dernières années que ses neurones glutamatergiques se projettent sur des neurones du bulbe rachidien contenant deux neurotransmetteurs inhibiteurs, le GABA et la glycine. Ces neurones inhibiteurs se localisent dans la partie ventro-médiane du bulbe rachidien dans un noyau appelé noyau gigantocellulaire ventral (GiV) [12]. Ces neurones se projettent sur et hyperpolarisent les motoneurones crâniens et spinaux pendant le sommeil paradoxal induisent ainsi l’atone musculaire caractéristique du stade (Figure 1).
Fig. 1. — Schéma du réseau du sommeil paradoxal Voir détails dans le texte.
Abréviations : 5HT, sérotonine ; Ach, acétylcholine ; BF, Télencéphale basal, DPGi, noyau réticulé dorsal paragigantocellulaire ; dDpMe, Noyau profond réticulé mécencephalique dorsal ; DRN, noyau raphé dorsal ; GiV, noyau réticulé ventral gigantocellulaire ; Glu, glutamate ; Gly, glycine ; Hcrt, hypocretin- (orexin) ; His, histamine ; LC, locus coeruleus ; Ldt, noyau tegmental laterodorsal, LPGi, noyau lateral paragigantocellulaire ; MCH, hormone de mélanoconcentration ; PH, hypothalamus posterieur ; PPT, noyau pedunculopontin ; vlPAG, substrance grise periaqueducale ventrolaterale ; VLPO, noyau ventrolateral preoptique ; SCN, noyau suprachiasmatique ; SLD, noyau sublaterodorsal.
Les voies cérébrales responsables de l’activation corticale au cours du sommeil paradoxal font encore débat. L’activation corticale dépendrait de trois structures :
les neurones cholinergiques du tegmentum pontique, glutamatergiques du SLD et glutamatergique du noyau bulbaire gigantocellulaire ventral [13]. Ces neurones se projettent, de manière diffuse sur les noyaux intralaminaires du thalamus et les neurones cholinergiques et GABAergiques du télencéphale basal, relais vers le cortex [13].
Les neurones inhibant la survenue du sommeil paradoxal pendant l’éveil et le sommeil lent
Ces neurones dits SP-OFF sont actifs pendant l’éveil, diminuent leur activité pendant le sommeil lent et s’arrêtent juste avant l’entrée en SP. Il a été proposé au début des années 70 que ces neurones se projetaient sur les neurones SP-on et les inhibaient au cours de l’éveil et du sommeil lent empêchant ainsi l’intrusion du SP.
Réciproquement, les neurones SP-on se projetteraient sur les neurones SP-on et les inhiberaient. L’apparition du SP serait ainsi sous la dépendance d’une balance inhibitrice entre ces deux types de neurones. Plusieurs types de neurones SP-OFF localisés de l’hypothalamus au bulbe rachidien ont été successivement mis en évidence : les neurones monoaminergiques (NA, 5-HT, HA) [14] et les neurones orexinergiques [15]. Au cours des dernières années, nous avons mis en évidence une nouvelle population de neurones SP-OFF de nature GABAergique localisée dans la substance grise périaqueducale ventrolatérale (vlPAG) et la région juste ventrale à celle-ci (noyau profond du mésencéphale dorsal, dDPMe) [12]. Nos résultats indiquent que cette population de neurones GABAergiques se projette sur les neurones glutamatergiques du SLD et les inhibent au cours de l’éveil et du sommeil lent. Il semble aujourd’hui que les autres neurones de type SP-off auraient seulement un rôle secondaire dans l’inhibition des neurones SP-on.
Les neurones à hypocrétines (Hcrt) ou orexines découverts en 1998 appartiendraient à cette catégorie. Ils jouent un rôle clef dans l’éveil et leur absence conduit à une pathologie très invalidante, la narcolepsie. Les patients atteints mais aussi les souris et les chiens sans hypocrétines ou sans leur deuxième récepteur ont un sommeil fragmenté et présentent des épisodes de cataplexie caractérisés par l’intrusion de périodes d’atonie musculaire au cours de l’éveil actif [16, 17]. Notre hypothèse actuelle est que ces neurones excitent les neurones GABAergiques SP-off localisés dans la vlPAG et le dDPMe pendant les émotions positives et renforcent ainsi l’inhibition des neurones glutamatergiques du SLD. Du fait de leur absence chez le narcoleptique, les émotions positives induiraient une activation des neurones descendants du noyau de l’amygdale central qui en retour exciterait les neurones glutamatergiques du SLD induisant l’atonie musculaire caractéristique de la cataplexie.
Nos résultats récents indiquent que l’arrêt de l’activité de l’ensemble des neurones SP-OFF nécessaire à l’apparition du sommeil paradoxal serait induite par l’action d’autres neurones SP-on de type GABAergique. Ces neurones seraient situées dans l’hypothalamus postérieur (PH), la substance grise périaqueducale ventrolaterale (vlPAG) et la partie dorsomédiane du bulbe rachidien (noyau dorsal paragigantocellulaire, DPGi). Les neurones GABAergiques SP-on du PH inhiberaient pendant le sommeil paradoxal les neurones SP-off voisins histaminergiques et à hypocrétines.
Approximativement un tiers de ces neurones GABAergiques contiennent également un neuropeptide appelé ‘‘ hormone de mélanoconcentration ’’ (MCH). L’injection intracérébroventriculaire de ce neuropeptide induit une très forte augmentation des quantités de sommeil paradoxal. Ce peptide est à notre connaissance la seule substance neuroactive de type hypnogène. Une deuxième population de neurones SP-on GABAergiques se localiserait dans la vlPAG. Ils inhiberaient les neurones GABAergiques SP-off localisés dans la même structure et les neurones SP-off sérotoninergiques. Enfin, les neurones SP-on GABAergiques localisés dans le DPGi bulbaire inhiberaient les neurones SP-off noradrénergiques du locus coeruleus.
Notre hypothèse actuelle est que la mise en route de l’ensemble de ces populations de neurones SP-on GABAergiques est l’élément clef dans la mise en route du sommeil paradoxal. Leur mise en route induirait l’arrêt des neurones SP-OFF en particulier GABAergiques et par la-même la désinhibition des neurones SP-on glutama- tergiques du SLD. Les neurones GABAergiques SP-on intégreraient un grand nombre de paramètres physiologiques et possèderaient une horloge endogène leur permettant de calculer les quantités de sommeil paradoxal nécessaires. Ils se mettraient en route uniquement au cours du sommeil lent quand leur inhibition par les neurones SP-off serait au plus bas [4].
CONCLUSION
Le sommeil paradoxal est généré par des neurones glutamatergiques localisés dans le SLD. Ces neurones induisent l’activation corticale via des projections sur les neurones thalamiques intralaminaires et l’atonie musculaire via une projection sur des neurones glycinergiques et GABAergiques localisés dans la formation réticulé bulbaire. La mise en route des ces neurones dépendrait de l’arrêt d’une inhibition des neurones SP-off GABAergiques localisés dans la vlPAG et le dDPMe. L’arrêt de ces neurones et des autres neurones SP-off serait dû à la mise en route simultanée des trois groupes de neurones GABAergiques SP-on localisés dans l’hypothalamus postérieur, la vlPAG et le DPGi.
BIBLIOGRAPHIE [1] Aserinsky E., Kleitman N. — Regularly occurring periods of eye motility and concomitant phenomena during sleep. Science ., 1953, 118 , 273-4.
[2] Dement W., Kleitman N. — The relation of eye movements during sleep to dream activity: an objective method for the study of dreaming. Journal of Experimental Psychology Learning ,
Memory, and Cognition ., 1957, 53 , 339-46.
[3] Jouvet M, Michel F. — Corrélations électromyographiques du sommeil chez le chat décortiqué et mésencéphalique chronique. CR Soc Biol. , 1959, 153, 422-5.
[4] Luppi P.H., Clément O., Sapin E., Gervasoni D., Peyron C., Leger L. et al. — The neuronal network responsible for paradoxical sleep and its dysfunctions causing narcolepsy and rapid eye movement (REM) behavior disorder. Sleep Med. Rev ., 2010.
[5] Homeyer P., Sastre J.P., Buda C., Jouvet M. — Suppression of Ottoson waves in the isolated olfactory bulb during sleep in the pontine cat. Neuroreport , 1995, 6(5) , 773-6.
[6] Steriade M., Pare D., Datta S., Oakson G., Curro Dossi R. — Different cellular types in mesopontine cholinergic nuclei related to ponto-geniculo-occipital waves. J. Neurosci. , 1990, 10(8), 2560-79.
[7] Schmidt M.H., Valatx J.L., Schmidt H.S., Wauquier A., Jouvet M. — Experimental evidence of penile erections during paradoxical sleep in the rat. Neuroreport., 1994, 5(5) , 561-4.
[8] Jouvet M. — Recherches sur les structures nerveuses et les mécanismes responsables des différentes phases du sommeil physiologique. Arch. Ital. Biol ., 1962, 100 , 125-206.
[9] Sastre J.P., Jouvet M. — [Oneiric behavior in cats].
Physiol Behav. , 1979, 22(5) , 979-89.
[10] Sakai K., Kanamori N. — Are there non-monoaminergic paradoxical sleep-off neurons in the brainstem? Sleep Res. Online, 1999, 2(3) , 57-63.
[11] Clément O., Sapin E., Berod A., Fort P., Luppi P.H. — Evidence that Neurons of the Sublaterodorsal Tegmental Nucleus Triggering Paradoxical (REM) Sleep Are Glutamatergic.
Sleep, 2011, 34(4) , 419-23.
[12] Sapin E., Lapray D., Berod A., Goutagny R., Leger L., Ravassard P. et al. — Localization of the brainstem GABAergic neurons controlling paradoxical (REM) sleep.
PLoS ONE , 2009, 4(1) , e4272.
[13] Sakai K., Crochet S., Onoe H. — Pontine structures and mechanisms involved in the generation of paradoxical (REM) sleep. Arch. Ital. Biol ., 2001, 139(1-2) , 93-107.
[14] Hobson J.A., McCarley R.W., Wyzinski P.W. — Sleep cycle oscillation: reciprocal discharge by two brainstem neuronal groups. Science , 1975, 189(4196) , 55-8.
[15] Lee M.G., Hassani O.K., Jones B.E. — Discharge of identified orexin/hypocretin neurons across the sleep-waking cycle. Journal of Neuroscience , 2005, 25(28) , 6716-20.
[16] Lin L., Faraco J., Li R., Kadotani H., Rogers W., Lin X. et al . — The sleep disorder canine narcolepsy is caused by a mutation in the hypocretin (orexin) receptor 2 gene.
Cell. , 1999, 98(3) , 365-76.
[17] Chemelli R.M., Willie J.T., Sinton C.M., Elmquist J.K., Scammell T., Lee C. et al. —
Narcolepsy in orexin knockout mice: molecular genetics of sleep regulation.
Cell ., 1999, 98(4) , 437-51.
DISCUSSION
M. Jean-Jacques HAUW
Les observations que vous avez effectuées sur des modèles animaux ont-elles des équivalents humains ?
Les résultats que nous avons obtenus chez l’animal sont corroborés, de façon parcellaire par la pharmacologie et l’imagerie chez l’homme. En effet, avec la pharmacologie systémique, les effets obtenus résulte d’un effet simultané sur l’ensemble des récepteurs d’un neurotransmetteur donné qui peuvent être exprimés dans des populations de neurones avec des effets physiologiques opposés. L’imagerie chez l’homme a une définition spatiale et temporelle très loin encore du cellulaire et du moléculaire. Nous avons deux modèles animaux de pathologies, des souris narcoleptiques (sans hypocrétine) et des rats avec une lésion du centre de commande de l’atonie musculaire qui sont un modèle de troubles du comportement en sommeil paradoxal. La souris narcoleptique est un peu différente du patient dont les neurones à hypocrétines ont été détruits par une attaque autoimmune. Le modèle de trouble du comportement en SP pourrait être assez proche du patient.
M. Henri-Philippe HUSSON (Académie nationale de pharmacie)
Quelle est l’importance relative des deux phases de sommeil ? Y a-t-il une phase plus réparatrice sur la fatigue, par exemple ?
La privation de sommeil total ou de sommeil paradoxal chez le rat est létale au bout de trois semaines. Il est impossible de priver un animal de sommeil lent sans abolir le sommeil paradoxal. En revanche, les patients dépressifs sous traitement IMAO sans sommeil paradoxal pendant des années ne présentent pas de déficits cognitifs majeurs…
L’hormone de croissance est libérée pendant le sommeil lent profond. En résumé, bien qu’il n’y ait pas aujourd’hui de réponse décisive sur cette question, il est très probable que les deux phases de sommeil aient un rôle important et complémentaire tant sur le plan du développement et de la récupération que sur l’apprentissage et la mémorisation.
M. Emmanuel-Alain CABANIS
Les travaux récents d’IRM (f), notamment à haut champs (3 à 7 Tesla) montrent l’activation corticale bilatérale de sommeil, et notamment l’activation basale de l’encéphale, l’ensemble isolant les réseaux. Existe-t-il une différence d’activation reconnue entre sommeil lent et sommeil paradoxal, notamment en région hypothalamo-thalamique et préoptique Gabaergique (sommeil) ?
En effet, l’activité hypothalamique et corticale est très différente pendant le sommeil lent et le sommeil paradoxal. Pendant le sommeil lent, le cortex est plutôt inactivé par rapport à l’éveil ou au sommeil paradoxal. Il présente néanmoins des activations phasiques synchrones qui induisent les ondes delta. Les fuseaux du sommeil lent léger sont générés par le noyau réticulé thalamique et transmis aux autres neurones thalamiques et corticaux. Pendant le sommeil paradoxal, le cortex préfrontal est peu actif par rapport à l’éveil alors que les structures limbiques ont une activité très importante. Au niveau hypothalamique, la région préoptique latérale est très active pendant le sommeil lent alors que l’hypothalamus postérieur est très actif pendant le sommeil paradoxal et l’éveil.
M. Jean COSTENTIN
Comment peut-on expliquer le rebond du sommeil paradoxal qui fait suite à sa privation ?
Phénomène important dans la pharmacodépendance aux hypnotiques.
La présence d’un rebond du sommeil paradoxal indique qu’un mécanisme neuronal décompte les quantités de sommeil paradoxal. Nos travaux récents indiquent que les neurones hypothalamiques exprimant l’hormone de mélanoconcentration (MCH) pourraient jouer le rôle d’horloge du sommeil paradoxal. Cette hypothèse n’exclut pas un rôle du cortex qui pourrait informer les neurones à MCH de leur besoin en sommeil paradoxal en fonction de leur état de fonctionnement.
Bull. Acad. Natle Méd., 2011, 195, no 7, 1517-1525, séance du 11 octobre 2011