Résumé
Les nématodes du genre Oesophagostomum sont des parasites intestinaux des ruminants, du porc et des primates. Ces parasites sont responsables d’une maladie parfois gravissime et qui est due à la formation de nodules dans la paroi intestinale. L’œsophagostomose nodulaire est endémique dans le nord du Ghana et du Togo. Dans ces régions, des enquêtes épidémiologiques ont été réalisées pour préciser l’histoire naturelle de la maladie chez l’homme. Des cas d’œsophagostomose nodulaire ont également été décrits chez des grands singes en Afrique. Des signes cliniques liés à la présence de nodules sont observés chez les animaux élevés dans les sanctuaires alors que les animaux sauvages, bien que parasités, ne semblent pas présenter de symptômes. Les mêmes espèces du genre Oesophagostomum sont identifiées chez l’homme et les grands singes et la question d’une transmission zoonotique reste ouverte. Au Ghana, la mise en évidence d’une structuration génétique des nématodes en fonction des hôtes (primates non-humains ou homme) suggère que l’œsophagostomose n’est que rarement zoonotique. En Ouganda, la situation semble différente et les infestations croisées sont probables.
Summary
Nematodes of the genus Oesophagostomum are common intestinal parasites found in cattle, pigs and primates. They can cause severe illness, resulting from the formation of granulomas, caseous lesions and abscesses in the intestinal wall. Human oesophagostomosis is endemic in northern Ghana and Togo. In these regions, epidemiological investigations have been conducted to determine the biological characteristics, transmission dynamics and optimal management of clinical cases. Nodular oesophagostomosis has also been described in free-ranging chimpanzees and gorillas. Clinical signs associated with nodules have been observed in great apes raised in sanctuaries, while the health status of their wild counterparts does not seem to be significantly affected. It has been suggested that some nonhuman primates may act as reservoirs for human oesophagostomosis. In Ghana, identification of genetic differences among Oesophagostomum nematodes infecting different primate hosts suggests that oesophagostomosis is a rare zoonosis. In Uganda, where the situation is different, cross-infection is probably more frequent.
INTRODUCTION
Les nématodes du genre
Oesophagostomum sont des parasites digestifs dont les larves sont parfois responsables de la formation de nodules, de lésions caséeuses ou d’abcès sur la paroi digestive du bétail, du porc et des primates dont l’homme [1]. Ce sont des nématodes de taille moyenne (1 à 2 cm) qui présentent une dilatation cuticulaire antérieure (appelée vésicule céphalique) (figure 1). Les femelles fécondées sont très prolifiques (jusqu’à 5 000 œufs sont pondus chaque jour par chaque femelle) [2]. Ces œufs, libérés dans les matières fécales, éclosent et les larves se développent dans le milieu extérieur en passant par trois stades (L1, L2, L3). Dans les conditions optimales de température et d’hygrométrie, le stade L3 infestant est atteint en 4 à 7 jours. Les hôtes s’infestent en ingérant des larves L3 présentes dans l’eau, la nourriture ou la terre. Habituellement, les larves évoluent rapidement en adultes, parasites histophages du gros intestin. En de rares occasions (liées aux conditions environnementales et sans doute à l’immunité de l’hôte), les larves L3 s’enkystent dans la paroi digestive pour former des nodules, parfois très volumineux. Les lésions nodulaires peuvent passer inaperçues ou au contraire (si elles sont très nombreuses ou si le transit est interrompu par un nodule de grande taille) conduire à la mort de l’hôte. L’œsophagostomose nodulaire représente un réel problème de Santé publique dans certains pays africains où des milliers de cas sont rapportés chaque année. Des outils diagnostics ont été développés et des campagnes de prévention ont été récemment mises en place. Les enquêtes coproscopiques ont confirmé que l’infestation par des œsophagostomes est fréquente chez des primates sauvages et nous avons décrit quelques cas d’œsophagostomose nodulaire chez des grands singes en Afrique. Deux espèces principales ( O. bifurcum et O. stephanostomum ) sont identifiées chez l’homme et les grands singes et la question d’une transmission zoonotique reste ouverte.
Fig. 1. — Aspect de la partie antérieure d’un nématode adulte du genre
Œsophagostomum . La vésicule céphalique est bien visible (grossissement x 100).
L’ŒSOPHAGOSTOMOSE NODULAIRE CHEZ L’HOMME
Les tous premiers cas d’œsophagostomose nodulaire ont été rapportés il y a un siècle [3, 4]. Ces cas correspondent à des découvertes d’autopsie chez des patients originaires d’Ethiopie ou du Brésil. Par la suite, des cas isolés ont été décrits en Malaysie, en Indonésie, au Sultanat de Brunei, au Brésil et dans plusieurs pays Africains (Ghana, Togo mais aussi Zimbabwe, Ethiopie, Côte d’Ivoire, Ouganda et Nigeria) [5]. La forme clinique la plus caractéristique a été dénommée « tumeur de Dapaong » par Gigase et coll . en 1986 [6]. Elle correspond à la formation d’un nodule unique mais très volumineux (jusqu’à 6 cm de diamètre) sur le colon ascendant ou transversal. Ce nodule est composé d’une paroi épaisse et il contient une larve L4 ou un pré-adulte d’œsophagostome. Initialement, l’homme était présenté comme un hôte accidentel et les œsophagostomes étaient considérés comme des agents de zoonose occasionnelle provenant des primates non humains. Au début des années 1990, Polderman et coll . ont découvert qu’il existait un foyer très actif d’œsophagostomose nodulaire dans le nord du Ghana et du Togo [5]. La maladie était bien connue des populations locales qui la désignaient sous le terme de « Kounkoul » (tortue en langage Moba) [7]. Classiquement, la tumeur de Dapaong est associée à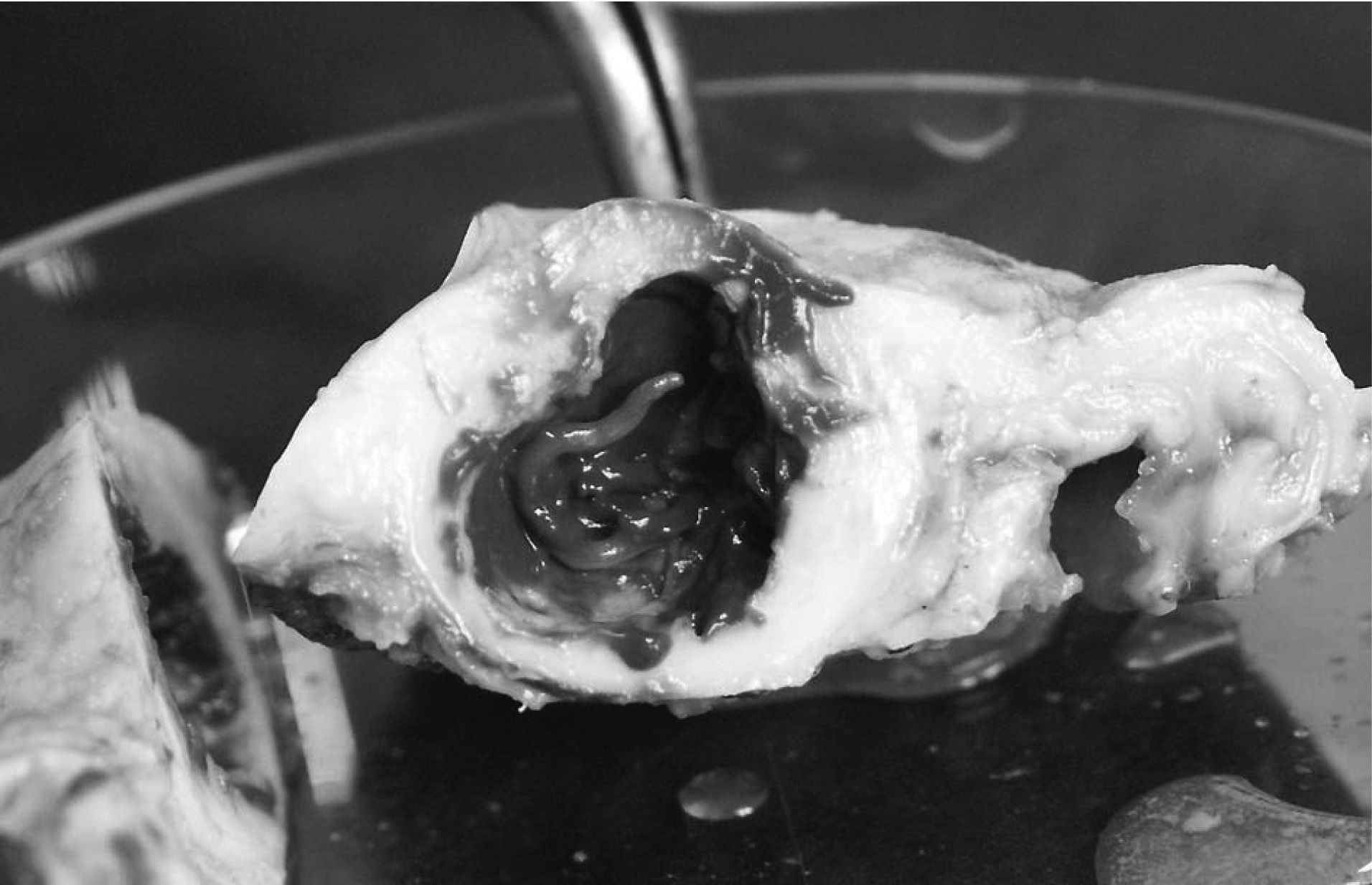
Fig. 2. — Lésion d’œsophagostomose nodulaire dans la paroi intestinale d’un chimpanzé de 12 ans provenant du Parc National Conkouati-Ndouli au Congo. Le nodule a été incisé et un nématode œsophagostome est visible à l’intérieur.
de l’hyperthermie, une douleur abdominale, une perte de poids et des troubles digestifs. Parfois, le nodule est responsable d’une péritonite ou d’un volvulus intestinal mortel. Une fistulisation est également possible. Le diagnostic différentiel inclut une appendicite, une amibiase, un processus néoplasique et une forme digestive de tuberculose [7]. L’échographie s’est rapidement imposée comme l’outil de dépistage le plus efficace au Ghana et au Togo. Les enquêtes épidémiologiques ont montré que le quart de la population vivant au nord-est du Ghana et au nord-ouest du Togo était infestée par des œsophagostomes et que plus d’un million d’individus étaient susceptibles d’être parasités. En 2007, Verweij et coll . ont développé une technique de PCR multiplex permettant de mettre en évidence l’ADN d’œsophagostomes ( Oesophagostomum bifurcum ) et d’ankylostomes ( Ancylostoma duodenale et Necator americanus ) directement à partir des matières fécales [8].
Des campagnes de prévention ont été mises en place au Ghana et au Togo. Au cours de sa thèse d’Université, Ziem (2006) a analysé l’impact de l’administration de deux doses uniques de 400 mg d’albendazole à six mois d’intervalle dans onze villages du nord-est du Ghana [9]. La prévalence des infestations parasitaires a diminué de 53.0 % à 5,4 % pour les œsophagostomes et de 86,9 % à 36,9 % pour les ankylostomes dès la première année. Deux ans après le début de l’étude, et après une série de quatre traitements successifs, la prévalence d’infestation était encore plus réduite (0,8 % pour les œsophagostomes et 23,4 % pour les ankylostomes). La couverture du traitement anthelminthique allait de 70 à 79 %. Pendant la même période, dans les régions témoins adjacentes, où aucun traitement antiparasitaire n’était en cours, la prévalence des infestations a augmenté de 18,5 à 37 % pour les œsophagostomes et de 86,1 à 91,3 % pour les ankylostomes.
La présence d’un foyer d’œsophagostomose nodulaire dans le nord du Ghana et du Togo (et son absence dans des régions comparables en Afrique) est assez surprenante. La composition du sol (qui serait favorable à la survie des larves) ou une prédisposition génétique des populations locales ont été évoquées. Une transmission à partir des primates non-humains est une autre hypothèse qui a fait l’objet de plusieurs études dès le début des années 1990.
Trois espèces d’œsophagostomes sont retrouvées chez l’homme : Œsophagostomum bifurcum , O. stephanostomum et O. aculeatum [5]. Dans le nord de la zone d’endémie d’œsophagostomose nodulaire, le nombre de primates a beaucoup diminué et les singes ne semblent donc plus jouer un rôle majeur dans la transmission locale de la maladie aux hommes. À l’inverse, dans les autres régions du Ghana, des babouins ( Papio anubis ), des cercopithèques ( Cercopithecus mona ) et des colobes ( Colobus vellerosus ) vivent dans et autour des villages et des campements humains. Cependant, alors qu’une forte prévalence d’infestation par
O. bifurcum est mise en évidence chez les cercopithèques et les babouins (de 75 à 99 %), aucun cas d’œsophagostomose n’a été rapporté chez les humains. Les colobes ne semblent pas infestés, ce qui pourrait s’expliquer par leur mode de vie strictement arboricole [10]. Des études génétiques sur une portion du gène Cox1 n’ont pas permis de distinguer les parasites provenant des humains et ceux provenant des primates non-humains [11].
D’autres études ont par contre mis en évidence une structuration génétique d’ O.
bifurcum en fonction des hôtes (babouins, cercopithèques, singes rouges et homme) [12, 13]. Ces derniers résultats semblent indiquer que dans les régions de forte endémicité, une spéciation d’hôte est en cours et que l’œsophagostomose due à O.
bifurcum n’est sans plus une zoonose.
L’ŒSOPHAGOSTOMOSE NODULAIRE CHEZ LES GRANDS SINGES
Des cas d’œsophagostomose nodulaire sont décrits depuis de très nombreuses années chez des grands singes en captivité. Dans une revue générale portant sur la pathologie des gorilles et des chimpanzés, Rousselot et Pellissier [14] ont colligé 50 cas d’œsophagostomose mortelle chez des gorilles survenant dans le mois qui a suivi leur capture. L’espèce O. stephanostomum a été identifiée dans la plupart des cas. En 1975, Crestian et Crespeau réalisent l’examen nécropsique d’un chimpanzé récemment importé du Cameroun [15]. Dans les nodules digestifs, ces auteurs mettent en évidence des nématodes appartenant à l’espèce O. stephanostomum . Le stress lié à la capture et un comportement de coprophagie exacerbé pourraient rendre comte de la survenue de ces cas d’œsophagostomose mortelle.
En 2008, Krief et coll . ont décrit des cas d’œsophagostomose multi-nodulaire chez des grands singes en dehors du contexte de la capture [16]. L’espèce
O. stephanostomum a été identifiée dans tous les cas. Le diagnostic a été réalisé lors de l’autopsie (un chimpanzé sauvage heurté par une voiture dans le parc national de Kibale en Ouganda, un chimpanzé en République du Congo et un gorille au Gabon). L’identification d’espèce ( O. stephanostomum ) a été obtenue à partir d’échantillons de parasites extraits de nodules (figure 2). Alors que chez les grands singes sauvages, aucun symptôme sévère n’est associé à l’infestation par des œsophagostomes, les chimpanzés élevés en sanctuaire souffrent (et parfois meurent) d’œsophagotomose nodulaire.
Une hypothèse permettant d’expliquer cette différence réside dans l’usage de feuilles rugueuses par les chimpanzés sauvages qui permettent d’expulser les parasites et de prévenir des infestations sévères responsables de d’une évolution fatale [16].
LES ESPÈCES D’ŒSOPHAGOSTOMES PARASITES DE PRIMATES
Chez les grands singes sauvages en Afrique (chimpanzés, bonobos et gorilles), la prévalence du genre Oesophagostomum est élevée mais la plupart des auteurs des publications n’identifient pas l’espèce affectant les hôtes [17-19]. En utilisant les outils de la biologie moléculaire, Krief et coll . (2010) ont mis en évidence que les chimpanzés sauvages du site de Kanyawara (en Ouganda) étaient en fait parasités par deux espèces d’œsophagostomes ( O. bifurcum et O. stephanostomum ) [20] . Cette première espèce n’ayant jamais été décrite chez le chimpanzé, ce résultat suggère une éventuelle transmission de l’homme aux grands singes en Ouganda.
Dans l’objectif de mieux comprendre l’épidémiologie de l’œsophagostomose chez les grands singes et leur éventuel rôle de réservoir pour l’homme, l’équipe de Sabrina Krief a tenté de déterminer les hôtes potentiels infestés par les œsophagostomes et les espèces de parasites. En complément de l’étude coproscopique des selles de chimpanzés, des primates au mode de locomotion principalement terrestre (babouins) ou arboricoles (colobes) ont été échantillonnés ainsi que des humains vivant ou travaillant à proximité de la forêt durant la même période d’étude (juin-août 2010 et juillet-août 2011) sur le site de Sebitoli en Ouganda. La présence d’œsophagostomes a aussi été recherchée chez deux autres espèces de grands singes :
les gorilles de plaine en République Centrafricaine et les bonobos en République Démocratique du Congo. L’analyse coproscopique montre que les parasites infestant les quatre espèces de primates du site de Sebitoli sont différents en terme de composition mais aussi de prévalence (tableau 1). Des œufs de strongles sont présents dans les selles de toutes les espèces. Les trichures sont les parasites les plus fréquents chez les hommes et sont présents dans la grande majorité des échantillons de matières fécales chez les babouins. Ces parasites sont rares mais présents chez les chimpanzés alors que dans une précédente étude portant simultanément sur les chimpanzés et les humains du site de Kanyawara, aucun œuf de trichures ou d’ascarides (parasites présents chez les humains dans cette zone) n’était présent dans les 295 échantillons de selles de chimpanzés examinés.
Tableau 1. — Résultats des examens coproscopiques chez des primates d’Ouganda ou de République Démocratique du Congo.
Ouganda
Ouganda
Rép. Dém. du site de Kanyawara site de Sebitoli
Congo 2006 2010 2011
Espèce
Chimpanzés Humains Chimpanzés Babouins Colobes Humains BonobosHumains (nombre (n=295) (n=72) (n=37) (n=31) (n=40) (n=38) (n= 112) (n=27) d’échantillons examinés)
Ciliés 94 % 0 92 % 0 0 0 92 % 0 (Troglodytella sp.)
Œufs 0 0 11 % 23 % 0 0 0 0 d’anguillules
Œufs 0 4 % 5 % 94 % 87 % 14 % 0 0 de trichures
Œufs 0 15 % 0 0 0 0 0 37 % d’ascarides
Œufs 61 % 15 % 73 % 97 % 5 % 3 % 65 % 48 % de strongles*
Oxyures 27 % 0 16 % 0 0 0 11 % 0 * dont œufs d’œsophagostomes Les analyses PCR réalisées à partir des matières fécales ont permis de confirmer la présence de nématodes du genre Oesophagostomum chez les six espèces de primates (chimpanzés, bonobos, colobes, babouins, gorilles, hommes). Le séquençage des produits d’amplification a révélé que l’espèce O. stephanostomum est présente chez les chimpanzés des sites de Kanyawara et de Sebitoli (8 échantillons) et chez un homme vivant à Sebitoli à proximité de la bordure de la forêt. L’espèce O. stephanostomum a aussi été mise en évidence chez les gorilles vivant sur le site de Bai
Hokou en République Centrafricaine (deux parasites ont été récupérés dans les selles d’une femelle gorille adulte). L’espèce O. bifurcum a été identifiée chez les chimpanzés sur le site de Kanyawara (cinq échantillons) et chez les babouins sur le site de Sebitoli (six échantillons).
CONCLUSION
Les œsophagostomes sont fréquemment retrouvés chez l’homme et chez les grands singes dans certains pays en Afrique. L’œsophagostomose nodulaire demeure un problème majeur de Santé publique dans le nord du Ghana et du Togo. Une maladie équivalente est possible chez les chimpanzés ou les gorilles en captivité ou élevés dans des sanctuaires. Pour les populations sauvages, le pouvoir pathogène des œsophagostomes semble plus réduit et les comportements d’automédication participent sans doute au maintien d’un équilibre hôte-parasite. La question concernant le rôle des grands singes dans l’épidémiologie de l’œsophagostomose nodulaire humaine reste ouverte. Seule l’analyse de la génétique des populations de parasites permettra de déterminer dans quelles proportions intervient la transmission zoonotique. Ce type d’étude, appliqué aux ascarides parasites de l’homme et du porc, a clairement montré que l’importance de la transmission zoonotique varie en fonction des pays [21]. Il en est peut être de même avec les œsophagostomes parasites de primates au Ghana, au Togo ou en Ouganda.
BIBLIOGRAPHIE [1] Bussieras J., Chermette R. — Abrégé de parasitologie vétérinaire. Fascicule III : Helminthologie vétérinaire. 2nde éd. 1995. Ecole Nationale Vétérinaire d’Alfort, Service de parasitologie.
299 pages.
[2] Krepel H.P., Polderman A. M. — Egg production of Oesophagostomum bifurcum , a locally common parasite of humans in Togo.
Amer. J. Trop. Med. Hyg. , 1992, 46 , 469-472.
[3] Railliet A., Henry A. — Encore un nouveau sclérostomien (
Oesophagostomum brumpti ) parasite de l’homme.
CR. Soc. Biologie , 1905, 53 , 643-645.
[4] Thomas H.W. — The pathological report of a case of oesophagostomiasis in man.
Annals Trop.
Med. Parasitol. , 1910, 4 , 57-88.
[5] Polderman A.M., Blotkamp J. —
Oesophagostomum infections in humans. Parasitol. Today, 1995, 12 , 451-456.
[6] Gigase P., Baeta S., Kumar V., Brandt J. — Frequency of symptomatic human Oesophagostomiasis (Helminthoma) in Northern Togo. Helminth zoonoses (symposium), 1986, 228- 236.
[7] Storey P.A., Faile G., Hewitt E., Yelifari L., Polderman A.M., Magnussen P. — Clinical epidemiology and classification of human oesophagostomiasis. Trans. Royal Soc. Trop. Med.
Hyg. , 2000, 94 , 177-182.
[8] Verweij J., Brienen E.A., Ziem J., Yelifari L., Polderman A.M., Van Lieshout L. — Simultaneous detection and quantification of Ancylostoma duodenale , Necator americanus and
Oesophagostomum bifurcum in fecal samples using multiplex real-time PCR. Am. J. Trop. Med.
Hyg. , 2007, 77 , 685-690.
[9] Ziem J.B. — Controlling human oesophagostomiasis in northern Ghana. Thèse de Doctorat de l’Université de Leiden, Pays Bas 2006.
[10] Van Lieshout L., De Gruijter J.M., Adu-Nsiah M., Haizel M., Verweij J.J., Brienen E.A., Gasser R.B., Polderman A.M. — Oesophagostomum bifurcum in non-human primates is not a potential reservoir for human infection in Ghana.
Trop. Med. Int. Health , 2005, 10 , 1315-1320.
[11] Gasser R.B., De Guijter J.M., Polderman A.M. — Insights into the epidemiology and genetic make-up of Oesophagostomum bifurcum from human and non-human primates using molecular tools. Parasitol. 2006, 132 , 453-460.
[12] De Gruijter J.M., Ziem J., Verweij J.J., Polderman A.M., Gasser R.B. — Genetic substructuring within Oesophagostomum bifurcum (Nematoda) from human and nonhuman primates from Ghana based on random amplification of polymorphic DNA analysis.
Am. J. Trop. Med.
Hyg. , 2004, 71 , 227-233.
[13] De Guijter J.M., Gasser R.B., Polderman A.M., Asigri V., Dijkhoorn, L. — High resolution DNA fingerprinting by AFLP to study the genetic variation among Œsophagostomum bifurcum (Nematoda) from human and nonhuman primates from Ghana. Parasitol., 2005, 129 , 1-9.
[14] Roussellot R., Pellissier A. — Œsophagostomose nodulaire à Oesophagostomum stephanos- tomum . Pathologie du gorille et du chimpanzé. Bull. Soc. Path. Exot. , 1952, 9 , 569-574.
[15] Crestian J. Crespeau F. — Observation d’un cas d’Œsophagostomose du chimpanzé.
Rec.
Méd. Vét. , 1975, 151 , 13-18.
[16] Krief S., Jamart A., Mahé S., Leendertz F.H., Matz-Rensing K., Crespeau F., Bain O., Guillot J. — Clinical and pathological manifestation of œsophagostomosis in African great apes. Does self-medication in wild apes influence disease progression ? J. Med. Primatol. , 2008, 37 , 188-195.
[17] Kawabata M., Nishida T. — A preliminary note on the intestinal parasites of wild chimpanzees in the Mahale Mountains, Tanzania. Primates , 1991, 32 , 275-278.
[18] Krief S., Huffman M., Sévenet T., Guillot J., Bories C., Hladik C.M., Wrangham R.W. — Non invasive monitoring of the health of Pan troglodytes schweinfurthii in the Kibale National
Park, Uganda.
Int. J. Primatol. , 2005, 26 , 467-490.
[19] Muehlenbein M.P. — Parasitological analyses of the Male Chimpanzees (
Pan troglodytes schweinfurthii ) at Ngogo, Kibale National Park, Uganda. Am. J. Primatol. , 2005, 65 , 167-179.
[20] Krief S., Vermeulen B., Lafosse S., Kasenene J., Nieguitsila A., Berthelemy M., L’Hostis M., Bain O., Guillot J. — Nodular worm infection in wild chimpanzees in Western Uganda:
a risk for human health? PLoS Negl. Trop. Dis. , 2010, 4 , e630.
[21] Criscione C.D., Anderson J.D., Sudimack D., Peng W., Jha B., Williams-Blangero S., Anderson T.J. — Disentangling hybridization and host colonization in parasitic roundworms of humans and pigs. Proc. Biol. Sci. , 2007, 274 , 2669-2677.
DISCUSSION
M. Christian NEZELOF
Les individus atteints d’œsophagostomose développent-ils une immunité spécifique, marquée par la présence d’anticorps ? D’autre part, existe-t-il une éosinophilie locale et sanguine ?
Les mécanismes immunitaires mis en jeu lors de l’infestation par les nématodes du genre Œsophagostomum sont semblables à ceux qui ont été décrits pour d’autres parasites intestinaux (comme les ankylostomes). Ces mécanismes associent une réponse cellulaire et humorale. Certains anticorps semblent spécifiques des œsophagostomes et un test ELISA a pu être développé (mais jamais commercialisé). Chez l’homme, une éosinophilie sanguine est rapportée dans 10 à 25 % des cas d’œsophagostomose nodulaire. L’éosinophilie semble plus fréquente lors de forme multinodulaire que lors de lésion unique (type « tumeur de Dapaong »). La paroi des nodules comporte de cellules inflammatoires mononucléées (principalement des histiocytes et des macrophages). Des éosinophiles peuvent être présents mais en plus faible nombre.
Bull. Acad. Natle Méd., 2011, 195, no 8, 1955-1963, séance du 29 novembre 2011



