Résumé
Les patients dépistés comme infectés par le virus de l’immunodéficience humaine (VIH), sont actuellement, pour la très grande majorité, bien contrôlés pour leur infection virale. Cependant, chez certains de ces patients qui prennent de l’âge, les médecins constatent la survenue de pathologies classiquement observées dans la population générale lors du vieillissement : atteintes cardio-vasculaires, ostéoporose, troubles neurocognitifs, atteintes métaboliques, hépatiques, rénales, cancers. Cependant, chez les patients infectés par le VIH, ces atteintes surviennent dix à quinze ans « trop » tôt. Il est important de comprendre la physiopathologie de ce vieillissement prématuré. Les études en cours font fortement envisager la conjonction de causes multiples. Outre l’infection résiduelle par le virus, une activation immune accrue conduisant à un état d’immunodéficience ainsi que la prise de certaines molécules antirétrovirales thérapeutiques pourraient être impliquées dans une inflammation systémique à bas grade. Celle-ci précipiterait la survenue de la sénescence tissulaire et des atteintes dégénératives et prolifératives en cause dans le vieillissement. La prise en charge de ces patients privilégie les modifications liées au mode de vie et l’ajustement des traitements antirétroviraux utilisant des molécules de plus faible toxicité métabolique. Un traitement anti-inflammatoire pourrait être envisagé chez les patients à risque.
Summary
Most patients diagnosed with human immunodeficiency virus (HIV) infection now receive effective treatment. However, as the HIV-infected population gets older, manifestations of aging is starting to emerge 10-15 years earlier than in the general population, such as cardiovascular disease, osteoporosis, neurocognitive disorders, metabolic complications, and kidney and liver failure. Clinical studies suggest that the pathophysiology of this premature aging may be multifactorial. In addition to residual HIV infection, immune activation (leading to immunodeficiency) and some antiretrovirals might contribute to low-grade systemic inflammation that could drive tissue senescence and provoke degenerative and proliferative disorders. Management of these patients involves lifestyle modifications and switching from first-generation antiretrovirals towards less toxic drugs. Antiinflammatory treatment could be considered for at-risk patients.
INTRODUCTION
L’infection par le VIH, responsable dans les premières années de l’épidémie d’une morbi-mortalité très importante dans un tableau d’immunodéficience sévère conduisant à la survenue de complications et de décès dits classants-SIDA, a bénéficié, en quelques années, d’avancées thérapeutiques majeures grâce à la mise au point de plusieurs nouvelles classes de molécules antirétrovirales. Chacune de ces classes, en ciblant différentes étapes soit de l’entrée du virus dans les cellules immunitaires, soit du cycle infectieux viral, permet de diminuer le potentiel infectieux du VIH et sa production. Actuellement, l’utilisation conjointe chez les patients d’associations de molécules de différentes classes (inhibiteurs nucléosidiques ou non-nucléosidiques de la transcriptase inverse virale, inhibiteurs de la protéase maturant les protéines virales, inhibiteurs d’entrée ou de fusion, inhibiteurs de l’intégration du virus) permet, dans la très grande majorité des cas, de contrôler l’infection VIH sur le long terme (infection évaluée par la charge virale circulante) et de restaurer l’immunité (comme attesté par le taux circulants des lymphocytes T CD4) mais en aucun cas de la guérir.
Survenue précoce de comorbidités associées au vieillissement chez les patients infectés par le VIH
Certains des patients sont infectés depuis plus de vingt ans et restent contrôlés pour leur infection avec une charge virale indétectable et un taux de lymphocytes T CD4 correct. Ces patients, exposés depuis longtemps au virus et aux molécules antirétrovirales de première génération, prennent de l’âge. Alors que l’infection VIH est le plus souvent bien contrôlée chez ces patients avec l’arsenal thérapeutique actuel, des atteintes dégénératives ou tumorales touchant différents tissus, atteinte cardio- vasculaire et infarctus du myocarde, hypertension, ostéoporose, troubles neurocognitifs, dyslipidémie, diabète, insuffisance hépatique ou rénale, cancers nonclassant SIDA sont fréquemment diagnostiqués chez ces sujets [1, 2] . Ces atteintes sont semblables à celles associées au vieillissement dans la population générale.
Cependant, plusieurs études suivant des cohortes de patients infectés montrent qu’elles surviennent dix à quinze ans plus tôt chez les patients infectés par le VIH que dans la population générale conduisant à évoquer la survenue d’un vieillissement accéléré chez ces patients. Sans que cette donnée soit bien étayée, on considère le patient infecté par le VIH comme « âgé » à cinquante ans alors que cette limite est de soixante-cinq ans dans la population générale dans les pays du Nord.
Mécanismes en cause dans le vieillissement tissulaire
Le vieillissement est un processus physiologique qui diminue progressivement les capacités de l’organisme à répondre aux atteintes cellulaires et aux différents stress engendrés dans les cellules et les tissus entraînant des modifications de type dégéné- ratif (insuffisance d’organe) ou prolifératif (prolifération tumorale). Les mécanismes en cause dans le vieillissement physiologique sont complexes et restent actuellement mal connus [3]. Parmi les nombreux dommages que peuvent subir les cellules et les tissus, certains vont toucher l’ADN et induire des mutations et des modifications épigénétiques. Ils peuvent également modifier les protéines et les lipides (oxydation, glycation). Ces dommages ne sont pas univoques et l’hypothèse géné- ralement retenue est que c’est l’accumulation de ces atteintes moléculaires qui induit la cellule à entrer en sénescence. Deux grands mécanismes de sénescence ont été décrits. La sénescence réplicative, physiologique, qui aboutit à un arrêt des divisions cellulaires lorsque les extrémités télomériques des chromosomes se sont trop raccourcies et qui signe l’« usure » cellulaire et l’arrêt de la réplication et la sénescence induite pas le stress conduisant la cellule à un arrêt de division précoce, alors que les télomères sont encore préservés, lors d’agressions intracellulaires. Une des grandes théories du vieillissement a été la théorie du stress oxydant conduisant à postuler que c’est l’accumulation de molécules dérivées de l’oxygène toxiques qui était responsable du vieillissement. Cependant des données obtenues en particulier chez Caenorhabditis elegans mais aussi dans des modèles murins ont conduit à revoir cette théorie en montrant que les dérives réactifs de l’oxygène n’étaient pas la cause initiale du vieillissement mais seraient plutôt une conséquence. Un taux modéré de ces dérivés s’avère nécessaire au bon fonctionnement de la cellule et c’est leur accumulation excessive qui aurait un caractère délétère [4, 5].
Dans les procesus de sénéscence, outre l’arrêt de division cellulaire, l’activation des voies du stress conduit souvent à l’activation des voies de l’inflammation, en particulier par l’intermédiaire du facteur de transcription NFκB, conduisant les cellules à produire des cytokine pro-inflammatoires, l’IL-6 en premier lieu, et des chimiokines, attractrices des cellules de l’immunité, au sein des tissus concernés.
Ainsi, la majorité des tissus sénescents participe à un état d’inflammation à bas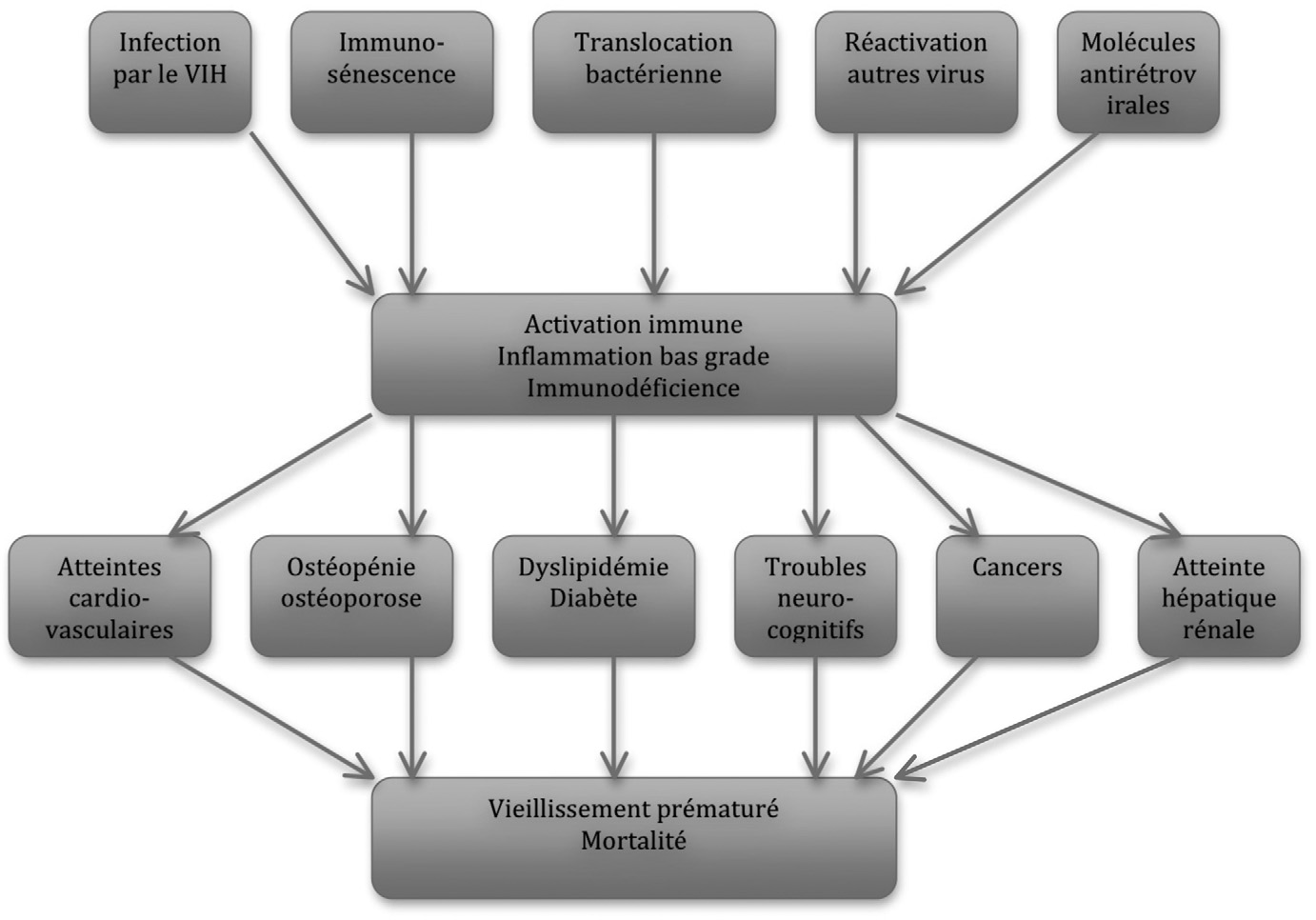
Fig. 1. — Mécanismes physiopathologiques hypothétiques en cause dans le vieillissement accéléré des patients infectés par le VIH grade qui a été montré comme associé au vieillissement et a été dénommé « inflammaging » [6].
Cette atteinte est sans doute impliquée dans le vieillissement général de l’organisme.
S’y ajoutent des atteintes plus spécifiques de différents tissus qui vont induire l’apparition de différentes comorbidités d’organe associées au vieillissement. Les atteintes de type dégénératif vont affecter l’os (ostéoporose) les muscles (sarcopénie) le cerveau (maladies neurodégénératives) le système cardio-vasculaire (infarctus, insuffisance cardiaque, athérosclérose, hypertension), le métabolisme (dyslipidémie, diabète et résistance à l’insuline) et de nombreux organes (insuffisance rénale, hépatique, pulmonaire). Ces atteintes peuvent également être de type prolifératif, et la prolifération non contrôlée participe à la survenue de cancers. L’équipe de Judith Campisi [7] a bien montré que l’inflammation de bas grade associée au vieillissement jouait un rôle important dans la survenue de ces deux types d’atteinte dans la population générale au cours du vieillissement.
Parmi les autres facteurs en cause dans le vieillissement, la lamine A, une protéine du réseau nucléaire de la lamina, réseau filamentaire qui tapisse la membrane interne du noyau, pourrait jouer un rôle particulier. Son intervention dans ce processus a été montrée par la mise en évidence de mutations dans son gène, responsables de plusieurs syndromes de vieillissement prématuré dont le plus emblématique est la progéria de Hutchinson Gilford [8]. Les mutations observées chez ces malades préviennent la maturation complète de son précurseur, la prélamine A qui doit acquérir un groupement farnésyl au cours de sa maturation normale puis subir une étape de clivage protéolytique par une métalloprotéase nommée ZMPSTE24 ou FACE1, qui lui permet de devenir mature, non farnésylée, et d’entrer dans le noyau.
Chez les patients progéria, ce clivage ne peut avoir lieu du fait de la présence d’une mutation qui entraîne une délétion de la séquence contenant le site de clivage protéolytique conduisant à l’accumulation d’une forme tronquée farnésylée dénommée progérine. Dans d’autres syndromes de vieillissement prématuré, c’est l’atteinte par mutation ou déficience de l’enzyme ZMPSTE24 qui empêche de cliver la prélamine A farnésylée en lamine A mature conduisant là aussi à l’accumulation de prélamine farnésylée. Plusieurs études plaident en faveur d’un rôle toxique de ce précurseur dont l’accumulation serait en cause dans le vieillissement précoce de certains organes. Cependant les données sont plus complexes et les mécanismes en cause restent encore à identifier.
En dehors de ces syndromes gravissimes de vieillissement prématuré, est-il envisageable que la progérine ou la prélamine fanésylée soient impliquées dans le vieillissement dans la population générale ? La présence de progérine à faible concentration a été rapportée dans la peau de sujets normaux âgés [9]. Surtout, une étude récente a montré que la prélamine A farnésylée était présente dans les cellules musculaires lisses artérielles de sujets âgés et absente chez les sujets jeunes et que sa présence était associée à la sénescence de ces tissus [10]. Il serait important de confirmer ces données par de nouvelles études.
Recherche des mécanismes responsables du vieillissement prématuré des patients infectés par le VIH
La mise au point des premières molécules antirétrovirales capables de contrôler l’infection VIH, molécules dites de première génération, a montré leur capacité à contrôler l’infection VIH et à restaurer l’immunité cellulaire permettant de véritablement « ressusciter » des patients gravement atteints et dont le pronostic vital était effroyable. Cependant, leur utilisation s’accompagnait chez les patients d’effets secondaires importants. Les analogues nucléosidiques inhibiteurs de la réverse transcriptase virale, stavudine et zidovudine, ont été montrés comme responsables d’une redistribution importante du tissu adipeux ou d’une perte généralisée, la lipodystrophie, associée à une résistance à l’insuline, atteinte qui concernait au début des années 2000 la moitié des patients.
Dans l’ensemble, la lipoatrophie a régressé avec le remplacement de ces molécules par des molécules moins toxiques de seconde génération dans les pays du Nord mais elle reste fréquente chez les patients traités depuis longtemps, la réversion n’ayant souvent été que partielle chez les patients qui en ont été affectés. La survenue d’une lipoatrophie est fréquente dans les pays du Sud, dans lesquels ces molécules font partie actuellement de l’arsenal thérapeutique généralement utilisé. La survenue d’une inflation du tissu adipeux au niveau du tronc, de l’abdomen, du cou est, elle, fréquente et reste prévalente même avec les molécules utilisées actuellement. Cette prise de graisse localisée dans la partie supérieure du corps est délétère et entraîne un risque métabolique [11]. Nous avons montré que le risque de survenue du diabète était important chez les patients ayant reçu des molécules antirétrovirales de première génération et présentant une lipoatrophie.
Les premiers inhibiteurs de la protéase virale ont été associés à une insulinorésistance, la survenue de diabète et des atteintes cardio-vasculaires de type infarctus du myocarde.
Très logiquement, lorsque les patients ont montré des comorbidités associées au vieillissement, le rôle des molécules antirétrovirales a été suspecté en premier lieu.
Une grande étude internationale SMART s’est proposé de comparer deux stratégies chez les patients bien contrôlés pour leur infection : une interruption thérapeutique en maintenant un taux de CD4 correct et en acceptant de fait une augmentation de la charge virale ou un maintien du contrôle viral strict par la poursuite sans interruption du traitement. Les résultats de cette étude [12] ont montré que le bras ayant épargné les molécules thérapeutiques présentait plus de complications qu’elles soient classantes SIDA (ce qui était attendu) mais aussi non-classantes SIDA. Ces patients présentaient de plus un statut inflammatoire, mesuré par les taux d’IL6 et de CRP, qui était associé à la survenue ultérieure de décès [13].
Il est actuellement considéré que plusieurs mécanismes seraient responsables de la survenue précoce des complications liées au vieillissement via cet état inflammatoire : la présence du virus même lorsque l’infection est bien contrôlée, le déficit immunitaire qui peut résulter d’un traitement insuffisant mais aussi de l’épuisement du système immunitaire dans le cadre de l’immunosénescence et l’effet délétère de certaines molécules antirétrovirales.
Le rôle essentiel du déficit immunitaire, attesté par la baisse du taux de CD4, dans la morbidité et mortalité dues à des évènements non-classants SIDA a été montré dans plusieurs très grandes cohortes internationales suivant des patients infectés par le VIH [14]. L’augmentation de la mortalité chez les patients ayant des CD4 abaissés est associée de façon majeure aux cancers non-classants SIDA et aux atteintes hépatiques, la relation étant plus faible en ce qui concerne les décès par atteinte cardio-vasculaire [15]. Cette augmentation de mortalité est graduelle avec l’abaissement du taux de CD4 : les différentes études montrent bien qu’un taux de CD4 supérieur à 500/mm3 (considéré comme normal) est associé à une mortalité moindre pour toutes les causes qu’un taux situé entre 350 et 500/mm3 (soit modérément abaissé), la mortalité étant encore accrue pour des valeurs de CD4 plus basses.
Ces études confirment la mise en évidence récente de l’importance du taux de CD4 dans la morbi-mortalité dues à des causes non-classantes SIDA à côté, bien évidemment, du rôle essentiel de l’immunodéplétion dans les causes de mortalité classantes SIDA [15].
La baisse du taux de CD4 peut venir d’une insuffisance ou d’une inadaptation du traitement mais également d’un défaut de réponse de l’organisme tel celui observé au cours du vieillissement. Le concept d’immunosénéscence répond à l’épuisement de l’immunité cellulaire observée chez les personnes âgées entraînant une augmentation de la susceptibilité aux infections et un risque augmenté de survenue des cancers [1, 16].
L’infection par le VIH induit une immunosénescence en particulier du fait d’un état prolongé d’activation immune induite par l’infection active. Ceci a été bien montré chez les patients non traités. Chez les patients sous traitement antiviral actif, il est probable que ce mécanisme d’immunosénéscence se mette également en place à plus long terme que chez les patients non traités mais plus tôt que dans la population générale de fait de l’état d’activation immune persistant chez ces patients pendant des années, même si l’infection VIH est bien contrôlée. En effet le système immunitaire reste activé du fait de la réponse anti-VIH mais également du fait de la circulation de produits bactériens tels le LPS (lipopolysaccharide) libérés par la flore intestinale, la perméabilité intestinale étant affectée lors de l’infection VIH et restant altérée sur le long terme, même chez les patients traités. Le LPS est capable d’activer les cellules de l’immunité innée, monocytes et macrophages et d’entraîner la production de cytokines pro-inflammatoires participant à l’état inflammatoire à bas grade.
Cette activation immune va à son tour induire une activation des lymphocytes T CD4 et CD8.
Lors de l’infection VIH, on observe également une réactivation des infections virales latentes comme celle à CMV. Enfin la réplication virale, même à bas grade, entraîne la libération de protéines du VIH capables d’agir sur les cellules de proximité et participer à l’activation immune. Chez les patients bien contrôlés, cette réplication et la libération de protéines virales délétères pourrait concerner en particulier les réservoirs macrophagiques qui sont présents dans différents tissus lésés au cours du vieillissement : tissu adipeux, os, foie, paroi vasculaire, cerveau, muscles. Sur le long terme cet état va conduire peu à peu à un épuisement des ressources immunes avec diminution des capacités réplicatives et diminution de la réponse anti-VIH. Le système immunitaire sénescent produit plus de cytokines pro-inflammatoires comme l’IL-6, le TNF alpha ou l’IL1 beta participant à l’état inflammatoire à bas grade et au processus « d’inflammaging » [16].
La diminution du taux de CD4 est un des facteurs majeurs de risque retrouvé dans la survenue des cancers non-classants SIDA, poumon, foie, marge anale, Hodgkin.
Il est probable que la baisse des défenses immunitaires chez les patients infectés par le VIH favorise la croissance de tumeurs viro-induites, HCV et HBV dans l’hépatocarcinome, HPV dans les cancers du col et de la marge anale.
Certaines molécules antirétrovirales pourraient également jouer un rôle. Les analogues nucléodiques inhibiteurs de la reverse transcriptase virale sont, pour certains, capables d’affecter la mitochondrie et d’induire un stress oxydant qui peut favoriser la survenue d’une sénescence liée au stress. Dans la classe des inhibiteurs de la protéase virale, certains sont capables d’inhiber la protéase qui mature la prélamine A en lamine A, conduisant à l’accumulation de prélamine A farnésylée toxique dans les tissus des patients [17, 18]. Cette situation induit un stress oxydant et une inflammation de bas garde qui participe à l’état de sénescence qui a pu être montré dans certains tissus des patients infectés par le VIH.
Enfin, des facteurs liés au patient et à son environnement sont également à prendre en compte.
L’âge et le sexe sont des facteurs fortement impliqués dans le vieillissement dans la population générale ainsi que le mode de vie : tabagisme, sédentarité, régime hyperlipidique et pauvre en fruits et légumes, prise régulière d’alcool, consommation de drogues.
Une étude réalisée sur la population générale anglaise montre que lorsque l’on considère les facteurs de risque, tabac, régime, sédentarité, alcool, la présence d’un de ces facteurs fait vieillir de cinq ans, la présence des quatre facteurs accélère le vieillissement de douze ans, une durée équivalente à celle retrouvée chez les patients infectés par le VIH, qui cumulent souvent plusieurs de ces risques [19].
Ainsi, la survenue précoce de complications liées au vieillissement ne peut pas s’expliquer de façon simple chez ces patients et il faut évoquer plusieurs mécanismes qui s’associent.
Quelles pistes thérapeutiques envisager pour la prise en charge de ces patients ?
Bien que certaines molécules antirétrovirales présentent une toxicité, il apparaît actuellement que la sévérité de l’infection initiale par le virus et le retard à l’instauration du traitement antirétroviral induisent des atteintes irréversibles en particulier au niveau de la muqueuse intestinale. Il est donc justifié de traiter tôt en utilisant si possible des molécules ayant une faible toxicité sur les tissus de façon à contrôler l’infection. Dans les recommandations actuelles [20] basées sur le nombre de lymphocytes CD4, le traitement doit être envisagé si le nombre des lymphocytes est inférieur à 350 cellules /mm3 mais il est actuellement le plus souvent conseillé de traiter à partir du taux de 500 cellules/mm3.
Chez ces patients naïfs de traitement, la première ligne thérapeutique peut utiliser un inhibiteur de la protéase virale (lopinavir, atazanavir ou darunavir le plus souvent) « boosté » par du ritonavir (donné à faible dose pour prolonger les concentrations efficaces de la première molécule par inhibition de sa dégradation hépatique) associé à deux analogues nucléosidiques de faible toxicité mitochondriale (le plus souvent tenofovir plus emtricitabine ou abacavir plus lamivudine).
L’autre choix possible est d’associer un analogue non-nucléosidique de la reverse transcriptase virale (le plus souvent efavirenz) aux deux analogues nucléosidiques.
La simplification des prises médicamenteuses et la diminution des effets secondaires permettent d’obtenir une meilleure observance du traitement ce qui est essentiel pour son efficacité.
Lorsque la charge virale est indétectable de façon prolongée (inférieure à 50 copies/ml), il est possible d’alléger le traitement. En cas d’effets secondaires, en particulier métaboliques, il est possible d’utiliser des molécules ayant une faible toxicité métabolique (atazanavir, darunavir, tenofovir). En cas d’atteinte osseuse ou rénale, le tenofovir ne doit pas être prescrit. D’autres associations antirétrovirales peuvent être utilisées en particulier avec les nouvelles classes thérapeutiques : inhibiteur du récepteur d’entrée du virus CCR5 comme le maraviroc ou inhibiteur de l’inté- grase permettant d’intégrer l’ADN viral comme la raltégravir. Enfin, une molécule inhibitrice de la fusion du virus avec la membrane, le T20, a été également proposée.
Cet arsenal thérapeutique qui va encore se diversifier dans les prochaines années permet de contrôler l’infection virale dans la très grande majorité des cas.
Ce sont maintenant les effets secondaires des médicaments et en particulier les complications à long terme qui posent le plus de problèmes dans leur prise en charge.
En effet, la présence des complications liées au vieillissement, diabète et hypertension, est clairement associée à une surmortalité chez les patients infectés par le VIH [15] et leur prise en charge doit être une priorité. De même il faut traiter les dyslipidémies, faire maigrir en cas de surpoids, ne pas hésiter à traiter les co-infections, rechercher et traiter les troubles dépressifs chez ces patients.
Les modifications des facteurs personnels sont un enjeu majeur, arrêt du tabac, régime adapté, exercice physique, maintien d’une vie sociale.
Du fait du rôle délétère de l’état inflammatoire à bas grade, se pose actuellement la question d’utilisation d’un traitement anti-inflammatoire. Les statines, déjà justifiées chez de nombreux malades du fait de la présence d’une dyslipidémie, semblent les plus adaptées en première intention mais une effet bénéfique chez ces patients sur le risque cardio-vasculaire non lié à l’effet hypolipémiant reste à monter.
BIBLIOGRAPHIE [1] Effros R.B., Fletcher C.V., Gebo K. et al. — Aging and infectious diseases: workshop on
HIV infection and aging: what is known and future research directions.
Clin. Infect. Disea., 2008, 47 , 542-53.
[2] Deeks S.G., Phillips A.N. — HIV infection, antiretroviral treatment, ageing, and non-AIDS related morbidity. BMJ., 2009, 338 , a3172.
[3] Le Gall J.Y., Ardaillou R. — [The biology of aging].
Bulletin de l’Academie nationale de medecine, 2009, 193 , 365-402 ; discussion 402-4.
[4] Hekimi S., Lapointe J., Wen Y. — Taking a ‘‘ good ’’ look at free radicals in the aging process.
Trends in cell biology, 2011, 21 , 569-576.
[5] Ristow M., Zarse K. — How increased oxidative stress promotes longevity and metabolic health: The concept of mitochondrial hormesis (mitohormesis). Experimental gerontology, 2010, 45 , 410-8.
[6] Franceschi C., Capri M., Monti D. et al. — Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans.
Mech Ageing Dev., 2007, 128 , 92-105.
[7] Freund A., Orjalo A.V., Desprez P.Y. et al. — Inflammatory networks during cellular senescence: causes and consequences.
Trends Mol. Med. 2010, 16 , 238-46.
[8] Worman H.J., Fong L.G., Muchir A. , et al. — Laminopathies and the long strange trip from basic cell biology to therapy.
J. Clin. Invest. 2009, 119 , 1825-36.
[9] McClintock D., Ratner D., Lokuge M. et al. — The mutant form of lamin A that causes
Hutchinson-Gilford progeria is a biomarker of cellular aging in human skin.
PLoS One, 2007, 2 , e1269.
[10] Ragnauth C.D., Warren D.T., Liu Y. et al. — Prelamin A acts to accelerate smooth muscle cell senescence and is a novel biomarker of human vascular aging.
Circulation, 2010, 121 , 2200-10.
[11] Caron-Debarle M., Lagathu C., Boccara F. et al. — HIV-associated lipodystrophy: from fat injury to premature aging.
Trends Mol. Med., 2010, 16 , 218-29.
[12] Kuller L.H., Tracy R., Belloso W. et al. — Inflammatory and coagulation biomarkers and mortality in patients with HIV infection.
PLoS Med, 2008, 5 , e203.
[13] Neuhaus J., Jacobs D.R., JR., Baker J.V. et al. — Markers of inflammation, coagulation, and renal function are elevated in adults with HIV infection.
J. Infect. Dis., 2010, 201 , 1788-95.
[14] Deeks S.G. — Immune dysfunction, inflammation, and accelerated aging in patients on antiretroviral therapy. Top HIV Med., 2009, 17 , 118-23.
[15] Smith C., Sabin C.A., Lundgren J.D. et al. — Factors associated with specific causes of death amongst HIV-positive individuals in the D:A:D Study.
AIDS, 2010, 24 , 1537-48.
[16] Appay V., Sauce D. — Immune activation and inflammation in HIV-1 infection: causes and consequences. J. Pathol., 2008, 214 , 231-41.
[17] Caron M., Auclair M., Donadille B. et al. — Human lipodystrophies linked to mutations in
A-type lamins and to HIV protease inhibitor therapy are both associated with prelamin A accumulation, oxidative stress and premature cellular senescence. Cell Death Differ., 2007, 14 , 1759-67.
[18] Lefèvre C., Auclair M., Boccara F. et al. — Premature senescence of vascular cells is induced by HIV protease inhibitors: implication of prelamin A and reversion by statin.
Arterioscler Thromb. Vasc Bio.l, 2010, 30 , 2611-20.
[19] Kvaavik E., Batty G.D., Ursin G. et al. — Influence of individual and combined health behaviors on total and cause-specific mortality in men and women: the United Kingdom health and lifestyle survey. Arch. Intern. Med., 2010, 170 , 711-8.
[20] Yeni P. — Groupe d’experts,
Prise en charge médicale des personnes infectées par le VIH. , 2010,
Ministère de la Santé et des Sports.
DISCUSSION
M. Jacques-Louis BINET
A côté de la CRP et de l’IL-6 qui sont des examens déjà sophistiqués, la simple vitesse de sédimentation pourrait-elle être utilisée comme marqueur de ce syndrome inflammatoire ?
Les patients présentent un état inflammatoire de bas grade. Les modifications des taux d’IL-6 et de CRP restent faibles par rapport aux modifications observées dans un syndrome inflammatoire aigu. De ce fait, ces deux marqueurs sont peu utilisables en pratique clinique pour un patient donné, car leur taux peut être modulé par de nombreux facteurs. La vitesse de sédimentation serait dans ce cadre un marqueur insuffisamment sensible. Il reste à identifier un bon biomarqueur pour cet état inflammatoire chronique, utile en pratique clinique.
M. Charles LAVERDANT
Je crois me souvenir qu’une étude américaine, publiée dans Neurology il y a quelques mois, a montré que les sujets infectés par le VIH ont trois fois plus de risques de présenter un AVC que les autres. La moyenne d’âge de survenue de l’AVC serait ainsi, au total aux USA, inférieure à 50 ans chez les sujets infectés, c’est-à-dire beaucoup plus basse que dans la population générale. Pour les auteurs, cette étude suggère que le virus lui-même, et surtout les associations médicamenteuses anti-VIH sont susceptibles d’être, directement impliqués dans la survenue d’un AVC. A moins que ne joue aussi, comme cela a été expérimentalement démontré, l’exposition prolongée au virus lui-même par l’ intervention de l’un des processus que vous venez de décrire ? Quel est votre point de vue ?
Ces données peuvent entrer dans le cadre de cette atteinte inflammatoire à bas grade. De nombreuses études ont montré que les patients infectés par le VIH avaient un risque cardio-vasculaire accru, surtout évalué par les atteintes myocardiques, et un risque également accru de troubles neurocognitifs. Cette étude montre qu’il y a aussi un risque accru d’AVC, en accord avec le risque cardio-vasculaire. Ce sur-risque est probablement associé à une dysfonction endothéliale montrée chez les patients infectés par le VIH et qui participe à la production de facteurs pro-inflammatoires. Les causes de cette dysfonction et de ce risque accru d’AVC pourraient être l’infection virale, même bien contrôlée, et d’autre part certaines molécules antirétrovirales, mais ces points restent hypothétiques.
M. Claude JAFFIOL
Il existe un parallélisme entre le syndrome métabolique et les anomalies lipodystrophiques observées chez les patients traités pour VIH. A-t-on des connaissances sur le microbiote intestinal de ces sujets ?
Effectivement, certains patients infectés par le VIH présentent un profil dysmétabolique très semblable à celui présent dans le syndrome métabolique. Par ailleurs, ils ont également fréquemment une hypertrophie du tissu adipeux de la partie supérieure du corps.
La présence d’une atteinte de la microflore intestinale a été évoquée dans le syndrome métabolique. Cependant, chez les patients infectés par le VIH, aucune étude bien conduite n’a examiné cette microflore à la recherche d’une dysbiose. Nous avons une étude qui vient d’être acceptée pour financement à l’ANRS qui va se pencher sur ce problème.
M. Jacques BATTIN
La longueur des télomères qui diminue avec le vieillissement a-t-elle été étudiée chez ces malades ?
La longueur des télomères a été étudiée chez des patients infectés par le VIH mais naïfs de traitement antirétroviral. Une diminution de la longueur des télomères aux stades tardifs de l’infection a été rapportée. Cependant, actuellement, la très grande majorité des patients est traitée et contrôlée pour son infection. Nous avons réalisé une petite étude chez des patients infectés depuis longtemps mais bien contrôlés, avec le groupe expert d’Athanase Bénétos à Nancy. Les données obtenues n’ayant pas montré de raccourcissement des télomères, cette étude n’a pas été poursuivie.
M. Charles-Joël MENKÈS
L’ostéonéocrose de la tête fémorale est-elle favorisée plus particulièrement par l’infection virale, l’attente vasculaire, le type d’antiviral ou par un mélange de ces différents facteurs ?
L’ostéonécrose de la tête fémorale est une atteinte beaucoup plus fréquente chez les patients infectés par le VIH que dans la population générale mais son étiologie reste mal comprise. En particulier, elle n’a pas été associée à une classe spécifique de molécules antirétrovirales, même si des données initiales ont suggéré une implication de certains inhibiteurs de protéase par leur effet hyperlipémiant.
Bull. Acad. Natle Méd., 2011, 195, no 9, 2013-2024, séance du 13 décembre 2011


