Résumé
Le flutter auriculaire typique peut maintenant très fréquemment être définitivement guéri en une seule séance par une technique non pharmacologique : l’ablation par radiofréquence. Mais le terme même de flutter auriculaire est porteur d’une certaine confusion dans la communauté cardiologique. Une revue de l’histoire de cette tachycardie montre que cette entité est en réalité multiple. On peut en fait classifier les flutters en fonction de leur aspect électrocardiographique, et/ou de leur mécanisme électrophysiologique. Cet article énonce les éléments du diagnostic des flutters typiques, ainsi que les divers traitements qui peuvent actuellement être proposés.
Summary
Typical atrial flutter can now be permanently cured by a single session of radiofrequency ablation, a non pharmacological technique. The term ‘‘ atrial flutter ’’ is in fact somewhat confusing. A review of the history of this form of tachycardia shows that atrial flutter is indeed a multiple entity. While the reentrant nature of atrial flutter has long been known, most cardiologists refer to the typical ECG aspect and right atrial macro reentry circuit with counterclockwise rotation, as described by Puech. It is now possible to classify these flutters according to their electrocardiographic aspect and electrophysiological mechanisms. This article describes the diagnostic signs of typical flutter, and provides a detailed description of the most frequently used radical therapy, namely catheter ablation of the cavotricuspidian isthmus. This technique delivers radiofrequency pulses, under continuous local temperature monitoring, in order to permanently interrupt conduction in this structure. Outcome is assessed with the pacing technique and local electrocardiography. In experienced hands the immediate success rate is very high, late recurrence is rare, and complications are virtually absent.
Le flutter auriculaire est un trouble du rythme cardiaque fréquent, représentant 60 à 65 % des tachycardies auriculaires de l’adulte (à l’exclusion de la fibrillation atriale). Il s’agit d’une arythmie auriculaire organisée, rapide qui se reconnaît dans sa forme typique sur l’électrocardiogramme, par une déformation caractéristique des ondes auriculaires en « dent-de-scie ». Sa morphologie en est identique d’un individu à l’autre. Il est très souvent symptomatique, sous forme de palpitations, de dyspnée, de lipothymies ou de douleurs thoraciques, et reste difficilement contrôlé par le traitement médical. Cette relative « résistance » au traitement a contribué à l’essor des techniques ablatives permettant un traitement radical de l’arythmie.
HISTORIQUE
Le terme flutter auriculaire apparaît en 1912 employé par Sir thomas Lewis afin de décrire « le mouvement singulier des oreillettes au cours de la tachycardie » ; cette « curieuse » forme d’accélération extrême des oreillettes lui évoquant le battement frénétique des ailes d’un papillon [1]. C’est aussi Lewis qui, en 1920, fut le premier à montrer qu’il s’agissait d’un mouvement circulaire ou une onde mère circulait autour des obstacles naturels que sont les veines caves, en émettant des ondes filles en direction des parois auriculaires [2].
Les modèles expérimentaux, puis les études cliniques réalisées chez l’homme, ont montré que le flutter auriculaire humain est secondaire à un circuit de réentrée macroscopique dans l’oreillette droite. À la fin des années 80, l’amélioration des techniques d’électrophysiologie, a permis d’établir une description plus précise du circuit et notamment ses rapports avec les structures anatomiques adjacentes.
LES CLASSIFICATIONS DES FLUTTERS AURICULAIRES
Puech et Grolleau ont classifié les flutters auriculaires en fonction de leur aspect électrocardiographique en « commun » avec onde F biphasique à négativité prédominante dans les dérivations inférieures précédant la positivité en V1 ; « atypiques » avec une morphologie qui pouvait être similaire dans le plan frontal mais dont la positivité en V1 précédait la positivité en V6, et « rares » lorsque l’onde F était positive dans le plan frontal et en V6 ainsi que fréquemment en V1 [3]. La transmission aux ventricules est telle qu’habituellement une onde de flutter (appelée onde F)
sur deux est transmise. La fréquence des ondes F étant le plus souvent 300, il en résulte que la fréquence ventriculaire est de 150/mn.
Après ces travaux initiaux de cartographie dont est issue la majorité des connaissances actuelles sur le flutter auriculaire, sont apparues des techniques plus sophistiquées d’enregistrement électrophysiologique qui ont fait évoluer la notion même de flutter typique et atypique. Il est apparu que le flutter de loin le plus fréquent était celui que Puech avait appelé commun. Pour des raisons didactiques il nous semble plus opportun d’appeler celui ci flutter typique et réserver le terme « typique » à tous les flutters dont la boucle de circuit emprunte l’isthme cavotricuspidien. [4]. Des travaux récents combinant le repérage échographique intracardiaque et les techniques de cartographie par entraînement ont permis de préciser que la limite anté- rieure de ce circuit était la valve tricuspide autour de la quelle l’influx pouvait tourner, et la limite postérieure la crête terminale [5].
Mécanisme du flutter typique : Rôle de l’isthme cavotricuspidien et de l’entraînement transitoire dans la définition du caractère typique du flutter
L’élément majeur du flutter typique est la dépendance à l’isthme cavotricuspidien [4, 6]. Il existe en effet un point de passage de l’influx étroit et obligatoire dans la partie basse de l’oreillette droite limité en avant par la valve tricuspide et en arrière par la veine cave inférieure. La rotation dans l’oreillette droite y est le plus souvent antihoraire (lorsque l’oreillette est vue en incidence oblique antérieure gauche (figure 1).
L’entraînement transitoire de la tachycardie lorsqu’il est effectué dans cet isthme (et plus particulièrement dans sa portion médiane ou septale) permet de constater plusieurs phénomènes témoignant de la nature réentrante de la tachycardie, mais aussi du caractère critique de cette zone anatomique [7, 8, 9]. Il est important en présence d’un flutter auriculaire au laboratoire d’électrophysiologie d’effectuer ces techniques de cartographie par entraînement car il est maintenant clairement démontré qu’un certain nombre de flutters peuvent se présenter avec un aspect typique sur l’électrocardiogramme de surface, mais cependant ne pas être dépendants de l’isthme cavotricuspidien [10]. Dans ces conditions, ce type de flutter ne peut être appelé flutter typique même si l’aspect ECG en est très évocateur.
Pour les mêmes raisons anatomiques, un autre type de flutter typique doit alors être envisagé. Il s’agit du flutter typique à rotation inverse [11]. Il est important de classer ce type de flutter dans les typiques précisément du fait de cette dépendance à l’isthme, car son aspect électrocardiographique est plus variable. S’il peut parfois ressembler fortement au flutter d’aspect commun, il en diffère souvent et les ondes F sont parfois positives dans les dérivations inférieures. Le circuit utilisé en est le même mais la rotation a lieu dans le sens des aiguilles d’une montre lorsque l’on regarde l’oreillette en oblique antérieure gauche à travers la valve tricuspide (figure 2). Ce flutter appelé aussi « à rotation horaire » est dix fois moins fréquent que le flutter à rotation antihoraire. Si l’aspect en est variable dans les dérivations frontales, il est
FIG. 1. — Panneau de gauche : Aspect électrocardiographique du flutter typique à rotation antihoraire : lors d’une diastole ventriculaire plus longue que les autres car induite par un massage sinocarotidien, l’aspect en « dents de scie » ou « toits d’usine » classique peut être observé dans les dérivations inférieures (D2, D3, aVF).
Panneau de droite, bas. L’activation de la paroi latérale de l’oreillette droite telle qu’enregistrée par un cathéter multipolaire permet de voir que les pôles supérieurs (H17-18) sont activés avant les pôles inférieurs (H3-4), qui eux mêmes précèdent l’activation de l’isthme cavotricuspidien (isthme).
Panneau de droite, haut : Vue radiologique en incidence oblique antérieure gauche à 45 degrés (OAD 45). Tout se passe comme si l’oreillette droite était vue en fuite à partir de la valve tricuspide. Quatre cathéters sont visibles : Un multipolaire inséré dans le sinus coronaire par vois sous clavière, et trois par voie fémorale droite : Un multipolaire arrondi épousant les parties supérieures et latérale de l’oreillette le long des muscles pectinés, un dans la région hisienne, et un dans l’isthme cavotricuspidien c’est à dire au site de l’ablation. La flèche indique la rotation de l’influx dans le sens antihoraire.
caractérisé par la quasi constante négativité de l’onde F en V1 [12]. Ce type de flutter est important à reconnaître car bien que d’aspect ECG trompeur il est en fait typique et emprunte de façon obligatoire l’isthme cavotricuspidien, relevant des mêmes techniques ablatives.
Plus récemment d’autres flutters ont été décrit qui peuvent être aussi classés dans les formes typiques du fait de leur dépendance à l’isthme cavotricuspidien. Dans un
FIG. 2. — Panneau de gauche : Aspect électrocardiographique du flutter typique à rotation horaire :
L’aspect n’est plus réellement celui en « dents de scie » ou « toits d’usine » dans les dérivations inférieures mais sera volontiers décrits comme « à ondes F positives ».
Panneau de droite, bas. L’activation de la paroi latérale de l’oreillette droite permet de voir que les pôles supérieurs (H19-20) sont maintenant activés après les pôles inférieurs (H3-4).
Panneau de droite, haut : Vue radiologique en OAD 45. La flèche indique la rotation de l’influx dans le sens horaire.
premier cas le flutter conservait son aspect électrocardiographique typique mais voyait son cycle raccourcir. Dans ces conditions un circuit macro réentrant auriculaire classique où l’influx tournait autour de l’ensemble de la crête terminale alterne avec un circuit plus petit où le point de réflexion supérieur de circuit traversait celle-ci à une hauteur variable [13]. De ce fait les dimensions anatomiques du circuit étant plus petites, le circuit est plus rapidement traversé et la fréquence auriculaire était plus élevée. La portion de myocarde activée dans un sens différent du circuit de base étant relativement congrue, l’aspect électrocardiographique de surface n’est pas changé de façon majeure.
Un autre type de flutter est probablement beaucoup plus rare et résulte de la survenue dans le circuit habituel du flutter typique d’une double boucle de réentrée ou coexistent une grande boucle classique et une boucle plus petite.
Le flutter post atriotomie droite n’est habituellement pas dépendant de l’isthme cavotricuspidien mais sa fréquente association à un flutter typique mérite d’être signalée. En fait ce dernier est plus fréquent après une atriotomie droite que la rotation péri cicatricielle déjà observée il y plusieurs décennies par Rosenblueth et Garcia Ramos dans des modèles animaux [14]. De ce fait et en pratique nous réalisons systématiquement l’ablation de l’isthme dans ce cas et ce de façon additive à l’ablation du circuit principal de la tachycardie clinique. En outre nous avons récemment pu aussi observer un cas de ce type de flutter ou en tachycardie l’onde F ressemblait à celle issue du nœud sinusal [15]. Ceci était du au fait que l’atriotomie, grossièrement parallèle à l’anneau tricuspidien, prolongeait l’isthme de façon artificielle jusqu’à la région sinusale lors d’un flutter qui était pourtant typique à rotation inverse. La figure 3 résume l’essentiel de ces données.
L’ABLATION PAR RADIOFRÉQUENCE.
La première ablation du flutter typique a eu lieu à Rouen en 1987, utilisant la technique dite de fulguration et visant la région de l’ostium du sinus coronaire [16].
L’équipe de Cosio a été la première à proposer en 1992 d’utiliser des tirs de radiofréquence et à guider l’ablation sur la cible purement anatomique qui s’avérera définitive : L’isthme cavotricuspidien [17]. À l’heure actuelle dans l’immense majorité des cas, c’est l’énergie de radiofréquence qui est utilisée. Celle-ci est maintenant bien codifiée pour l’ablation des flutters typiques et est très largement répandue.
Cette technique est maintenant couronnée d’un fort succès et permet dans plus de 95 % des cas la guérison définitive du flutter auriculaire typique.
Utilisant le critère de non inductibilité après les tirs ayant interrompu le flutter, le taux de récidive restait cependant significatif, limitant l’intérêt de cette technique.
En 1995, nous avons montré que la mise en évidence d’un bloc de conduction de l’influx, complet et bidirectionnel au niveau de l’isthme cavotricuspidien était un excellent marqueur de succès à long terme, avec un taux de récidive de 9 % à 12 mois [18, 19]. Ceci a permis de traiter les patients en rythme sinusal (entre les crises, ou chez lesquels le flutter n’était pas déclenchable [20]. Avec ce nouveau critère de succès, l’ablation isthmique par radiofréquence est devenue la meilleure thérapeutique de prévention du flutter auriculaire typique.
Avant la procédure
L’ablation obéit comme pour toute procédure invasive à certaines règles d’encadrement. Le consentement éclairé du patient doit toujours être obtenu. Si la loi n’impose pas le recueil de la signature de ce dernier, la plupart des sociétés savantes le recommandent, et la Société Française de Cardiologie a édité un formulaire adapté aux techniques ablatives que nous soumettons au patient. De plus hors urgence nous voyons toujours le patient lors d’une consultation d’information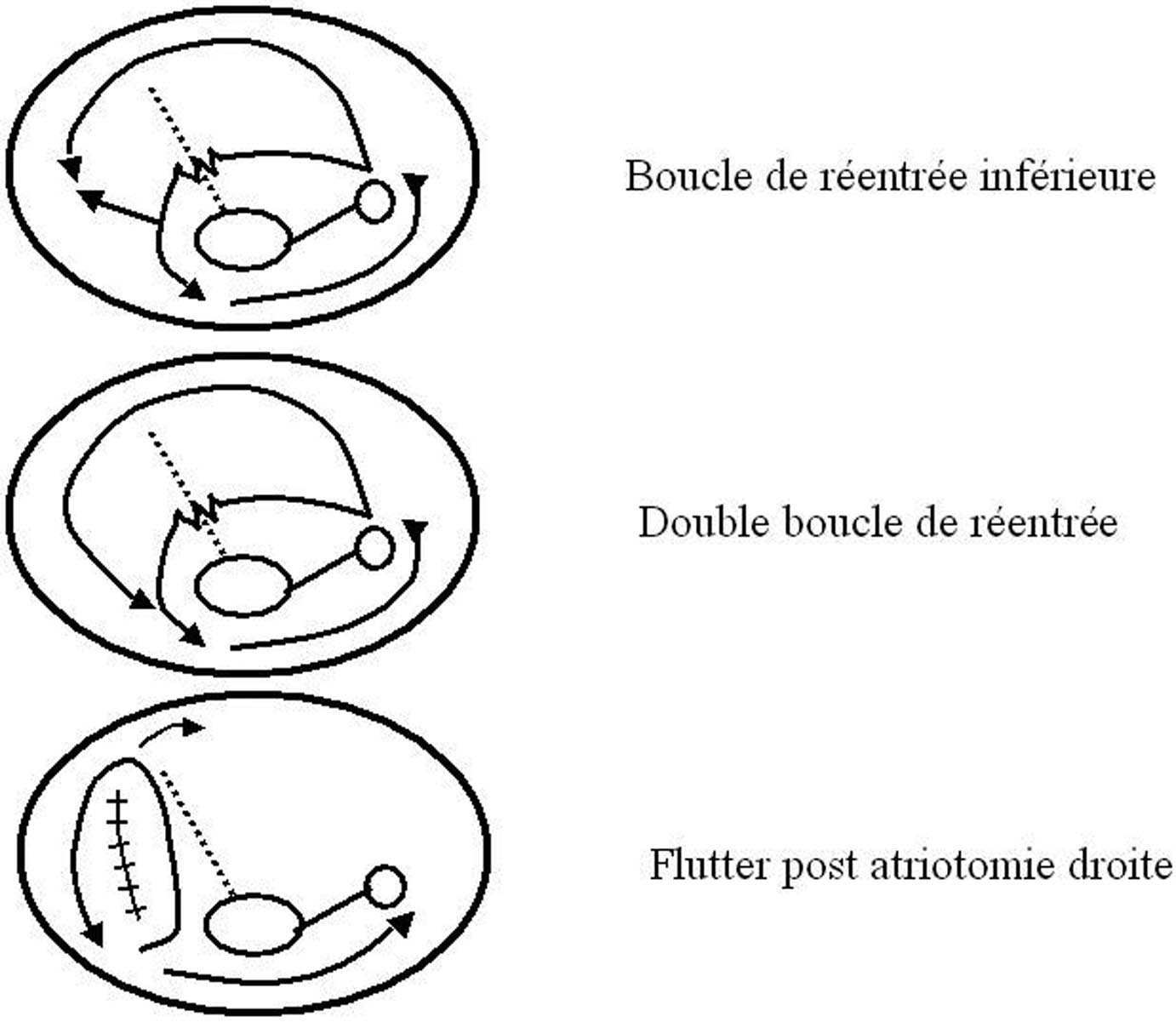
FIG. 3. — Représentation schématique de l’oreillette droite en OAG avec trois possibilités de circuits différents parmi les plus fréquents.
Macroréentrée auriculaire droite à rotation antihoraire Macroréentrée auriculaire droite à rotation horaire Boucle de réentrée inférieure Double boucle de réentrée
préalable pendant laquelle la technique sera décrite et les complications énumérées.
De notre point de vue l’anticoagulation préalable à l’ablation doit être comparable à celle de la fibrillation auriculaire. Quoi que moins fréquent qu’avec celle-ci, le potentiel emboligène du flutter typique a longtemps été sous estimé.
Les traitements médicamenteux associés à la procédure
Cette technique est anxiogène, parfois douloureuse et peut s’ensuivre de réaction vagales marquées. C’est la raison pour laquelle une prémédication est systématiquement réalisée dans notre laboratoire par le dichlorhydrate d’hydroxyzine (ATARAX®) 100 mg la veille au soir et deux heures avant la procédure. Pendant celle ci de la nalbuphine (NALBUPHINE®) à la dose de 10 mg IV éventuellement renouvelable est injectée à la demande. Le Midazolam (HYPNOVEL®) sera de la plus grande utilité à des doses de 2 à 5 mg par voie intraveineuse pour aider à l’obtention d’une sédation vigile appropriée à l’ablation. De même de l’atropine (ATROPINE SULFATE LAVOISIER®) à la dose de 0,5 à 1 mg sera administrée à la demande. Si le patient est en rythme sinusal en début de procédure, l’ablation de courte durée (en règle inférieure à quarante-cinq minutes), et si le patient n’a pas au préalable anticoagulé du fait de la rareté et du caractère non prolongé des crises, nous n’administrons que peu de traitement anticoagulant (héparine 30 à 50 mg en fonction du poids). En dehors de ces cas une anticoagulation sera débutée avant et poursuivie largement après la procédure de manière analogue à ce qui est réalisée pour la cardioversion d’un épisode de fibrillation auriculaire.
Les cathéters
Plusieurs cathéters sont insérés dans l’oreillette droite par voie veineuse fémorale sous anesthésie locale à la lidocaïne à 1 % (XYLOCAÏNE ®). Nous recommandons l’insertion d’au moins deux cathéters dont un spécialement préformé pour épouser la partie antéro-inférieure de l’oreillette droite. Ainsi sera au mieux réalisée la cartographie de cette région pendant le tir de radiofréquence. Le cathéter de radiofréquence aura toujours une longue courbe et au mieux sera préformé pour atteindre la partie antérieure (tricuspidienne de l’isthme). L’électrode distale pourra être standard (de quatre mm munie d’un moniteur de température) mais de plus en plus souvent du fait de la relative innocuité de cette technique, des cathéters plus « agressifs » sont utilisés. Il pourra s’agir d’électrodes distales plus longue (de six ou huit mm) munies d’un ou deux thermocouples ou d’électrodes « irriguées ». Les premiers ont l’avantage d’une efficacité plus grande que les cathéters standards avec un moindre coût surajouté mais n’autorisent pas une cartographie de la ligne d’ablation aussi fine et précise que ceux avec une tête plus petite. Les seconds autorisent une cartographie plus fine mais sont plus chers et potentiellement plus dangereux dans la mesure ou le monitoring de la température est alors sans objet. Ils sont cependant irremplaçables pour les cas ou, du fait d’une poche sous Eustachienne, ou d’une grande valve d’Eustachi, le flux sanguin local est si faible que
l’électrode distale n’étant pas refroidie, la température cible est atteinte avec une énergie trop faible pour pouvoir créer une lésion transmurale. Les résultats clinique d’une étude récente suggèrent que cette dernière approche est rapide efficace et sans danger significatif surajouté [21].
La délivrance des tirs
Des tirs de radiofréquence sont alors délivrés lors d’une stimulation permanente du sinus coronaire ou de la portion antéro inférieure de l’OD ou lors du flutter. Son but est de créer une ligne de nécrose isthmique transmurale continue s’étendant de la valve tricuspide à la veine cave inférieure. Pour que les tirs soient efficaces il faut que la température dépasse au moins 50° C de façon prolongée. En pratique, des températures cibles de entre 60 et 70° seront programmées pendant des durées allant de 60 à 240 secondes). Le cathéter sera initialement positionné sur l’anneau tricuspidien de telle manière à ce qu’un électrogramme ventriculaire soit très prédominant sur l’électrogramme auriculaire. Le site optimal de positionnement latéral du cathé- ter n’est plus discuté. On peut se représenter l’anneau tricuspidien tel que vu en incidence oblique antérieur gauche à environ 45°. S’il est clair qu’un positionnement septal (à cinq heures) entraîne un risque marqué de bloc auriculo-ventriculaire parfois définitif [22], en pratique et en fonction des particularités anatomiques locales (présence d’un grande valve d’Eustachi, d’une poche sous Eustachienne, de gros muscles pectinés) la position idéale de départ est selon les cas entre six et sept heures. Il existe en effet des variations anatomiques entre la crête d’Eustachi et le sinus coronaire qui peuvent être en continuité ou non. Ainsi dans environ 10 % des cas la crête d’Eustachi est séparée du sinus coronaire, son extrémité distale se positionne alors plutôt en arrière du sinus coronaire rendant plus délicate les techniques de vérification de l’existence d’un bloc isthmique (cf plus bas) [23, 24].
Les critères de succès
C’est l’observation de la présence d’un bloc de conduction bidirectionnel stable après une période d’observation de trente minutes dans notre laboratoire qui déterminera la fin de la procédure. Plusieurs techniques ont été décrites.
L’étude de la cartographie d’activation de part et d’autre de la ligne d’ablation
En stimulation permanente de part et d’autre de la ligne d’ablation il doit être démontré que l’influx ne peut plus traverser la région ablatée. Par exemple en stimulation du sinus coronaire proximal en l’absence d’un bloc isthmique, deux fronts d’activation peuvent être visualisés par l’enregistrement intracardiaque en mode bipolaire : l’un ascendant le long du septum inter-auriculaire puis descendant le long de la paroi latérale de l’oreillette droite, l’autre traversant l’isthme cavotricuspidien et remontant la partie basse de l’oreillette droite. La région où l’on observe la collision des deux fronts d’activation est située à la partie médiane de l’oreillette droite.
En présence d’un bloc isthmique complet, le sens de dépolarisation de l’oreillette droite va changer et la stimulation du sinus coronaire entraîne un seul et unique front d’activation descendant le long de la paroi latérale de l’oreillette droite, puisque aucun influx ne peut traverser l’isthme et se propager vers la partie basse de l’oreillette droite. Ainsi est mis en évidence l’incapacité de traverser l’isthme dans le sens septum vers paroi latérale de l’oreillette droite (bloc horaire). Ceci doit alors entraîner la vérification du caractère bidirectionnel de ce bloc par la mise en évidence concomitante d’un bloc isthmique anti-horaire par un procédé symétrique.
Lors de la détermination du bloc de conduction par la cartographie d’activation de la région isthmique, il est important d’éliminer une conduction résiduelle ralentie au niveau de la ligne d’ablation. Ce type de conduction a été appelé bloc isthmique incomplet [20]. En fait sa mise en évidence peut être rendue particulièrement difficile du fait de l’existence fréquente de conduction transverse de la Crète terminale [25].
L’étude de la ligne d’ablation elle même
Il a été proposé l’analyse de la seule ligne d’ablation pour identification du caractère complet du bloc isthmique. En effet l’activation de part et d’autre de la ligne d’ablation peut permettre au cathéter d’ablation lui même d’enregistrer l’activation séquentielle des deux berges de la ligne d’ablation sous la forme de deux potentiels clairement et largement séparés et parallèles de l’anneau tricuspidien à la veine cave inférieure. Si cette approche a l’avantage de la simplicité et du coût moindre, certains problèmes se sont fait jour qui en limitent la seule application. Outre l’inconnu sur la valeur d’écart entre les doubles potentiels identifiant à coup sûr le bloc complet, les critiques essentielles en ont été la fréquente difficulté à pouvoir clairement les individualiser. Les stimulations différentielle puis positionnelle ont alors été proposées comme aide au diagnostic [26, 27]. Dans la seconde approche la variation des points de stimulation entre le sinus coronaire, la berge septale de la ligne d’ablation et le mur postérieur de l’oreillette droite fait la distinction entre un aspect de bloc incomplet lié à une conduction isthmique résiduelle et celui lié à un shunt dans le crête terminale masquant un bloc complet.
Nous pensons qu’au mieux c’est l’utilisation conjointe de ces deux approches qui permettent d’authentifier la présence d’un bloc isthmique [28]. Ces critères ainsi appliqués les taux de succès dépassent 96 % au terme de deux années de suivi.
Les complications inhérentes aux procédures d’ablation
Elles sont rares dans l’ablation du flutter typique et dans des mains entraînées. Outre les habituels risques du cathétérisme droit incluant les rarissimes hémopéricarde ou thrombose pariétale, sans être réellement une complication une gène intra thoracique est ressentie assez nettement dans environ un tiers des cas. Elle peut être suffisamment intense et gêner la procédure dans moins de 5 % des cas. Elle est par contre absente si l’énergie utilisée est non plus la radiofréquence mais la cryothérapie au dépends d’un succès à long terme légèrement inférieur [29]. Le risque le plus
significatif est la possibilité de survenue d’une altération de la conduction auriculoventriculaire pour les cas ou la délivrance des tirs est septale. Plus récemment a été rapporté l’occlusion d’une artère coronaire droite lors d’une ablation à haute énergie [30].
Récidives après création initiale d’un bloc isthmique complet
Dans notre étude après un suivi moyen de 26 fi 17 mois sans traitement antiarythmique, le taux de récidive a été de 5,4 %. Lorsqu’il y a eu des récidives malgré création initiale d’un bloc isthmique complet, le délai moyen d’apparition de celles ci a été de onze mois, avec un maximum de 3 ans. Dans les nombreux travaux de la littérature, elles surviennent essentiellement au cours des six premiers mois [31]. Des palpitations peuvent survenir après l’ablation qui ne sont pas nécessairement le signe d’une rechute et d’une inefficacité secondaire de la procédure, même après un succès primaire. En effet le flutter typique est fréquemment associé à la fibrillation auriculaire et le traitement de celle ci par ablation en est différent. Il est important de retenir que l’ablation de l’isthme cavotricuspidien ne prévient pas la fibrillation auriculaire [19].
Les indications de l’ablation du flutter typique
Il peut paraître surprenant, vu l’ancienneté de l’ablation et son caractère relativement bien codifié, que celles ci soient encore discutées en 2004. Les conclusions des récentes recommandations des société Européennes et Nord Américaines suggèrent aussi, quoique prudemment, que l’ablation peut être discutée précocement dans l’histoire clinique du patient affecté d’un flutter typique [32].
BIBLIOGRAPHIE [1] LEWIS T., FEIL H.S., STROUD W.D. — Observations upon a curious and not uncommon form of extreme acceleration of the auricles. Heart, 1912, 4 , 171.
[2] LEWIS T., FEIL H.S., STROUD W.D. — Observations upon flutter and fibrillation. II. Nature of auricular flutter. Heart, 1920, 7 , 191.
[3] PUECH P., LATOUR H., GROLLEAU R. — Le flutter et ses limites.
Arch. Mal. Cœur., 1970, 63, 116-144.
[4] SAOUDI N., COSIO F., WALDO A., et coll. — A classification of atrial flutter and regular atrial tachycardia according to electrophysiological mechanisms and anatomical bases. A Statement from a Joint Expert Group from the Working Group of Arrhythmias of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Eur. Heart. J ., 2001, 22(14), 1162-82.
[5] OLGIN J.E., KALMAN J.M., FITZPATRICK A.P., LESH M.D. — Role of right atrial structures as barriers to conduction during human type I atrial flutter. Activation and entrainment mapping guided by intracardiac echocardiography. Circulation, 1995, 92 , 1839-1848.
[6] COSÍO F.G., LÓPEZ GIL M., ARRIBAS F., et al. — The mechanisms of entrainment of human common flutter studied with multiple endocardial recordings. Circulation, 1994, 89 , 2117-2126.
[7] GROLLEAU R., CARABASSE D., LECLERCQ F., MESSNER-PELLENC P., PASQUIE J.M. — Transient entrainment of tachycardia. Arch. Mal. Cœur., 1995, 88 , 5, 63-70.
[8] SAOUDI N., ANSELME F., POTY H., CRIBIER A., CASTELLANOS A. — Entrainment of supraventricular tachycardias : A review. P.A.C.E., 1998, 21 , 2105-2125.
[9] MORTON J.B., SANDERS P., DEEN V., VOHRA J.K., KALMAN J.M. — Sensitivity and specificity of concealed entrainment for the identification of a critical isthmus in the atrium : Relationship to rate, anatomic location and antidromic penetration. J. Am. Coll. Cardiol., 2002, 39 , 896-906.
[10] RICARD P., IMIANITOFF M., YAÏCI K., et al. — Atypical Flutters.
Europace, 2002, 4 , 229-239.
[11] SAOUDI N., NAIR M., ABDELAZZIZ A., et al. — Electrocardiographic Patterns and Results of Radiofrequency Catheter Ablation of Clockwise Type I Atrial Flutter. J. Cardiovasc. Electrophysiol. , 1996, 7 , 931-942.
[12] COSIO F.G., LÓPEZ GIL M., ARRIBAS F., GONZÁLEZ H.D. — Mechanisms of induction of typical and reversed atrial flutter. J. Cardiovasc. Electrophysiol., 1998, 9 , 281-191.
[13] CHENG J., CABEEN W.R., SCHEINMANN M.M. — Right atrial flutter due to lower loop reentry.
Mechanism and anatomic substrate. Circulation , 1999, 99 , 1700-1705.
[14] ROSENBLUETH A., GARCIA RAMOS J. — The influence of artificial obstacles on experimental auricular flutter. Am. Heart. J., 1947, 33 , 677-84.
[15] KASAÏ A., ANSELME F., CRIBIER A., SAOUDI N. — Post operative tachycardia with a P wave identical to that of sinus rhythm. What is the tachycardia mechanism ? J. Cardiovasc. Electrophysiol., 2000, 11 , 823-824.
[16] SAOUDI N., MOUTON SCHLEIFFER D., LETAC B. — Direct catheter fulguration of atrial flutter.
The Lancet , 1987, 8585 , 568-569.
[17] COSIO F.G., LOPEZ-GIL M., GOICOLEA A., ARRIBAS F., BARROSSO J.L. — Radiofrequency ablation of the inferior vena cava-tricuspid valve isthmus in common flutter. A.m J. Cardiol., 1993 , 71 , 705-9.
[18] POTY H., SAOUDI N., ABDEL AZZIZ M., NAIR M., LETAC B. — Radiofrequency catheter ablation of type I flutter. Prediction of late success by electrophysiologic criteria. Circulation, 1995, 92 , 1389-1392.
[19] ANSELME F., SAOUDI N., POTY H., DOUILLET R., CRIBIER A. — Radiofrequency catheter ablation of common atrial flutter : Significance of palpitations and quality of life evaluation in patients with proven isthmus block. Circulation, 1999, 99 , 534-540.
[20] POTY H., SAOUDI N., NAIR M., ANSELME F., LETAC B. — Radiofrequency catheter ablation of atrial flutter. Further insights into the various types of isthmus block : Application to ablation in sinus rhythm. Circulation, 1996, 94 , 3204-3123.
[21] JAÏS P., SHAH D., HAÏSSAGUERRE M., et al. — Prospective randomized com-parison of irrigatedtip versus conventional-tip catheters for ablation of common flutter. Circulation , 2000, 101 , 772-776.
[22] ANSELME F., KLUG D., SCANU P., et coll. — Randomized comparison of two targets in typical atrial flutter ablation. Am. J. Cardiol., 2000, 85 , 11, 1302-1307.
[23] WANG Z., JORGE A., JO W. et al. — Anatomic variability of the human Eustachian ridge.
PACE , 1996, 19 , 634.
[24] SAOUDI N., POTY H., ANSELME F., LETAC B. — Endocardial activation mapping of the area posterior to the coronary sinus ostium in type I atrial flutter J. Am. Coll. Cardiol. , 1995, 943-11 , 168 A.
[25] ARENAL A., ALMENDRAL J., ALDAY J.M., et coll. — Rate-dependent conduction block of the crista terminalis in patients with typical atrial flutter : influence on evaluation of cavotricuspid isthmus conduction block. Circulation , 1999, 99 , 2771-2778.
[26] SHAH D., HAÏSSAGUERRE M., TAKAHASHI A., JAÏS P., HOCINI M., CLÉMENTY J. — Differential Pacing for Distinguishing Block From Persistent Conduction Through an Ablation Line .
Circulation, 2000, 102 , 1517-1522.
[27] ANSELME F., SAVOURE A., CRIBIER A., SAOUDI N. — Catheter ablation of typical atrial flutter :
A randomized Comparison of 2 methods for determining Complete bi-directional block .
Circulation, 2001, 13 , 103, 1434-1439.
[28] ANSELME F., SAOUDI N. — Assessment of complete isthmus block after ablation of typical atrial flutter. Can we rely on a single criterion ? J. Cardiovasc. Electrophysiol., 2001, 12 , 400-401.
[29] MANUSAMA R., TIMMERMANS C., LIMON F., PHILIPPENS S., CRIJNS H.J., RODRIGUEZ L.M. — Catheter-based cryoablation permanently cures patients with common atrial flutter. Circulation , 2004, 109 , 1636-9.
[30] OUALI S., ANSELME F., SAVOURÉ A., CRIBIER A. — Acute coronary occlusion during radiofrequency catheter ablation of typical atrial flutter. J. Cardiovasc. Electrophysiol. , 2002, 10 , 1047-9.
[31] ESPALIAT E., LAGRANGE P., BOVEDA S. et al. — Ablation par radiofréquence du flutter auriculaire. Facteurs prédictifs du succès primaire et du devenir à moyen terme.
Arch. Mal. Cœur., 1999, 92 , 29-34.
[32] BLOMSTRÖM-LUNDQVIST C., SCHEINMAN M.M., ALIOT E.M., AND THE COMMITTEE MEMBERS, TASK FORCE MEMBERS, AND ESC COMMITTEE FOR PRACTICE GUIDELINES MEMBERS. — ACC/AHA/ESC Guidelines for the Management of Patients With Supraventricular Arrhythmias* — Executive Summary : A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines. Circulation , 2003, 108 , 1871-1909.
DISCUSSION
M. Jean-Paul BOUNHOURE
On observe actuellement des flutters le plus souvent atypiques ‘‘ dits post atriotomies ’’ après intervention des communications inter auriculaires. L’ablation de l’isthme cavotrianspidien est-elle une mesure thérapeutique recommandée ? Quelques patients, à mon avis difficiles à traiter, font des alternances de flutter et de fibrillation auriculaire. Que recommandez-vous ? Si possible l’ablation de l’isthme puis l’ablation des foyers veineux pulmonaires à la source de la fibrillation ou la simple ablation de l’isthme et un traitement de la fibrillation médical, pharmacologique ?
Les flutters post-atriotomies sont consécutifs à des circuits de macro-réentrées dont l’impulsion tourne autour de l’incision auriculaire ayant permis au chirurgien l’abord des structures profondes du cœur. Lorsqu’une telle incision a été effectuée, elle reproduit le mode de ROSENBLUETH et GARCIA-RAMOS qui ont servi comme modèles animaux ayant permis de comprendre les mécanismes de ré-entrée. Ces « circuits post-atriotomie » ou l’influx électrique tourne autour de l’incision, s’accompagnent, en outre, d’une plus grande incidence de flutter péri-tricuspidien tel le flutter typique. C’est la raison pour laquelle l’ablation de l’isthme cavo-tricuspidien est une mesure thérapeutique recom-
mandée dans cette situation, en association à une ablation joignant le pôle inférieur de l’atriotomie à un obstacle naturel, le plus souvent, la veine cave inférieure. Lorsque les patients font à la fois de la fibrillation et du flutter auriculaire, une façon d’aborder le problème est de regarder la prévalence respective de l’une et l’autre des arythmies. En cas de flutter extrêmement prédominant, l’ablation de l’isthme cavo-tricuspidien sera alors une bonne méthode simple et relativement sans danger de première étape de traitement.
La plus part du temps, le traitement anti-arythmique sera à continuer et de longues périodes de quiescence clinique peuvent être obtenues. A contrario , si la fibrillation est plus fréquente, l’ablation de l’isthme devra alors s’inscrire dans une stratégie d’ablation de la fibrillation auriculaire qui passe alors au premier plan. Celle-ci a des indications reconnues, quoique encore mouvante, mais une telle procédure doit être réservée à des centres spécialisés possédant une grande expertise en la matière, et à certains types de patients (plutôt relativement jeunes, à oreillette également peu ou pas dilatées, encore que ces données soient-elles-mêmes discutables).
M. André VACHERON
L’incidence du flutter auriculaire est environ cent fois plus faible que celle de la fibrillation auriculaire. Maladie souvent chronique autrefois, avec des accès paroxystiques plus ou moins bien prévenus par les médicaments anti-arythmiques, le flutter peut être définitivement guéri aujourd’hui par la radiofréquence. Mais la restauration du rythme sinusal s’accompagne d’une véritable sidération auriculaire avec stase sanguine. Le risque thromboembolique est loin d’être négligeable surtout chez les sujets âgés, hypertendus, coronariens et insuffisants cardiaques. Quelle couverture anti-coagulante préconisez-vous avant et après la réduction du flutter et pendant combien de temps ?
La réduction de tout trouble du rythme auriculaire peut s’accompagner d’une sidération mécanique entraînant une plus grande probabilité de complication thrombotique intraatriale gauche avec leur cortège d’embolie. C’est la raison pour laquelle, quelle que soit l’arythmie, flutter ou fibrillation, nous considérons que le traitement anticoagulant doit être appliqué en l’absence de contre-indication. Nous conseillons un traitement anticoagulant pendant au moins un mois avant puis, après ablation et restauration de ce fait du rythme sinusal pendant environ trois mois. Ces trois mois servent de période de surveillance, permettant de s’assurer de l’absence de rechute.
M. Louis GUIZE
Y-a-t-il une place pour l’imagerie scanner ou IRM pour préciser l’anatomie locale avant l’ablation ? La cartographie électro-anatomique est-elle utile pour le choix du site d’ablation et la validation du résultat ? La cryo-ablation a l’avantage d’être indolore et de comporter un moindre risque, de bloc auriculo-ventriculaire notamment. Dans notre expé- rience, l’efficacité est comparable à celle de la radiofréquence à condition d’utiliser de larges catheters et de réserver la technique à des sujets pas trop corpulents. Avez-vous une expérience dans ce domaine ?
Les scanners multi-barrettes et l’IRM moderne, précisent de façon formidable, l’anatomie intra-cardiaque, avec un très haut degré de précision. Leur indication pourrait en être le dépistage d’une grande valve d’Eustachie qui pourrait gêner l’abord de l’isthme cavo-tricuspidien par la sonde d’ablation. Cependant, la présence d’une telle valve peut
se diagnostiquer directement du fait des difficultés de manipulations per-opératoires et le cathéter devra alors être changé pour un cathéter irrigué qui permettra de délivrer au fond de la poche sous-Eustachienne (immédiatement antérieure à la valve) un courant de radiofréquence suffisamment efficace pour constituer une nécrose trans-murale. Ce phénomène est cependant suffisamment rare pour que nous ne nous demandions pas une telle imagerie en pré-opératoire de façon systématique. La cartographie électroanatomique est particulièrement utile pour déterminer le mécanisme précis d’une arythmie et sa localisation dans les cavités cardiaques avec pour conséquence, le choix du site d’ablation optimal. Cependant, pour le flutter typique, l’isthme cavo-tricuspidien est toujours la cible et nous n’utilisons pas systématiquement une telle cartographie. Lorsque cette arythmie est associée à d’autres flutters atriaux droits au gauche mais non typiques, nous utilisons ce type de système. Une telle stratégie peut être choisie après observation minutieuse des données ECG dans la période pré-opératoire. La cryoablation est indolore et ceci est un grand avantage sur la radiofréquence mais nous n’avons aucune expérience dans ce domaine. Le risque de bloc auriculo-ventriculaire qui a été initialement décrit lors des tirs dirigés dans une zone trop proche du septum inter-auriculaire n’existe plus dans notre série (dernier cas il y a plus de dix ans, et dans le cadre d’un protocole où volontairement, des tirs septaux ont été délivrés). Le coût de cette technique et sa relative faible diffusion fait que nous ne l’utilisons pas dans cette indication.
M. Michel BOUREL
En dehors des guillemets (significatifs de l’interrogation de l’auteur) qui encadrent le terme ablation, l’auteur peut-il donner l’éventail des âges des patients de sa cohorte (existe-t-il une limite d’âge, vers le bas, comme vers le haut) ?
Le terme ablation est consacré par l’usage bien qu’il soit trompeur et laisse à penser qu’il s’agit d’une extirpation d’allure chirurgicale alors qu’en fait, seule la tachycardie est « retirée ou ablatée ». Le patient de notre cohorte ont d’un âge compris entre une vingtaine d’années pour les plus jeunes, volontiers sportifs, à 86 ans. Il n’y a pas de véritable limite vers le bas mais la prévalence du flutter est si rare dans l’extrême jeunesse que cette situation ne se rencontre pratiquement jamais. A contrario , les flutters sont plus fréquents chez les sujets très âgés et c’est plus l’âge physiologique que l’âge numérique qui devra constituer une limite à l’interventionnisme rythmologique.
* Service de Cardiologie ; Centre Hospitalier Princesse Grace, Avenue Pasteur, 98000 MONACO. nsaoudi@chpg.mc. Tirés-à-part : Professeur Nadir SAOUDI, même adresse. Article reçu le 21 février 2005, accepté le 13 juin 2005.
Bull. Acad. Natle Méd., 2006, 190, no 1, 139-153, séance du 17 janvier 2006


