Résumé
Le capital osseux se constitue au cours de la vie par les mécanismes de modelage et de remodelage. Le tissu trabéculaire est constitué par un ensemble de travées (plaques et piliers) dont la répartition est hautement anisotrope : les travées se disposent parallèlement à la résultante des lignes de contraintes (Loi de Wolff). La microarchitecture trabéculaire apparaît conditionnée par les contraintes mécaniques qui s’exercent sur les pièces squelettiques. Cependant, peu de méthodes sont actuellement validées cliniquement pour apprécier et suivre l’évolution de la microarchitecture dans les ostéopathies. Les études les plus développées portent sur l’appréciation microarchitecturale par histomorphométrie osseuse grâce à l’utilisation de nouveaux algorithmes permettant d’apprécier en 2D différentes caractéristiques trabéculaires dont la connectivité. Plusieurs travaux ont montré que l’appréciation de la microarchitecture devait utiliser plusieurs techniques indépendantes. La microtomographie X (microCT), la micro IRM, le synchrotron permettent aussi de mesurer en 3D l’architecture trabéculaire de façon non destructive sur des prélèvements osseux. Cette revue décrit l’évolution des connaissances sur la microarchitecture osseuse, son rôle dans les maladies osseuses comme l’ostéoporose et les différentes méthodes d’évaluation histologique en 2D et en 3D.
Summary
Bone mass is determined throughout life by modeling and remodeling mechanisms. Trabecular bone consists of a network of trabeculae (plates and rods) whose distribution is highly anisotropic: trabeculae are disposed parallel to the resultant of stress lines (Wolff’s law). The trabecular microarchitecture appears to be conditioned by mechanical stresses exerted on skeletal bones. Few clinically validated methods are available to assess and monitor the bone microarchitecture in bone diseases. The best-developed is bone histomorphometry, with the use of new algorithms to appreciate various 2D characteristics of the trabeculae, such as thickness and connectivity. Several studies have shown that several independent techniques should be used to study microarchitecture parameters. X-ray microtomography (microCT), microMRI and synchrotron devices can give non destructive 3D measurements of the trabecular microarchitecture of bone specimens. This review describes advances in our knowledge of bone microarchitecture, its role in bone diseases such as osteoporosis, and methods of 2D and 3D histological evaluation.
INTRODUCTION
Le tissu osseux est un tissu conjonctif de soutien en constante adaptation tout au cours de la vie ; deux processus fondamentaux contrôlent notre capital osseux :
Le modelage permet l’acquisition de la forme et de la quantité d’os durant l’enfance et l’adolescence. Il assure la croissance des pièces squelettiques. L’activité ostéoblastique est prédominante sur l’activité ostéoclastique. L’activité de modelage s’exerce nettement dans la zone d’ossification des cartilages de croissance lorsque les spicules de cartilage calcifiés sont recouverts de tissu osseux. Dans les os de membrane, l’apposition ostéoblastique s’effectue directement sans maquette cartilagineuse préalable. La phase de modelage permet d’atteindre le pic de masse osseuse vers 25-30 ans. Le modelage peut persister chez l’adulte dans quelques circonstances :
cals fracturaires, métaplasies osseuses bénignes ou tumorales et phase d’adaptation rapide de l’os aux biomatériaux.
Le remodelage permet l’adaptation du tissu osseux aux variations de contraintes, aux modifications hormonales et métaboliques pendant tout le reste de la vie. Il est lié à l’action coordonnée des ostéoclastes et des ostéoblastes agissant en unités multicellulaires de remodelage (BMU). Le remodelage osseux est caractérisé par une phase de résorption de zones osseuses devenues mécaniquement (ou métaboliquement) moins performantes, puis une phase de formation d’une nouvelle unité de structure (BSU) mieux adaptée. Les ostéoblastes élaborent les BSU de façon diffé- rente dans l’os cortical (sous forme d’ostéons) (Fig. 1) et dans l’os trabéculaire (où ils forment des structures arciformes, sorte d’ostéons incomplets). Les BSU sont agencées et compactées de façon différente dans l’os cortical (os dense) et dans l’os trabéculaire (où ils forment les travées osseuses) (Fig. 2). Ce niveau d’organisation représente la microarchitecture osseuse. Au cours des ostéopathies bénignes et malignes, la microarchitecture osseuse peut être altérée ; il en résulte une altération de la qualité de l’os en tant que matériau et un risque accru de fractures.
Notre squelette est composé d’environ 20 % d’os trabéculaire et 80 % d’os cortical.
L’os trabéculaire a un niveau de remodelage supérieur à celui de l’os cortical. Chez l’enfant, l’os trabéculaire apparaît essentiellement constitué par un réseau dense de plaques souvent à disposition isotrope. Chez l’adulte, une orientation préférentielle des plaques est observée, elle se fait en fonction de la direction des contraintes qui s’exercent sur la pièce squelettique. Jusque dans les années 1980, l’architecture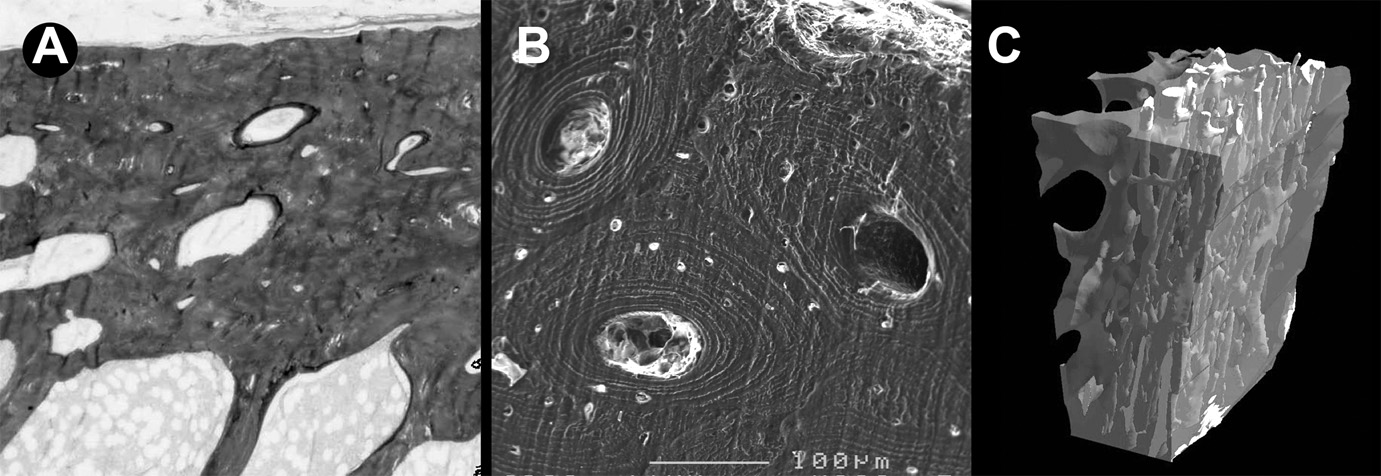

Fig. 1. — A) microarchitecture de l’os cortical en microscopie optique ; B) microscopie électronique à balayage ; C) en microCT. La corticale, poreuse, est composée d’ostéons compactés, les canaux de Havers sont disposés parallèlement au grand axe de la pièce squelettique, selon la ligne des contraintes maximales. En microCT, les canaux de Havers sont colorisés en clair et l’os minéralisé rendu semi transparent.
Fig. 2. — A) microarchitecture de l’os trabéculaire en microscopie optique ; B) microscopie électronique à balayage ; C) en microCT. Les deux types de travées (plaques et piliers) sont méconnus en microscopie optique mais bien visualisés en microscopie à balayage et microCT.
osseuse n’était pas prise en compte dans la compréhension des mécanismes physiopathogéniques des ostéopathies décalcifiantes ; l’ostéoporose n’était comprise que comme une maladie associée à une réduction du volume osseux trabéculaire.
Depuis, la définition de l’ostéoporose associe une réduction de la masse osseuse et la survenue d’altérations de la microarchitecture [1].
LE RÔLE DE LA MICROARCHITECTURE OSSEUSE
Historique
La microarchitecture osseuse de l’os trabéculaire est un facteur important dans l’appréciation de la qualité du tissu osseux. La qualité osseuse est comprise actuellement comme un ensemble de nombreux facteurs interagissant entre eux pour donner à l’os sa compétence biomécanique. La valeur biomécanique du matériau dépend d’une part de son volume mais aussi de sa répartition spatiale, c’est à dire de sa microarchitecture.
Dès 1867, l’anatomiste allemand Von Meyer avait étudié les postures squelettiques. Il décrivit l’orientation des travées dans l’extrémité fémorale supérieure. Lors de la pré- sentation de ses résultats, l’ingénieur suisse Culmann s’est aperçu que la distribution spatiale des travées avait une ressemblance avec les lignes de contraintes qu’il avait analysées pour la conception d’une grue. Culman et Von Meyer postulèrent ensemble une théorie disant que les travées osseuses coïncidaient avec les lignes des contraintes.
Wolff, anatomiste allemand, confirma que, non seulement les travées osseuses étaient alignées avec les directions des contraintes, mais que leurs orientations pouvaient être modifiées si les contraintes changeaient. Pour la première fois, on prit conscience que la microarchitecture osseuse pouvait répondre et s’adapter aux variations mécaniques en minimisant la masse de matériau (loi de Wolff).
Roux, chirurgien allemand, suggéra pour la première fois que des cellules contenues à l’intérieur de l’os pouvaient répondre aux stress mécaniques en régulant l’apposition osseuse et la résorption. L’anatomiste américain Koch confirma en 1917 les travaux de Wolff et montra que la densité osseuse est plus élevée dans les zones où les contraintes sont maximales. Il suggéra que la masse osseuse était distribuée de façon à obtenir une adaptation maximale pour une masse minimale de matériau.
Frost, chirurgien orthopédique américain, montra que l’adaptation de la microarchitecture osseuse passait par le remodelage osseux. Il décrivit les premières théories cellulaires impliquées dans le remodelage et montra les différences entre modelage et remodelage osseux. Il détermina que l’activité des ostéoclastes et des ostéoblastes était couplée dans le temps et dans l’espace (théorie du BMU : basic multicellular unit) [2] et s’adaptait aux contraintes en fonction de leur intensité (SATMU : Structural adaptations to mechanical usage) selon la théorie du mechanostat [3, 4].
Une redécouverte de l’importance de la microarchitecture s’est produite dans les années 80, en particulier sur l’impulsion de Parfitt qui, le premier modélisa la microarchitecture en prenant conscience de sa répartition non homogène dans l’espace (anisotropie). Dans le tissu osseux dense des corticales, les ostéons sont assemblés de telle sorte que l’axe du canal de Havers est parallèle à la contrainte qui s’exerce sur la pièce squelettique. Dans le tissu trabéculaire, les plaques sont disposées parallèlement aux contraintes, les piliers transverses assurent la cohésion de l’ensemble du système. Il proposa un ensemble de techniques permettant de mesurer des descripteurs de la microarchitecture des travées [5]. Ses techniques de mesure sont basées sur l’hypothèse que les travées sont soit des piliers, soit des plaques (‘‘ the plate and rod ’’ model).
Les paramètres mesurant la microarchitecture de l’os trabéculaire
Les paramètres histomorphométriques statiques basés sur le ‘‘ plate and rod model ’’ sont : l’épaisseur moyenne des travées (Tb.Th, en μm), leur densité (Tb.N en /mm) et l’écartement intertrabéculaire (Tb.Sp, en μm). Ces paramètres sont dérivés d’une combinaison de mesures des surfaces et des périmètres trabéculaires [6]. Depuis, plusieurs méthodes histomorphométriques ont été proposées pour étudier la microarchitecture en utilisant des méthodes indépendantes des mesures de surface et de périmètre trabéculaire.
Le facteur de répartition trabéculaire : trabecular bone pattern factor (Tb.P ).
f
Cette méthode est basée sur l’utilisation de la morphologie mathématique: dans une structure parfaitement connectée, les surfaces concaves sont abondantes, alors que les surfaces convexes sont peu nombreuses [7]. Inversement, lorsque l’on est en présence d’une structure déconnectée, les surfaces concaves deviennent moins abondantes que les surfaces convexes sont alors plus nombreuses. Ainsi, plus le réseau trabéculaire sera déconnecté, plus les surfaces convexes seront nombreuses, et plus Tb.P augmente.
f L’index d’interconnectivité (ICI)
Il s’agit d’une méthode décrite pour l’étude des coraux [8]. Elle est basée sur les relations architecturales inverses qui existent entre le réseau trabéculaire et les espaces médullaires : plus le réseau trabéculaire est déconnecté, plus les espaces médullaires sont connectés. La squelettisation (technique d’analyse d’images), permet de réduire les espaces médullaires en une ligne de « partage des eaux » qui comporte des « arbres » (lignes interconnectées) et des « branches » qui s’arrêtent à l’interface des travées osseuses. L’index d’interconnectivité mesure le nombre de ces différentes structures.
La caractérisation du réseau trabéculaire (Strut analysis)
Par squelettisation, on identifie les différents types de travées et l’on mesure leur connectivité [9, 10]. Les nœuds entre travées, les travées avec une extrémité libre sont mesurées, ainsi que les travées reliant deux nœuds ou les travées reliant les corticales au reste du réseau trabéculaire. On dénombre les nœuds, les extrémités libres, les travées interconnectées … et l’on décrit ainsi précisément la micro architecture.
Le star volume
Cette méthode, décrite pour mesurer la porosité des ciments, est basée sur l’étude des espaces médullaires [11] : à partir d’un point quelconque de l’espace médullaire, on projette des rayons dans toutes les directions de l’espace. Les rayons s’arrêtent dès qu’ils rencontrent, soit une travée osseuse, soit une corticale osseuse, soit les bords de la coupe [12]. On constitue ainsi une sorte d’étoile dont on mesure la longueur de chaque rayon. Plus le réseau est déconnecté, plus la longueur des rayons est importante. On met en évidence les perforations à l’intérieur du réseau trabéculaire.
Les techniques de superposition de grilles (MIL, maximum intercept length) permettent des algorithmes beaucoup plus rapides que les méthodes par étoile.
Le nombre d’Euler-Poincaré.
La méthode consiste à compter le nombre de particules n présentes dans l’espace trabéculaire et le nombre m de cavités médullaires circonscrites par les travées. Le nombre d’Euler E = n — m . Plus le réseau trabéculaire est connecté, plus E est faible (voire négatif).
Le trajet maximum au sein du réseau.
Le réseau trabéculaire peut être vu comme un labyrinthe dans lequel on peut se déplacer dans toutes les directions. Plus le trajet est court, plus il y a de perforations qui permettent de passer d’une cavité médullaire à l’autre [13].
La dimension fractale du réseau trabéculaire.
Les objets biologiques présentent une irrégularité et une complexité qui sont souvent difficiles de quantifier par la géométrie euclidienne. L’analyse fractale permet d’approcher la complexité des structures et des courbes. Sur une coupe 2D, le périmètre des travées peut occuper plus ou moins la surface de la coupe en fonction de la complexité du réseau trabéculaire, des branchements… La dimension fractale D est mesurée par des méthodes qui superposent à l’image des contours trabéculaires des outils de mesure dont on fait varier la taille. Le périmètre est exprimé chaque fois en fonction du nombre d’outils utilisés. D est obtenue en déterminant la pente de la droite de régression entre le logarithme du nombre d’outils et celui de la taille de l’outil (graphique de Richardson). On peut mesurer plusieurs dimensions fractales en utilisant la techniques des boîtes (D de Kolmogorov) [14], la techniques des « saucisses dynamiques » (D de MinskowskiBouligand), ou la technique de mass radius / lacunarité [15].
L’ensemble de ces méthodes a montré qu’il faut toujours utiliser plusieurs techniques pour caractériser le réseau trabéculaire car elles n’explorent pas les mêmes composants de la microarchitecture [15, 16]. Les relations entre paramètres sont décrites par analyse hiérarchique par clusters : plusieurs variables sont étroitement liées pour décrire la complexité du réseau, la quantité d’os qui compose une travée ou les espaces médullaires. Il devient aisé de voir que, selon les mécanismes physiopathologiques impliqués dans la genèse des différents types d’ostéoporoses, certains paramètres se révélent plus sensibles que d’autres à des temps plus précoces [16, 17]. Dans les modèles animaux, la mesure de la microarchitecture osseuse est beaucoup plus précocement altérée que les mesures de volume osseux et densitométrie [18].
Des relations non linéaires (hyperboliques ou exponentielles) sont fréquemment rencontrées entre masse osseuse et paramètres architecturaux. Le point d’inflexion des courbes se situe pour un volume moyen de 11 %, correspondant à un seuil décrit en histomorphométrie comme un seuil fracturaire spontané [19]. Il correspond à des travées d’épaisseur moyenne 70 μm. Les ostéoclastes résorbent le tissu osseux à une profondeur de 40 μm. Il suffit donc que deux ostéoclastes érodent face à face une travée amincie pour que survenienne une perforation. Ce mécanisme, montré dans l’ostéoporose secondaire liée à la corticothérapie, est aussi retrouvé dans l’ostéoporose masculine [20]. On estime que la résorption osseuse aboutit à une diminution progressive de l’épaisseur trabéculaire moyenne au cours de la vie mais avec conservation de l’architecture trabéculaire. Dès que des perforations surviennent, elles ont alors des conséquences considérables sur la valeur biomécanique du réseau trabé- culaire.
Avec le développement de la microinformatique, de nouveaux outils de mesure permettant l’analyse tridimensionnelle de l’os sont apparus récemment. Il s’agit de microIRM (rares actuellement) et surtout des microtomographes X (« microscanners » ou microCT) qui permettent une exploration rapide et une quantification 3D des échantillons osseux. Des scanners périphériques sont disponibles chez les petits animaux pour l’analyse in vivo [21] et chez l’homme pour une analyse au niveau du radius et du tibia [22]. Le synchrotron est une technique intéressante mais très limitée part son coût, son accessibilité et la taille réduite des échantillons analysables [23].
Les radiographies standard, effectuées en routine, sont une projection bidimensionnelle (2D) du tissu osseux sur un film argentique ou un capteur numérique. Plusieurs groupes ont essayé d’apprécier les troubles microarchitecturaux de cette façon. Bien que les relations 3D → 2D soient aujourd’hui mal connues, il existe une interdépendance vérifiée en histomorphométrie et en microCT [24, 25]. L’analyse de la texture du réseau trabéculaire sur images radiographiques apparaît comme un moyen intéressant et peu onéreux d’appréciation de la microarchitecture osseuse [26]. Les techniques d’analyse d’images employées sont fondées sur l’étude des longueurs de plages, de l’hétérogénéité et sur des algorithmes s’appuyant sur la géométrie fractale (méthode des gratte-ciel, des couvertures, de Hurst…) La microtomographie (microCT) permet la mesure du volume trabéculaire et des caractéristiques trabéculaires directement en 3D. Elle permet aussi la mesure de nouveaux paramètres : le Structure model index (SMI) est proche de 0 si le réseau trabéculaires est essentiellement composé de plaques, proche de 3 si les piliers sont prépondérants, le degré d’anisotropie, la fréquence de distribution des épaisseurs trabéculaire ainsi que des cavités médullaires. Cependant, la technique n’en est qu’à ses débuts, il n’y a pas encore d’uniformisation des paramètres entre les constructeurs et les algorithmes peuvent être sujets à caution : les algorithmes utilisés pour la mesure des épaisseurs sont très fortement influencés par la forme même des objets mesurés. Les nœuds entraînent une majoration considérable des valeurs d’épaisseur pouvant aboutir à des conclusions erronées [27, 28]. La technique a l’inconvénient de ne fournir aucun renseignement sur les activités cellulaires mais elle a l’avantage de n’être pas destructrice pour les échantillons osseux qui peuvent ainsi être utilisés ensuite en histomorphométrie conventionnelle.
LES ALTÉRATIONS DE LA MICROARCHITECTURE
Au cours du vieillissement
Chez le sujet jeune, le réseau trabéculaire est dense et plexiforme. Au cours du vieillissement physiologique, les travées osseuses s’amincissent en raison d’une dépression ostéoblastique constante. Comme toute cellule conjonctive, l’ostéoblaste voit ses capacités de synthèse de matrice (protéines collagéniques et non collagéniques diminuer). Il existe une conversion progressive des plaques en piliers.
En pathologie tumorale
Nous avons montré qu’elle pouvait permettre un prédiagnostic rapide dans les suspicions de métastases osseuses, dans le myélome ou les gammapathies de signification indéterminée [29]. La microarchitecture est aussi considérablement altérée au cours des métaplasies myéloïdes avec myélofibrose [30].
Chez la femme
À la ménopause, la carence oestrogénique entraîne une augmentation des cytokines (IL-6, IL-7, TNFα. ..) conduisant à une stimulation de l’activité de résorption ostéoclastique [31]. Le nombre de BMU activés devient plus important et les ostéoclastes érodent les travées pendant un temps plus long (inhibition de l’apoptose) [32]. Il s’ensuit des perforations trabéculaires (perforation des plaques ou rupture des piliers) (Figure 3) qui désorganisent l’architecture du réseau 3D [33].
Certains auteurs parlent alors de « killer osteoclasts » (Fig. 3D).
Fig. 3. — A) Relation non linéaire entre paramètres microarchitecturaux dans une série de sujets ostéoporotiques (index d’interconnectivité et strut analysis) B) travée osseuse (pilier) d’épaisseur normale ∼120 μm — microscopie électronique à balayage C) travée fine avec une perforation —microscopie électronique à balayage ; D) deux ostéoclastes (flèches) perforant une travée osseuse, détection histoenzymologique.
Chez l’homme
Chez l’homme, le capital osseux maximum, acquis au début de la troisième décennie, est supérieur d’environ 30 % à celui de la femme, en raison du plus grand diamètre des os. La croissance pré pubertaire, qui conditionne largement la taille des pièces osseuses, est plus longue de 2 ans en moyenne chez l’homme. Le diamètre des os longs et les surfaces vertébrales sont ainsi plus élevés d’environ 20 à 25 % contribuant à une résistance biomécanique accrue. La densitométrie biénergétique montre que la perte osseuse trabéculaire liée à l’âge est identique dans les deux sexes (en dehors de la période ménopausique), tout particulièrement au rachis. L’évolution des os longs est par contre différente : la porosité corticale et la résorption endostéale, communes aux deux sexes, sont moins élevées chez l’homme tandis que l’apposition périostée est au contraire plus forte. La circonférence des os longs, facteur de résistance mécanique, s’accroît avec l’âge chez l’homme (particulièrement au col fémoral). La microarchitecture de l’os cortical est mal connue et des travaux récents ont montré en histomorphométrie qu’à volume osseux égal, les patients fracturés étaient ceux qui avaient une porosité corticale élevée [34].
L’évolution avec l’âge de l’architecture osseuse trabéculaire évaluée par histomorphométrie semble également différente. Les perforations des travées osseuses sont moins fréquentes chez l’homme de sorte que la microarchitecture osseuse serait mieux préservée [35].
Chez l’homme, les facteurs étiologiques qui aboutissent à une ostéoporose sont multiples, intriqués et la démarche diagnostique est plus complexe que chez la femme. L’étude de la microarchitecture osseuse a apporté des données importantes à la connaissance de la physiopathologie. Au cours de l’ostéoporose primitive ou secondaire, il existe une réduction marquée du volume trabéculaire osseux, de l’épaisseur et du nombre des travées mais surtout une très franche désorganisation de la microarchitecture trabéculaire : diminution du nombre de nœuds (sur la strut analysis), augmentation du nombre d’extrémités libres (travées osseuses non reliées au reste du réseau), majoration de l’ICI, et du star volume des espaces médullaires.
Une élévation importante et brutale des indices architecturaux, qui traduit l’apparition d’une désorganisation du réseau trabéculaire, survient lorsque le volume trabéculaire osseux devient inférieur à 11 % ou l’épaisseur des travées inférieure à 70 microns (Fig 3D) [36]. Une étude par régression logistique récente, réalisée chez 108 hommes ostéoporotiques a permis de confirmer que le risque relatif de fractures vertébrales était fortement influencé par la qualité de la microarchitecture osseuse [20]. Selon les facteurs étiologiques, les anomalies microarchitecturales du réseau trabéculaire sont différentes [37]. Dans l’ostéoporose masculine, l’effet des facteurs de risque est additif sur la microarchitecture osseuse : un sujet présentant un hypogonadisme ET un éthylisme aura une microarchitecture plus altérée qu’un sujet ne présentant qu’un facteur de risque et son risque fracturaire sera aussi plus élevé [27].
CONCLUSION
La microarchitecture osseuse est un facteur important de la qualité du tissu osseux.
C’est le premier facteur identifié et son importance s’est rapidement imposée.
Malheureusement, peu d’outils cliniques permettent de la mesurer par des méthodes non invasives. Elle est altérée très précocément au cours des maladies osseuses avant qu’un retentissement sur la masse osseuse ne soit détectable. Les autres facteurs de la qualité osseuse (hétérogénéité de la minéralisation, propriétés biomé- caniques à l’échelon nanométrique, taille des cristaux d’hydroxyapatite, microarchitecture de l’os cortical…) vont correspondre à des champs de recherche nouveaux, d’autant que les thérapeutiques actuelles peuvent modifier certains d’entre eux.
BIBLIOGRAPHIE [1] Anonymous. — Consensus development conference. Prophylaxis and treatment of osteoporosis. Am. J. Med. 1993, 94 , 646-650.
[2] Frost H.M. — Some ABCs of skeletal pathophysiology. III: Bone balance and the delta B.BMU. Calcif. Tissue Int. 1989, 45 , 131-133.
[3] Frost H.M. — Bone ‘‘ mass ’’ and the ‘‘ mechanostat ’’: a proposal.
Anat. Rec. 1987, 219 , 1-9.
[4] Frost H.M. — Skeletal structural adaptations to mechanical usage (SATMU): 2. Redefining Wolff’s law: the remodeling problem. Anat. Rec. 1990, 226 , 414-422.
[5] Parfitt A.M., Matthews C.H.E., Villanueva A.R. , et al. — Relationships between surface, volume and thickness of iliac trabecular bone in aging and in osteoporosis. Implications for the microanatomic and cellular mechanisms of bone loss. J Clin Invest 1983, 72 , 1396-1409.
[6] Parfitt A.M., Drezner M.K., Glorieux F.G. , et al. — Bone histomorphometry: standardization of nomenclature, symbols, and units. Report of the ASBMR Histomorphometry Nomenclature Committee. J. Bone Miner. Res. 1987, 2 , 595-610.
[7] Hahn M., Vogel M., Pompesius-Kempa M. , et al. — Trabecular bone pattern factor — A new parameter for simple quantification of bone microarchitecture.
Bone 1992, 13 , 327-330.
[8] Le H.M., Holmes R.E., Shors E. , et al. — Computerized quantitative analysis of the interconnectivity of porous biomaterials.
Acta Stereologica 1992, 11S1 , 267-272.
[9] Compston J.E. — Connectivity of cancellous bone: Assessment and mechanical implications.
Bone 1994, 15 , 463-466.
[10] Dempster D.W. — Bone histomorphometry in glucocorticoid-induced osteoporosis.
J. Bone
Miner. Res. 1989, 4 , 137-141.
[11] Levitz P., Tchoubar D. — Disordered porous solids: from chord distributions to small angle scattering. Journal de Physique — France 1992, 2 , 771-790.
[12] Vesterby A. — Star volume in bone research: a histomorphometric analysis of trabecular bone structure using vertical sections. Anat. Rec. 1993, 235 , 325-334.
[13] Tabor Z. — Analysis of the influence of image resolution on the discriminating power of trabecular bone architectural parameters. Bone 2004, 34 , 170-179.
[14] Fazzalari N.L., Parkinson I.H. — Fractal dimension and architecture of trabecular bone.
J.
Pathol. 1996, 178 , 100-105.
[15] Chappard D., Legrand E., Haettich B. , et al. — Fractal dimension of trabecular bone:
comparison of three histomorphometric computed techniques for measuring the architectural two-dimensional complexity. J. Pathol. 2001, 195 , 515-521.
[16] Chappard D., Legrand E., Pascaretti C. , et al. — Comparison of eight histomophometric methods for measuring trabecular bone architecture by image analysis on histological sections.
Microsc. Res. Tech. 1999, 45 , 303-312.
[17] Chappard D., Alexandre C., Riffat G. — Spatial distribution of trabeculae in iliac bone from 145 osteoporotic females. Acta Anat. 1988, 132 , 137-142.
[18] Libouban H., Moreau M.F., Legrand E. , et al. — Comparison of histomorphometric descriptors of bone architecture with dual-energy X-ray absorptiometry for assessing bone loss in the orchidectomized rat. Osteoporos Int 2002, 13 , 422-428.
[19] Meunier P.J., Courpron P., Edouard C. , et al. — Physiological senile involution and pathological rarefaction of bone. Quantitative and comparative histological data.
Br. Med. J.
1973, 2 , 239-256.
[20] Legrand E., Chappard D., Pascaretti C. , et al. — Trabecular bone microarchitecture, bone mineral density and vertebral fractures in male osteoporosis.
J. Bone Miner. Res. 2000, 15 , 13-19.
[21] Waarsing J.H., Day J.S., Van Der Linden J.C. , et al. — Detecting and tracking local changes in the tibiae of individual rats: a novel method to analyse longitudinal in vivo micro-CT data.
Bone 2004, 34 , 163-169.
[22] Sornay-Rendu E., Boutroy S., Munoz F. , et al. — Alterations of cortical and trabecular architecture are associated with fractures in postmenopausal women, partially independent of decreased BMD measured by DXA: the Ofely study. J. Bone Miner. Res. 2007, 22 , 425-433.
[23] Peyrin F., Muller C., Carillon Y. , et al. — Synchrotron radiation microCT: a reference tool for the characterization of bone samples.
Adv. Exp. Med. Biol. 2001, 496 , 129-142.
[24] Chappard D., Guggenbuhl P., Legrand E. , et al. — Texture analysis of X-ray radiographs is correlated with bone histomorphometry.
J. Bone Miner. Metab. 2005, 23 , 24-29.
[25] Guggenbuhl P., Bodic F., Hamel L. , et al. — Texture analysis of X-ray radiographs of iliac bone is correlated with bone micro-CT.
Osteoporos Int 2006, 17 , 447-454.
[26] Lespessailles E., Chappard C., Bonnet N. , et al. — Imaging techniques for evaluating bone microarchitecture.
Joint Bone Spine 2006, 73 , 254-261.
[27] Chappard D., Josselin N., Rouge-Maillart C. , et al. — Bone microarchitecture in males with corticosteroid-induced osteoporosis.
Osteoporos Int 2007, 18 , 487-494.
[28] Chappard D., Retailleau-Gaborit N., Legrand E. , et al. — Comparison insight bone measurements by histomorphometry and microCT.
J. Bone Miner. Res. 2005, 20 , 1177-1184.
[29] Chappard D., Libouban H., Legrand E. , et al. — Computed microtomography of bone specimens for rapid analysis of bone changes associated with malignancy.
Anat. Rec. 2010, 293 , 1125-1133.
[30] Schmidt A., Blanchet O., Dib M. , et al. — Bone changes in myelofibrosis with myeloid metaplasia: a histomorphometric and microcomputed tomographic study.
Eur. J. Haematol.
2007, 78 , 500-509.
[31] Cohen-Solal M.E., Boitte F., Bernard-Poenaru O. , et al. — Increased bone resorbing activity of peripheral monocyte culture supernatants in elderly women.
J. Clin. Endocrinol.
Metab. 1998, 83 , 1687-1690.
[32] Hernandez C.J., Beaupré G.S., Carter D.R. — A theoretical analysis of the changes in basic multicellular unit activity at menopause. Bone 2003, 32 , 357-363.
[33] Kleerekoper M., Villanueva A.R., Stanciu J. , et al. — The role of three dimensional trabecular microstructure in the pathogenesis of vertebral compression fractures.
Calcif. Tissue Int. 1985, 37 , 594-597.
[34] Ostertag A., Cohen-Solal M., Audran M. , et al. — Vertebral fractures are associated with increased cortical porosity in iliac crest bone biopsy of men with idiopathic osteoporosis.
Bone 2009, 44 , 413-417.
[35] Mosekilde L. — Sex differences in age-related loss of vertebral trabecular bone mass and structure-biomechanical consequences. Bone 1989, 10 , 425-432.
[36] Chappard D., Legrand E., Basle M.F. , et al. — Altered trabecular architecture induced by corticosteroids: a bone histomorphometric study.
J. Bone Miner. Res. 1996, 11 , 676-685.
[37] Audran M., Chappard D., Legrand E. , et al. — Bone microarchitecture and bone fragility in men: DXA and histomorphometry in humans and in the orchidectomized rat model.
Calcif.
Tissue Int. 2001, 69 , 214-217.
DISCUSSION
M. Patrice QUENEAU
Dans l’ostéoporose cortisonique, qu’observez-vous, en fonction de l’importance du traitement (posologie, durée…) et quelle est la reversibilité de ces anomalies après arrêt de la corticothérapie ?
Dans la littérature, l’ostéoporose de la maladie de Cushing est décrite comme pouvant être réversible. Dans l’ostéoporose cortisonique, peu de travaux ont pu être faits en histomorphométrie chez l’homme au cours du premier temps d’évolution de la maladie.
Nous avons montré en histomorphométrie que survenait un amincissement des travées osseuses puis les perforations sont observées dès lors que l’épaisseur trabéculaire devient inférieure à 70 μm. Cependant, les études animales permettent d’envisager qu’au cours de la première phase de l’affection, lors de la phase de perte osseuse rapide, une augmentation de l’activité de résorption, couplée à une dépression de l’activité ostéoblastique, survient en raison d’une action directe des glucocorticoïdes sur les ostéoclastes.
M. Jacques-Louis BINET
Chez l’homme, vous pouvez étudier la microarchitecture que vous nous avez décrite. Dans quelles maladies demandez-vous cette biopsie et où la pratiquez-vous ? La nouvelle imagerie radiologique permet-elle d’observer les mêmes phénomènes ?
Chez l’homme, la microarchitecture osseuse peut être étudiée dans de nombreuses affections ; nous avons pu l’étudier dans les métaplasies myéloïdes avec myélofibrose, au cours du myélome, de la maladie de Waldenström, des MGUS (gammapathies de signification indéterminées) ainsi que des métastases osseuses lytiques, condensantes ou mixtes. D’autres anomalies architecturales ont été décrites dans l’hyperparathyroïdie primitive, dans la maladie osseuse de Paget. A l’heure actuelle, de nouveaux microtomographes X dédiés (pQCT-Peripheral Quantitative computed tomography) permettent de mesurer et de visualiser la microarchitecture de l’extrémité distale du radius et du tibia.
Cette technique permet une analyse in vivo des anomalies microarchitecturales. Cepen- dant, les micro-scanners de haute précision n’ont encore qu’une résolution de l’ordre de 82 μm par pixel ce qui est très largement supérieur à l’épaisseur que peuvent prendre certaines travées dans l’ostéoporose. Il y a donc un abord imparfait des anomalies microarchitecturales avec ces techniques mais ces nouvelles technologies sont en passe de se développer ainsi que des technologies par micro IRM dédiée.
M. Gérard MILHAUD
Avez-vous des informations relatives à l’effet du traitement de l’ostéoporose par des doses élevées de fluor sur la microarchitecture de l’os ?
Il existe peu de données sur les anomalies de la microarchitecture au cours des fluoroses osseuses. Nous avons une série personnelle d’environ cinq à six cas de fluorose iatrogène ou due à une intoxication par l’eau de Vichy Saint Yorre associées à une condensation. En ce qui concerne les traitements fluorés (qui n’ont plus à l’heure actuelle l’AMM), les anomalies sont souvent à type de foyer de mini remodelage et se présentent sous forme de petites appositions à la surface des travées pré-existantes.
M. Pierre JOUANNET
Quelles sont les modifications de microstructure osseuse induite par l’hyperandrogénie et notamment en cas d’utilisation d’anabolisant à haute dose ?
La plupart des études ont porté sur les effets de l’hypo-androgénie sur le tissu osseux et montrent la survenue de perforations trabéculaires. Il serait effectivement tout à fait intéressant de regarder quels sont les effets de l’hyper-androgénie sur la microarchitecture osseuse en particulier chez les athlètes pouvant s’être soumis à des prises importantes d’androgènes. Cependant, dans la littérature, nous n’avons pu trouver de référence sur ce sujet. On sait cependant, le rôle important des androgènes sur la stimulation de la croissance de l’os sous-périosté et l’augmentation progressive du diamètre des pièces squelettiques en fonction de l’âge lié à ce facteur.
Bull. Acad. Natle Méd., 2010, 194, no 8, 1469-1481, séance du 16 novembre 2010



