Résumé
La chirurgie coronaire à thorax fermé et à cœur battant est théoriquement réalisable par des techniques thoracoscopiques grâce à l’utilisation d’un télémanipulateur chirurgical, commandé à distance par l’opérateur. Cet objectif ultime, attendu par les patients, ne peut être atteint que par étapes successives. L’analyse de l’expérience acquise chez les 20 premiers malades opérés avec l’aide du système fait l’objet de ce rapport. Chez dix-neuf malades, la dissection de l’artère mammaire interne a été conduite à thorax fermé, dans d’excellentes conditions : sans saignement aucun et sans spasme de l’artère. L’anastomose de l’artère mammaire interne sur l’artère interventriculaire antérieure a pu être réalisée selon cette nouvelle technique chez 6 malades, chez 3 patients l’anastomose d’un greffon veineux sur une artère diagonale a été réalisée avec le télémanipulateur. Cette expérience initiale démontre la qualité du geste réalisé, tant au niveau de la dissection que de l’anastomose vasculaire, mais aussi les problèmes à surmonter pour que l’intervention soit réalisable, dans son intégralité, de façon reproductible, à thorax fermé et à cœur battant.
Summary
Routine totally endoscopic, beating heart, coronary surgery should be made possible by the use of computer enhanced surgical techniques. It includes a totally endoscopic mammary artery harvesting, a correct exposure and an adequate stabilization of the coronary artery at the anastomotic site, a perfect anastomosis of the mammary artery on the left anterior descending coronary artery using a microsurgical suture technique. This complex surgical * Correspondant de l’Académie nationale de médecine.
CNRS. UPRES-A 7054 « Thérapeutiques Substitutives du Cœur et des Vaisseaux » Association Claude Bernard « Centre de Recherche des Transplantations Cardiaques ».
Service de Chirurgie Thoracique et Cardiovasculaire, Hôpital Henri Mondor, 51 avenue du Maréchal de Lattre de Tassigny — 94010 Creteil cedex. Tél. 01 49 81 35 53 — e-mail :
loisance@univ-paris12.fr .
Tirés-à-part : Professeur Daniel LOISANCE, à l’adresse ci-dessus.
Article reçu le 19 décembre 2000, accepté le 19 mars 2001.
protocol will be reached by a step by step approach. The first 20 patients who accepted to be operated with tele-manipulated instruments make the substance of this first report. In 19 cases, the dissection of the internal mammary artery could be performed with an optimal result : the lack of bleeding during the dissection emphasizes the excellent visualization of the operative field and the precision of the dissection. The satisfactory blood flow in the mammary artery at the time of the coronary anastomosis suggests the lack of spasm and confirms the atraumatic dissection. The distal anastomosis of the coronary bypass has been performed through a mid line sternotomy to avoid an excessive prolongation of the operative time. The anatomic conditions and the quality of the vessel wall allowed to perform the coronary anastomosis with the tele-manipulated instruments in nine cases only : in six patients, the mammary artery has been implanted on the descending artery, in three, a venous autograft on the diagonal branch. Our initial clinical experience with this new technique suggests that a very precise and fine surgery can be performed with an acceptable prolongation of the operative time. More experience and further developments in the instrumentation are nevertheless required to allow completion of the entire procedure totally closed chest, on a beating heart.
INTRODUCTION
La chirurgie cardiaque connaît actuellement une évolution très importante : les techniques utilisées depuis 20 ans, parfaitement évaluées et qui ont très largement fait la preuve de leur efficacité, au prix de risques acceptables, sont remises en cause.
Sous la pression croissante des malades, qui recherchent des procédures endovasculaires (dilatation, stent) ou endoscopiques permettant à un moindre coût un résultat comparable, sous, aussi, la pression du monde industriel, qui souhaite ouvrir de nouveaux marchés, de nouvelles techniques opératoires sont actuellement proposées : chirurgie coronaire à thorax ouvert, à cœur battant, évitant les problèmes propres à la circulation extracorporelle (CEC), chirurgie coronaire et valvulaire par des voies d’abord réduites ou par thoracoscopie [1, 2].
Le développement de télémanipulateurs chirurgicaux, improprement appelés robots, intervient dans le contexte. L’acte opératoire peut être réalisé par des instruments endothoraciques, introduits par des trocarts, télémanipulés par le chirurgien, à distance [3]. Le Service a pu s’équiper, au printemps 2000, du système de Vinci (Intuitive Surgical) afin de permettre à notre groupe de participer à la mise au point de nouvelles techniques opératoires moins invasives, notamment la chirurgie coronaire sans CEC et à thorax fermé.
LES ÉQUIPEMENTS
Le système de Vinci (Intuitive Surgical) comprend trois composants : le télémanipulateur (Fig. 1 et 2), au contact du patient, muni d’un thoracoscope à deux canaux,

permettant la reconstruction tridimensionnelle des vues endothoraciques et de deux bras articulés porteurs de longues tiges thoraciques munies à leur extrémité d’une rotule elle-même porteuse des instruments (pince, ciseaux, bistouri électrique …) ; la console chirurgien (Fig. 3), connectée par des câbles d’une vingtaine de mètres au télémanipulateur, qui comprend l’écran de visualisation (Fig. 4) et où intervient la commande des instruments ; un ordinateur à très haute performance, qui analyse les mouvements des doigts du chirurgien et impose le déplacement des bras articulés porteurs des instruments. La caractéristique essentielle du dispositif est la rapidité de la transmission des ordres donnés par les doigts du chirurgien, quasi instantanée, la précision de l’action des instruments et leur extrême liberté de mouvements.
Les équipements ancillaires comprennent les équipements standards de toute intervention thoracoscopique, les sources de lumière froide, l’insufflateur de CO , le 2 bistouri électrique, les enregistreurs vidéo numériques, l’échocardiographe et la sonde oesophagienne. La totalité des vues opératoires recueillies par la caméra thoracique est archivée sur disque informatique.
PROTOCOLE OPÉRATOIRE
L’anesthésie générale est obtenue par propofol, sufentanyl et curare intraveineux et ne diffère pas du protocole standard du service. L’intubation trachéale est également réalisée de façon routinière, la sonde de Carlens, permettant l’exclusion d’un poumon, étant rapidement apparue inutile. Les éléments de la surveillance sont constitués d’un cathéter artériel radial, d’une sonde à thermodilution de Swan Ganz, d’un cathéter à multiples voies, type Cordis, jugulaire droit, d’une sonde urinaire.
Le malade est placé en décubitus dorsal. Un billot permet une légère surélévation de l’hémi-thorax gauche. Un trocart est placé dans le 4ème espace intercostal gauche, sur la ligne axillaire médiane. Le pneumothorax est réalisé avec un débit de 11/min de CO avec une surveillance attentive des pressions artérielles et pulmonaires, de la 2 saturation artérielle en oxygène. La caméra de Vinci est introduite, permettant l’exploration de la cavité pleurale gauche. Sous contrôle visuel par la caméra (optique à 30°, vers le haut), les trocarts permettant l’accès intrathoracique aux instruments sont placés dans le 3ème et le 5ème espace intercostal, sur la ligne médioclaviculaire.
La dissection de l’artère mammaire interne est réalisée au bistouri électrique bipolaire (Fig. 5). Les artères intercostales de petite taille sont coagulées, celles plus importantes sont sectionnées entre deux clips. Ceci impose le retrait du bistouri électrique, puis l’introduction successivement de 2 clips vasculaires portés par une pince adéquate, enfin le passage du ciseau pour la section. La réintroduction du bistouri électrique permet alors la poursuite de la dissection. Celle-ci est entreprise en regard du 2ème espace intercostal (EIC), au niveau du croisement de la veine mammaire interne, et poursuivie vers l’aval, jusqu’en regard du 7ème EIC, au-delà de la division du vaisseau en ses branches terminales. La dissection s’achève à l’origine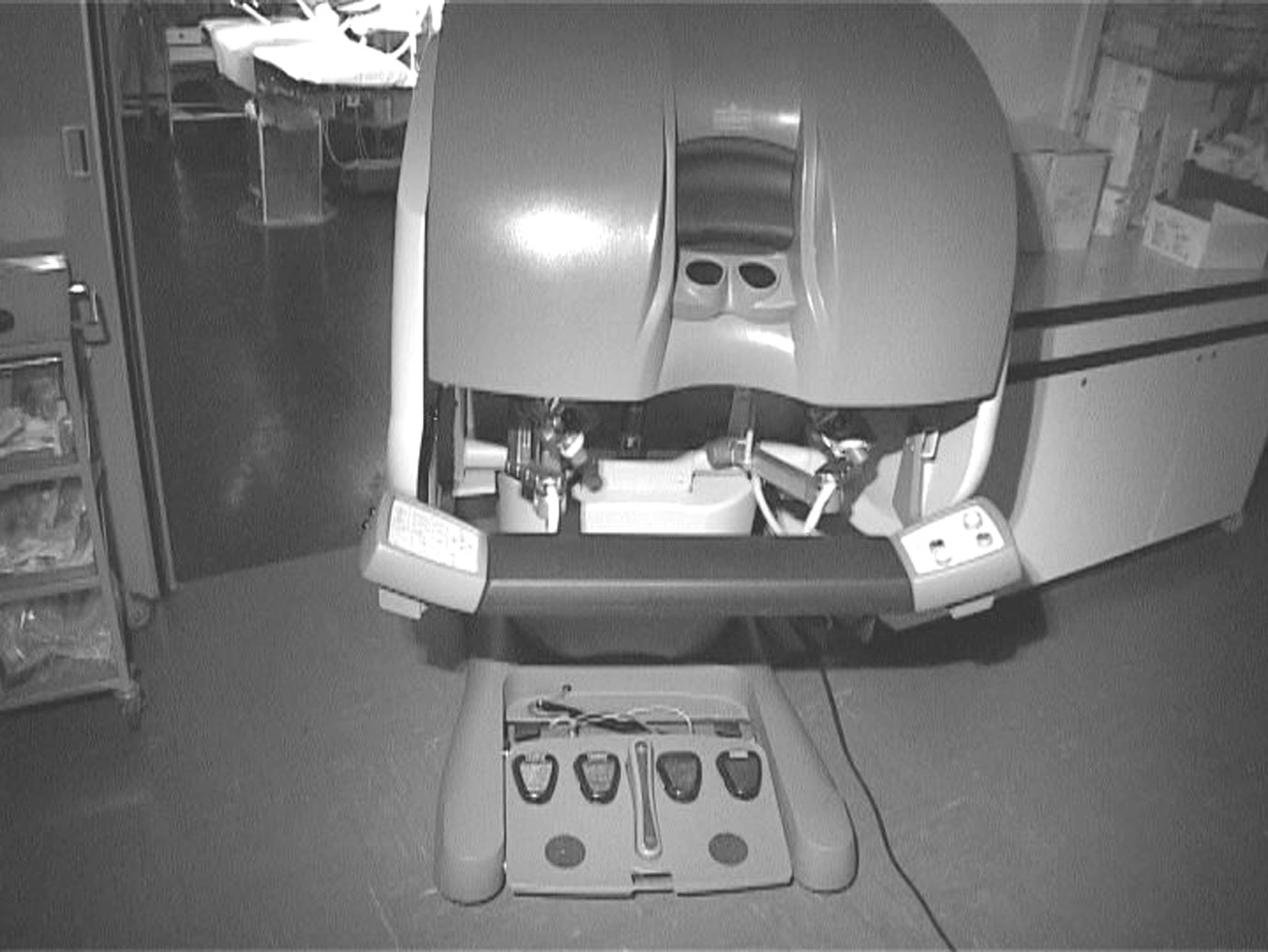

du vaisseau : le nerf phrénique gauche est visualisé, les deux premières artères intercostales sont clipées et sectionnées. Au terme de la dissection du pédicule mammaire, l’artère mammaire interne elle-même est disséquée, au plus près, dans le segment qui sera sectionné, puis mobilisé vers l’artère coronaire à ponter.
La rotation à 180° de l’optique sur son axe permet de passer au second temps de l’intervention : ouverture du péricarde longitudinale, du médiastin supérieur en haut au diaphragme en bas. Le massif cardiaque tend alors à basculer sur son axe vers la gauche et le plan postérieur, facilitant l’exposition de l’artère interventriculaire antérieure (IVA), agrandissant l’espace rétrosternal. Le site du pontage est repéré. Un trocart accessoire est placé, antérieurement, permettant l’accès des matériels de suture.
L’intervention peut se poursuivre de trois manières différentes selon les difficultés opératoires et le programme de revascularisation fixé :
— soit après sternotomie médiane, sous CEC et après clampage aortique, les anastomoses elles-mêmes sont réalisées à l’aide du télémanipulateur. Cette technique est préférée chez les patients devant recevoir de multiples pontages coronaires ;
— soit à thorax fermé, cœur arrêté après mise en place d’une circulation extracorporelle par les vaisseaux fémoraux et introduction d’un endo-clamp aortique (Heartport). Cette technique est utilisée lorsque les vaisseaux fémoraux autorisent l’introduction des canules ;
— soit à thorax fermé, cœur battant, utilisant alors un stabilisateur coronaire.
Celui-ci est introduit par une mini-voie d’abord sous et rétroxyphoïdienne. Deux types de stabilisateurs mécaniques sont utilisables, le stabilisateur Intuitive Surgical, le Donaught® (Medivas). Cette technique est réservée aux patients chez qui seul un pontage IVA est nécessaire.
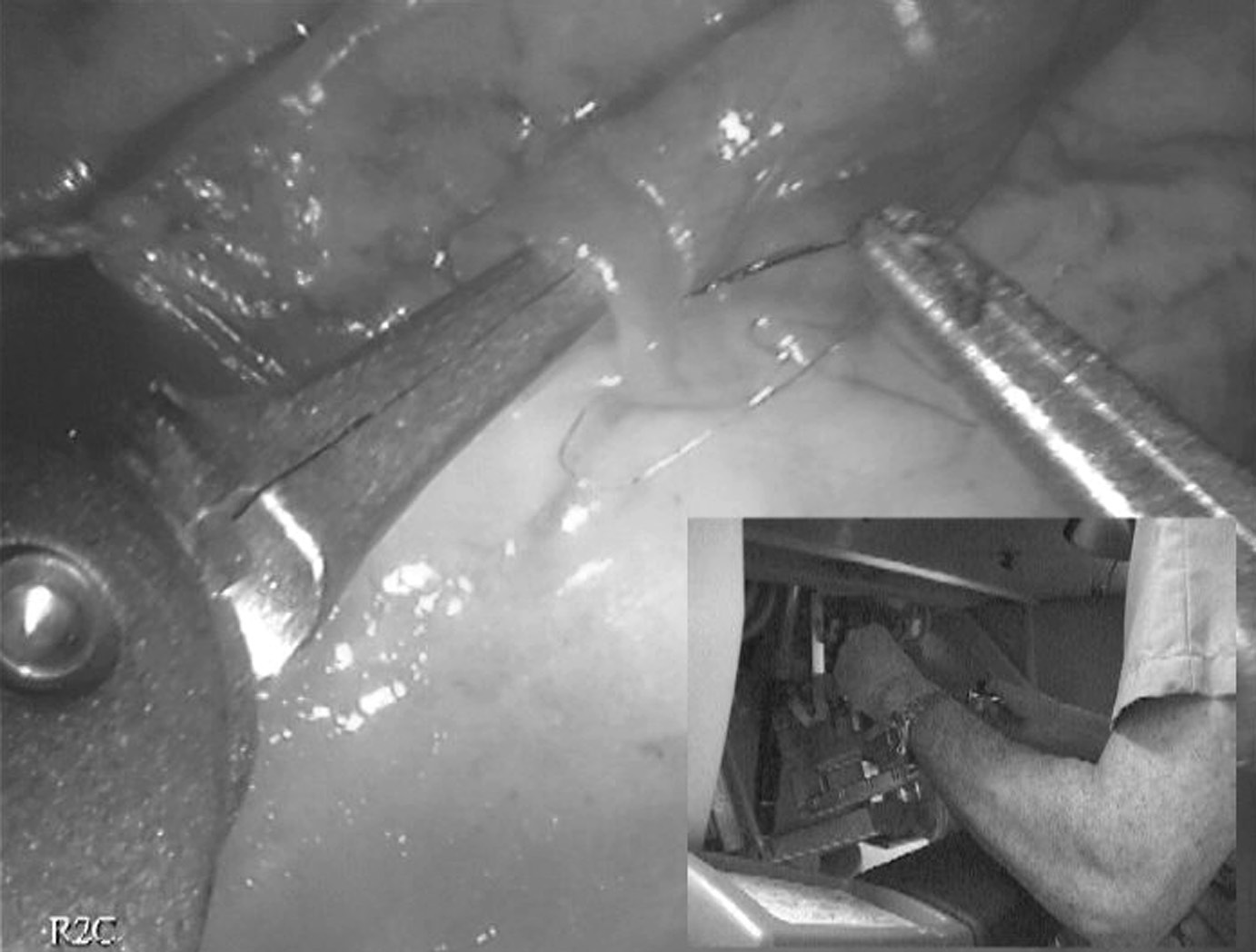
L’anastomose coronaire elle-même est toujours réalisée selon la technique standard utilisée dans le service : un surjet continu de fil monobrin Prolène 9/0, monté sur des aiguilles souples de 5 mm, pour l’anastomose de l’artère mammaire sur l’ IVA, un surjet de Prolène 8/0 quand le greffon utilisé pour le pontage est un greffon veineux (Fig. 6).
PROTOCOLE D’ÉTUDE
Après la phase d’acquisition de la maîtrise du système, réalisée sur modèles in vitro (suture terminolatérale sur segments d’artère mammaire interne humaine conservée, pontages mammaire IVA sur cœur de veau conservé, placé dans une enceinte fermée), l’évaluation des possibilités du système est réalisée selon le protocole suivant : les malades, dûment informés, sont sélectionnés, en fonction des facteurs de risque prédictif et du programme opératoire fixé lors de la discussion médicochirurgicale. Seuls les malades ne présentant pas de facteurs de risque important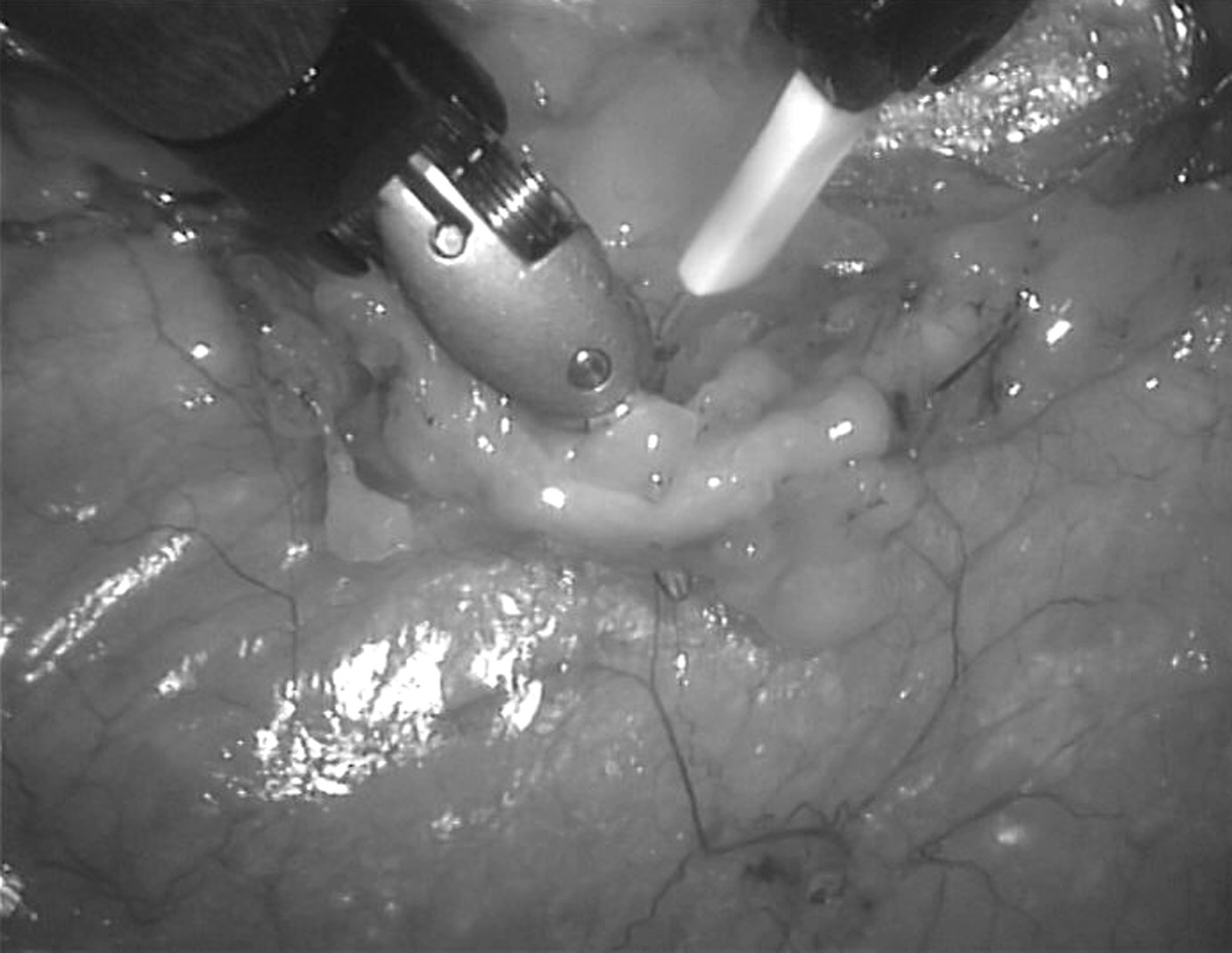
(dysfonction ventriculaire gauche sévère, maladie polyartérielle, bronchopathie chronique sévère….) sont retenus.
RÉSULTATS
L’étude inclut les 20 premiers patients coronariens ayant bénéficié de la technique.
L’âge moyen est de 52 ans ; tous sont du sexe masculin, 12 ont moins de 60 ans. Tous sont opérés pour angor stable. Tous présentent une fonction ventriculaire normale ou peu altérée (fraction d’éjection du ventricule gauche > 40 %). Les lésions coronaires sont monotronculaires, intéressant l’IVA chez 3 patients, bitronculaires (droite et IVA) chez 1 patient, tritronculaires chez 16 patients, 5 d’entre eux présentant en outre des lésions significatives du tronc commun. Cette population diffère très sensiblement de la population générale des coronariens opérés dans le service, par un âge plus jeune, par un moindre nombre de vaisseaux lésés, par une fonction ventriculaire meilleure.
Dissection de l’artère mammaire interne
Elle est menée à son terme dans de bonnes conditions chez 19 malades. Chez un malade, la dissection de l’artère mammaire interne n’a pas pu être réalisée du fait de conflits, à l’intérieur du thorax, entre les 2 bras supports des instruments. La morphologie atypique du thorax ainsi que le placement des orifices des trocarts peuvent expliquer cette complication. Chez les autres malades, le temps moyen de dissection est de 45 minutes [25-65] significativement plus long qu’avec la technique classique (20 minutes). Dans tous les cas, le greffon mammaire est, en fin d’intervention, de bonne qualité, indemne de spasme ou de lésions pariétales. La qualité de l’hémostase, et notamment celle des branches intercostales, est constamment satisfaisante sauf chez deux patients, chez qui la mise en place des clips hémostatiques s’est avérée nécessaire, après la sternotomie. Le saignement lors de la dissection est nul chez 17 malades, réduit à quelques millilitres chez 3, alors lié à une section non contrôlée d’une artère intercostale et alors contrôlée en moins de 3 minutes par la mise en place de clips.
Les anastomoses coronaires
Elles ont, dans cette expérience initiale, toujours été réalisées après sternotomie médiane. En effet, les 3 seuls patients ayant une indication de pontage unique sur l’IVA présentaient des lésions artérielles périphériques, rendant risquée la mise en place d’une CEC périphérique. Par ailleurs, la maîtrise insuffisante du stabilisateur mécanique a fait préférer la sternotomie. Chez les 17 autres malades, le nombre important de pontages à réaliser justifiait la sternotomie.
L’intervention est poursuivie à cœur battant chez 2 patients dont les lésions imposent seulement un pontage unique mammaire IVA ou un double pontage antérieur
(IVA-diagonale). Chez les 18 autres, l’intervention est réalisée sous CEC, avec clampage aortique et arrêt cardioplégique.
La moyenne des pontages réalisés par patient est de 2,9 [1-5]. Le pontage est unique (3 cas), double (5 cas), triple (6 cas), quadruple (5 cas), quintuple (1 cas). Tous les patients reçoivent un pontage mammaire sur l’IVA. Les pontages complémentaires utilisent l’artère mammaire interne droite (1 fois), les greffons veineux saphène autologues dans tous les autres cas. L’anastomose de l’artère mammaire interne à l’IVA n’a été réalisée avec le télémanipulateur que chez 6 patients, et ce pour diverses raisons : trois fois l’IVA présente un trajet intramyocardique ou des parois trop athéromateuses ; onze fois le nombre de pontages à réaliser est trop important pour autoriser une anastomose assistée par ordinateur, qui prend plus de temps, et maintenir la durée du clampage aortique inférieur à 120 minutes. Une anastomose veineuse sur l’artère diagonale a été également réalisée avec l’aide du télémanipulateur, chez trois patients.
Dans ces conditions, la durée du clampage aortique est de 104 minutes (25-157) chez les patients recevant des anastomoses conventionnelles. Chez les 9 patients, chez qui une suture est réalisée avec la machine, la durée est de 86 minutes. Les temps de CEC sont identiques dans les deux groupes : 159 minutes (71-259) et de 159 minutes (59-180).
Suites opératoires
Aucun patient ne présente, dans la période postopératoire, de complication sévère tel un décès, un infarctus du myocarde. Treize patients ne présentent aucune complication au cours de leur séjour en réanimation et dans le service. Quatre présentent une fibrillation auriculaire transitoire. Un patient présente une hémorragie digestive due à un ulcère du bulbe, traitée chirurgicalement avec succès. Un patient présente une infection pulmonaire à évolution favorable. Enfin, une infection sternale est observée, traitée avec succès par reprise chirurgicale, parage des lésions et aspiration prolongée par micro drains de Redon.
La durée de séjour en réanimation est de 3,9 jours (3-16 jours), non différente de celle observée pour l’ensemble des opérés du service en 1999 (3,9 jours) ou chez les coronariens opérés en 2000 (3,1 jours), dans la même période de temps que cette étude.
DISCUSSION
Aucune des techniques actuellement utilisées pour réaliser une intervention coronaire moins invasive que la chirurgie coronaire conventionnelle n’atteint véritablement l’objectif idéal souhaité par les malades : une revascularisation chirurgicale complète, durable, utilisant des greffons artériels, réalisée sans CEC, donc à cœur battant, sans ouverture du thorax.
En effet, la chirurgie à cœur battant actuellement pratiquée, si elle évite les problè- mes liés à la CEC (l’activation de l’inflammation et son cortège de manifestations cliniques) et au clampage aortique (l’embolisation cérébrale des débris athéromateux) n’est véritablement sûre et reproductible que si elle est pratiquée après une sternotomie complète. Les tentatives d’abord direct de la coronaire par une thoracotomie limitée ont en effet révélé un risque élevé de dysfonction du greffon mammaire IVA, conséquence de la médiocre exposition des lésions et des difficultés techniques de l’anastomose elle-même. L’utilisation de la CEC périphérique et de l’endo-clamp aortique (Heartport), si elle permet une CEC moins agressive et un arrêt cardiaque dans de bonnes conditions, ne règle pas la difficulté d’exposition et de gestes chirurgicaux précis à travers des trocarts, à la pointe de longs instruments.
Les tentatives de suture coronaire à l’aide d’instruments thoracoscopiques se sont en effet soldées par des échecs et en aucun cas la technique n’apparaît reproductible.
L’utilisation d’instruments endothoraciques, couplée à une reconstruction tridimensionnelle de l’image du champ opératoire, constitue donc la solution conceptuellement la plus élégante. Deux stratégies sont alors envisageables selon les lésions et le programme opératoire :
— le pontage mammaire-IVA à cœur battant chez le patient monotronculaire, couplé à la dilatation des autres lésions coronaires chez le patient tritronculaire ;
— les pontages multiples réalisés sous CEC périphérique chez le patient tritronculaire.
Les difficultés à résoudre pour atteindre cet objectif sont importantes [4, 5]. Elles tiennent à la maîtrise de la chirurgie assistée par ordinateur par tous les intervenants : les panseuses dont la technicité de la tâche devient plus importante ; l’anesthésiste qui doit maîtriser les risques liés à une procédure thoracoscopique (risque d’hypoventilation) et dont le rôle devient encore plus important lorsqu’une CEC périphérique est utilisée ; le chirurgien qui doit non pas adapter sa technique aux contraintes du télémanipulateur (risque d’une technique opératoire grossière) mais imposer à la machine une technique qui a été reconnue comme étant optimale, telle la microchirurgie vasculaire.
La deuxième difficulté est liée à l’allongement prévisible du temps opératoire.
Malgré une expérience croissante, l’habillage du robot, la mise en place de trocarts, les temps de dissection ou de suture vasculaire apparaissent significativement plus longs que lors d’interventions conventionnelles [5, 6]. Cependant, le caractère peu agressif de ces gestes, l’absence de saignement compensent à l’évidence ce problème, dont l’ampleur s’estompera par le développement de l’expérience. Il n’en reste pas moins vrai que l’addition de temps opératoires plus longs est un souci réel, qui a justifié notre prudence et une approche très progressive de l’objectif final optimal.
La troisième difficulté est liée aux conditions anatomiques et aux limites actuelles de la technique. La dissection mammaire impose l’exclusion du poumon gauche, ce qui
peut poser problème chez le coronarien présentant aussi une bronchopathie chronique obstructive. La réalisation de la suture sur un vaisseau difficilement accessible car enfoui dans le muscle, aux parois athéromateuses paraît, aujourd’hui, comporter avec le télémanipulateur un risque particulier que nous avons préféré à ce jour éviter. L’absence de sensation tactile, notamment de perception de la force exercée en pointe d’instrument, les insuffisances actuelles de l’instrumentation paraissent gêner la réalisation d’anastomoses difficiles comme celles portant sur des vaisseaux fragiles, aux parois anormalement indurées, voire calcifiées, difficiles à pénétrer par l’aiguille. Il faut souligner à cette occasion que, comme dans la plupart des techniques endoscopiques, l’opérateur intervient seul, ce qui pose un problème délicat notamment pour l’exposition du champ opératoire et la mise en tension du surjet vasculaire. Cette observation souligne l’intérêt des recherches sur les techniques alternatives à la suture classique pour la réalisation des anastomoses vasculaires.
La réalisation du programme idéal, le pontage totalement endoscopique à cœur battant, s’il a pu être réalisé de façon anecdotique [5-7] reste donc un challenge technique difficile à maîtriser, les stabilisateurs mécaniques actuellement disponibles pour cet usage étant peu satisfaisants. Néanmoins, le progrès de ce type d’instrumentation n’est pas hors d’atteinte et cet obstacle devrait pouvoir être rapidement surmonté [8].
Au total, les premières applications du système en clinique humaine nous apparaissent très prometteuses. Elles montrent bien les difficultés actuelles, temps opératoire allongé, difficultés d’une chirurgie très précise du fait de la taille excessive des instruments et de l’absence de sensation tactile. Elles identifient bien les voies du progrès : une plus grande maîtrise de l’instrumentation par une utilisation plus routinière, une plus grande finesse des instruments, un stabilisateur coronaire mieux adapté, la réalisation de pontages coronaires à cœur battant. Elles invitent aussi à une évaluation rigoureuse de procédures hybrides, couplant le pontage artériel IVA, réalisé avec le télémanipulateur à thorax fermé, à une dilatation des vaisseaux secondaires (coronaires droites, artères diagonales et marginales) réalisée dans le même temps anesthésique.
REMERCIEMENTS
L’auteur adresse ses remerciements à Monsieur François Pinault, dont la grande géné- rosité a permis l’acquisition des équipements indispensables à la chirurgie robotique et le financement de notre programme.
BIBLIOGRAPHIE [1] MACK M.J. — Coronary surgery : off-pump and port access.
Surg Clin North Am. , 2000, 8 0, 1575-91.
[2] LOOP F.D. — Coronary artery surgery : the end of the beginning. Eur J Cardiothorac Surg. , 1998, 14 , 554-71.
[3] CARPENTIER A., LOULMET D., AUPECLE B., BERREBI A., RELLAND J. — Computer-assisted cardiac surgery. The Lancet , 1999, 353 (9150), 379-380.
[4] KAPPERT U., SCHNEIDER J., CICHON R., GULIELMOS V., SCHADE I., NICOLAI J., SCHUELER S. — Closed chest totally endoscopic coronary artery bypass surgery : fantasy or reality ? Curr Cardiol Rep. , 2000, 2 , 558-563.
[5] CICHON R., KAPPERT U., SCHNEIDER J., SCHRAMM I., GULIELMOS V., TUGTEKIN S.M., SCHULER S. — Robotic enhanced arterial revascularization for multivessel coronary artery disease. Ann Thorac Surg , 2000, 70 , 1060-1062.
[6] BOEHM D.H., REICHENSPURNER H., GULBINS H., DETTER C., MEISER B., BRENNER P., HABAZETTL H., REICHART B. — Early experience with robotic technology for coronary artery surgery. Ann Thorac surg. , 1999, 68 , 1542-1546.
[7] LOULMET D., CARPENTIER A., D’ATTELLIS N., BERREBI A., CARDON C., PONZIO O., AUPECLE B., RELLAND J.Y. — Endoscopic coronary artery bypass grafting with the aid of robotic assisted intrusments. J Thorac Cardiovasc Surg. , 1999, 118 , 4-10.
[8] CHITWOOD W.R. Jr. — Endoscopic robotic coronary surgery is this reality or fantasy ?
J Thorac
Cardiovasc Surg. , 1999, 118 , 1-3.
DISCUSSION
M. Christian CABROL
Je voudrais d’abord vous féliciter chaleureusement pour nous avoir montré l’application que vous avez faite de cette méthode, certes nouvelle, mais déjà utilisée par un certain nombre de centres tant en France qu’à l’étranger. À ce propos, puisque vous nous avez fait l’honneur de citer certains pionniers de la méthode, je vous suggère de compléter votre bibliographie en citant le professeur Gandjbakhch et son équipe qui ont effectué, il y a plus d’un an, une première dans ce domaine.
Les travaux originaux du professeur Gandjbakhch, dans le domaine des techniques non invasives de chirurgie coronaire, nous sont bien sûr familiers. Effectivement, il y a quelques années le professeur Gandjbakhch a décrit une technique de prélèvement mammaire aidée par vidéoscopie, suivi de l’anastomose coronaire par une mini-incision thoracique, technique qui à l’époque ne faisait pas appel à la chirurgie robotique.
M. Jean-Daniel SRAER
Il a été signalé certaines difficultés pour repérer la branche coronarienne sur laquelle sera faite l’anastomose. N’est-il pas possible de prévenir ces difficultés par les méthodes d’imagerie moderne : IRM et/ou scanner couplé à l’angiographie ?
Effectivement, les techniques d’imagerie moderne devraient faciliter le repérage peropé- ratoire des segments artériels coronaires. Il sera bientôt possible de réaliser, avant le début de l’intervention elle-même, une reconstruction en 3 dimensions sur un écran d’ordinateur d’images obtenues par scanner ou IRM sur laquelle pourraient se superposer des images angiographiques.
M. Yves GROSGOGEAT
Dans quelle mesure la technique à thorax fermé, avec robot, permet-elle de repérer la qualité du tissu artériel et l’existence de plaques d’athérome calcifié sur le site de l’anastomose ?
Quel geste d’urgence en cas de blessure artérielle et d’hémorragie profuse inopinée ?
L’un des gros problèmes de la chirurgie assistée par ordinateur est la disparition du sens tactile : la palpation du vaisseau si utile pour identifier les plaques indurées n’est actuellement pas possible. En cas d’hémorragie importante inopinée, la conversion de l’intervention assistée par ordinateur en une intervention conventionnelle peut être immédiate. Cette éventualité justifie d’ailleurs la présence du chirurgien, habillé, auprès du patient.
M. Maurice TUBIANA
Qu’adviendrait-il si une difficulté survenait au cours de l’intervention ?
Toute difficulté majeure survenant en cours d’intervention conduit au retour immédiat à une procédure conventionnelle.
M. René KÜSS
Cette technique permet-elle l’utilisation de greffons veineux ?
L’utilisation d’un greffon veineux pour réaliser un pontage aortocoronaire n’est pas possible avec cette technique : la réalisation de l’anastomose proximale sur l’aorte n’a, à ce jour, jamais été tentée.
M. Roger NORDMANN
J’ai été frappé de voir que cette technique de pointe comporte encore l’utilisation de fil pour réaliser les anastomoses. Il me semblait que des méthodes utilisant le laser et des colorants électivement sensibles permettaient de réaliser de telles anastomoses avec un gain de temps appréciable. Qu’en est-il ?
Effectivement les recherches sont très actives pour permettre une technique d’anastomose sans suture : des micro-agrafes, éventuellement faites à l’aide de métaux à mémoire de forme, la fusion tissulaire au laser ou l’intérêt de colle biologique sont autant de voies de recherche intéressante. A ce jour, cependant, les meilleurs résultats restent ceux obtenus avec les sutures micro-chirurgicales.
M. André VACHERON
Habituellement, les cardiologues opacifient l’artère mammaire interne lors de la coronarographie peropératoire et le chirurgien connaît les caractéristiques et le calibre de cette artère. Combien de malades de la série ont-ils eu une sternotomie pour achever la suture de l’artère mammaire interne sur l’artère coronaire ou en vérifier la qualité ?
À ce stade de développement de notre programme, toutes les anastomoses coronaires ont été réalisées après sternotomie. Il s’agissait en effet de valider la réalisation de l’anastomose elle-même avec la machine. À terme, cette anastomose pourra être réalisée à thorax fermé, à cœur battant.
M. Michel ARTHUIS
Peut-on réaliser un triple pontage avec cette technique, en particulier un pontage posté- rieur ?
La technique présentée aujourd’hui ne permet pas de réaliser des pontages sur des vaisseaux postérieurs. C’est pourquoi, l’intervention hybride, combinant à un pontage artériel de l’IVA la dilatation des lésions sur les vaisseaux droits ou postérieurs, fait l’objet de travaux de recherche clinique.
M. Claude-Henri CHOUARD
Est-ce le même robot qui est utilisé en chirurgie urologique etc., et peut-on envisager une salle d’opération dévolue, au sein d’un CHU, à cette chirurgie assistée ? Ne faut-il pas réserver, au moins dans les cinq ans à venir, le lourd investissement nécessaire à quelques pôles d’excellence en nombre limité ?
Ce robot a pu être utilisé dans des spécialités comme l’urologie, la chirurgie vasculaire à l’étape abdominale, la chirurgie viscérale, la chirurgie réparatrice. L’installation réalisée au CHU Henri Mondor permet cette utilisation multidisciplinaire. La technique étant encore à ce jour au stade tout à fait initial de son développement, la concentration de diverses expertises sur un même site est probablement souhaitable.
M. Jean NATALI
Qu’en est-il de l’apprentissage de cette technique ? Quels sont les critères retenus pour le choix des malades ? Quelle information donnez-vous à vos patients ?
La formation du chirurgien à cette technique peut être réalisée au mieux en utilisant des modèles de thorax ou d’abdomen dans lesquels sont placés des organes frais d’animaux.
L’apprentissage est en réalité tout à fait aisé du fait de la qualité exceptionnelle de la représentation 3 D du champ opératoire et de la précision des poignets articulés. À votre seconde question, je dirai que les patients, souvent demandeurs de la technique, sont avertis précisément des difficultés de réalisation de l’anastomose à cœur battant thorax fermé et du risque de conversion de l’opération vers une technique conventionnelle.
Bull. Acad. Natle Méd., 2001, 185, no 7, 1225-1238, séance du 2 octobre 2001


