Résumé
Depuis une dizaine d’années, un regain d’intérêt et d’investissements financiers pour le vaccin contre le paludisme ont permis des avancées scientifiques et techniques qui pour être prometteuses n’en sont pas moins encore limitées. De nombreux antigènes d’intérêt vaccinal sont en cours d’étude dans différentes plateformes technologiques, la majorité d’entre elles ont pour but le développement de vaccins sous-unitaires. L’approche du vaccin sporozoitaire atténué reste envisageable, même si les défis technologiques et réglementaires restent à ce jour un facteur limitant. Il reste de nombreuses inconnues scientifiques qui sont des obstacles au développement du vaccin, en particulier certains aspects de la relation hôte-parasite, de la qualité de la réponse immunitaire nécessaire pour induire une protection. Les avancées technologiques ne sont pas non plus la panacée et l’amélioration de l’antigénicité, l’optimisation de la réponse immunitaire induite, restent des pans de recherche à venir. Le facteur limitant a été et est encore le soutien financier de la recherche.
Summary
During the last 10 years the development of a malaria vaccine has attracted an increasing amount of attention both from the political sector and from financial investors. This has led to a number of major scientific and technological advances, but much remains to be done. Numerous potential target antigens are under investigation, and most research is focusing on a subunit vaccine. Irradiated attenuated sporozoites are also a promising approach, even if major technological and regulatory challenges remain to be overcome. Barriers to vaccine development include an inadequate understanding of certain aspects of host-parasite biology and protective immune responses. Other challenges are to increase the antigenicity of some antigens, and to optimize the quality of the immune response. However, research funding remains the main obstacle.
Le paludisme reste l’infection parasitaire la plus mortelle et la plus prévalente dans le monde. Un enfant meurt de paludisme toutes les trente secondes dans le monde.
Plus de cinq-cent millions de personnes dans le monde sont sérieusement malades à cause du paludisme, et plus d’un million en meurent par an [1]. L’Afrique subsaharienne est le continent qui paie le plus grand tribu à la maladie, avec plus de 90 % des décès. Le taux de mortalité très élevé en Afrique, est principalement le fait d’un des quatre types de paludisme humain, le Plasmodium falciparum.
Les trois autres types,
Plasmodium vivax , P. malariae, P. ovale sont beaucoup moins présents, même si leur morbidité est loin d’être négligeable. Malgré les programmes de santé publique mis en place pour traiter ou prévenir le paludisme P. falciparum , ces dernières années ont vu son extension à de nouvelles régions, voire un résurgence dans des zones où il avait disparu.
P. falciparum est responsable de tableaux cliniques remarquables par leur gravité et leur diversité. Les nourrissons et les enfants ont le plus grand risque de développer une forme clinique grave d’anémie, mettant leur vie en danger, les enfants plus âgés sont menacés de neuro-paludisme entraînant coma [2] et décès, les femmes primigravides courent le péril d’une forme grave due à la séquestration placentaire du parasite [3].
Ce sont les populations les plus pauvres du globe qui sont le plus affectées par le paludisme et si un vaccin était disponible, ce sont elles qui bénéficieraient le plus.
Depuis des décennies, le vaccin, promis de nombreuses fois, reste évanescent, malgré la mobilisation des chercheurs. Alors que d’autres vaccins ont fait leur preuves, et que la vaccination est universellement reconnue comme une des stratégie de santé publique la plus efficace et la plus rentable, pourquoi le vaccin contre le paludisme, plus de cent ans après la découverte du parasite, n’est-il toujours pas disponible ?
Est-ce la complexité de l’organisme infectieux, de la relation hôte-parasite ? Ne serait-ce pas aussi le manque d’engagement financier, privé ou public, qui a toujours fait du paludisme le parent pauvre de la recherche vaccinale ? Ce n’est pas faute d’esprits brillants et précurseurs qui ont jalonné la route de la recherche contre le paludisme.
LES GRANDES ÉTAPES DE LA RECHERCHE DU VACCIN CONTRE LE PALUDISME
Le paludisme , qui, au dix-septième siècle, a été appelé malaria (« mal’aria » :
mauvais air en italien ancien) est déjà décrit dans des textes chinois de la dynastie
Xia en 2700 avant J.C. Il est très peu d’autres maladies infectieuses qui ont eu un tel impact socio-économique depuis si longtemps. Les grecs et les romains avaient observé la relation entre la fréquentation des marais et l’apparition de fièvre et de splénomégalie. Palud (zone de marécages en France) est à l’origine du terme « paludisme ».
L’avancée majeure dans la compréhension du paludisme a été la découverte, le 6 novembre 1880, par Charles-Louis-Alphonse Laveran, du parasite protozoaire, Plasmodium spp, responsable du paludisme [4, 5]. Ses travaux de recherche sur les protozoaires lui valurent le Prix Nobel de Médecine et de Physiologie en 1907. En 1894, Ronald Ross, sur les hypothèses de Alphonse Laveran et Patrick Manson, entrepris une série d’expérimentations afin de vérifier la transmission du paludisme par les moustiques, ce qu’il démontra en 1897, en décrivant pour la première fois le cycle du parasite.
En 1881, le principe de la vaccination était exposé à l’Académie des sciences, par
Louis Pasteur [6], principe éminemment simple : exposer la population à une forme atténuée de la maladie pour la prémunir de la forme grave. Les trois principes fondateurs de la vaccinologie étaient posés : « d’abord Identifier, ensuite Inactiver, enfin Inoculer ». Cette méthode considérée comme universelle devait pouvoir s’appliquer à toutes les maladies infectieuses, qu’elles soient virales, bactériennes ou parasitaires.
En 1973, suivant les principes pasteuriens, David Clyde réussit à protéger des volontaires en injectant des sporozoites atténués par irradiation [7]. En 1974, Rieckmann et son équipe reproduisirent l’expérimentation initiale de Clyde [8]. La difficulté de production à large échelle de sporozoites irradiés a contraint les chercheurs à explorer de nouvelles voies de recherche. Toutefois cette étude clinique princeps a démontré qu’il était possible de provoquer une réponse immunitaire protectrice, ouvrant ainsi une nouvelle ère dans la recherche du vaccin contre le paludisme.
Dix ans plus tard, en 1983 le clonage du premier antigène du Plasmodium , la protéine CS du sporozoite du
Plasmodium knowlesi était réalisé par Ellis et coll. [9].
Depuis 2002, le séquençage du génome du
Plasmodium falciparum est terminé et publié [10]. Toutefois, la forme infectieuse du
Plasmodium comporte des milliers de protéines (cinq à six mille), représentant un défi pour le développement du vaccin, et nécessitant de réduire la bibliothèque de protéines à celles qui induisent une réponse immunitaire protectrice.
La complexité des différentes phases du cycle du parasite, avec des mécanismes immunitaires de protection et des antigènes le plus souvent différents a entraîné une multitude d’approches vaccinales.
Toutefois, le développement du vaccin représente toujours un défi pour les chercheurs, en raison de la complexité du parasite qui vit dans deux hôtes différents, possédant plus de cinq mille trois-cents gènes avec une expression des protéines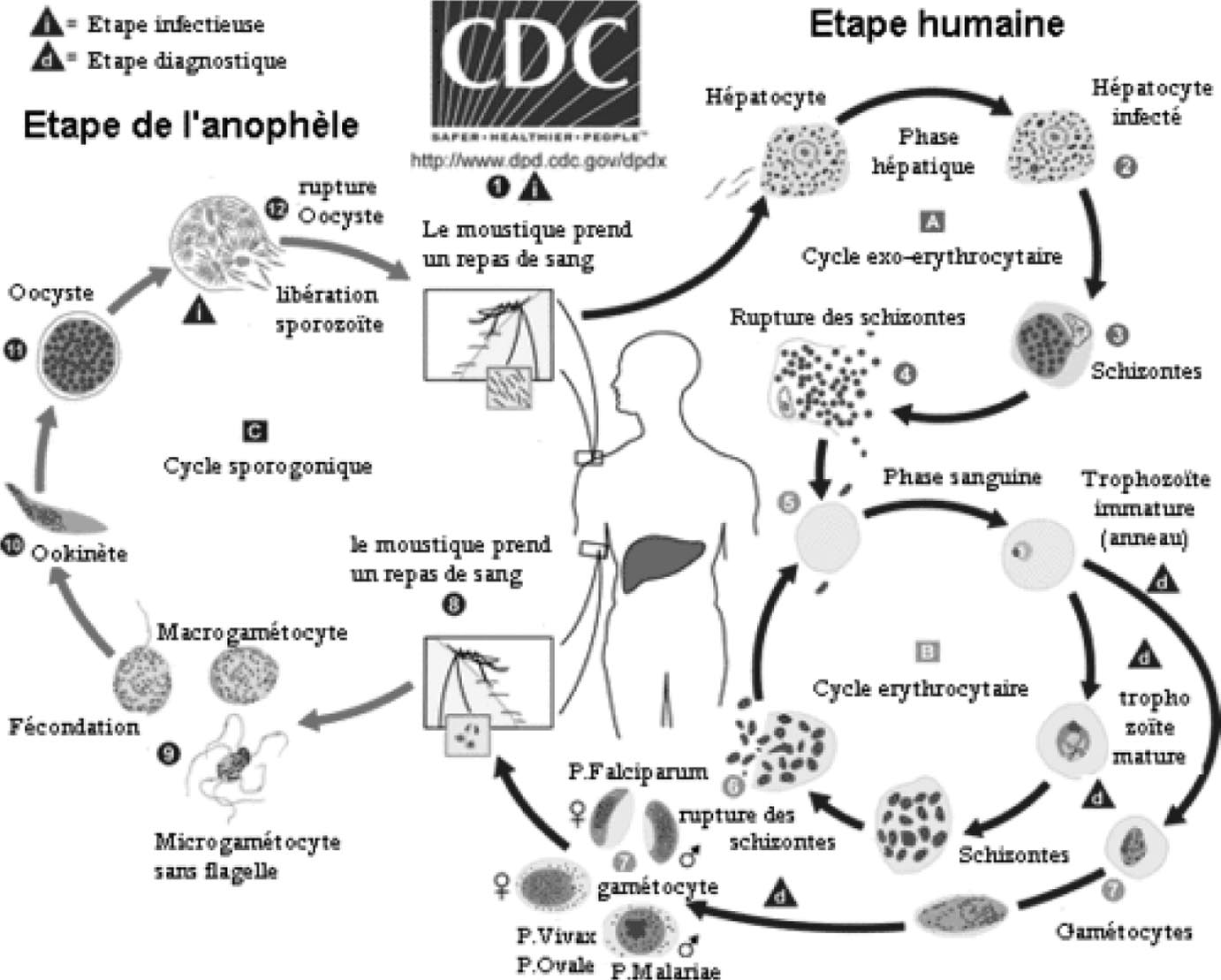
FIGURE 1. — Le cycle parasitaire du
Plasmodium .
dépendante des différentes phases du cycle. Mais la difficulté majeure provient de sa longue évolution chez son hôte humain, au cours de laquelle il a développé des mécanismes pour échapper et pour moduler le système immunitaire [10, 12].
LE CYCLE DU PLASMODIUM DANS LA PERSPECTIVE DU DÉVELOPPEMENT DU VACCIN (fig. 1)
Le paludisme est causé par un
Plasmodium transmis par un moustique Anopheles .
Lors d’un repas de sang, le moustique infecté, injecte dans la circulation sanguine de l’hôte, des sporozoites qui en quelques heures vont gagner le foie et infecter les hépatocytes. La phase hépatique de l’infestation est asymptomatique. Le sporozoite se multiplie par division cellulaire, jusqu’à la rupture de l’hépatocyte qui, environ sept à dix jours après la piqûre infestée, va libérer dans la circulation sanguine, des milliers de mérozoites. Les mérozoites infectent les hématies où ils continuent de se multiplier. Au stade sanguin, les symptômes cliniques peuvent apparaître. En 48 heures, l’hémolyse simultanée des globules rouges est à l’origine des accès de fièvre et de l’anémie. L’obstruction des vaisseaux sanguins par les hématies infectées est la cause du coma et des troubles rénaux. Les mérozoites libérés vont infecter d’autres
hématies et le cycle asexué se poursuit. Une partie des mérozoites vont se différencier en gamétocytes male et femelle, qui ingérés par le moustique au cours de son repas de sang, vont ensuite poursuivre leur cycle en se transformant en gamètes dont la fécondation engendre un zygote, qui se différencie ensuite en oocyste dans le tube digestif du moustique. Les oocystes produisent des sporozoïtes, qui migrent vers les glandes salivaires du moustique.
Chaque stade du cycle présente des particularités qui ont un intérêt vaccinal, en raison des différents antigènes secrétés à la surface du parasite. Le tableau 1 passe en revue les antigènes selon le stade du cycle parasitaire et le mécanisme d’action souhaité du vaccin.
En résumé, trois catégories d’approche sont développées actuellement. Le vaccin anti-infection cible le stade hépatique, bloquant l’invasion des hépatocytes par les sporozoites, ainsi que leur croissance et leur multiplication. C’est le vaccin adapté aux voyageurs, ou aux habitants des zones de faible endémicité. Le vaccin antimorbidité ou anti-mortalité , agit en empêchant l’invasion des érythrocytes par les mérozoites, en prévenant leur multiplication et leur effet toxique sur les érythrocytes.
Cette approche est la plus prometteuse pour les enfants, les femmes enceintes et les immigrants vivant dans les zones de forte endémie. Enfin, le vaccin altruiste , sans bénéfice immédiat pour le vacciné, bloque la transmission du parasite d’un individu à l’autre, en inhibant la fécondation dans le moustique.
L’identification d’un antigène dans la protection ne suffit pas à le considérer comme un candidat vaccin. Bien souvent, les protéines antigéniques sont polymorphiques, et sont exprimées au décours de vagues successives de parasitémie. Toutefois la nature précise des réponses immunitaires, les mécanismes effecteurs, l’ampleur de la réponse, la spécificité des antigènes qui participent à la réduction ou à la prévention de la maladie, restent largement inconnus.
L’Organisation Mondiale de la Santé (OMS) et les différentes agences de financement du vaccin contre le paludisme ont inventorié toutes les approches vaccinales en cours de développement [13]. Fin 2006, vingt-cinq candidats vaccins étaient en phase clinique, neuf candidats stade hépatique, treize candidats stade sanguin, un candidat stade sporogonique et deux candidats combinant plusieurs stades.
POURQUOI UN VACCIN CONTRE LE PALUDISME EST UN OBJECTIF RÉALISABLE ?
Vaccination avec des sporozoites irradiés
Les études de challenge, qui consistent à infecter un hôte animal ou humain en inoculant des sporozoites, ont permis de démonter que la protection induite par la vaccination avec des sporozoites atténués par irradiation. Dans ce modèle les moustiques infectés sont irradiés par rayons X et sont ensuite mis en présence de leur hôte animal, afin qu’ils puissent prendre leur repas sanguin et donc infecter l’hôte
TABLEAU 1. — Les différents candidats vaccins et leur stade de développement, d’après Richie T. [19].
Phase du cycle du
Antigènes
Cible et mécanisme d’action
Plasmodium et fonction
Cycle exo-erythrocytaire
Vaccins Anti-infection
Invasion des hépatocytes Anticorps liés aux antigènes exprimés Sporozoites irradiés, à la surface du sporozoite, empêchent Dérivés de la protéine les interactions nécessaires pour Circumsporozoite CSP , l’invasion
TRAP/SSP2 ,
STARP, SALSA Croissance, schizogénèse Sporozoites irradiés, Reconnaissance cellulaire T des anti- CSP, TRAP/SSP2 , gènes exprimés à la surface des hépaSTARP, SALSA, LSA1, tocytes infectés et relargage d’IFN-γ
EXP1, LSA3 entrainant la mort intracellulaire du parasite Cycle erythrocytaire
Vaccins anti-morbidité/mortalité
Invasion des érythrocy-
MSP1, MSP2, MSP3, Les anticorps liés aux antigènes parates MSP4, PfEBA175, sitaires responsables de — agglutinaPvDABP, AMA1, tion ou évite le relargage des merozoi- SERA, GLURP, tes, bloque l’ínvasion des érythro- Pf155/RESA , RAP1, cytes, induction du relargage par les RAP2 monocytes de médiateurs immuns solubles qui inhibent les parasites, favorise la phagocytose Croissance, séquestra- pfEMP1, Pf 332, rifins Les anticorps liés aux antigènes exprition més à la surface des érythrocytes agissent en augmentant la clairance splé- nique, ou la lyse médié par complément, interfèrant avec la nutrition et la croissance du parasite, provoquant une inhibition cellulaire anticorps dépendante, prévenant ou inversant l’adhérence endothéliale Rupture érythrocytaire GlycosylphosphatidyliLes anticorps liés au GPI préviennent nositol (GPI) ancres les effets toxiques Cycle sporogonique
Vaccins bloquant la transmission
Fécondation, oogénèse Pfs25 , Pfs28, Pfs48/45, Les anticorps liés aux antigènes para-
Pfs230 sitaires responsables d’inhibition de l’exflagellation et la fécondation, le complément provoque la lyse des gamètes et des zygotes, neutralise la fontion ookinètique ( En gras : les antigènes en phase clinique) avec les sporozoites atténués qui vont réaliser un cycle incomplet, leur irradiation les rendant inaptes à atteindre le stade de mérozoites. À ce stade intermédiaire, les parasites induisent une protection de 95 % contre le challenge avec des sporozoites
intacts [14]. La protection semble passer par une production de lymphocytes T, sans réelle spécificité antigénique démontrée [15, 16].
Les hôtes vaccines avec des sporozoites irradiés restent susceptibles lors de challenge au stade sanguin, leur immunité protectrice est donc cantonnée au stade hépatique.
Hoffman et son équipe pensent sur la base de données humaines limitées qu’il existe une protection inter-espèces [14].
Immunité naturelle acquise
Le paludisme est une infection chronique, avec une habilité particulière du parasite à échapper à toutes les voies du système immunitaire. La chronicité des infections paludéennes peut être considérée comme une adaptation du parasite aux aléas de la transmission. Sama, Killeen and Smith ont calculé que la durée de l’infection par P.
falciparum est de deux ans [17]. Le corollaire à cette infection persistante est l’absence d’immunité stérilisante, expliquant la réinfection lors de nouvelle exposition par les sujets qui ont été traités [18]. Cette faculté du parasite à échapper aux défenses de son hôte humain, et sa longue survie est le défi majeur du développement du vaccin [19].
Les populations vivant dans les zones d’endémie acquièrent, après des infections répétées, une immunité naturelle qui protège des formes sévères du paludisme, mais qui n’empêche pas les infections. Les immunoglobulines provenant d’adultes cliniquement immuns, lorsqu’elles sont administrées à des enfants parasitémiques, diminuent la densité de parasite ainsi que la gravité des symptômes [20]. L’immunité naturelle acquise est associée avec une réponse humorale aux antigènes du stade sanguin, mais ne repose pas seulement sur ce mécanisme. En effet, la protection contre les infections du stade sanguin a aussi été associés à une réponse immunitaire cellulaire en absence d’anticorps [21] tout autant qu’à une inhibition par anticorps monocyte-dépendante [22]. Sur la base de ces observations, il est rationnel de penser qu’un vaccin basé sur un ou des antigènes sanguins, pourrait limiter les infections et prévenir les formes sévères de la maladie et donc la mortalité.
LES VACCINS SOUS-UNITAIRES
Les antigènes identifiés d’intérêt vaccinal sont nombreux (ref. Table 1) et celui qui a suscité depuis longtemps le plus d’investissement financier et scientifique est l’antigène du stade hépatique CS. Les candidats antigènes sont exprimés en protéines recombinantes dans des systèmes bactériens, viraux, levures ou cellules d’insectes et leur réponse immunitaire est le plus souvent améliorée par l’utilisation d’adjuvants.
Certains groupes développent des peptides synthétiques quand d’autres explorent des vecteurs viraux, bactériens, protozoaires ou des vaccins ADN technologies utilisés pour le développement de ces vaccins sous unitaires [23-29].
Aucune de ces approches n’a pour l’instant démontré qu’une protection limitée et ne peut être identifiée comme le vaccin à venir. Les principaux obstacles au dévelop-
pement des approches sous unitaires sont scientifiques et nécessitent une recherche approfondie sur l’hétérogénéité des hôtes et des parasites, la biologie hôte-parasite, sur les manières de générer une réponse immunitaire cellulaire efficace et enfin sur l’établissement de corrélats immunologiques de protection.
Un bon exemple de ces obstacle est le vaccin RTS,S, basé sur la protéine CS, et développé par Glaxo-Smith-Kline. Si les études préliminaires ont démontré une association entre niveau d’anticorps et protection, ces résultats ne se sont pas confirmés [31]. Dans l’étude clinique conduite au Mozambique chez des enfants, il n’y a pas de corrélation entre taux d’anticorps et protection contre les formes symptomatiques du paludisme [32, 33]. Une explication pourrait être que l’immunité cellulaire a joué un rôle dans la protection limitée à 30 %, conférée par le RTS, S, ainsi que le statut immun des sujets avant la vaccination, tout autant que certain facteurs spécifiques de la relation hôte-parasite qui restent à déterminer.
LES VACCINS VIVANTS ATTENUÉS
Sanaria Inc, une société de biotechnologie américaine, sous l‘impulsion du Prof.
Hofmann essaie de résoudre les défis techniques attachés à la production d’un vaccin sporozoitaire atténué par radiations X. La production de quantité importante de sporozoites, qui ne peuvent être obtenus à ce jour que par le prélèvement dans les glandes salivaires du moustique[14]. Assurer une qualité de bons procédés de fabrication pour atteindre les exigences de pureté et de stérilité est une tâche extrêmement complexe, à laquelle s’ajoute la nécessité de trouver une technologie de conservation du vaccin qui garantira sa stabilité. Enfin, la route d’administration d’un tel vaccin reste à définir et il faudra en évaluer la bonne tolérance.
Une solution à cette approche pourrait être le développement de sporozoites génétiquement modifiés [34].
L’AVENIR
Aucune des approches actuelles n’est suffisamment convaincante pour ne s’en tenir qu’à une seule, et il est fort probable qu’il n’y ait pas un vaccin universel ; les vaccins combinant antigènes des différentes phases du cycle et même différentes espèces sont une hypothèse raisonnable. Le développement du vaccin contre le paludisme nécessite un retour à la recherche fondamentale sur la relation hôte-parasite, les mécanismes immunitaires de protection, tout autant que sur les avancées technologiques, en particulier celles permettant d’améliorer l’antigénicité des candidats, d’optimiser la réponse immunitaire de ces antigènes et le développement de nouveaux adjuvants pourraient fortement y contribuer, d’améliorer les formulations vaccinales pour obtenir des vaccins stables à la chaleur.
Tous ces efforts nécessitent le déploiement de moyens financiers qui ont toujours cruellement fait défaut à la recherche pour le vaccin contre le paludisme, en
particulier en Europe, même si depuis les années 2000, certains états membres européens comme la Suède, le Danemark, les Pays Bas et l’Irlande se sont associés pour soutenir l’European Malaria Vaccine Initiative qui finance le développement de vaccins antipaludéens de treize institutions de recherche européennes. Ces efforts pour soutenir la recherche européenne, malgré sa qualité remarquable, paraissent bien insuffisants au regard du soutien apporté par des organismes comme le NIH ou la Fondation Bill et Melinda Gates. Il serait toutefois illusoire de penser que la puissance financière américaine est suffisante. Le financement de la recherche sur le vaccin contre le paludisme, au regard d’autres vaccins comme le vaccins contre le SIDA ou la tuberculose reste globalement notoirement insuffisant.
BIBLIOGRAPHIE [1] HAY S.I., GUERRA C.A., TATEM A.J., ATKINSON P.M., SNOW R.W. — Urbanization, malaria transmission and disease burden in Africa. Nat. Rev. Microbiol ., 2005, 3(1), 81-90.
[2] MARSH K., SNOW R.W. — Malaria transmission and morbidity.
Parasitologia, 1999, 41(1-3), 241-6.
[3] FRIED M., DUFFY P.E. — Maternal malaria and parasite adhesion. J. Mol. Med ., 1998 76(3-4) , 162-71.
[4] LAVERAN A. — Nature parasitaire des accidents de l’impaludisme. Description d’un nouveau parasite trouvé dans le sang des malades atteints de fièvre palustre . Editions J.-B. Baillière et fils, 1881.
[5] LAVERAN A. — Traité des fièvres palustre avec la description des microbes du paludisme.
(Edition Octave Douin), 1884.
[6] PASTEUR L. — Comptes rendus de l’Académie des Sciences, 1881, 92 .
[7] CLYDE D.F., MOST H., MCCARTHY V.C., VANDERBERG J.P. — Immunization of man against sporozite-induced falciparum malaria. Am. J. Med. Sci ., 1973, 266(3), 169-77.
[8] RIECKMANN K.H., CARSON P.E., BEAUDOIN R.L. et al. — Letter : Sporozoite induced immunity in man against an Ethiopian strain of Plasmodium falciparum.
Trans. R. Soc. Trop. Med.
Hyg. ,1974, 68(3) , 258-9.
[9] ELLIS J., OZAKI L.S., GWADZ R.W. et al. — Cloning and expression in E. coli of the malarial sporozoite surface antigen gene from Plasmodium knowlesi.
Nature . 1983, 7 , 302(5908) , 536-8.
[10] GARDNER M., HALL N., FUNG E. et al. — Genome sequence of the human malaria parasite
Plasmodium falciparum . Nature , 2002, 419 , 498-511.
[11] CARUCCI D.J. — Malaria vaccine not ‘‘ just around the corner ’’.
The Lancet Infectious Diseases .
2003, 3 , 393.
[12] HISAEDA H., YASUTOMO K. and HIMENO K. — Malaria : immune evasion by parasites.
Interna- tional Journal of Biochemistry and Cell Biology , 2005, 37 , 700-706.
[13] OMS, Initiative pour la Recherche des Vaccins. « Candidate malaria vaccines in clinical development, December 2006. http : //www.who.int/vaccine-research/documents/ RainbowTable-ClinicalTrials-December2006.pdf (site accédé le 29/06/2007).
[14] HOFFMAN S., GOH L., LUKE T. et al. — Protection of Humans against Malaria by Immunization with Radiation-Attenuated Plasmodium falciparum Sporozoites.
The Journal of Infectious Diseases, 2002, 185 , 1155-64.
[15] KRZYCH U. and SCHWENK J. — The dissection of CD8 T cells during liver-stage infection.
Current Topics in Microbiology and Immunology , 2005, 297 , 1-24.
[16] DOOLAN D.L. and MARTINEZ-ALIER N. — Immune response to pre-erythrocytic stages of malaria parasites. Current Molecular Medicine 6 , 169-185.
[17] DOOLAN D.L., SEDEGAH M., HEDSTROM R.C., HOBART P., CHAROENVIT Y. and HOFFMAN S. — Circumventing genetic restriction of protection against malaria with multigene DNA immunization : CD8+ cell-, interferon gamma-, and nitric oxide-dependent immunity. Journal of Experimental Medicine , 1996, 183 , 1739-1746.
[18] SAMA W., KILLEEN G. and SMITH T. — Estimating the duration of Plasmodium falciparum infection from trials of indoor residual spraying. American Journal of Tropical Medicine and Hygiene , 2004, 70 , 625—634.
[19] HOFFMAN S L., OSTER C.N., PLOWE et al. — Naturally acquired antibodies to sporozoites do not prevent malaria : vaccine development implications.
Science , 1987, 237 , 639-642.
[20] RICHIE T.L., SAUL A. — Progress and challenges for malaria vaccines.
Nature , 2002 7,415 (6872), 694-701.
[21] SCHOFIELD L. and MUELLER I. — Clinical immunity to malaria.
Current Molecular Medicine, 2006, 6, 205-221.
[22] POMBO D.J., LAWRENCE G., HIRUNPETCHARAT C. et al . — Immunity to malaria after administration of ultra-low doses of red cells infected with Plasmodium falciparum.
Lancet , 2002, 360 , 610-617.
[23] OEUVRAY C., THEISEN M., ROGIER C., TRAPE J.F., JEPSEN S. and DRUILHE P. — Cytophilic immunoglobulin responses to Plasmodium falciparum glutamate-rich protein are correlated with protection against clinical malaria in Dielmo, Senegal. Infection and Immunity, 2000, 68 , 2617-2620.
[24] MAHANTY S., SAUL A. and MILLER L.H. — Progress in the development of recombinant and synthetic blood-stage malaria vaccines. Journal of Experimental Biology , 2003, 206 , 3781-3788.
Malaria Vaccine Technology Roadmap (2005). http : // www.malariavaccineroadmap.net/ [25] BALLOU W.R., AREVALO-HERRERA M., CARUCCI D. et al . — Update on the clinical development of candidate malaria vaccines.
American Journal of Tropical Medicine and Hygiene, 2004, 71 , 239-247.
[26] MOORTHY V.S., GOOD M.F. and HILL A.V. — Malaria vaccine developments. Lancet, 2004, 363 , 150-156.
[27] REED Z.H., FRIEDE M. and KIENY M.P. — Malaria vaccine development : progress and challenges. Current Molecular Medicine, 2006, 6 , 231-245.
[28] WALTHER M. — Advances in vaccine development against the pre-erythrocytic stage of Plasmodium falciparum malaria. Expert Reviews of Vaccines, 2006, 5 , 81-93.
[29] HILL A.V. — Pre-erythrocytic malaria vaccines : towards greater efficacy.
Nature Reviews
Immunology , 2006, 6, 21-32.
[30] GOOD M.F. — Vaccine-induced immunity to malaria parasites and the need for novel strategies.
Trends in Parasitology, 2005, 21 , 29-34.
[31] PERLAZA B.L., SAUZET J.P., BALDE A.T., BRAHIMI K., TALL A., CORRADIN G., DRUILHE P. — Long synthetic peptides encompassing the Plasmodium falciparum LSA3 are the target of human B and T cells and are potent inducers of B helper, T helper and cytolytic T cell responses in mice. Eur. J. Immunol ., 2001, 31(7 ), 2200-9.
[32] BALLOU W.R., HOFFMAN S.L., SHERWOOD J.A. and all . — Safety and efficacy of a recombinant
DNA Plasmodium falciparum sporozoite vaccine.
Lancet, 1987, 8545 , 1277-1281.
[33] ALONSO P.L., SACARLAL J., APONTE J.J. et al . — Duration of protection with RTS,S/AS02A malaria vaccine in prevention of Plasmodium falciparum disease in Mozambican children :
single-blind extended follow-up of a randomised controlled trial. Lancet, 2005, 366 , 2012- 2018.
[34] ALONSO P.L., SACARLAL J., APONTE J.J. et al . — Efficacy of the RTS,S/AS02A vaccine against
Plasmodium falciparum infection and disease in young African children : randomised controlled trial. Lancet, 2004, 364 , 1411-1420.
[35] MUELLER A.K., LABAIED M., KAPPE S. H. and MATUSCHEWSKI K. — Genetically modified Plasmodium parasites as a protective experimental malaria vaccine. Nature, 2005, 433 , 164- 167.
DISCUSSION
M. André PARODI
Mis à part le cas heureux où les vaccins sous-unitaires agissant sur la phase intra hépatique du parasite entraînent son éradication, dans tous les autres cas de figure ces vaccins empêchent l’expression clinique de la maladie, sans empêcher la parasitémie. Ce qui signifie qu’ils créent des ‘‘ porteurs sains ’’ qui seront responsables du maintien de l’endémie.
Comment évaluez-vous cet inconvénient ?
En, effet tous les vaccins sous-unitaires ciblant seulement le stade érythrocytaire ont pour effet de réduire la morbidité et la mortalité, ce qui en terme de santé publique est loin d’être négligeable, mais ces vaccins ne peuvent être des outils de l’éradication du parasite chez les populations exposées. C’est la raison pour laquelle la stratégie de développement du vaccin contre le paludisme doit s’attacher au développement de vaccins combinés, comportant des antigènes d’intérêt vaccinal de tous les stades, y compris le stade gamétocytaire. Aussi efficace que soit le vaccin final, il ne sera qu’un des axes de la lutte contre le parasite, en conjonction avec la lutte anti-vectorielle, la prévention médicamenteuse, et les autres moyens de prévention comme les moustiquaires.
M. Airezki IZRI 1
Par la transmission de la leishmaniose, le rôle des protéines présentes dans la salive des phlébotominés est démontrée, protéines produites par le phlébotome, ou par les leishmanies.
Qu’en est-il pour la transmission du paludisme ? Travaille-t-on sur les protéines contenues dans la salive des anophèles ?
Dans le domaine du paludisme, les protéines salivaires des anophèles gambiae sont, à ma connaissance, étudiées seulement comme un marqueur de risque du paludisme et non comme antigènes d’intérêt vaccinal.
1. Parasitologue, Entomologiste, université Paris 13.
M. André VACHERON
Le président Ambroise-Thomas a souligné l’intérêt des moustiquaires imprégnées d’insecticide. Qu’en est-il aujourd’hui du DDT ?
Depuis 2006, le DDT est à nouveau recommandé par l’OMS comme insecticide à effet rémanent pour des pulvérisations à l’intérieur des habitations.
* Directeur général, European Malaria Vaccine Initiative, Artillerivej 5, Copenhague 2300S Danemark. oly@ssi.dk Tirés-à-part : Docteur Odile LEROY, même adresse.
Bull. Acad. Natle Méd., 2007, 191, no 7, 1249-1260, séance du 30 octobre 2007


