Summary
Our view of white adipose tissue (WAT) has changed over the last decade, from an inert triglyceride storage tissue to a highly active metabolic organ. Indeed, WAT secretes proinflammatory cytokines such TNF-a, interleukin-1 (IL-1), interleukin-1 receptor antagonist (IL-1Ra), and interleukin-6 (IL-6), and chemokines such as monocyte chemoattractant protein-1 (MCP-1), interferon γ inducible protein 10 (IP-10), interleukin-8 (IL-8), RANTES, and peptides with hormone-like actions such as adiponectin, leptin and resistin. Through their paracrine actions these factors contribute to local WAT inflammation, neoangiogenesis and differentiation. On entering the systemic circulation they can contribute to creating or maintaining a systemic inflammatory state, hypertension and insulin resistance, and can also affect central control of food intake. When located around organs such as the kidney, heart and blood vessels, WAT can adversely affect organ function by secreting cytokines and chemokines. For example, perivascular WAT, which secretes proatherogenic cytokines and chemokines and which is present around large and mediumsized arteries, could contribute to the development of atherosclerotic lesions by attracting inflammatory cells and stimulating neoangiogenesis, thereby amplifying the chronic vascular inflammation which is the hallmark of atherosclerosis.
INTRODUCTION
Le tissu adipeux blanc (TAB) est probablement un des organes sur lequel les connaissances ont le plus évolué pendant ces dix dernières années. Basé sur l’anthropologie il a été considéré pendant longtemps comme un organe inerte stockant de d’énergie sous forme de triglycérides, nous permettant de survivre en cas de famine.
Hors, depuis une dizaine d’années, il y a eu de plus en plus d’évidences que le TAB est un organe en entier en soi, capable de sécréter une vaste gamme de peptides d’actions variées et multiples qui contribuent à la résistance à l’insuline, au réglage central de la prise alimentaire, mais aussi à l’état inflammatoire retrouvé chez le sujet obèse et de ce fait, est impliqué dans les nombreuses complications de l’obésité [1].
Ainsi, le TAB est devenu un organe central du métabolisme et de l’inflammation [2].
De plus, il a été démontré que la distribution du tissu adipeux n’est pas uniforme dans le corps humain, mais que la localisation du TAB joue un rôle primordial par des effets paracrines avec des conséquences sur les organes adjacents [3].
Cette brève revue fait le point sur les différentes molécules inflammatoires secrétées par le tissu adipeux (cytokines et chémokines) et les conséquences sur l’état inflammatoire et la résistance à l’insuline retrouvés chez le sujet obèse.
Le tissu adipeux comme organe sécrétoire
Le TAB est capable de sécréter de nombreuses différentes molécules proinflammatoires, telles que les cytokines (peptides régulant l’inflammation), et les chémokines (cytokines avec propriétés attrayantes pour d’autres cellules inflammatoires) ainsi que des protéines plus grandes avec une action de type hormonale. Ces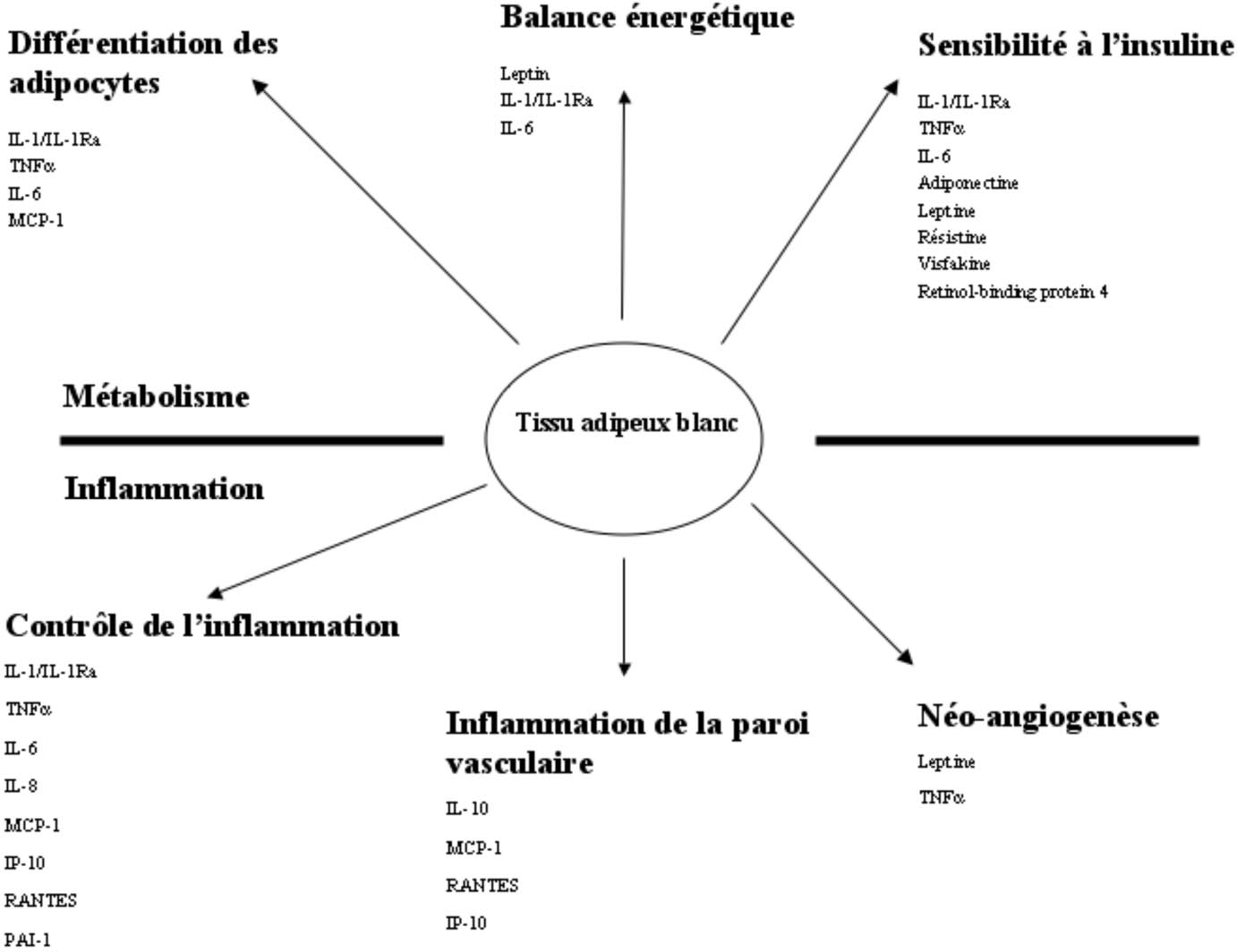
FIG. 1. — Le tissu adipeux comme organe sécrétoire. Les différentes molécules secrétées par le tissu adipeux blanc et leur effet sur le métabolisme et l’inflammation molécules peuvent être séparées en molécules qui agissant soit localement par un gradient de concentration (paracrine), soit dans tout le corps par voie systémique.
Elles peuvent aussi être divisées selon leur mode d’action en des molécules modulant l’inflammation ou en molécules modifiant l’homéostasie métabolique, tel que le contrôle de la prise de poids ou la sensibilité à l’insuline [1]. La figure 1 présente les différents peptides secrétés par le TAB selon leur mode d’action sur l’inflammation ou le métabolisme.
Les cytokines : médiateurs de l’inflammation
Il s’agit là d’une classe de petits peptides, sécrétées suite à des stimuli d’origine divers, actives biologiquement à des très petites concentrations et qui jouent un rôle dans l’inflammation, l’intégrité cellulaire, la maturation et prolifération cellulaire.
Plus d’une centaine de cytokines ont été décrites, telles que les interleukines, interférons, facteurs hématopoïétiques ou facteurs de croissance. Ces cytokines aux multiples actions sont produites par de nombreuses lignées cellulaires telles que les macrophages, les cellules tueuses naturelles ( natural cell killers ), les lymphocytes T
ou B, mais aussi par des cellules d’autre origine telles que les fibroblastes, hépatocytes ou cellules éptihéliales [4]. Les plus connues sont le tumor nécrosis factor alpha (TNF-α), l’interleukine-1(IL-1) ou -6 (IL-6) qui sont produites par le TAB et qui jouent un rôle dans l’inflammation et l’athérosclérose.
TNF- α
Cette cytokine pro-inflammatoire est une des plus étudiées et connues. Initialement décrite pour induire la nécrose de tumeur après une infection bactérienne aigue, elle est impliquée dans les processus inflammatoires, la genèse des tumeurs et des métastases, la fièvre, le choc septique et la réplication virale. Des endotoxines, des virus et d’autres cytokines, telles que l’IL-1, peuvent induire sa production, tandis que d’autres cytokines, tels que l’interféron α (IFNα) ou — β (IFNβ) et l’IL-6 sont inhibitrices [1]. Le TNFα est produit par une variété de cellules différentes incluant des cellules du système immun, les fibroblastes, les cellules musculaires lisses et les adipocytes [5].
Du point de vue de la sensibilité à l’insuline, le TNF-α diminue les transporteurs du glucose de type 4 (GLUT 4) et, en concordance avec cela, des souris invalidées pour le gène du TNF-α sont moins résistantes à l’insuline que leurs confrères sauvages [6].
TNF-α est produit non seulement par les adipocytes du TAB viscéral, mais aussi par les adipocytes péri-vasculaires [7]. Secrété par ces adipocytes, le TNF-α pourrait contribuer à l’hypertension de l’obèse par différents mécanismes. Il a été démontré que le TNF-α inhibe l’enzyme endothéliale de la synthèse du monoxyde d’azote (NO), la eNOS. Il en résulte une diminution du NO, un puissant vasodilatateur.
D’autre part, l’insuline est un vasodilatateur dont l’action est médiée par le NO. Une diminution de celui-ci entraîne une résistance à l’insuline par un apport abaissée de glucose et d’insuline en périphérie [8].
IL-1 and IL-1Ra
L’interleukine-1 (IL-1) est une famille composée de trois différentes molécules (IL-1α, IL-1β et interleukine-1 recepteur antagoniste (IL-1Ra)) produites par des gènes différents. IL-1α et IL-1β ont des actions similaires pro-inflammatoires sur la plupart des cellules. IL-1 est produit par les monocytes et macrophages activés avec pour conséquence la stimulation de la fièvre, la prolifération de fibroblastes, des cellules musculaires lisses ou mésangiales et la production de protéines de la phase aigue au niveau hépatique. IL-1 a également une action sur le TAB en favorisant la néoangiogenèse et la differentiation des adipocytes via l’inhibition des récepteurs peroxisome proliferators-activated γ (PPARγ) [9].
Au contraire, l’IL-1Ra est un cas de figure unique du fait d’une action antiinflammatoire et antagoniste à celle du IL-1 en bloquant le récepteur de l’IL-1 de façon compétitive sans émettre de signal intracellulaire en aval [10]. IL-1Ra est produit par les fibroblastes, monocytes et neutrophiles et est inhibé par d’autres
cytokines. De part sa nature, IL-1Ra représente donc un mécanisme de défense de l’hôte contre l’inflammation et la fièvre [11]. Bien qu’une augmentation plasmatique de l’IL-1Ra, comme on le retrouve dans le sérum des patients obèses, puisse à première vue représenter un mécanisme de protection, celle-ci a été associée chez l’animal à une résistance musculaire à l’insuline, une résistance acquise à la leptine ainsi qu’une désinhibition de l’adipogenèse [12]. Produits par le TAB périvasculaire, l’IL-1 et l’IL-1Ra pourraient jouer un rôle dans la formation de la plaque en favorisant la différentiation du tissu adipeux et la néo-angiogenèse, deux caractéristiques fondamentales de l’athérosclérose.
IL-6
L’IL-6, ensemble avec le TNFα et IL-1, induit la phase aïgue hépatique en stimulant la fièvre et la production de certaines protéines, dont la CRP. IL-6 partage avec IL-1Ra des actions modulatrices de l’inflammation telles que la diminution du TNFα et de l’interferon-γ (IFNγ) et stimule la production de l’IL-1Ra [1]. L’obésité est associée à une élévation des taux d’IL-6 alors qu’une perte de poids entraîne une diminution des taux plasmatiques [13]. Au niveau de la sensibilité à l’insuline, IL-6 augmente la résistance à l’insuline en diminuant le nombre de récepteurs à l’insuline (IRS-1) et le GLUT4 [14]. IL-6 a aussi des actions centrales en augmentant la dépense énergétique et diminue de ce fait la quantité de tissu adipeux [15]. Avec l’IL-1 et les autres cytokines, IL-6 contribue à la balance entre médiateurs pro- et anti-inflammatoires secrétés par le TAB.
Les chémokines
Les chémokines sont des petites protéines sécrétées souvent par les mêmes cellules que les cytokines suite à de nombreux stimuli divers ; elles sont impliquées dans la chémo-attraction de cellules inflammatoires par la génération de gradient locaux, agissant donc essentiellement par un effet paracrine [1]. Leur effet dépend donc souvent de la proximité de leur sécrétion et de l’organe voisin. Il a été démontré que le TAB secrète de nombreuses chémokines contribuant à l’attraction de cellules inflammatoires au sein du tissu adipeux. Parmi les plus que 40 différentes chémokines connues à ce jour, au moins 4 sont produites par le tissu adipeux : l’« interferon γ inducible protein 10 » (IP10), l’IL-8, le « monocyte chemoattractant protein-1 » (MCP-1) ou encore le « regulated upon activation normal T cell express sequence » (RANTES). De plus, le tissu adipeux situé autour d’un organe, comme par exemple autour de vaisseaux sanguins ou du rein, peut contribuer à l’inflammation de ce tissu et entraver sa fonction par un effet paracrine.
MCP-1
MCP-1 est une chémokine dont le taux basal est très faible, mais qui peut être induite par différentes cytokines telles que l’IL-1 ou le TNFα ou par des endotoxines. L’expression de MCP-1 est augmentée chez les souris obèses [16] et chez
l’humain, le MCP-1 produit par le tissu adipeux inhibe la signalisation de l’insuline au niveau musculaire ; de plus le MCP-1 joue un rôle dans la différentiation des adipocytes [17].
MCP-1 est surtout connu pour sa capacité chémotactique de recrutement des macrophages, étape esssentielle dans le développement de l’athérosclérose comme maladie inflammatoire des vaisseaux. En concordance avec ceci, le récepteur au MCP-1, CCR2, est fortement exprimé au niveau des monocytes circulants [18]. Son rôle causal dans l’artériosclérose a été démontré chez des modèles murins, où l’invalidation du gène codant soit pour la MCP-1 ou soit pour le CCR2 était associée à une réduction du nombre et de la taille des plaques d’athérosclérose [19, 20].
Nous avons pu démontrer que MCP-1 est aussi sécrété par le tissu adipeux périvasculaire spécifiquement [7]. Ce TAB périvasculaire étant très proche de la lumière des vaisseaux (moins de 50-100 µm), MCP-1 peut contribuer à l’afflux de cellules inflammatoires que l’on retrouve dans les plaques athérosclérotiques.
De plus, MCP-1 a une action pro-angiogénique et proliférative sur les cellules musculaires lisses, deux phénomènes caractéristiques retrouvés dans l’athérosclérose.
IL-8
IL-8, aussi nommée CXCL-8, est une autre chémokine impliquée dans le développement de l’athérosclérose. Elle est produite par les monocytes, mais aussi par les lymphocytes, granulocytes, fibroblastes, cellules endothéliales ou bronchiales et les hépatocytes. Certaines cytokines ont un effet inhibiteur sur sa synthèse (interféron β), tandis que d’autres (IL-1β et TNFα) la stimulent [1]. IL-8 est tactile non seulement pour les monocytes, mais aussi pour les cellules musculaires lisses, les basophiles, neutrophiles et les lymphocytes de type T.
IL-8 est augmentée chez le sujet obèse et peut contribuer à l’état inflammatoire de l’obèse [21]. Au niveau du développement de l’athérosclérose, IL-8 permet l’arrêt des monocytes circulants sur l’endothélium [22], le premier pas essentiel de l’athé- rosclérose. En concordance avec ceci, IL-8 est fortement exprimée au sein de la plaque d’athérome, pouvant attirer des nouvelles cellules inflammatoires.
Nous avons pu démontrer que l’IL-8 est secrétée par le tissu adipeux périvasculaire, qui en raison de sa proximité des vaisseaux peut ainsi contribuer au développement des plaques d’athéromatose [7].
IP-10
IP-10 est une autre chémokine qui elle aussi est produite par de nombreuses cellules suite à des stimuli divers tels que des cytokines ou des lipopolysaccharides. In vivo, son expression est augmentée lors d’états tels que l’obésité, le diabète ou l’athérosclérose (E. Henrichot, C.A. Meier, données non publiées). IP-10 est aussi sécrété par le tissu adipeux périvasculaire et donc peut contribuer à la chemo-attraction de cellules inflammatoires dans la paroi du vaisseau.
RANTES
La chémokine ‘‘ regulated on activated normal T-cell expressed and secreted ’’ chemokine (RANTES) ou CCL5 est aussi impliquée dans la pathogenèse de l’athé- rosclérose. RANTES est chemoattractive pour les monocytes et lymphoctes T et induit une diminution de la production du collagène. RANTES est sécrétée par les plaquettes, les lymphocytes T activés, les macrophages, les cellules musculaires lisses et les cellules endothéliales.
Son association avec le développement de l’athérosclérose a été démontré dans un modéle murin ; en effet, chez la souris, l’antagonisme du RANTES diminue la formation des plaques d’athérosclérose . Chez l’humain, un polymorphisme du RANTES a été associée à une augmentation de la mortalité chez l’insuffisant rénal ou chez le diabétique . De nouveau, RANTES est aussi produit par le tissu adipeux viscéral et périvasculaire et peut de ce fait contribuer activement à l’athérosclérose du patient obèse.
Autres protéines à effet hormonal
Une des hormones les plus connues produite par le TAB est l’adiponectine qui représente l’hormone dérivée du TAB la plus abondante au niveau plasmatique. Elle joue un rôle positif sur la sensibilité à l’insuline et l’on retrouve des taux abaissés chez le diabétique de type 2 [25]. L’adiponectine aussi joue un rôle antiathérosclérotique car elle inhibe la prolifération de cellules musculaires lisses, phé- nomène important dans l’athérosclérose [26].
La résistine, dérivée du TAB et des macrophages, comme son nom l’implique a des effets délétères sur la résistance à l’insuline et a été associée à l’obésité et à la résistance à l’insuline [27]. De plus, en facilitant l’expression de molécules adhésives au niveau endothélial, la résistine pourrait avoir un effet pro-inflammatoires [28].
D’autres nouvelles molécules dérivées du TAB, tels que la visfatine ou la rétinol binding protein-4 (RBP-4) ont été découvertes dans les dernières années et ont été associées à la résistance à l’insuline [29, 30]. De même, le plasminogen activator inhibitor-1 (PAI-1) qui est un inhibiteur de la dégradation de la fibrine et favorise la formation de thrombus sur les plaques d’ahtérosclérose, est élevé chez le sujet obèse et pourrait contribuer à l’excès de risque cardio-vasculaire retrouvée dans cette population [31].
La leptine a été investiguée de façon intensive sur les dernières années ; la leptine a non seulement des actions centrales sur la modulation de la prise alimentaire au niveau hypothalamique, mais a aussi des effets inflammatoires en régulant l’expression de cytokines et chémokines. De plus la leptine a aussi des effets proangiogéniques indirectes via la stimulation des métalloprotéinases (MMPs) [32], une famille d’enzymes nécessaires à la dégradation du tissu extracellulaire, première étape du processus néo-angiogénique.
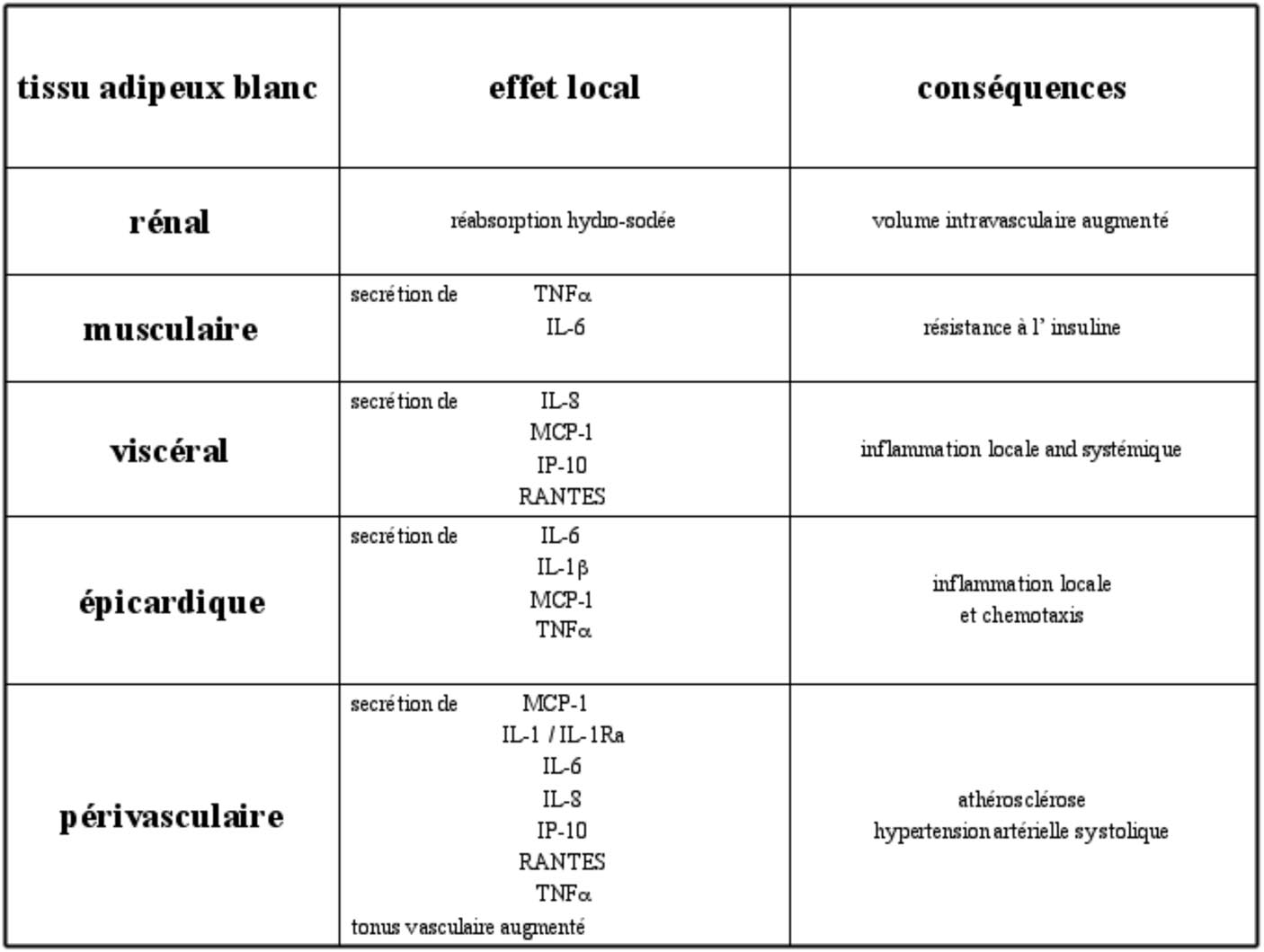
TABLEAU 1. — Distribution du tissu adipeux blanc chez l’humain avec effet local et conséquences cliniques Distribution du tissu adipeux dans l’organisme humain
Chez l’être humain, le tissu adipeux s’étend lors d’une prise pondérale non seulement aux localisations classiques telles que le tissu adipeux sous-cutané ou viscéral, mais aussi autour d’organes spécifiques tels que le rein, les muscles, le cœur (TAB épicardique) ou autour des vaisseaux (TAB périvasculaire) (tableau 1) [33]. Ces localisations spécifiques peuvent avoir des conséquences sur le tissu adjacent via un effet mécanique de compression et/ou via la sécrétion de substances entravant la fonction de l’organe voisin [3].
L’abondance du TAB viscéral ou intra-abdominal a été corrélée avec une augmentation du risque cardio-vasculaire [34]. Ce TAB est un facteur de risque pour une dyslipidémie, la résistance à l’insuline, le diabète et l’hypertension et peut être estimé par la mesure du tour de taille. Le tissu adipeux que l’on retrouve autour du cœur (TAB épicardique) peut être lui mesuré par échographie et semble être corrélé avec le TAB viscéral [35]. De plus, le TAB épicardique a une capacité sécrétoire importante [36]. En effet, récemment, il a été démontré que le TAB épicardique est capable de secréter de l’IL-6, le MCP-1 ou le TNFα. Chez des patients ayant subi une
opération de chirurgie cardiaque, la résistine et le TNFα sont augmentés transitoirement, contribuant à la résistance à l’insuline post-opératoire retrouvée chez ces patients [37].
Au niveau musculaire, il est bien connu qu’une accumulation de lipides intracellulaires au niveau des cellules musculaires est associée à une diminution de la sensibilité à l’insuline tel que cela a été décrit chez des indiens Pima [38]. Cependant, des données récentes suggèrent aussi que le tissu adipeux extracellulaire, localisé sous le fascia lata de la cuisse est associé à une augmentation de la résistance à l’insuline [39]. Des cytokines avec effet négatif sur la résistance à l’insuline telles que l’IL-6, TNFα ou des acides gras libres pourraient contribuer au développement d’une résistance locale à l’insuline.
Dans des modèles d’obésité murine, des dépôts de tissu adipeux intrarénaux altèrent la structure rénale [33]. Il a été démontré que lors de dépôts de tissu adipeux intra-rénal, il y a une réabsorption augmentée de sodium et d’eau, pouvant contribuer à l’hypertension retrouvée chez le sujet obèse. De plus, l’hyperinsulinisme a un effet de rétention hydro-sodée direct avec par conséquence une augmentation du volume intra-vasculaire [40]. D’autres mécanismes ont été évoquées dans la pathogenèse de l’hypertension artérielle associée à l’obésité telles que l’activation du système sympathique ou du système rénine-angiotensine [41].
Rôle du tissu adipeux périvasculaire dans le développement de l’athérosclérose
Le tissu adipeux périvasculaire que l’on retrouve autour des artères peut avoir un effet direct local dans la pathogenèse de l’artériosclérose via la sécrétion de cytokines /chemokines susmentionnées et par une augmentation mécanique de la rigidité de la paroi [3, 42]. L’augmentation du tissu adipeux périvasculaire que l’on retrouve chez l’obèse peut par une diminution de l’effet Windkessel (vitesse de l’onde de retour au cœur plus rapide et par conséquence augmentation de la pression durant la systole) et par une rigidité accrue de la paroi, contribuer à l’hypertension retrouvée chez l’obèse.
D’autre part, le tissu adipeux périvasculaire sécrète de nombreuses cytokines/ chémokines avec un effet pro-angiogénique [3]. Cette néo-angiogenèse est une caractéristique de la formation de la plaque, car elle permet de créer un réseau nutritif (oxygène et nutriments) nécessaire au développement de la plaque et son expansion.
Conclusion
Le tissu adipeux se développe lors d’un excès pondéral et par sa sécrétion de cytokines pro-inflammatoires telles que l’IL-1 et IL-1Ra, le TNFα ou l’IL-6 contribue à l’inflammation systémique que l’on retrouve dans l’obésité. De plus, le tissu adipeux s’expand dans des localisations diverses au niveau du corps avec comme conséquences au niveau rénal une augmentation du volume intra-vasculaire et au
niveau du muscle squelettique une résistance à l’insuline. De par sa localisation ubiquitaire, le tissu adipeux périvasculaire pourrait jouer un rôle majeur dans le développement de l’athérosclérose. En effet, le TAB périvasculaire sécrète de nombreuses cytokines et chémokines (IL-1, TNFα, IL-6, MCP-1, RANTES) qui induisent une inflammation localisée de la paroi vasculaire suivie d’un remodelling et une chemo-attraction de nouvelles cellules inflammatoires. Parallèlement, ce phénomène inflammatoire induit une migration et prolifération des cellules musculaires lisses ainsi qu’une néo-angiogenèse nécessaire pour le développement et l’expansion de la plaque.
Si on considère tous ces éléments ensemble, le tissu adipeux viscéral et périvasculaire, de part leur capacité sécrétoire contribuent à l’inflammation systémique et probablement à la progression de l’athérosclérose et l’hypertension qui sont des facteurs de morbidité et mortalité majeurs chez le patient obèse. Dans le futur, de nouvelles études seront nécessaires pour évaluer de façon spécifique l’action causale de chaque élément de cette cascade inflammatoire.
BIBLIOGRAPHIE [1] JUGE-AUBRY C.E., HENRICHOT E., MEIER C.A. — Adipose tissue : a regulator of inflammation.
Best. Pract. Res. Clin. Endocrinol. Metab., 2005, 19, 547-566.
[2] SCHAFFLER A., MULLER-LADNER U., SCHOLMERICH J., BUCHLER C. — Role of adipose tissue as an inflammatory organ in human diseases. Endocr. Rev., 2006, 27 , 449-467.
[3] THALMANN S., MEIER C.A. — Local adipose tissue depots as cardiovascular risk factors.
Cardiovasc. Res., 2007.
[4] FELDMANN M., OPPENHEIM J.J. —
Introduction to the Role of cytokines in Innate Host Defense and Adaptative Immunity . 2001, p. 3-20.
[5] AGGARWAM B., SAMANTA A., FELDMANN M. — In Oppenheim JJ & Feldmann M (eds.) —
TNF.
Cytokine Reference 2000, New York, London, p. 413-434.
[6] VENTRE J., DOEBBER T., WU M., MACNAUL K., STEVENS K., PASPARAKIS M. et al. — Targeted disruption of the tumor necrosis factor-alpha gene : metabolic consequences in obese and nonobese mice. Diabetes, 1997, 46, 1526-1531.
[7] HENRICHOT E., JUGE-AUBRY C.E., PERNIN A., PACHE J.C., VELEBIT V., DAYER J.M. et al. —
Production of chemokines by perivascular adipose tissue : a role in the pathogenesis of atherosclerosis. Arterioscler. Thromb. Vasc. Biol., 2005, 25, 2594-2599.
[8] SCHERRER U., SARTORI C. — Defective nitric oxide synthesis : a link between metabolic insulin resistance, sympathetic overactivity and cardiovascular morbidity. Eur. J. Endocrinol., 2000, 142, 315-323.
[9] SUZAWA M., TAKADA I., YANAGISAWA J., OHTAKE F., OGAWA S., YAMAUCHI T. et al. —
Cytokines suppress adipogenesis and PPAR-gamma function through the TAK1/TAB1/NIK cascade. Nat. Cell. Biol., 2003, 5, 224-230.
[10] AREND W.P. — Interleukin-1 receptor antagonist : discovery, structure and properties.
Prog
Growth Factor Res., 1990, 2, 193-205.
[11] BURGER D., DAYER J. in Oppenheim JJ & Feldmann M (eds.) —
Cytokine Reference 2000, New
York, London, 319-336.
[12] SOMM E., HENRICHOT E., PERNIN A., JUGE-AUBRY C.E., MUZZIN P., DAYER J.M. et al. —
Decreased fat mass in interleukin-1 receptor antagonist-deficient mice : impact on adipogenesis, food intake, and energy expenditure. Diabetes, 2005, 54, 3503-3509.
[13] RONTI T., LUPATTELLI G., MANNARINO E. — The endocrine function of adipose tissue : an update. Clin. Endocrinol. (Oxf.,) 2006, 64, 355-365.
[14] ROTTER V., NAGAEV I., SMITH U. — Interleukin-6 (IL-6) induces insulin resistance in 3T3-L1 adipocytes and is, like IL-8 and tumor necrosis factor-alpha, overexpressed in human fat cells from insulin-resistant subjects. J. Biol. Chem., 2003, 278, 4 5777-45784.
[15] WALLENIUS V., WALLENIUS K., AHREN B., RUDLING M., CARLSTEN H., DICKSON S.L. et al. —
Interleukin-6-deficient mice develop mature-onset obesity.
Nat. Med., 2002, 8, 75-79.
[16] TAKAHASHI K., MIZUARAI S., ARAKI H., MASHIKO S., ISHIHARA A., KANATANI A. et al. —
Adiposity elevates plasma MCP-1 levels leading to the increased CD11b-positive monocytes in mice. J. Biol. Chem., 2003, 278, 46654-46660.
[17] SELL H., DIETZE-SCHROEDER D., KAISER U., ECKEL J. — Monocyte chemotactic protein-1 is a potential player in the negative cross-talk between adipose tissue and skeletal muscle. Endocrinology, 2006, 147, 2458-2467.
[18] BOISVERT W.A. — Modulation of atherogenesis by chemokines.
Trends Cardiovasc. Med. ;
2004, 14, 161-165.
[19] GOSLING J., SLAYMAKER S., GU L., TSENG S., ZLOT C.H., YOUNG S.G. et al. — MCP-1 deficiency reduces susceptibility to atherosclerosis in mice that overexpress human apolipoprotein B. J. Clin. Invest., 1999, 103, 773-778.
[20] BORING L., GOSLING J., CLEARY M., CHARO I.F. — Decreased lesion formation in CCR2-/-mice reveals a role for chemokines in the initiation of atherosclerosis. Nature, 1998, 394, 894-897.
[21] STRACZKOWSKI M., DZIENIS-STRACZKOWSKA S., STEPIEN A., KOWALSKI I., SZELACHOWSKA M., KINALSKA I. — Plasma interleukin-8 concentrations are increased in obese subjects and related to fat mass and tumor necrosis factor-alpha system. J. Clin. Endocrinol. Metab., 2002, 87, 4602-4606.
[22] HUO Y., WEBER C., FORLOW S.B., SPERANDIO M., THATTE J., MACK M. et al. — The chemokine
KC, but not monocyte chemoattractant protein-1, triggers monocyte arrest on early atherosclerotic endothelium. J . Clin. Invest., 2001, 108, 1307-1314.
[23] VEILLARD N.R., KWAK B., PELLI G., MULHAUPT F., JAMES R.W., PROUDFOOT A.E. et al. —
Antagonism of RANTES receptors reduces atherosclerotic plaque formation in mice.
Circ. Res.
2004, 94, 253-261.
[24] BOGER C.A., FISCHEREDER M., DEINZER M., ASLANIDIS C., SCHMITZ G., STUBANUS M. et al. —
RANTES gene polymorphisms predict all-cause and cardiac mortality in type 2 diabetes mellitus hemodialysis patients. Atherosclerosis, 2005, 183, 121-129.
[25] KADOWAKI T., YAMAUCHI T., KUBOTA N., HARA K., UEKI K., TOBE K. — Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J. Clin. Invest.
2006, 116, 1784-1792.
[26] CHANDRAN M., PHILLIPS S.A., CIARALDI T., HENRY R.R. — Adiponectin : more than just another fat cell hormone ? Diabetes Care, 2003, 26, 2442-2450.
[27] AZUMA K., KATSUKAWA F., OGUCHI S., MURATA M., YAMAZAKI H., SHIMADA A. et al. —
Correlation between serum resistin level and adiposity in obese individuals.
Obes. Res., 2003, 11, 997-1001.
[28] SKILTON M.R., NAKHLA S., SIEVEKING D.P., CATERSON I.D., CELERMAJER D.S. — Pathophysiological levels of the obesity related peptides resistin and ghrelin increase adhesion molecule expression on human vascular endothelial cells. Clin. Exp. Pharmacol. Physiol., 2005, 32, 839-844.
[29] HUG C., LODISH H.F. — Medicine. Visfatin : a new adipokine.
Science, 2005, 307, 366-367.
[30] CHO Y.M., YOUN B.S., LEE H., LEE N., MIN S.S., KWAK S.H. et al. — Plasma retinol-binding protein-4 concentrations are elevated in human subjects with impaired glucose tolerance and type 2 diabetes. Diabetes Care, 2006, 29, 2457-2461.
[31] THOGERSEN A.M., JANSSON J.H., BOMAN K., NILSSON T.K., WEINEHALL L., HUHTASAARI F. et al. — High plasminogen activator inhibitor and tissue plasminogen activator levels in plasma precede a first acute myocardial infarction in both men and women : evidence for the fibrinolytic system as an independent primary risk factor. Circulation, 1998, 98, 2241-2247.
[32] PARK H.Y., KWON H.M., LIM H.J., HONG B.K., LEE J.Y., PARK B.E. et al. — Potential role of leptin in angiogenesis : leptin induces endothelial cell proliferation and expression of matrix metalloproteinases in vivo and in vitro . Exp. Mol. Med. , 2001, 33, 95-102.
[33] MONTANI J.P., CARROLL J.F., DWYER T.M., ANTIC V., YANG Z., DULLOO A.G. — Ectopic fat storage in heart, blood vessels and kidneys in the pathogenesis of cardiovascular diseases. Int. J.
Obes. Relat. Metab. Disord., 2004, 28 Suppl 4, S58-65.
[34] KANNEL W.B., CUPPLES L.A., RAMASWAMI R., STOKES J. RD, KREGER B.E., HIGGINS M. — Regional obesity and risk of cardiovascular disease ; the Framingham Study. J. Clin. Epidemiol., 1991, 44, 183-190.
[35] IACOBELLIS G., ASSAEL F., RIBAUDO M.C., ZAPPATERRENO A., ALESSI G., DI MARIO U. et al. —
Epicardial fat from echocardiography : a new method for visceral adipose tissue prediction.
Obes. Res. , 2003, 11, 304-310 [36] MAZUREK T., ZHANG L., ZALEWSKI A., MANNION J.D., DIEHL J.T., ARAFAT H. et al. — Human epicardial adipose tissue is a source of inflammatory mediators.
Circulation, 2003, 108, 2460- 2466.
[37] KREMEN J., DOLINKOVA M., KRAKICKOVA J., BLAHA J., ANDERLOVA K., LACINOVA Z. et al. —
Increased subcutaneous and epicardial adipose tissue production of proinflammatory cytokines in cardiac surgery patients : possible role in postoperative insulin resistance. J. Clin.
Endocrinol. Metab., 2006.
[38] PAN D.A., LILLIOJA S., KRIKETOS A.D., MILNER M.R., BAUR L.A., BOGARDUS C. et al. —
Skeletal muscle triglyceride levels are inversely related to insulin action.
Diabetes, 1997, 46, 983-988.
[39] GOODPASTER B.H., THAETE F.L., KELLEY D.E. — Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. Am. J. Clin. Nutr. , 2000, 71, 885-892.
[40] HALL J.E. — Mechanisms of abnormal renal sodium handling in obesity hypertension.
Am. J.
Hypertens., 1997, 10, 49S-55S.
[41] MONTANI J.P., ANTIC V., YANG Z., DULLOOO A. — Pathways from obesity to hypertension :
from the perspective of a vicious triangle. Int. J. Obes. Relat. Metab. Disord., 2002, 26 Suppl 2, S28-38.
[42] TOUNIAN P., AGGOUN Y., DUBERN B., VARILLE V., GUY-GRAND B., SIDI D. et al. — Presence of increased stiffness of the common carotid artery and endothelial dysfunction in severely obese children : a prospective study. Lancet, 2001, 358, 1400-1404.
DISCUSSION
M. Jean CIVATTE
Les adipocytes tumoraux (des lipomes, des lipomatoses plus ou moins systémiques, adipose généralisée) conservent-ils ou perdent-ils leur capacité secrétoire ? Qu’en est-il pour les
adipocytes de la « graisse brune » qui fonctionnent chez les animaux hibernants) et qui, chez l’homme, constituent des tumeurs appelées hibernomes ?
Bien que l’on sache que la graisse brune sécrète également des peptides, tels que la leptine, il n’y a pas d’études approfondies concernant des différences dans le profil sécrétoire du tissu adipeux brune et blanc. En ce qui concerne les adipocytes tumoraux, il n’y a pas à ma connaissance de donnés publiées. Néanmoins, les dépôts de tissu adipeux blanc intra-artriculaires ont été examinés dans l’arthrite rhumatoïde et on s’est aperçu que ces cellules produisent des quantités importantes de cytokines pro et anti-inflammatoires contribuant ainsi à la régulation de l’inflammation articulaire.
M. Roger NORDMANN
Il est classique de considérer que les surcharges adipeuses abdominales sont, notamment chez l’homme, plus athérogènes que les surcharges périphériques, en particulier chez la femme. Cette différence (si elle est confirmée) est-elle liée à une différence métabolique entre les deux localisations adipocytaires ou seulement à une localisation différente par rapport au système artériel de ces adipocytes ? Les cultures d’adipocytes sont-elles faites aussi bien à partir d’adipocytes d’origine périphérique ou abdominale ou convient-il de comparer les cultures issues de l’une ou l’autre de ces origines ?
La différence dans le profil sécrétoire des adipocytes abdominales et sous-cutanés est surtout quantitative et moins qualitative. Spécifiquement, le tissu adipeux viscéral produit typiquement des quantités plus importantes de cytokines pro-inflammatoires ainsi que certaines protéines (telles que la visfatine) qui lui sont propres. Les expériences décrites dans mon exposé ont surtout été effectuées avec le tissu adipeux sous-cutané, mais l’on retrouve des donnés comparable dans les quelques expériences que nous avons effectuées avec des adipocytes intraabdominaux.
M. Jean-François BACH
Vous avez décrit le rôle éventuel des adipocytes proches des grosses artères dans la pathogénie de l’athérosclérose. Qu’en est-il des petites artères ? Par ailleurs quel est le rôle des lymphocytes T que vous avez mentionnés ? Quel(s) antigène(s) reconnaissent-ils ?
Dans nos expériences nous avons surtout examiné le tissu adipeux périvasculaire entourant les grandes artères, telles que l’aorte. Cependant, il existe une publication qui a examiné le rôle du tissu adipeux entourant les artères épicardiques. À ma connaissance il n’y a pas d’étude qui a exploré le rôle du tissue adipeux entourant des artères plus petites.
Bien que nous ayons démontré que le tissu adipeux sécrète des cytokines chimiotactiques pour les leucocytes, nous n’avons pas exploré le rôle spécifique des lymphocytes T ou la nature des antigènes qu’ils reconnaissent. Cependant, les travaux d’autres groupes concernant l’inflammation chronique des artères qui caractérise l’athérosclérose, impliquent les lymphocytes dans la pathogenèse et la progression des plaques athéromateuses.
M. André-Laurent PARODI
Une publication récente fait état du rôle de la flore bactérienne intestinale sur le développement d’obésité et de diabète. Le facteur en cause serait la sécrétion accrue d’endotoxine,
laquelle développerait un rôle phlogogène systémique sur le tissu adipeux. Pourriez-vous commenter cette observation ?
Il s’agit d’une publication fort intéressante et stimulante. Elle fournit une hypothèse concernant l’inflammation à bas bruit présente chez des patients obèses. Cependant, ces travaux sont méthodiquement très exigeants et nécessitent certainement une confirmation à plus large échelle.
* Départment de Médecine Interne, Triemli Hôpital, Birmensdorferstrasse 497, CH-8063 Zürich, Suisse. ** Université de Genève, Faculté de Médecine, rue Michel-Servet 1, CH-1211 Genève 1, Suisse. Tirés-à-part : Professeur Christoph A. MEIER, même adresse. Article reçu et accepté le 14 mai 2007
Bull. Acad. Natle Méd., 2007, 191, nos 4-5, 897-910, séance du 22 mai 2007


