Résumé
En sécurisant le geste et en réduisant le risque de resténose, le stent a largement contribué à l’extension des indications de l’angioplastie coronaire qui, aujourd’hui, occupe l’ensemble du terrain clinique et coronarographique des coronaropathies. Hier nu et inactif et aujourd’hui habillé et actif, le stent couvert de substances susceptibles de minimiser au mieux le risque de resténose porte les espoirs de la cardiologie interventionnelle. Les premiers résultats sont prometteurs. Si le stent actif est effectivement efficace dans la prévention de la resténose, il lui reste cependant à prouver son efficacité sur le critère fort de la mortalité et des récidives d’infarctus du myocarde. Il ouvre la voie de la cardiologie post interventionnelle centrée par l’évaluation médico-économique, l’imagerie cardiaque non invasive et la stabilisation pharmacologique de l’athérosclérose.
Summary
By making safe the act and decreasing the restenosis risk, the stent had contributed to the development of coronary artery angioplasty wich fill nowadays the whole of clinical and coronarographical field of coronary artery disease. The new stent, coated with substances amenable to minimise the best the restenosis risk, holds the hopee of the interventional cardiology. The first results are promising. If the coated stent is effectively efficient in preventing restenosis, it has to proove his efficacy on the strong criterion of mortality and myocardial infarct recurences.
L’angioplastie coronaire transluminale (ACT) a grandement participé à améliorer le pronostic des coronaropathies chroniques et aiguës. Elle a profondément remanié la prise en charge diagnostique et thérapeutique des coronariens. Depuis la première
angioplastie coronaire, la cardiologie interventionnelle tente d’élargir son champ d’application en développant des dispositifs susceptibles de sécuriser le geste et d’en garantir le résultat à long terme. Seuls les stents, qui ont bénéficié d’un environnement médicamenteux associant deux antiagrégants plaquettaires, se sont véritablement imposés en démontrant leur aptitude à réduire le risque des deux écueils majeurs de l’angioplastie : l’occlusion coronaire lors de la procédure et la resténose à moyen terme. Aujourd’hui, le stent actif, couvert (habillé) de substances susceptibles de minimiser au mieux le risque de resténose porte les espoirs de la discipline.
Avec la pose d’au moins un stent dans 90 % des cas environ, la cardiologie interventionnelle occupe actuellement l’ensemble du territoire clinique et anatomique des coronaropathies. Et pourtant, malgré ses spectaculaires et gratifiants succès, la méthode reste encore aujourd’hui à valider à l’aune de l’évaluation médicoéconomique et à nuancer au regard des résultats obtenus par les mesures de prévention et les progrès du traitement médicamenteux athéro-stabilisateur. Et pourtant, malgré la place éminente qu’il occupe aujourd’hui, le coronarographiste dilatateur voit sa place et son rôle discutés par l’émergence de l’imagerie cardiaque non invasive.
LE DÉVELOPPEMENT DES STENTS
Le principe et la réalisation d’une contention d’un vaisseau anormal sont bien antérieurs à la pratique des premières dilatations artérielles. En effet, on assure que, déjà dans l’antiquité, les Égyptiens soignaient les rétrécissements de l’urètre par l’introduction d’un petit roseau dans le canal urinaire afin, pense-t-on, de rétablir des relations plus fluides entre le monde du dedans et celui du dehors (Figure 1). La médecine ayant trouvé depuis lors des solutions curatives et préventives moins douloureuses, il y a bien longtemps que les Égyptiens ne s’infligent plus une telle punition. Et pourtant, aujourd’hui, si nous n’introduisons plus de stent végétal dans l’urètre, nous posons des stents métalliques dans la coronaire.
L’implantation du premier stent endocoronaire appartient à la logique d’une longue évolution diagnostique et thérapeutique qui a conduit la médecine à décrire l’angine de poitrine, comprendre l’ischémie myocardique, observer les anomalies de la lumière coronaire par la coronarographie, contourner les sténoses par le pontage puis les effacer par l’angioplastie et enfin à poser ce corps étranger dans la lumière coronaire afin d’en contenir la paroi. Les véritables initiateurs et inventeurs de cette étape thérapeutique sont Charles Dotter et Andréas Grüntzig. Dès 1969, le premier, radiologue, avait démontré chez l’animal qu’il était possible d’implanter dans une lumière artérielle un tube métallique sans compromettre automatiquement la perméabilité du vaisseau. Le second, cardiologue, a conçu et réalisé les premières dilatations artérielles par ballonnet, diffusé la méthode et identifié le double risque d’occlusion et de resténose. Le projet du stent était dès lors évident afin de contrôler ces deux complications potentielles de l’angioplastie.

FIG. 1. — Stent végétal et … urétral.
J’ai implanté le premier stent endocoronaire chez l’homme au mois de mars 1986, au décours d’une expérimentation animale bien trop courte qui, si elle avait prouvé la faisabilité de la méthode et confirmé le développement rapide d’un recouvrement néo endothélial des mailles du stent, n’avais pas permis de mesurer le réel potentiel thrombogène de ce corps étranger. L’histoire du premier patient est bien banale :
63 ans, une hypertension artérielle et une resténose symptomatique six mois après une dilatation par ballonnet du deuxième segment de l’interventriculaire-antérieure (IVA) (1). Cette première, réalisée sous le couvert d’une seule héparinothérapie sous cutanée administrée pendant six semaines, fut un succès angiographique et clinique. Le patient est aujourd’hui âgé de 83 ans. Sa coronaropathie a évolué puisqu’il a dû subir une angioplastie par athérectomie directionnelle de l’IVA ostiale en 1995 et la pose d’un deuxième stent sur la circonflexe en 2004 (Figure 2). Un succès initialement prometteur mais cependant trompeur. En effet, les premières séries de patients ont révélé un taux d’occlusion précoce exagérément élevé voisin de 15 à 20 % et ainsi, démontré la faible efficacité du traitement anticoagulant dans la prévention de cette complication responsable d’infarctus du myocarde et/ou de décès.
Le stent n’a véritablement trouvé sa place dans l’arsenal instrumental de l’angioplastie que dix ans plus tard quand d’une part le recours à une double antiagrégation plaquettaire a permis de réduire significativement le taux d’occlusion par thrombose
FIG. 2. — Premier stent coronaire posé chez l’homme au mois de mars 1986 au deuxième segment de l’IVA pour une resténose post dilatation. Pas de resténose au contrôle angiographique réalisé 18 ans plus tard en 2004 pour un angor instable en relation avec une sténose de la circonflexe.
au-dessous du seuil de 10 % et quand d’autre part l’endoprothèse a prouvé sa supériorité sur la seule dilatation au ballonnet dans la prévention de la resténose [2-5]. Dès lors, le stent pouvait se développer sans contrainte et même depuis peu …
s’habiller de substances pharmacologiquement actives.
L’histoire du premier stent coronaire est instructive. Si notre premier malade a été épargné par la thrombose sur stent et la resténose intrastent, il n’a pas échappé à l’évolution du processus athéromateux responsable de deux reprises angineuses nécessitant deux nouvelles angioplasties. Son histoire apprend que le stent n’est qu’une solution mécanique et focale apportée à une affection diffuse, évolutive et de nature biologique et que l’athérosclérose relève d’un traitement systémique curatif et surtout préventif. Dans le concert de louanges qui salue les triomphes de la cardiologie interventionnelle, la discipline peut se demander si, à l’instar du petit roseau urétral, le stent n’est pas appelé, lui aussi, à disparaître.
Les performances et la place du stent
Aujourd’hui, plus sûre et de réalisation plus rapide, l’angioplastie occupe l’ensemble du terrain anatomique et clinique des coronaropathies et représente la première des méthodes de revascularisation avec un rapport de 5 pour 1 environ au regard du pontage. Depuis l’ischémie myocardique silencieuse jusqu’à la phase aiguë de
l’infarctus du myocarde (IDM) en passant par l’angor stable, depuis la sténose simple jusqu’à la lésion du tronc commun gauche en passant par la sténose des bifurcations, le cardiologue interventionnel a démontré la faisabilité de la méthode.
Ainsi, en France de 1990 à 2002 [6], le nombre annuel de patients traités par ACT a évolué de 30 885 en 1990 à plus de 110 000 en 2003. La pose d’un stent est quasiment systématique sauf dans les rares situations coronarographiques où l’implantation de ce corps étranger est impossible. Au cours de l’année 2000, les angioplasties pratiquées en France ont été complétées par la pose d’au moins un stent dans 84 % des cas avec une moyenne de 1,4 stent par patient.
Les résultas immédiats sont excellents et incitent, bien sûr, à l’élargissement des indications de la méthode. Les résultats d’un observatoire récent (registre PACIFIQUE coordonné par Nicolas Danchin), conduit sur une période de deux semaines au cours du mois de janvier 2004, illustrent la maîtrise de l’angioplastie. Ce registre, qui recrute 2357 patients pris en charge dans 55 % des cas dans le cadre d’un syndrome coronaire aigu, rapporte un taux de « stenting » de 95 %. Il fait état d’un succès primaire (sténose résiduelle < à 50 % sans complication clinique hospitalière) dans 96 % des cas avec une mortalité hospitalière de 1,8 % et un taux de recours à la chirurgie en urgence de 0,3 %. Les circonstances propices à la survenue d’une occlusion aiguë ou d’une migration de matériel athéro-thrombotique, susceptibles de provoquer un infarctus du myocarde et/ou un décès, sont bien identifiées. Elles correspondent aux formes les plus sévères des coronaropathies : l’angor instable, l’infarctus du myocarde aigu, le diabète, les lésions thrombosées et, bien sûr, les angioplasties mal conduites.
Ultérieurement le patient est exposé à un triple risque : d’abord la resténose intrastent et l’occlusion aiguë par thrombose du stent et, plus tardivement, l’évolutivité du processus athéromateux.
La pose d’un stent réduit de 30 à 40 % le risque de resténose post ATC en contrecarrant le phénomène de retour élastique de la paroi de l’artère observé après une dilatation par ballonnet. Le stent nu et inactif, toutefois, ne supprime pas le risque de resténose car il n’interdit pas, et voire même exagère, le phénomène de cicatrisation hyperplasique de la paroi. En recouvrant les mailles du stent, en isolant ainsi ce corps étranger et en minimisant le risque d’agrégation plaquettaire et de thrombose, ce phénomène cicatriciel est salutaire. Mais il peut être délétère quant il est bourgeonnant et par conséquent sténosant. Fibreuse, passive, menaçant les six premiers mois d’évolution et n’engageant pas le pronostic à long terme, la resténose sur un stent nu inactif demeure souvent asymptomatique (7). Elle est alors dépistée par les tests d’effort. Son incidence clinique est appréciée par le taux de nouvelle revascularisation du vaisseau traité qui, selon les circonstances, varie de moins de 10 % à plus de 50 % chez les patients qui cumulent les facteurs de risque de resténose actuellement bien identifiés ; diabète, angor instable, élévation de la CRP, sténoses longues, artères de petit calibre, pose de plusieurs stents et résultat imparfait de la procédure.
Moins élevé, le risque d’occlusion aiguë secondaire par thrombose sur stent est beaucoup plus grave (8). Observée dans 1 % des cas environ, en dépit d’une double antiagrégation plaquettaire, la thrombose d’un stent nu survient le plus souvent dans le mois suivant l’implantation et exceptionnellement au-delà. Ses conséquences sont gravissimes, dominées par un taux d’infarctus du myocarde de 65 % et une mortalité à 6 mois de 20 %.
Au-delà, le risque est celui de l’évolution du processus athéromateux. Ce risque doit être évalué dès la phase hospitalière. L’évaluation globale du risque appartient au cardiologue interventionnel qui est aussi en devoir de rédiger l’ordonnance de sortie, de mettre en place les mesures hygiéno-diététiques et de programmer le suivi du patient et non de la seule angioplastie.
Les stents actifs
Le stent peut être utilisé comme une plateforme destinée à délivrer des substances pharmacologiques actives susceptibles de contrôler le processus de recouvrement hyperplasique des mailles et de minimiser au mieux le risque de resténose. De nombreux médicaments, portés in situ par le stent, ont déjà été évalués. Les anticoagulants (héparine), les corticoïdes (dexaméthazone), les agents supposés interdire la migration des cellules musculaires lisses qui participent à l’hyperplasie de recouvrement (batimasta) ont échoué dans la prévention de la resténose. Seuls, les stents actifs, porteurs et délivreurs de substances cytotoxiques ou cytostatiques à partir d’une gaine de polymères habillant les mailles, ont fait la preuve clinique de leur efficacité.
En 2002, l’étude RAVEL [9] a ouvert la porte clinique aux stents actifs. Recrutant 238 patients présentant des sténoses simples, cet essai randomisé novateur a évalué chez l’homme l’efficacité d’un stent habillé de sirolimus, agent cytostatique. À six mois, le taux de resténose est nul dans le groupe de patients ayant reçu un stent actif et de 26,6 % dans le groupe des sujets traités par la pose d’un stent nu inactif. Pour la première fois, une étude révélait l’absence de resténose intrastent. Spectaculaire, ce résultat n’a pas manqué de soulever l’enthousiasme d’une discipline prompte à s’enflammer.
Plus représentatives, car incluant des patients peu sélectionnés, deux études récentes appuient les résultats de RAVEL en les nuançant cependant. SIRIUS [10] et TAXUS [11] évaluent deux stents actifs délivrant le Sirolimus pour la première et le paclitaxel, agent cytotoxique, pour la seconde (Tableau 1). L’une et l’autre confirment l’efficacité des stents actifs sur le critère angiographique de la resténose. Bien sûr, dans ces deux études, le taux de deuxième intervention sur la coronaire étayée est significativement plus faible dans le groupe des patients recevant un stent actif. Ce bénéfice est observé dans les différents sous groupes de ces deux études, notamment dans les populations à risque élevé de resténose tels que les diabétiques et dans les sténoses longues affectant des artères coronaires de petit calibre. Cependant, sur les critères fort de l’évaluation clinique, ces deux essais n’affirment pas la supériorité des stents actifs. En effet, à huit mois dans SIRIUS et à un an dans TAXUS, les taux de mortalité et d’IDM ne sont pas différents entre les deux groupes de malades.
TABLEAU 1.
SIRIUS (Sirolimus) TAXUS (Paclitaxel) (n = 1053 pts) (n = 1314 pts) Stent actif Stent nu Stent actif Stent nu Resténose > à 50 % (%) 3,2*
35,4 7,9*
26,6*
Deuxième revascularisation (%) 4,1*
16,6 3,0*
11,3 Décès (%) 0,9 0,6 1,4 1,3 Infarctus du myocarde (%) 2,8 3,2 3,5 4,7 Thrombose intrastent (%) 0,4 0,8 0,6 0,8 * Différence significative.
La portée des résultats de ces études reste limitée car le recul de leur suivi est encore insuffisant pour apprécier l’incidence réelle de la resténose et de la thrombose tardives dont les taux sont possiblement sous-estimés. Actif afin de contrôler le phénomène de recouvrement cicatriciel des mailles, le stent peut soit retarder l’installation de ce processus avec le développement possible d’une resténose tardive soit, en revanche, l’interdire avec le risque potentiel d’une thrombose différée de ce corps étranger métallique non recouvert par une néo intima. Au cours de la première année du suivi, le taux de thrombose n’est pas différent entre les stents actifs et les stents nus. Au-delà, quelques cas de thromboses tardives sur stents actifs, survenues à l’occasion de l’interruption du traitement antiagrégant plaquettaire, sont déjà rapportés dans la littérature [12, 13]. Ces observations soulignent l’impérieuse nécessité du maintien au long cours d’une double antiagrégation plaquettaire dans les suites de l’implantation d’un stent actif. Arbitrairement proposée pour un délai de 6 à 12 mois, la durée de l’association aspirine — clopidogrel reste à préciser.
Il convient donc d’assurer un suivi à long terme des stents actifs, implantés dans le cadre des essais comme des registres, pour porter un jugement plus clairvoyant sur la réelle utilité de cette dernière acquisition de la cardiologie interventionnelle. Dans l’attente, les indications de l’implantation d’un stent actif restent à préciser. Au regard du risque, faible mais gravissime, de la thrombose et du risque, plus fort mais bénin, de la resténose, seuls les patient à très fort risque de resténose relèvent aujourd’hui raisonnablement de l’implantation d’un stent actif. C’est le cas des diabétiques présentant de longues sténoses sur des artères de petit calibre. À l’opposé, la pose d’un tel stent doit être formellement évitée dans toutes les situations où le maintien durable de l’association de clopidogrel et d’aspirine ne peut pas être garanti. C’est le cas des patients à risque hémorragique élevé et des malades devant faire l’objet d’une intervention ultérieure imposant l’arrêt de l’antiagrégation médicamenteuse.
La cardiologie post interventionnelle.
Les stents actifs apparaissent dans un contexte clinique, scientifique et thérapeutique qui n’est plus celui de la cardiologie interventionnelle. Le temps n’est plus celui de la conquête interventionnelle. La faisabilité de la méthode n’est plus à démontrer, il faut en prouver la réelle utilité pour le patient en particulier et la santé publique en général. Il ne s’agit plus seulement de développer de nouveaux outils interventionnels qui, pour la plupart, sont appelés à rejoindre le musée de la médecine comme l’illustre l’éphémère histoire des lasers, athérotomes, ballons chauffants et autres ballons coupants. Le temps est aussi celui d’une connaissance clinique plus approfondie du processus athéromateux qui ne place plus la seule image coronarographique et le seul cardiologue angioplasticien coronarographiste au centre des décisions diagnostiques et thérapeutiques.
Quatre fois supérieur à celui du stent nu, le prix du stent actif souligne les devoirs de l’évaluation précise non seulement du dispositif mais aussi de l’angioplastie dans son ensemble. Le stent actif est en cours de validation par rapport au stent nu qui, lui-même, a prouvé sa supériorité sur la seule dilation par ballonnet. Cependant, la validation de l’angioplastie et celle, en amont, de la coronarographie restent encore approximatives, incertaines et évolutives au regard du polymorphisme des formes cliniques des coronaropathies et de la grande disparité des anomalies coronaires détectées par la coronarographie. Si l’une et l’autre se justifient dans le cadre des syndromes coronaires aigus, leur place reste controversée dans le contexte des formes stables et a fortiori asymptomatiques de la maladie [14, 15]. Sur les bases de la coronarographie, il est trop souvent réalisé une angioplastie sur le seul argument de la faisabilité. Il convient préalablement de justifier le principe même de la revascularisation au regard du risque myocardique, des anomalies observées et ensuite d’en définir la modalité, chirurgicale ou interventionnelle. Les recommandations n’apportent pas toutes les réponses aux questions posées par le choix du traitement des anomalies coronarographiques. C’est encore au cas par cas que la décision thérapeutique est prise en tenant compte du rapport bénéfice risque soumis aux trois règles de l’efficacité, de la sécurité et de la sobriété. Les registres et les essais avec un suivi au long cours sont encore indispensables pour établir des recommandations plus pertinentes.
Les décisions thérapeutiques sont prises sur la base des données d’un examen dont les performances diagnostiques et pronostiques sont limitées parce que la coronarographie visualise la seule lumière et n’explore pas la paroi de l’artère. Les discordances entre la nature des images coronarographiques d’une part et la présentation clinique et évolutive des coronaropathies d’autre part témoignent des limites de cet examen effractif dont le pouvoir prédictif négatif reste pauvre (Figure 3). En effet, les récidives d’IDM sont le plus souvent en relation avec des lésions non identifiées par la coronarographie pratiquée au décours du premier IDM [16].
L’imagerie cardiaque non effractive, avec le scanner multi-barrettes et la résonance magnétique nucléaire, est appelée à pénétrer le champ d’exploration des coronaires
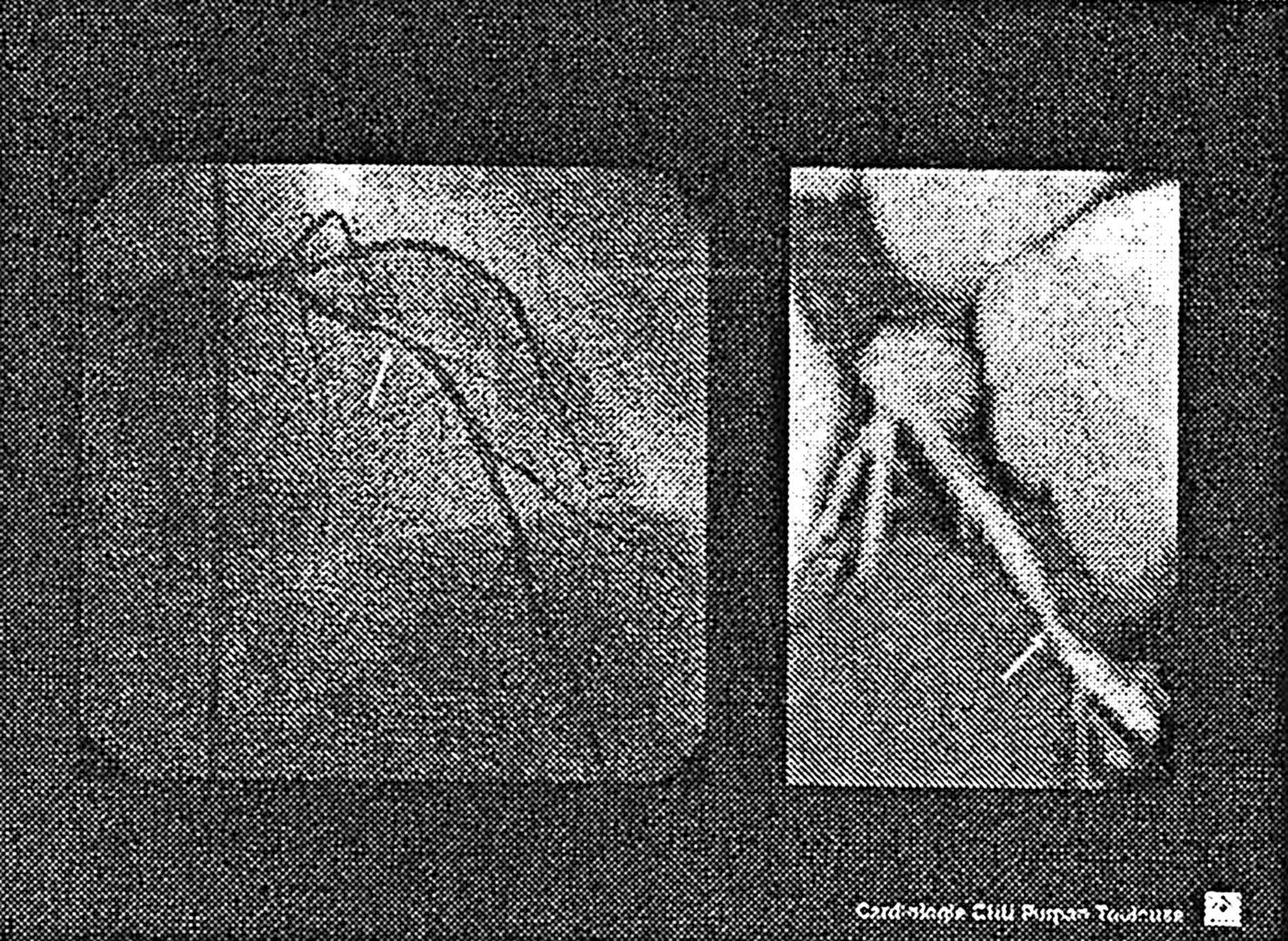
FIG. 3. — Discordance anatomique et coronarographique qualitative. A) Coronarographie sub normale à la première heure d’une lyse réalisée à la deuxième heure d’un IDM antérieur. B) Échographie endocoronaire (IVUS) : lésion athéromateuse (pointillés jaunes) non sténosante et rompue avec faux chenal intra pariétal (**).
FIG. 4. — Lésion significative de l’IVA moyenne (flèche) objectivée par la coronarographie à gauche et visualisée par le scanner multi-barrettes à droite.
(figure 4). Cette nouvelle imagerie, qui d’ores et déjà est en mesure de visualiser les anomalies des gros troncs coronaires et d’identifier les lésions susceptibles de bénéficier d’une revascularisation [17], ambitionne aussi d’apporter des informations sur la qualité de la perfusion myocardique et, mieux que la coronarographie, d’approcher la nature des lésions athéromateuses. Avec l’amélioration de leurs performances, ces examens sont conduits à occuper une place grandissante dans la prise en charge des coronariens patents ou potentiels. La coronarographie ne sera plus aussi exclusivement déterminante dans les décisions de revascularisation et le rôle du coronarographiste ne sera plus aussi central dans le choix thérapeutique.
L’observation clinique actuelle de l’athérosclérose révèle que le pronostic des coronariens repose moins sur la sténose levée par l’ACT que sur le potentiel évolutif des lésions d’athérosclérose vulnérables et non sténosantes. L’avenir doit orienter bien sûr vers l’identification des lésions à risque éruptif mais surtout vers un meilleur dépistage et une prise en charge attentive des patients à risque évolutif. Les lésions à risque étant nombreuses et diffuses et leur devenir restant encore méconnu et imprévisible, l’avenir thérapeutique s’oriente moins vers le développement de la cardiologie interventionnelle que vers la mise en forme d’une athérostabilisation pharmacologique systémique préfigurée dès aujourd’hui par les statines, les inhibiteurs de l’enzyme de conversion et les antiagrégants plaquettaires.
BIBLIOGRAPHIE [1] PUEL J., JOFFRE F., ROUSSEAU H. et al . — Endoprothèses coronaires dans la prévention de la resténose post dilatation. Résultats préliminaires.
Arch. Mal. Cœur. Vaiss., 1987, 80 , 1311.
[2] BARRAGAN P., PIETRI P., VILLAIN P. et al. — Antiplatelet therapy during coronary endoprosthesis placement.
Arch. Mal. Cœur. Vaiss., 1996 Nov, 89 , 1515-20.
[3] KARRILLON G.J., MORICE MC., BEVENISTE E. et al. — Intracoronary stent implantation without ultrasound guidance and with replacement of conventional anticoagulation by antiplatelet therapy. 30-day clinical outcome of the French Multicenter Registry. Circulation , 1996, 1, 94 , 1519-27.
[4] BERTAND ME., LEGRAND V., BOLAND J. et al. — Randomized multicenter comparison of conventional anticoagulation versus antiplatelet therapy in unplanned and elective coronary stenting. The full anticoagulation versus aspirin and ticlopidine (Fantastic Study). Circulation, 1998, 98 , 1597-603.
[5] SERRUYS PW., DE JAEGERE P., KIEMENEIJ F. et al. — A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease. Benestent Study Group. N. Engl. J. Med., 1994, 331 , 489-95.
[6] LE TOURNEAU T., BLANCHARD D., LABLANCHE JM. et al. — Évolution de la Cardiologie interventionnelle en France au cours de la dernière décennie. 1991, 2000.
Arch. Mal. Cœur., 2002, 95, 1188-94.
[7] WEINTRAUB WS., GHAZZAL ZM., DOUGLAS JS. JR. et al. — Long-term clinical follow-up in patients with angiographic restudy after successful angioplasty.
Circulation , 1993, 87 , 831-40.
[8] CUTLIP DE., BAIM DS., HO KKL. et al. — Stent thrombosis in the modern era. Circulation, 2001, 103 , 1967-71.
[9] MORICE MC., SERRUYS PW., SOUSA JE . et al. — A randomized comparison of a sirolimuseluting stent with a standard stent for coronary revascularization.
N. Engl. J. Med., 2002, 346, 1773-80.
[10] MOSES JW., LEON MB., POPMA JJ. et al. — Sirolimus-Eluting Stents versus Standard Stents in
Patients with Stenosis in a Native Coronary Artery.
N. Engl. J. Med., 2003, 349 , 1315-23.
[11] STONE GW., ELLIS SG., COX DA. et al. — A polymer-based, paclitaxel-eluting stent in patients with coronay artery disease.
N. Eng. J. Med., 2004, 350 , 221-31.
[12] MC FADDEN EP., STABILE E., REGAR E. et al. — Late thrombosis in drug-eluting coronary stents after discontinuation of antiplatelet therapy.
Lancet. 2004, 364 , 1466-7.
[13] VIRMANI R., GUAGLIUMI G., FARB A. et al. — Localized hypersensitivity and late coronary thrombosis secondary to a sirolimus-eluting stent : should we be cautious ?
Circulation, 2004, 109 , 701-5.
[14] BERTAND ME., SIMOONS ML., FOX KA. et al. — Management of acute coronary syndromes in patients presenting without persistent ST-segment elevation.
EJ , 2002, 23 , 1809-40.
[15] DELAHAYE F., BORY M., COHEN A. et al. — Recommandations de la Société Française de
Cardiologie concernant la prise en charge de l’infarctus du myocarde après la phase aiguë,
Arch.
Mal. Cœur., 2001, 94 , 697-725.
[16] MICHAELS AD., GOLDSCHLAGER N. — Risk stratification after myocardial infarction in the reperfusion era. Progress in Cardiovascular disease., 2000, 42 , 273-309.
[17] ROPERS D., BAUM U., POHLE K. et al. — Detection of Coronary Artery Stenoses With
Thin-Slice Multi-Detector Row Spiral Computed Tomography and Multiplanar Reconstruction . Circulation , 2003, 107 , 664-6.
* Pôle cardiovasculaire et métabolique. CHU Rangueil, Toulouse. TSA500326, 31059 Toulouse cedex 9 — France. Tirés-à-part : Professeur Jacques PUEL . Article accepté et reçu le 17 janvier 2005.
Bull. Acad. Natle Méd., 2005, 189, no 2, 237-247, séance du 1er février 2005


