Résumé
Les syndromes néphrotiques graves correspondent aux syndromes néphrotiques corticorésistants et corticodépendants à haut seuil. La physiopathologie des formes corticorésistantes est double : immunologique impliquant les lymphocytes B et T et avec la synthèse d’un facteur de perméabilité ou bien, une cause génétique entraînant des anomalies dans la constitution du diaphragme de fente. La prise en charge des syndromes néphrotiques corticodépendants a bénéficié de traitements récents efficaces et moins toxiques : mycophé- nolate mofetil et rituximab. Les effets non immunologiques de la cyclosporine sur le cytosquelette du podocyte sont des notions intéressantes qui ouvrent des voies de recherche pour l’avenir.
Summary
Severe forms of the nephrotic syndrome are, by definition, steroid-resistant or strongly steroid-dependent. Steroid-resistant forms have two causes. The first is T and B lymphocyte dysfunction, which may result in the production of a lymphokine which increases the permeability of the glomerular filtration barrier. The second is mutation of genes that encode proteins involved in establishing and maintaining the glomerular filtration barrier. Mycophenolate mofetil and rituximab are effective new treatments for severe steroiddependent nephrotic syndromes. The beneficial effect of cyclosporine on proteinuria may result from stabilization of the actin cytoskeleton in podocytes. Fig. 1. — Définition française de la cortico résistance chez l’enfant. La définition du syndrome néphrotique de l’enfant reste classique : il s’agit d’une protéinurie massive supérieure à 50 mg/kg/jour responsable d’une hypoprotidémie (inférieure à 60 g/l) et d’une hypoalbuminémie (inférieure à 25g/l). Les syndromes néphrotiques graves sont, soit les formes corticorésistantes, soit les formes corticodépendantes à haut seuil. Nous avons exclu toutes les néphropathies glomérulaires secondaires à une maladie générale connue.
LE SYNDROME NÉPHROTIQUE CORTICORÉSISTANT
Il n’existe pas encore de consensus international définissant le syndrome néphrotique corticorésistant. Selon l’International Study of Kidney diseases in Children Guidelines (ISKDC) est défini comme corticorésistant un syndrome néphrotique qui ne répond pas à une corticothérapie par Prednisone à la dose de 60 mg/m2/jour pendant quatre semaines.
Dès les années 80, on pouvait considérer que cette définition était sujet à caution car un certain nombre de syndromes néphrotiques « corticorésistants » répondaient aux embols de méthylprednisolone [1]. De ce fait la définition de la corticorésistance par la Société de Néphrologie Pédiatrique (fig 1) complète la définition de l’ISKDC par l’absence de réponse à trois embols de méthylprednisolone.
La corticorésistance, malgré cette définition ne représente pas une entité homogène.
Il faut en effet distinguer les formes qui répondent aux anticalcineurines (cyclosporine ou tacrolimus) et celles qui sont résistantes. Dans une revue de la littérature l’équipe de J.C. Craig concluait que la cyclosporine réduisait le risque de persistance du syndrome néphrotique par 0,64 [2].
Il faut cependant noter qu’il n’existe pas de consensus concernant la définition de la résistance aux anticalcineurines : posologie à utiliser ? Mode d’administration (Ciclosporine IV ou orale) ? Durée du traitement ?
Physiopathologie du syndrome néphrotique corticorésistant
Le premier mécanisme est d’ordre immunologique, impliquant les lymphocytes T [3]. L’efficacité du Rituximab qui est un anti CD20 évoque fortement l’implication également de certaines sous classes de lymphocytes B dans les formes corticodépendantes [4] et certaines formes cortico-résistantes. De nombreux arguments sont fortement en faveur de la synthèse d’une lymphokine, un facteur circulant qui augmenterait la perméabilité de la paroi des capillaires glomérulaires [5].
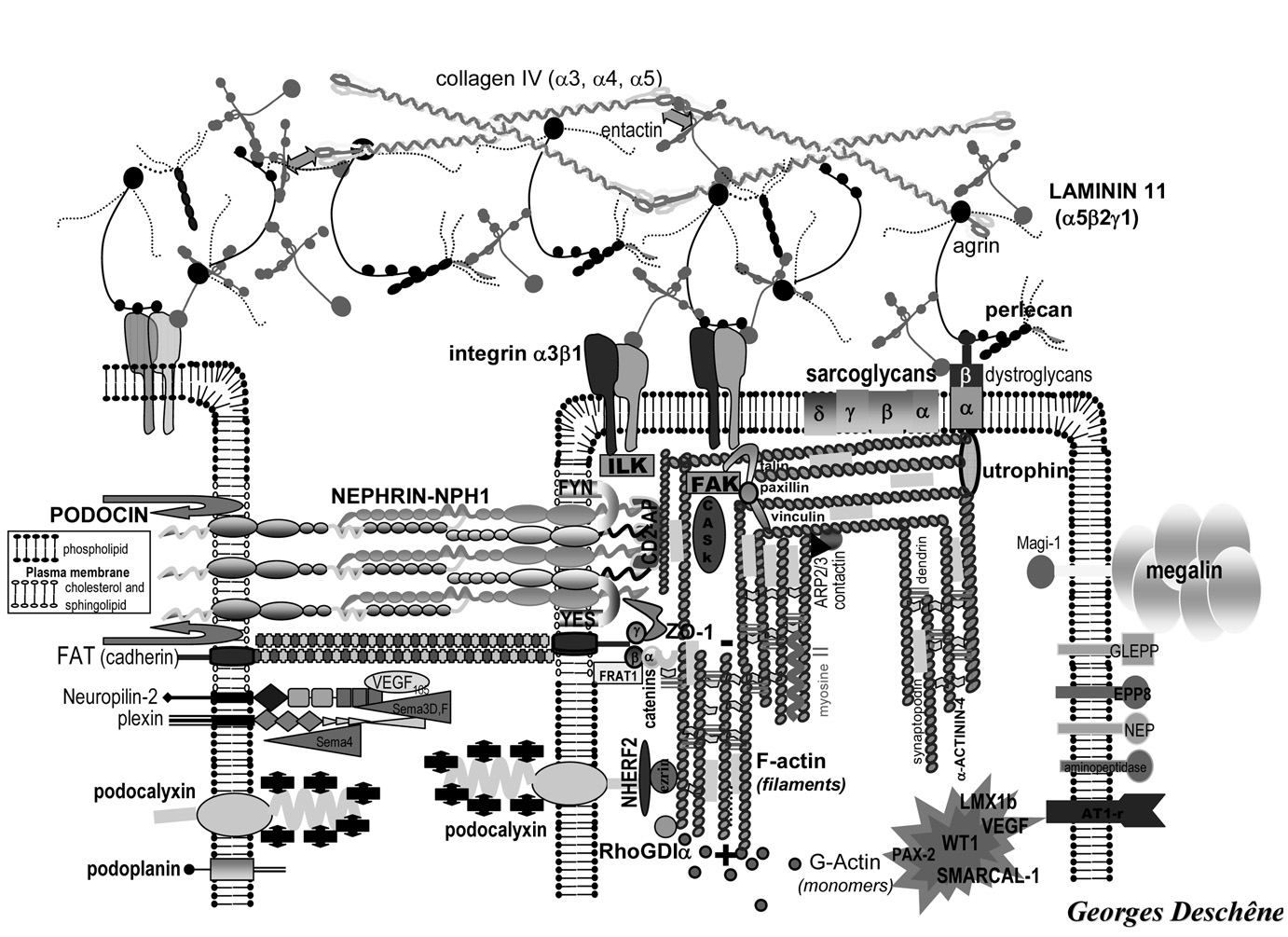
Le deuxième mécanisme est totalement différent du premier : génétique qui entraîne des anomalies dans la constitution des pieds des podocytes, du diaphragme de fente, de la membrane basale glomérulaire. On admet que plus de 60 % des syndromes néphrotiques corticorésistants de la première année de vie ont ce type d’anomalies génétiques [6] : les quatre principaux sont le gène NPHS1 codant pour la néphrine, le gène NPHS2 pour la podocine, le gène LAMβ codant pour la laminine β qui est 2 2 un constituant important de la membrane basale glomérulaire, le gène WT 1 ou Wilms tumor 1 (fig 2).
L’idéal serait de mieux définir le cadre dans lequel se situe le SN corticorésistant. En cas d’anomalie génétique la prescription d’un traitement immunosuppresseur n’est pas logique. Par contre lorsque le syndrome néphrotique a une cause immunologique, on peut être amené à augmenter l’immunosuppression comme cela est pratiqué après une rechute de syndrome néphrotique après transplantation rénale. Il y a donc deux risques dans la stratégie thérapeutique, soit mettre en route un traitement immunosuppresseur lourd et inutile, soit traiter insuffisamment ce syndrome néphrotique qui va évoluer vers l’insuffisance rénale terminale.
La difficulté vient du fait qu’un grand nombre de gènes, dont la mutation est responsable d’un syndrome néphrotique, ne peuvent pas être étudiés. Le diagnostic de la persistance d’un facteur de perméabilité est facile en cas de rechute d’un syndrome néphrotique après transplantation rénale, il est presque impossible avant la transplantation.
Nous avons postulé que par une étude précise des observations, le diagnostic de « facteur circulant persistant » pouvait être évoqué dans un petit nombre de cas lorsqu’une corticosensibilité et une cyclosporinosensibilité partielles avaient pré- cédé une corticorésistance et une cyclosporinorésistance secondaires.
Fig. 2. — Les principales protéines impliquées dans la barrière de filtration glomérulaire (d’après G. Deschênes) Chez trois enfants [7] nous avons montré que certains bons résultats thérapeutiques obtenus après rechute d’un syndrome néphrotique lors d’une transplantation rénale [8, 9] pouvaient l’être avant le développement d’une insuffisance rénale par la mise en route précoce d’un traitement lourd comprenant : échanges plasmatiques, cyclosporine A à fortes doses, cyclosphophamide, embols de prednisolone relayés par une corticothérapie orale.
Peut-on imaginer d’autre thérapeutique à l’avenir ? Dans deux publications récentes, il a été montré que le Rituximab associé à des échanges plasmatiques pouvait donner des résultats intéressants en cas de récidive d’un syndrome néphrotique après transplantation rénale [10, 11]. Il faudra étudier l’intérêt de cette stratégie thérapeutique à proposer avant le développement d’une insuffisance rénale terminale.
L’effet non immunologique des anticalcineurines dans la prise en charge de syndromes néphrotiques corticorésistants d’origine génétique [12]
Plusieurs publications de la littérature ont montré récemment que les anticalcineurines pouvaient diminuer la protéinurie de certains syndromes néphrotiques d’origine génétique : mutation des gènes WT1, podocine [13], phospholipase C epsilon [14]. Ces résultats sont à rapprocher de ceux qui avaient été publiés quant à la diminution de la protéinurie dans le syndrome d’Alport [15, 16].
L’actine est une protéine qui joue un rôle important dans la structure du cytosquelette du podocyte. La synaptopodine permet le maintien de l’intégrité de l’actine. La cyclosporine A en inhibant la déphosphorylation de la synaptopodine, prévient de ce fait la dégradation de cette protéine. En permettant la stabilisation du cytosquelette du podocyte, la cyclosporine A a un rôle antiprotéinurique [17].
LE SYNDROME NÉPHROTIQUE CORTICODÉPENDANT A HAUT SEUIL
Il s’agit de syndromes néphrotiques qui rechutent sous fortes doses de corticoïdes avec le risque des complications iatrogènes graves de la corticothérapie.
Après une première poussée de syndrome néphrotique, peut-on prévoir le haut degré de corticodépendance ? Ce risque est d’autant plus élevé que la mise en rémission a été longue. C’est le cas des enfants qui ont nécessité la prescription d’embols de méthylprednisolone [18]. La non observance du traitement peut être également une cause de rechute fréquente et un diagnostic différentiel avec la corticodépendance. Le test à la triamcinolone [19] peut permettre un diagnostic plus précis. L’enfant suspect de non observance au traitement corticoïde oral, reçoit des injections mensuelles de triamcinolone [19]. Si sous ce traitement le nombre de rechutes baisse d’une manière significative, la non observance est confirmée.
La cortico-dépendance nécessite l’adjonction aux corticoïdes d’épargnants corticoïdes dont le but est d’éviter ou de diminuer les complications iatrogènes de la corticothérapie. Le levamisole [20] a un mécanisme d’action mal connu, des études dont la méthodologie est discutable concluent à son efficacité. Dans la mesure où sa tolérance est bonne il est largement utilisé. Une étude prospective multicentrique internationale vient d’être mise en place dans le but d’étudier plus précisément son efficacité. En cas d’échec du levamisole le cyclophosphamide [21] et les anticalcineurines [22] (cyclosporine A, tacrolimus) sont proposés. Mais les complications de ces molécules (toxicité médullaire, gonadique, rénale) en restreignent leur utilisation.
La démonstration de l’efficacité du mycophenolate mofetil (M.M.F.) représente une avancée thérapeutique certaine car il n’est ni néphrotoxique ni gonadotoxique. Dans une étude prospective française [23], il a été bien montré que le MMF permettait de diminuer d’une manière significative le seuil de corticodépendance sans effets iatrogène significatifs. Il remplace au moins en première intention la cyclosporine. Chez les enfants déjà traités par cyclosporine des études ont montré qu’elle pouvait être remplacée par le MMF [24]. Dans certains syndromes néphrotiques très actifs, le MMF seul n’est pas suffisant et c’est l’association cyclosporine — MMF qui permet un meilleur contrôle de la maladie. L’intérêt du MMF est dans ce cas de diminuer les posologies des anticalcineurines donc leur toxicité.
Malgré tous ces progrès thérapeutiques, il persistait des syndromes néphrotiques corticodépendants à haut seuil de corticodépendance.
Les premières observations montrant l’efficacité remarquable du Rituximab (RTX) [25] étaient surprenantes. Il s’agit d’un anticorps monoclonal anti B alors qu’il était admis que le syndrome néphrotique corticosensible correspondait à un dysfonctionnement des T lymphocytes. Un travail multicentrique français récent [4] portant sur vingt-deux enfants a permis de conclure que le RTX avait permis d’abaisser d’une manière significative les doses des autres immunosuppresseurs. Sur ces vingt-deux enfants, il a été noté seulement trois échecs c’est-à-dire que les enfants sont restés néphrotiques au décours du traitement. Chez les autres enfants aucune rechute n’est survenue tant que la déplétion B (CD19 et CD20) était complète. Chez trois patients, quatre rechutes sont survenues à distance de la cure de RTX lors de la remontée du taux des CD19.
CONCLUSION
Beaucoup de progrès récents ont eu lieu dans la prise en charge des syndromes néphrotiques sévères grâce à plusieurs molécules récentes. Cependant beaucoup d’études prospectives sont encore nécessaires. L’escalade thérapeutique doit prendre en compte les effets secondaires des traitements immuno-suppresseurs lourds.
Les effets non immunologiques de la cyclosporine sur le cytosquelette du podocyte sont des notions très intéressantes. Elles ouvrent des voies de recherche pour l’avenir : découvrir des molécutes qui ont le même effet que la cyclosporine mais sans sa néphrotoxicité ni ses effets immuno-suppresseurs.
BIBLIOGRAPHIE [1] Murnaghan K., Vasmant D., Bensman A. — Pulse methysprednisolone therapy in severe idiopathic childhood nephrotic syndrome. Acta Paediatr. Scand. , 1984, 73 , 733-739.
[2] Hodson M., Habashy D., Craig J.C. — Interventions for idiopathic steroid resistant nephrotic syndrome in children. Cochrane Database Syst. Rev ., 2006, 19, CD 003594.
[3] Araya C., Diaz L., Wasserfall C. et al. — T regulatory cell function in idiopathic minimal lesion nephrotic syndrome.
Pediatr. Nephrol., 2009, 24 , 1691-1698.
[4] Guigonis V., Dallochio A., Baudouin V. et al. — Rituximab treatment for severe steroid or cyclosporine — dependant nephrotic syndrome : a multicentric series of 22 cases.
Pediatr.
Nephrol. , 2008, 23 , 1269-1279.
[5] Gari E.H. — Circulating mediators of proteinuria in idiopathic minimal lesion nephrotic syndrome. Pediatr. Nephrol. , 2000., 14 , 872-878 [6] Hinkes B.G. et al — Nephrotic syndrome in the first year of life: two thirds of cases are caused by mutations in 4 genes (NPHS1, NPHS2, WT1 and LAMβ ).
Pediatrics , 2007, 119 , e907-e919.
2 [7] Ulinski T., Perrin L., Guigonis V., Driss F., Deschenes G. et Bensman A. — Remission of steroid and CyA resistant nephrotic syndrome using multiple drug immunosuppression.
Pediatr. Nephrol. , 2007, 22 , 1723-6.
[8] Salomon R., Gagnadoux MF., Niaudet P. — Intravenous cyclosporine therapy in recurrent nephrotic syndrome after renal transplantation in children. Transplantation , 2003, 75 , 810-814.
[9] Cochat P. et al — Recurrent nephrotic syndrome after transplantation : early treatment with plasmaphaeresis and cyclosphophamide.
Pediatr. Nephrol., 1993, 7, 50-54.
[10] Jeroen K.J. et al — Rituximab for plasma exchange dependant recurrent focal segmental glomerulosclerosis after renal transplantation.
Nephrol. Dial. Transplant., 2008, 22 , 85-88.
[11] Apelandt et al. — Rituximab therapy in early recurrent focal segmental sclerosis after renal transplantation.
Nephrol. Dial. Transplant , 2008, 22 , 2091-94.
[12] Bensman A., Niaudet P. — Non immunologic mechanisms of calcineurin inhibitors explain its antiproteinuric effects in genetic glomerulopathies. Pediatr. Nephrol., 2010, (sous presse).
[13] Malina M., Cinek O., Sanda J., Seeman T. — Partial remission with cyclosporine A in a patient with nephrotic syndrome due to NPHS2 mutation. Pediatr. Nephrol. , 2009, 24 , 2051- 2053.
[14] Hinkes B., Wiggins RC., Gbzdegesin R. et al. — Positional cloning uncovers mutations in
PLCE1 responsible for a nephrotic syndrome variant that may be reversible
Nature genetics , 2006, 38 , 1397-1405.
[15] Callis L., Vila A., Carrera M., Nieto J. — Long term effects of cyclosporine A in Alport’s syndrome. Kidney Int. , 1999, 55, 1051-1056.
[16] Charbit M., Gubler M.C. et al — Cyclosporine therapy in patients with Alport syndrome.
Pediatr. Nephrol. , 2007, 22, 57-63.
[17] Faul C., Donnely M., Merscher-Gomez S. et al . — The actin cytoskeleton of kidney podocytes is a direct target of the antiproteinuric effect of cyclosporine A.
Nature Medicine , 2008, 14 , 931-938.
[18] Letavernier B., Letavernier E., Leroy S., Baudet-Bonneville V., Bensman A., Ulinski T.
— Predicton of high-degree steroid dependency in pediatric idiopathic nephrotic syndrome.
Pediatr. Nephro., 2008, 23 , 2221-6.
[19] Ulinski T. et al — Triamcinolone acetonide: a new management of non compliance in nephrotic children.
Pediatr. Nephrol ., 2005, 20 , 759-762.
[20] Levamisole for corticosteroid-dependant nephrotic syndrome in childhood British association for Paediatric Nephrology. Lancet , 1991, 337 —8757), 1555-1557.
[21] Cyclophosphamide treatment of steroid dependent nephrotic syndrome : comparison of eight week with 12 week course — Report of Arbeitsgemlinschaft fur Padiatrische Nephrologie. Arch.
Dis. Child , 1987, 62 , 1102-1106.
[22] Ishikura K., Ikeda M., Hattori S. et al. — Effective and sage treatment with cyclosporine in nephrotic children : a prospective randomized multicenter trial.
Kidney Int., 2008, 73, 1167- 1173.
[23] Baudouin V., Bensman A., Andre J.L. — Efficacy of mycophenolate mofetil (MF) in steroid dependent nephrotic syndrome: a prospective study. Pediatr. Nephrol ., 2006, 21 , 1511.
[24] Ulinski T. et al . — Switch from cyclosporine A to mycophenolate mofetil in nephrotic
Children.
Pediatr. Nephrol. , 2005, 20, 482-485.
[25] François H., Dugas E., Bensman A., Ronco P. — Unexpected efficacy of Rituximab in multirelapsing minimal change nephrotic syndrome. Am. J. Kidney Dis., 2007, 49, 158-161.
DISCUSSION
M. Jean-Daniel SRAER
Quels sont les progrès réellement décisifs de ces cinq dernières années et la physiopathologie de leur effet ?
Les progrès réellement décisifs de ces cinq dernières années portent d’abord sur le traitement : de nombreux syndromes néphrotiques corticorésistants sont mis en rémission grâce à des protocoles utilisant de fortes doses de cyclosporine. Le mycophenolate mophetil et le rituximab représentent une avancée thérapeutique certaine dans la prise en charge de certains syndromes néphrotiques corticodépendants sévères. Une meilleure compréhension du rôle fondamental joué par le diaphragme de fente dans la physiopathologie du syndrome néphrotique représente une avancée certaine et notamment grâce aux progrès de la génétique. La mise en évidence de la mutation de plusieurs gènes codant pour des protéines impliquées dans la constitution mais également la signalisation au niveau du diaphragme de fente représente un progrès très important.
M. Bernard PESSAC
Que sait-on des glycosaminoglyanes au cours des syndromes néphrotiques ? Quel est l’état immunologique précis de ces malades ? Quel est le mécanisme d’action et quelles sont les cellules du monoclonal anti CD-2o ?
La barrière de filtration glomérulaire est chargée négativement. Cette charge électrique négative joue un rôle important dans la prévention de l’albuminurie car l’albumine est également chargée négativement. Parmi les molécules qui interviennent dans la constitution de la charge électrique négative de la membrane basale glomérulaire : l’acide sialique, l’héparane sulfate protéoglycane. Chez l’enfant en rechute de syndrome néphrotique il existe une hypogammaglobulinémie et un déficit T partiel ce qui explique sa susceptibilité aux infections notamment au pneumocoque. L’anti CD20 (Rixutimab) est un antilymphocyte B. Il entraîne un taux nul de CD19 et CD20 pendant plusieurs semaines. Le fait que cet anti B entraîne une amélioration significative du syndrome néphrotique souligne l’implication de certains lymphocytes B dans la physiopathologie de la néphrose.
M. Jacques BATTIN
Quel est le support génétique de la néphropathie et de la surdité dans le syndrome d’Alport ?
Le syndrome d’Alport est dû à une mutation de certaines chaînes constituant le collagène IV : α3, α4, α5. Ces anomalies des chaînes du collagène IV sont retrouvées aussi bien au niveau de la membrane basale glomérulaire qu’au niveau de la cochlée.
Bull. Acad. Natle Méd., 2009, 193, no 8, 1727-1734, séance du 3 novembre 2009