Résumé
La prise en charge de l’ischémie cérébrale aiguë prend une importance considérable du fait de l’accroissement de l’espérance de vie de la population et de l’augmentation avec l’âge de la prévalence de la maladie athéroscléreuse, de la fibrillation auriculaire et de la maladie des petites artères intracrâniennes. Elle connaît aussi un regain d’intérêt car une prise en charge spécialisée dans des unités neurovasculaires permet 40 décès en moins, 50 retours au domicile en plus, et diminue de 30 % la durée de l’hospitalisation pour 1 000 patients traités dans ces unités, comparativement à une prise en charge non spécialisée. Ce bénéfice repose sur une meilleure connaissance, une prévention plus efficace, un meilleur dépistage et un traitement immédiat des nombreuses complications qui peuvent émailler l’évolution d’une attaque cérébrale jusqu’au retour au domicile du patient. Dans ces unités, l’accent est mis immédiatement sur la rééducation physique, cognitive, psychologique, sur la réadaptation fonctionnelle et sur la réinsertion sociale. Elles sont aussi le lieu privilégié pour l’administration et la surveillance de traitements très efficaces mais délicats à prescrire comme la thrombolyse. La thrombolyse, désormais approuvée par la plupart des autorités de santé dans le monde, fait l’objet d’une recommandation de grade 1A (niveau de recommandation le plus élevé) de la part des grandes sociétés savantes neurovasculaires nord américaines et européennes. Ce traitement n’est plus efficace ni bien toléré après la troisième heure qui suit les premiers symptômes. Le défi des prochaines années sera d’adapter notre système de soin actuel pour faciliter l’accès des patients aux unités neurovasculaires et à la thrombolyse et de développer des campagnes d’éducation de la population, des médecins généralistes et des urgentistes sur les signes d’alerte d’attaque cérébrale et la conduite à tenir devant ces signes.
Summary
Acute stroke management is becoming a major challenge for the next decades because of the increasing life expectancy, and subsequent increase of burden of atherosclerotic disease, atrial fibrillation and intracranial small vessel disease. New advances in stroke management has been mainly based on the development of stroke unit facilities. Stroke centers allow a multidisciplinaire approach of stroke care, involving stroke neurologists, neuroradiologists, cardiologists, specialized nurses, physiotherapists, occupational therapists, speech therapists, psychologists, social workers, etc… Compared to a usual care, treatment in stroke unit avoids 40 deaths, allows 50 more patients returning home, and reduces the length of stay by 30 %. This tremendous benefit is explained by a better knowledge of acute stroke complications by the entire stroke team. This allows their prevention, early detection, diagnosis and immediate treatment. Early emphasis is also put on rehabilitation in stroke units. They also are the right place for using powerful trament but delicate to prescrive such as intravenous thrombolysis. After its approval by regulatory agencies in western countries, intravenous thrombolysis has a grade 1A recommandation (the highest level of recommandation) by both North American and European neurovascular societies. However, after three hours of stroke onset, thrombolysis is no longer effective and safe. The real challenge for the next years will be to adapt our health systems to increase access to care in stroke unit and to thrombolysis, and to develop education campaigns directed towards patients, general practitioners and emergency physicians to increase their awareness on warning signs of stroke.
La prise en charge de l’infarctus cérébral à la phase aiguë est en train de vivre une transformation radicale en France car, à l’heure où nous écrivons ces lignes, les Agences Régionales d’Hospitalisation évaluent la possibilité de multiplier les unités de soins neurovasculaires et l’agence Européenne du médicament prend en considé- ration la mise sur le marché d’un médicament puissamment efficace. Le nihilisme thérapeutique et le fatalisme devant « l’attaque cérébrale » vont faire place à l’espoir de guérison. L’écueil va être sans doute que l’on risque de passer rapidement de « l’espoir de guérison » au « droit à la guérison ». La difficulté pour les « urgentistes » va être d’adapter la filière de prise en charge pour répondre à cette attente, en toute occasion, dans le respect des recommandations émises par la Société Française Neurovasculaire.
CIRCONSTANCES DEVANT LESQUELLES IL FAUT REDOUTER UN INFARCTUS CÉRÉBRAL
Tout symptôme neurologique focal d’installation soudaine ou rapidement progressive en quelques minutes ou quelques heures doit faire envisager le diagnostic d’attaque cérébrale. On entend par focal tout symptôme qui peut être relié à l’atteinte précise d’une partie du cerveau, donc potentiellement dans le territoire
d’une artère cérébrale. Par exemple un trouble moteur unilatéral est lié à une atteinte de la voie pyramidale dans le cortex, la capsule interne ou le tronc cérébral ; une aphasie est liée à une atteinte du cortex de l’hémisphère dominant. En revanche, une confusion ou une perte de connaissance sont le résultat d’une dysfonction globale du cerveau ; ils ne répondent pas à la définition d’un symptôme focal et doivent faire envisager des diagnostics fort différents.
Les symptômes d’alerte sont résumés dans le Tableau 1.
TABLEAU 1. — Présentations les plus fréquentes d’ischémie cérébrale.
Survenue soudaine de l’un des symptômes suivants • Faiblesse, paralysie, engourdissement, perte de sensibilité, incoordination de la face, du bras ou de la jambe d’un côté du corps.
• Diminution ou perte de la vision d’un œil ou des deux yeux, ou diminution partielle du champs visuel.
• Perte soudaine de la parole, ou difficulté pour parler ou comprendre ce qui est dit, trouble de l’articulation.
• Instabilité de la marche inexpliquée ou chute soudaine, trouble de l’équilibre, maladresse ou difficulté de la marche, en particulier en association avec l’un des symptômes précédents.
• Trouble de conscience, stupeur ou coma, confusion ou agitation (rare), crise d’épilepsie (rare).
• Vertige, vision double, perte unilatérale de l’audition (rare), nausée, vomissement, céphalée (surtout si elle est inhabituelle).
CONDUITE IMMÉDIATE À TENIR POUR LE PATIENT OU LE TÉMOIN :
APPELER LE 15
Il ne doit surtout pas minimiser ou négliger ces symptômes, ni « aller se coucher pour se reposer » ou « boire une tisane », ou encore penser, comme trop souvent, que cela « va passer ». Toute perte de temps est une perte de chance d’appliquer le traitement curateur, la thrombolyse par rt-PA. Le patient doit être dirigé par le centre 15 le plus vite possible vers l’hôpital le plus proche, équipé pour traiter l’infarctus cérébral (Tableau 2).
LE TRANSPORT
Il doit être le plus rapide possible, y compris par hélicoptère si l’état du patient répond aux critères d’un traitement thrombolytique possible. Si le patient est somnolent, il doit être accompagné par un médecin du SAMU. Le médecin surveille les fonctions vitales : liberté des voies aériennes supérieures, état hémodynamique.
TABLEAU 2. — Orientation du patient par téléphone 1. S’il appelle le centre 15 ou le SAMU • s’il n’est pas somnolent, conseiller d’aller à l’hôpital équipé pour le recevoir (cf. recommandations de la SFNV) par ses propres moyens ou une ambulance privée, sinon déplacer le SAMU, • déterminer l’heure du premier symptôme, • demander qu’il soit accompagné d’un proche (pour le consentement éclairé et l’anamnèse), • prévenir l’hôpital qu’il va recevoir ce patient.
2. S’il appelle son médecin généraliste ou son neurologue, cardiologue ou angiologue • surtout ne pas répondre que l’on passera en fin de visite • ne pas répondre que l’on passe immédiatement • ne pas lui dire de venir en urgence au cabinet • conseiller d’appeler le centre 15 3.
S’il appelle au service d’urgence le plus proche • Si l’hôpital n’est pas équipé, ne pas lui dire de venir • conseiller d’appeler le centre 15 qui le dirigera • Si l’hôpital est équipé et capable d’appliquer un traitement thrombolytique dans le respect des recommandations de la SFNV, lui dire de venir sans délai par ses propres moyens (accompagné par un proche ou un voisin, ou en ambulance privée) s’il n’est pas somnolent • Déterminer l’heure du premier symptôme • Prévenir le service de radiologie de l’arrivée du patient et de se préparer à lui faire un scanner cérébral dès son arrivée 4. S’il appelle son pharmacien ou son auxiliaire de soin • conseiller d’appeler le centre 15 → toute perte de temps est une perte de chance
Le patient est transporté allongé, en position latérale de sécurité s’il est nauséeux ou vomit. L’urgence est alors moins grande car la somnolence contre-indique la thrombolyse, mais certains infarctus œdémateux du cervelet avec trouble rapide de conscience requièrent un traitement chirurgical immédiat. Si le patient est conscient, il doit prendre le moyen de transport le plus rapide en fonction du lieu où il se trouve et des possibilités de son entourage. Si la pression artérielle est élevée, elle ne sera pas traitée, sauf circonstance exceptionnelle (OAP, dissection aortique, infarctus du myocarde aigu) ; aucun traitement antithrombotique ne sera administré avant qu’un scanner cérébral n’ait été réalisé ; une crise d’épilepsie impose un traitement par benzodiazépine du fait du risque élevé de récidive et du risque d’engagement en cas d’infarctus cérébral œdémateux.
AUX URGENCES
Deux cas se présentent :
— où le patient arrive dans les 3 heures suivant le premier symptôme focal :
envisager systématiquement une thrombolyse, — où le patient arrive au-delà de ce délai.
Arrivée dans les 3 heures aux urgences
Il faut systématiquement envisager une thrombolyse intraveineuse par rt-PA.
Le patient est alors confié au médecin de garde compétent en neurologie vasculaire [1]. L’état général, respiratoire (saturation), cardiaque (signes d’insuffisance cardiaque) et hémodynamique (pression artérielle) sera évalué. L’existence d’une fièvre devra d’emblée faire chercher une méningite ou une endocardite, et éliminer une encéphalite [2]. L’examen neurologique permet d’évaluer la sévérité, d’établir le score du National Institut of Health-NIH- (score désormais indispensable pour quantifier le déficit neurologique), de situer la lésion (Tableau 3), de prédire son étendue et un territoire vasculaire, de vérifier la persistance du déficit neurologique ou au contraire sa régression spontanée. Il doit chercher un syndrome méningé associé (céphalée, raideur de nuque), qui pourrait orienter vers une hémorragie méningée avec vasospasme, dissection ou thrombose veineuse cérébrale [3]. L’examen clinique oriente la recherche d’une cause artérielle cérébrale, aortique ou cardiaque. La découverte d’un souffle carotidien, ou un antécédent de sténose de la carotide déjà documenté orientera vers cette cause. Un examen ultrasonographique au moyen d’un Doppler de poche ou transportable vérifiera la perméabilité des artères carotides et vertébrales, la présence d’une accélération du flux témoignant d’une sténose, la présence d’un flux ophtalmique positif ou négatif témoignant du retentissement hémodynamique. Il sera complété, immédiatement après le scanner cérébral, par un examen ultrasonographique comprenant un Doppler transcrânien, une échographie carotidienne et vertébrale. L’existence d’un obstacle hémodynamique au Doppler impose une surveillance neurologique rapprochée du fait du risque d’aggravation dans les heures suivantes et peut nécessiter un décubitus strict en cas de désordres posturaux.
L’absence de pouls fémoral, une asymétrie tensionnelle, un souffle diastolique, avec ou sans douleur thoracique orientera vers la recherche d’une dissection aortique par un scanner thoracique. La découverte d’une arythmie, d’un souffle cardiaque, d’une douleur thoracique orientera vers la recherche d’une source cardiaque d’embolie.
Un électrocardiogramme sera systématiquement effectué recherchant une fibrillation auriculaire, des signes d’ischémie myocardique en évolution, des signes de péricardite. Au moindre doute une échocardiographie sera ordonnée immédiatement après le scanner cérébral. L’examen général cherchera des signes d’ischémie d’autres organes : membres inférieurs (pouls périphérique, chaleur cutanée, livedo) ;
TABLEAU 3. — Tableaux cliniques les plus communément rencontrés Hémisphère gauche (Dominant)
Aphasie, hémiparésie droite, anesthésie ou diminution de la sensibilité à droite, hémianopsie latérale homonyme droite, difficulté de poursuite oculaire vers la droite et déviation spontanée des yeux à gauche, dysarthrie, trouble de la lecture, de l’écriture, ou du calcul.
Hémisphère cérébral droit (non dominant)
Négligence spatiale gauche, anosodiaphorie (indifférence au trouble), anosognosie (négation du trouble), hémiasomatognosie (négation et non reconnaissance de son hémicorps), hémiparésie gauche, anesthésie ou diminution de la sensibilité à gauche, hémianopsie latérale homonyme gauche, difficulté de poursuite oculaire vers la droite et déviation spontanée des yeux à droite, dysarthrie, extinction sensitive gauche.
Tronc cérébral/ Cervelet/ Hémisphère cérébral postérieur
Paralysie ou perte de la sensibilité des 4 membres, signes croisés (par rapport à l’atteinte des nerfs crâniens), incoordination des membres, ataxie en position debout et de la marche, dysarthrie, excursion des yeux non conjuguée, nystagmus, amnésie, trouble bilatéral du champs visuel.
Petit infarctus profond (hémisphère ou tronc cérébral)
Atteinte motrice pure de la face, du bras ou de la jambe sans trouble du langage ni sensitif ni visuel.
Atteinte sensitive pure de l’hémicorps sans atteinte des fonctions supérieures, ni motrice ou visuelle.
signes d’infarctus rénal, splénique ou du mésentère. Il détectera aussi immédiatement les premières complications de l’infarctus cérébral (pneumopathie d’inhalation, globe vésical, fracture du col fémoral en cas de chute initiale, rhabdomyolyse).
Au terme de cet examen purement clinique, le médecin responsable doit avoir une idée précise sur l’indication et les contre-indications possibles de la thrombolyse chez le patient (Tableau 4). L’examen ne doit pas durer plus de quelques minutes. Il doit être fait immédiatement avant le scanner-X.
Un scanner-X cérébral doit être fait sans délai, sans injection de produit de contraste pour vérifier l’absence d’hémorragie. Celle-ci peut être très difficile à voir dans le cas d’hémorragie méningée localisée, ou d’hématome sous-dural isodense se présentant sous la forme d’un simple effacement des sillons corticaux. Des signes précoces d’ischémie peuvent être visibles d’emblée (atténuation de la densité des noyaux gris centraux-noyau caudé, putamen et pallidum essentiellement-, du ruban insulaire, absence de différentiation blanc-gris, effacement des sillons), mais la fiabilité de tels signes est très mauvaise en pratique et a peu d’intérêt dans les trois premières heures.
TABLEAU 4. — Indications et contre-indications de la thrombolyse intraveineuse.
Les 11 points de recommandations de la SFNV 1 — Le traitement de l’accident ischémique cérébral par la streptokinase est à l’origine d’une surmortalité par hémorragie cérébrale. Nous déconseillons l’utilisation de la streptokinase dans l’accident ischémique cérébral, en dehors du cadre réglementaire d’un essai clinique (classe 1a et b, grade A).
2 — Le traitement de l’accident ischémique cérébral par le rt-PA, moins de 3 heures après le début des symptômes, accroît les chances des malades de retrouver leur indépendance, sans augmenter leur mortalité. L’efficacité du traitement au-delà de la troisième heure n’est pas établie. Le traitement ne doit pas être administré si l’heure de début des symptômes ne peut être déterminée avec certitude. La posologie est de 0,9 mg/kg, sans dépasser la dose totale de 90 mg. Le traitement est administré par voie intraveineuse, 10 % de la dose totale en bolus, le reste en perfusion d’une heure (classe 1a et b, grade A).
3 — Le traitement par le rt-PA ne peut être recommandé chez les malades qui présentent un des critères d’exclusion de l’essai du NINDS : traitement anticoagulant oral en cours ou INR > 1,7 ; traitement par héparine au cours des 24 heures précédant l’accident ischémique cérébral et allongement du temps de céphaline activée ; nombre de plaquettes < 100 000/mm3 ; un autre accident vasculaire cérébral ou un traumatisme crânien sévère au cours des 3 mois précédents ; pression artérielle systolique > 185 ou pression artérielle diastolique > 110 au moment d’administrer le traitement ; déficit neurologique en voie de régression ; déficit neurologique mineur tel que déficit sensitif isolé, ataxie isolée, dysarthrie isolée ou déficit moteur minime ;
antécédent d’hémorragie intracrânienne ; glycémie < 0,5 g/l ou > 4g/l ; crise d’épilepsie lors de l’installation de l’accident ischémique cérébral ; hémorragie digestive ou urinaire au cours des 21 jours précédents ; infarctus du myocarde récent (classe 1b, grade A). Le traitement est également contreindiqué en cas de ponction récente d’un vaisseau non compressible.
4 — L’effet favorable du rt-PA apparaît malgré une augmentation de l’incidence des hémorragies cérébrales graves chez les malades traités. Les données disponibles suggèrent que le risque d’hémorragie cérébrale grave est particulièrement élevé chez les patients dont le scanner montre des signes étendus d’ischémie (atténuation de densité ou effet de masse dans plus du tiers du territoire de l’artère cérébrale moyenne). En attendant des données plus précises sur ce point, nous estimons plus prudent de déconseiller le traitement chez ces malades (classe 1b, grade B).
5 — De même, l’incidence des hémorragies cérébrales symptomatiques semblant plus élevée en cas de déficit neurologique sévère (défini par un score > 22 sur l’échelle du NIH ou un coma profond), le traitement est à éviter dans cette circonstance (classe1b, grade B).
6 — L’incidence des hémorragies cérébrales graves est accrue chez les sujets âgés.
Le rapport risque/bénéfice du traitement doit être soigneusement évalué chez les malades de plus de 80 ans (classe 1b, grade B).
7 — Nous ne pouvons faire de recommandation concernant les femmes enceintes et les malades de moins de 18 ans, car ils étaient exclus des essais cliniques.
8 — Les traitements antihypertenseurs doivent être utilisés avec prudence dans un contexte d’ischémie cérébrale aiguë. Toutefois, deux des essais cliniques du rt-PA (NINDS et ECASS 2) comportaient un protocole de traitement de l’hypertension artérielle pendant l’administration du traitement et les 24 heures suivantes, ce qui pourrait expliquer la plus faible incidence des hémorragies cérébrales graves dans ces essais. Nous recommandons que ce protocole, décrit dans l’annexe 1, soit appliqué (classe 1b, grade A).
9 — Les résultats obtenus dans le cadre des essais cliniques n’ont été reproduits en pratique courante que dans les centres spécialisés dans la prise en charge des accidents vasculaires cérébraux. Nous recommandons que la prescription de rt-PA dans le traitement de l’accident ischémique cérébral soit réservée aux neurologues dont la compétence neurovasculaire est reconnue (voir annexe 2).
Le traitement ne doit être administré que dans un environnement permettant une surveillance continue de l’état neurologique du malade et de sa tension artérielle. Ces conditions de surveillance sont réunies dans les unités neuro-vasculaires (voir annexe 2). Nous recommandons que le traitement soit administré dans ces unités (classe 1b, grade A).
10 — Le traitement ne doit être administré que dans un environnement permettant la prise en charge immédiate d’une complication hémorragique. Toute aggravation neurologique pendant l’administration du rt-PA impose son arrêt immédiat et la pratique d’un scanner cérébral. En cas de complication hémorragique, une prise de sang doit être effectuée pour des tests d’hémostase (temps de céphaline activée, taux de prothrombine-INR, fibrinogène, numération plaquettaire, hématocrite, hémoglobine) (classe 1b, grade A).
11 — Les patients traités par anticoagulant oral, les patients traités par héparine et qui ont un allongement du temps de céphaline activée au moment de la survenue de leur accident ischémique cérébral ne doivent pas être traités (classe 1b, gradeA).
Le risque d’hémorragie cérébrale ne semble pas augmenté chez les malades qui suivaient un traitement par l’aspirine lorsque l’accident ischémique cérébral est survenu12. Ces patients peuvent être traités par rt-PA (classe 1b, grade B). En l’absence de données suffisantes, il n’est pas possible de faire de recommandation concernant les malades traités par un autre antiplaquettaire que l’aspirine.
Certains centres actuellement (mais la plupart d’ici deux ou trois ans) feront d’emblée une IRM cérébrale en se passant du scanner-X. Cette IRM comprend avant tout une IRM de diffusion, capable de montrer le tissu cérébral qui souffre sous la forme d’un hypersignal (Figure 1) et d’évaluer son étendue dès la première heure ; parfois une IRM de perfusion, capable de montrer l’étendue de l’hypo
perfusion souvent beaucoup plus étendue que la zone visible de souffrance cérébrale vue en diffusion (la soustraction des deux définit la zone cérébrale à risque, grossiè- rement la pénombre ischémique, qui est la zone menacée de nécrose) ; une IRM en FLAIR, très sensible pour mettre en évidence les zones de souffrance cérébrale, sans permettre de les dater au contraire de l’IRM de diffusion qui ne montre que les lésions très récentes ; une IRM T-2 et T-1 qui ne montre que les lésions anciennes, au-delà du 4ème jour.
En fonction de l’examen clinique et de l’imagerie, la thrombolyse doit être débutée après consentement du patient ou de son plus proche parent (en cas d’aphasie). La dose est de 0,9 mg/kg sans dépasser 90 mg. Dix pour cent sont passés en bolus en une minute, le reste, après un quart d’heure et après vérification du maintien de la pression artérielle, est passé en une heure. La pression artérielle est vérifiée tous les quarts d’heure durant la perfusion et régulièrement après, suivant un protocole très précis (Tableau 5).
Le traitement thrombolytique ne doit pas être banalisé. Il est certes très efficace mais il expose à un risque hémorragique (et donc à un risque d’aggravation et de décès) qu’il faut savoir apprécier (Tableau 6 et Figure 2). La connaissance des facteurs de risque d’hémorragie cités dans le Tableau 6 est nécessaire, mais il faudra savoir les relativiser dans chaque cas. Le protocole d’utilisation est très strict et demande que les 11 points recommandés par la SFNV soient en totalité respectés (Tableau 4). Une expérience neurovasculaire des signes précoces d’ischémie cérébrale détectables cliniquement et par l’imagerie cérébrale est absolument indispensable. Tout médecin qui n’a pas suivi la formation nécessaire à cette connaissance ne doit pas prendre de décision de thrombolyse.
Cas d’un hôpital sans neurologue vasculaire en unité d’urgence neurovasculaire
Il ne doit pas y avoir perte de chance pour le patient. En dépit de tous les efforts que fera le centre 15 pour adresser le patient dans un hôpital ayant cette capacité, les patients arrivant dans les hôpitaux généraux ou ruraux ou même universitaires devront être pris en charge par un spécialiste formé à la neurologie vasculaire et certifié pour le NIH. Celui-ci agira comme personne référante. Elle sera en contact 24 heures sur 24 avec le service de neurologie vasculaire correspondant où le neurologue vasculaire de garde pourra dialoguer par téléphone avec cet urgentiste, avoir sur son écran d’ordinateur les images du scanner du patient, et ainsi prendre une décision de thrombolyse par voie veineuse qui sera faite sur place, puis le patient sera transféré. Prochainement, l’examen du patient via internet grâce à une webcam dirigée vers le patient et une autre dirigée vers le neurologue vasculaire à distance permettra de réaliser le score du NIH et de prendre ainsi la décision d’une thrombolyse pour les hôpitaux éloignés ou isolés, ruraux. Ces procédés fonctionnent au Canada et aux États-Unis d’Amérique.
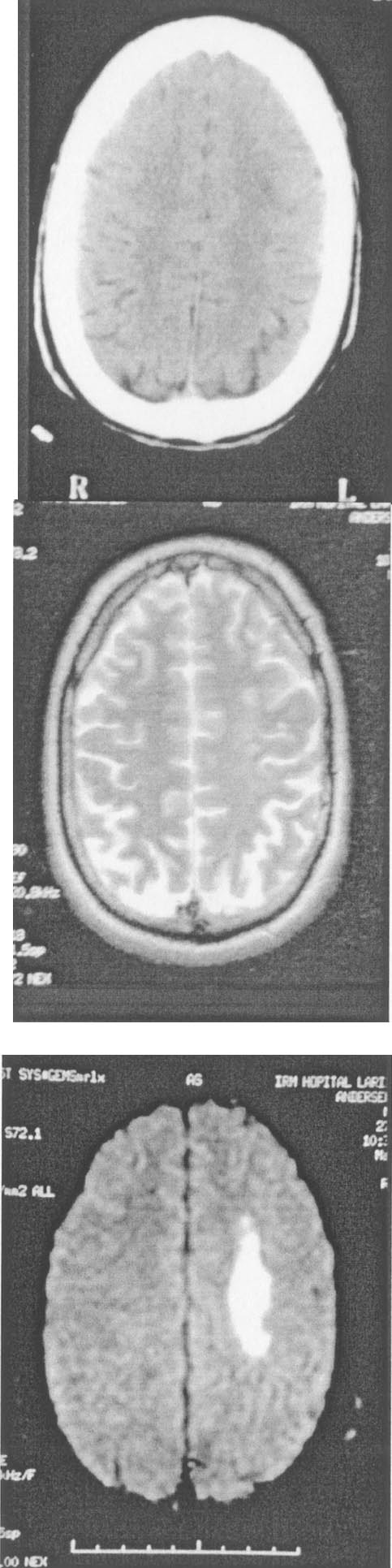
Figure 1. :
FIG. 1. — Scanner cérébral fait à deux heures, imagerie par résonnance magnétique concomitante pondérée en T2, et en diffusion. La souffrance ischémique n’apparaît clairement qu’en diffusion.
TABLEAU 5. — Recommandation de la SFNV concernant la prise en charge de l’HTA durant la perfusion de thrombolytique Traitement de l’hypertension artérielle pendant l’administration du rt-PA et au cours des 24 heures suivantes.
La pression artérielle doit être mesurée au moins toutes les 15 mn pendant l’administration du traitement et au cours des 2 heures suivantes, puis toutes les 30 mn pendant les 6 heures suivantes et toutes les 60 minutes pendant 24 heures.
1 — Pression artérielle diastolique > 140 mm Hg : commencer une perfusion intraveineuse de nitroprussiate de sodium 0,5 à 10 µg/kg/mn.
2 — Pression artérielle systolique >230 ou pression artérielle diastolique comprise entre 121 et 140 mm Hg : injection intraveineuse de labetalol 10 mg en 1 à 2 mn. Cette injection peut être renouvelée toutes les 10 mn, sans dépasser une dose totale de 150 mg. En l’absence de réponse suffisante, le nitroprussiate de sodium peut être utilisé.
3 — Si la pression artérielle systolique est de 180 à 230 mm Hg et/ou la pression artérielle diastolique de 105 à 120 mm Hg sur deux mesures séparées de 5 à 10 mn : injecter 10 mg de labetalol IV en 1 à 2 mn. Cette injection peut être renouvelée toutes les 10 mn, sans dépasser une dose totale de 150 mg.
Alternativement, à la suite du premier bolus de labetalol, une perfusion IV de labetalol, 2 à 8 mg/mn, peut être mise en place et maintenue jusqu’à ce que le niveau de pression artérielle désiré ait été atteint. La pression artérielle est mesurée toutes les 15 mn afin de réduire les risques d’hypotension.
NB : ce protocole est celui utilisé dans l’étude du NINDS et dans ECASS 2.
D’autres antihypertenseurs injectables, par exemple l’urapidil, peuvent être utilisés à la place du labetalol en visant les mêmes objectifs.
Arrivée au-delà de 3 heures après le début des symptômes
Le traitement thrombolytique par rt-PA intraveineux est alors contre-indiqué en dehors d’essais thérapeutiques.
Jusqu’à la sixième heure, compte tenu des données de l’étude PRO-ACT-II, il est possible d’envisager une thrombolyse par voie artérielle sous certaines conditions. Il s’agit cependant d’une recommandation de grade IIB, car elle repose sur un seul essai randomisé en double aveugle positif qui a porté sur un nombre faible de patients (180) et qui, selon la FDA (l’agence européenne n’a pas été saisie du dossier), ne permet pas encore d’autoriser la mise sur le marché de ce médicament (pro-urokinase, non disponible en France). Un nouvel essai est en cours. Nous ne disposons pas de recommandation de la SFNV concernant la thrombolyse intra artérielle.
À titre compassionnel, et compte tenu des nombreux cas anecdotiques rapportés dans la littérature et de notre expérience, il nous semble qu’il peut être tenté au cas par cas une thrombolyse intra artérielle par rt-PA ou urokinase lors d’occlusion de
TABLEAU 6. — Efficacité et tolérance de la thrombolyse (mêta analyse de la Cochrane Collaboration) Mort ou dépendance • réduction de 45 % (27 à 58 %) • soit 140 décès ou dépendance de moins pour 1 000 patients traités • dont 12 décès de moins pour 1 000 patients traités Hémorragie symptomatique • risque multiplié par 3,2 [2,4-4,3] • risque observé 6,5 % en moyenne (entre 3 et 15 % suivant les expériences) Facteurs de risque d’hémorragie symptomatique intracérébrale après thrombolyse • déficit neurologique sévère (Score du NIH >22) • signes précoces (observés dans les 3 heures) au scanner concernant plus du tiers du territoire de l’artère sylvienne • effet de masse • âge >80 ans • traitement antérieur par de l’aspirine FIG. 2. — Pourcentage de patient par score de Rankin dans les groupes Placebo et rt-PA de l’étude pivot nord-américaine NINDS-t-PA Trial.
Un score de Rankin de 0-1 correspond à une guérison. Les résultats sont donnés à trois mois.
l’artère sylvienne associée à un déficit neurologique massif (par embolie postcathétérisme cardiaque par exemple, ou dont le mécanisme et la cause sont parfaitement connus), ou en cas d’occlusion du tronc basilaire dont le taux de mortalité est très élevé (80 %). Il faut pour cela pouvoir confier le patient à un médecin formé à la neurologie interventionnelle et qui ait l’expérience de la thrombolyse intra artérielle.
Tous les centres prenant en charge en urgence les infarctus cérébraux ne seront pas capables d’administrer ce traitement. Le patient peut être transféré dans un centre adapté. En cas de transfert impossible, le patient sera traité sur le mode conventionnel. Les limitations sont les mêmes que pour l’accès à la cardiologie interventionnelle.
PRISE EN CHARGE DANS UNE UNITÉ DE SOINS INTENSIFS NEUROVASCULAIRES (USIN)
Qu’il arrive avant la troisième, avant la sixième heure ou plus tard, tout patient atteint d’infarctus cérébral devrait être pris en charge dans une telle unité. C’est une recommandation de l’OMS depuis 1996. La mêta analyse de la Cochrane Collaboration montre que, par rapport à une prise en charge classique en service de neurologie générale ou de médecine interne, pour 1 000 patients traités dans ces unités on évite 40 décès et 50 patients supplémentaires rentrent à domicile totalement indépendants. Ce résultat est dû à la prise en charge par un personnel soignant et médical entraîné et hautement spécialisé, rendant les complications moins fré- quentes et leurs traitements optimisés. Le tableau 7 donne la liste de ces complications.
Une fois le scanner-X cérébral réalisé, le patient est placé dans une unité de soins intensifs neurovasculaires.
Œdème cérébral et augmentation de la pression intracrânienne (PIC)
Seuls 10 à 20 % des patients vont développer un œdème cérébral qui nécessite un traitement. Il survient au cours de la première semaine avec un pic de fréquence entre le 3ème et le 5ème jour, mais seuls les infarctus malins ont une détérioration liée à une augmentation de la pression intracrânienne qui survient dans les premières 24 heures.
Les anomalies scanographiques peuvent d’emblée orienter vers un infarctus céré- bral malin, très œdémateux du fait d’absence d’anastomoses, menace d’engagement temporal ou amygdalien. Il s’agit de l’infarctus sylvien malin, avec troubles de vigilance rapidement apparents, hypodensité précoce dans le territoire de l’artère ou au moins effacement des noyaux gris, disparition de la différentiation blanc-gris, disparition des sillons corticaux, effet de masse sur les ventricules latéraux et au pire déplacement de la ligne médiane. Souvent le premier segment de l’artère sylvienne est hyperdense témoignant de la présence d’un thrombus occlusif. La mortalité de
TABLEAU 7. — Principales complications après un infarctus cérébral NEUROLOGIQUES
Œdème cérébral Hydrocéphalie Hypertension intracrânienne Crise d’épilepsie MÉDICALES
Troubles de déglutition Hypoventilation Pneumonie Ischémie myocardique Arythmie cardiaque Thrombose veineuse profonde Embolie pulmonaire Infection urinaire Escarres Dénutrition Contractures et spasticité Rétractions et enraidissement articulaire ces infarctus cérébraux est supérieure à 80 %. La réalisation précoce d’une craniectomie (idéalement avant la 24ème heure) réduit cette mortalité à 20 %. Elle améliorerait aussi le devenir fonctionnel, mais ceci est en cours d’évaluation dans plusieurs essais randomisés.
L’autre circonstance est l’infarctus œdémateux du cervelet. Tout patient qui a eu un grand vertige rotatoire, des céphalées, une instabilité en position debout, des vomissements, une dysarthrie, ou seulement deux de ces signes, doit avoir un scanner à la recherche d’un infarctus du cervelet. Le trouble de la vigilance dans ce contexte est le meilleur signe de compression du tronc cérébral et de menace d’engagement amygdalien. Il impose le transfert du patient en neurochirurgie. Le scanner, en cas d’infarctus œdémateux du cervelet, peut ne pas montrer d’hypodensité. Mais l’effacement du IVème ventricule, ou une simple hydrocéphalie sus-tentorielle isolée (épargnant le IVème ventricule) doit faire envisager le diagnostic d’infarctus œdémateux du cervelet. L’IRM à ce stade peut être d’un très grand secours, et il est justifié de la demander en urgence. Le patient est alors transféré en neurochirurgie car le tableau clinique, notamment l’état de vigilance, se détériore rapidement au cours des heures suivantes, et parce que la mise en place d’une dérivation externe (par trou de trépan) permet souvent de « réveiller » le patient. En cas d’inefficacité, il est réalisé une craniectomie sous-occipitale avec incision de la dure-mère et évacuation du tissu cérébelleux nécrosé. La récupération est le plus souvent excellente.
Outre ces mesures chirurgicales, il est nécessaire, uniquement lors de ces infarctus malins uniquement, de débuter une prophylaxie anti-épileptique car une crise d’épilepsie dans un tel cas pourrait précipiter un engagement cérébral fatal. Le patient est placé en décubitus dorsal tête (ou plutôt tête du lit) surélevée de 30 degrés.
La perfusion ne doit pas être hypo-osmolaire sous peine d’aggraver l’œdème céré- bral. Les facteurs susceptibles d’aggraver l’œdème cérébral doivent aussi être compensés tels que l’hypoxie (mais il est inutile et délétère de supplémenter systématiquement un patient en oxygène lorsqu’il est normoxique), l’alcalose, l’hyperglycémie, et l’hyperthermie. Une élévation de la pression artérielle à ce stade peut être simplement une réaction compensatoire de l’organisme pour maintenir une perfusion cérébrale convenable en dépit de l’élévation de la pression intracrânienne.
Il est donc fondamental de ne pas donner de traitement antihypertenseur, en particulier ceux qui induisent une vasodilatation cérébrale, sous peine d’aggraver le patient et de tarir les éventuelles anastomoses restantes.
Concernant le traitement anti-œdémateux chez les patients qui malgré ces mesures s’aggravent, les corticostéroïdes sont contre-indiqués car aucune étude n’a montré leur efficacité et ils sont associés à de nombreuses complications telles que pneumopathies, infections urinaires, hyperglycémie. Diurèse osmotique et hyperventilation (après intubation) sont recommandées pour les patients dont l’état se détériore et qui ont un engagement cérébral. L’hyperventilation est un traitement d’urgence qui agit presque immédiatement : une réduction de la PCO2 de 5 à 10 mmHg diminue la pression intracrânienne de 25 à 30 %. Mais elle ne permet que de passer un cap et elle doit être suivie d’une autre mesure pour contrôler l’œdème cérébral et la pression intracrânienne, tel qu’un traitement chirurgical par exemple. Il faut aussi maintenir une perfusion cérébrale suffisante car l’hyperventilation peut causer une vasoconstriction, elle-même aggravant l’ischémie cérébrale. Une diurèse osmotique par Mannitol (0,25 à 0,5 g/kg IV) perfusé en 20 minutes diminue rapidement la pression intracrânienne. Il peut être donné toutes les 6 heures. La dose de 2 g/kg par 24 heures ne doit pas être dépassée (néphrotoxicité). Le glycérol a été montré efficace sur la diminution de la mortalité des patients qui ont un infarctus cérébral étendu. Il est en fait peu utilisé car il est à l’origine d’hyperglycémie et souvent mal toléré par les patients. Le glycérol intraveineux peut induire une hémolyse. Enfin, le rôle des barbituriques dans le traitement de l’infarctus cérébral malin n’a pas été évalué. Les barbituriques de courte durée d’action comme le penthotal donnés en bolus peuvent réduire rapidement et efficacement la pression intracrânienne, par réduction du volume sanguin intracrânien. Cet effet est de courte durée et ne peut être recherché que pour un traitement unique de sauvetage avant chirurgie par exemple. L’usage des barbituriques requiert une ventilation assistée, et peut occasionner une chute de la pression artérielle qui nécessite l’utilisation de drogues adrénergiques pour la compenser. Enfin, l’usage des barbituriques pourrait avoir un effet délétère à long terme.
Épilepsie
Une crise d’épilepsie survient dans 4 à 40 % des cas selon les séries (peu comparables entre elles). La vérité est probablement autour de 5-10 %. Elle survient le plus souvent dans les 24 premières heures, est souvent partielle avec ou sans généralisation. Elle récidive dans 20 à 80 % des cas. La survenue de crise d’épilepsie est associée à un plus mauvais pronostic fonctionnel. Ces patients doivent être traités.
Les patients qui n’ont pas eu de crise d’épilepsie ne doivent pas être traités prophylactiquement, sauf en cas d’infarctus cérébral malin.
Prévention des complications générales
Les patients qui ont un déficit neurologique modéré ou léger doivent immédiatement pouvoir être mis au fauteuil et les rééducations motrice et orthophonique entreprises sans délai. Ceux qui ont un déficit sévère peuvent nécessiter un alitement s’il ont une aggravation de leurs signes neurologique lorsqu’ils se lèvent, s’assoient ou lèvent la tête du plan du lit. D’autres ont les mêmes symptômes hémodynamiques et n’ont pas de déficit ou un déficit léger. Les mesures thérapeutiques sont les mêmes.
Ces patients ont une condition hémodynamique très précaire, avec une pression de perfusion à la limite de l’ischémie, très sensible à l’orthostatisme. Le monitoring du flux de l’artère sylvienne ou du tronc basilaire par Doppler transcrânien est alors très utile. Dans certains cas, il peut être utile d’envisager d’augmenter la pression artérielle par dopamine (5 gamma/kg/mn associés à un remplissage) sous certaines conditions. Des récupérations spectaculaires de déficits neurologiques clairement hémodynamiques ont été notées dans des observations isolées.
Tous les patients doivent avoir un monitoring de leur température, pression arté- rielle, électrocardiogramme, glycémie et saturation en oxygène. Une mobilisation passive des membres paralysés doit débuter dans les 24 premières heures. Le patient doit être changé de position fréquemment. L’utilisation d’un matelas anti-escarres est nécessaire, de même qu’une surveillance étroite de l’état cutané. Il a été montré qu’une mobilisation précoce diminue le risque de complications majeures telles que pneumonie, thrombose veineuse profonde, embolie pulmonaire et escarres.
L’immobilité peut conduire à des contractures, des rétractions tendineuses, une algodystrophie (surtout si le patient, mal mobilisé, a subi des tractions du membre paralysé) avec arthralgie, calcifications articulaires, gonflement inflammatoire du bras ou de la main. On évitera le poids du drap sur les pieds qui seront protégés par un cerceau.
Troubles de déglutition et pneumopathie de déglutition
La malnutrition favorise escarres et infections. Les patients qui ont un trouble de déglutition doivent être nourris par voie intraveineuse initialement, et tout apport solide ou liquide par voie orale doit être interdit. La recherche d’un trouble de la déglutition est donc impérative, tout comme celle d’une anomalie du réflexe nau-
séeux, une dysphonie, ou l’efficacité de la toux. Un réflexe nauséeux présent ne signifie pas une absence de trouble de déglutition. Un test consistant à faire boire un peu d’eau au patient est la meilleure façon de procéder. Une alimentation entérale pourra ensuite être envisagée après 24 ou 48 heures. Une hyper alimentation intraveineuse est rarement indiquée.
La pneumopathie de déglutition est une des grandes causes de décès. Toute fièvre survenant après un infarctus cérébral doit faire chercher une pneumopathie d’inhalation, d’autant plus que le patient a vomi, est immobile ou incapable de tousser. Le traitement antibiotique doit être débuté immédiatement, par voie veineuse (Pénicilline-Flagyl® ou Augmentin®), doublé d’une kinésithérapie respiratoire. En cas d’inefficacité, ou d’encombrement important, il peut être envisagé de réaliser une aspiration sous fibroscopie.
Thrombose veineuse des membres inférieurs et embolie pulmonaire
Les embolies pulmonaires sont la cause de 10 % des décès. L’immobilité du membre paralysé est le facteur de risque majeur. En cas de paralysie du membre inférieur, une thrombose veineuse (asymptomatique) est détectée dans 30 à 80 % des cas selon les séries, et une thrombose proximale dans 30 % des cas. Tout patient alité avec une paralysie du membre inférieur doit recevoir un traitement par héparine de bas poids moléculaire à dose préventive. La compression intermittente des membres inférieurs est une bonne alternative en cas de contre-indication aux anticoagulants. Tous les patients doivent porter des bas de contention antithrombose.
Infections urinaires
Elles sont fréquentes et une septicémie peut en résulter chez 5 % des patients. Une sonde urinaire à demeure est parfois nécessaire en cas d’incontinence totale, pour prévenir les escarres. Cela doit être évité autant que possible. La recherche d’un globe vésical est systématique, en particulier devant un patient agité sans raison, ou confus, avec une exacerbation de sa spasticité. Une évaluation du résidu postmictionnel ou du contenu vésical doit être effectuée régulièrement. Elle doit être non invasive (éviter le sondage) au mieux à l’aide du « bladder scan » dont devraient être équipées toutes les unités de soins neurovasculaires. En cas de rétention, l’acidification des urines et le sondage intermittent diminuent le risque d’infection et permettent d’éviter les antibiotiques. Un traitement anticholinergique peut aider à la récupération de la fonction vésicale.
Fièvre et hyperglycémie
L’élévation de la température après un infarctus cérébral pourrait être un facteur aggravant. Il est recommandé de traiter immédiatement les patients par paracétamol dès que la température dépasse 37°5C.
L’hyperglycémie semble associée à un plus mauvais pronostic fonctionnel et à une mortalité accrue. Il est recommandé de traiter immédiatement par insuline les patients qui ont une glycémie supérieure à 2g/l ou 10 mmol/l. Des essais thérapeutiques sont en cours pour évaluer l’intérêt de maintenir systématiquement une glycémie normale. Jusqu’à ce que la glycémie soit connue, il ne faut pas donner de sérum glucosé à la phase aiguë de l’infarctus cérébral.
Prise en charge psychologique
Une prise en charge psychologique du patient et de sa famille, par une psychologue, est indispensable dès les toutes premières heures. L’infarctus cérébral frappe souvent des sujets en pleine activité ou responsables de famille, bouleverse les équilibres familiaux et génère angoisse, peur de la mort, anxiété devant l’avenir personnel, familial, souvent financier (crédits en cours, etc.) sources de revendication, parfois de débordement, ou de dépression. Le patient et sa famille doivent être informés sans dramatiser mais aussi sans minimiser, rassurés autant que possible et sans tromper, soutenus psychologiquement. Le personnel soignant, infirmier principalement, ne devrait pas avoir à subir tout le poids de cette « complication » très fréquente de l’infarctus cérébral. Le personnel lui-même, dans de nombreuses circonstances, doit aussi bénéficier d’un soutien psychologique.
Traitement antithrombotique
L’aspirine à la dose de 160 à 300 mg/j est le traitement antithrombotique de base de tout infarctus cérébral. Il évite 9 décès ou récidive pour 1 000 patients traités. Il peut être donné immédiatement, par voie orale ou par voie veineuse, sauf chez les patients traités par thrombolyse chez qui l’aspirine sera administrée après la 24ème heure.
L’héparine n’a pas d’indication à la phase aiguë de l’infarctus cérébral ; elle est même délétère lorsqu’on la donne à des patients non sélectionnés (Recommandation de grade 1A), ou porteurs d’un infarctus cérébral massif au scanner, ou d’une hémiplégie massive, de troubles de la conscience, d’une hypertension artérielle non contrôlée. Le risque d’hémorragie cérébrale, dans toutes ces circonstances, y compris dans la première citée, est supérieur au bénéfice que l’on pourrait escompter.
L’héparine n’a jamais été testée à la phase très aiguë de l’infarctus cérébral (avant les 12 premières heures). Certaines indications, encore empiriques, persistent pour certaines équipes (et qui devront faire l’objet d’essais thérapeutiques contrôlés chaque fois que possible) chez un patient non totalement paralysé et conscient :
cardiopathie emboligène à haut risque de récidive (rétrécissement mitral, infarctus du myocarde antérieur, thrombus mural intracardiaque, cardiopathie dilatée, prothèse valvulaire mécanique), sténose carotide ou vertébrobasilaire serrée avec retentissement hémodynamique d’aval au Doppler transcrânien (dissection ou sténose athéroscléreuse), ou encore accident en évolution.
Traitements adjuvants visant à protéger les cellules cérébrales
L’hémodilution isovolémique (diminuant l’hématocrite de plus de 15 %, diminuant ainsi la viscosité sanguine et donc améliorant le débit sanguin cérébral) n’a apporté aucun bénéfice dans deux grandes études randomisées en terme de mortalité et de handicap. L’hémodilution hypervolémique n’a été évaluée que dans deux petites études randomisées, et pas dans les toutes premières heures. Son efficacité n’a pas été établie par ces études et elle pourrait causer un œdème cérébral.
Aucun agent neuroprotecteur n’a d’action dans l’ischémie cérébrale. Tous les essais ont été négatifs, incluant ceux qui ont étudié les inhibiteurs calciques par voie orale ou par voie veineuse, les inhibiteurs NMDA, les antiglutamates, les éboueurs de radicaux libres, le fibroblast growth factor .
BIBLIOGRAPHIE [1] ADAMS H.P., BROTT T.G., CROWELL R.M. et coll. — Guidelines for the management of patients with acute ischemic stroke. A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Circulation , 1994, 90 , 1588-1601.
[2] ALBERS G.W., AMARENCO P., EASTON J.D., SACCO R.L., TEAL P. — Antithrombotic and thrombolytic therapy for ischemic stroke. Chest , 2001, 119, 300S-320S.
[3] European Stroke Initiative (EUSI). — Recommandations for stroke management.
Cerebrovasc
Dis., 2000, 10 (suppl 3), 1-34.
[4] LARRUE V., AMARENCO P., CAUSSANEL J-P., DUCROCQ X., LUCAS C., MAHAGNE M-H., ROUANET F. pour la Société Française Neurovasculaire. — Recommandations pour l’utilisation du traitement thrombolytique intraveineux dans l’accident ischémique cérébral. La Lettre du Neurologue, 2000, 4, 55-62.
* Service de Neurologie et Centre d’Accueil et de Traitement de l’Attaque Cérébrale, Hôpital Bichat, 46 rue Henri Huchart — 75018 Paris. Tirés-à-part : Professeur Pierre AMARENCO, à l’adresse ci-dessous. Article reçu le 12 juin 2002, accepté le 24 juin 2002.
Bull. Acad. Natle Méd., 2002, 186, n° 7, 1189-1207, séance du 15 octobre 2002


