Résumé
L’hypersensibilité à l’aspirine se manifeste le plus souvent par un syndrome clinique associant une rhinite chronique, une polypose nasale et des crises d’asthme exacerbées par l’ingestion d’aspirine ou d’autres médicaments anti-inflammatoires non stéroidiens (AINS). Ce syndrome a été décrit pour la première fois par Widal en 1922. Jusqu’à récemment, le mécanisme pathophysiologique de l’hypersensibilité aux AINS était resté quelque peu mystérieux. Le fait que les médiateurs principalement impliqués sont les sulfidoleukotrienes (LTC4, LTD4, LTE4) et que les médicaments impliqués ont pour caractéristique commune d’inhiber la cyclooxygénase-1 (COX-1) a fait présupposer une anomalie pharmacogénétique dans le métabolisme de l’acide arachidonique chez de tels patients. Une étude immunopharmacologique portant sur l’activation des basophiles détectée par cytométrie de flux et la production de sulfidoleukotrienes in vitro en présence d’ AINS, dont les résultats sont brièvement présentés, ainsi que d’autres études passées en revue permettent d’établir que : — les basophiles des patients atteints du syndrome de Widal sont hyperactivés de manière non spécifique, probablement sur la base d’une inflammation chronique au niveau de la peau ou des voies respiratoires ; — ces basophiles hyperactifs produisent des quantités augmentées de sulfidoleukotrienes mais diminuées de PGE2 sous l’effet d’AINS. Ces constatations ont permis pour la première fois d’établir un test diagnostique in vitro , susceptible de remplacer dans bien des cas le test de provocation, considéré jusqu’ici comme la seule procédure permettant objectivement de confirmer le diagnostic. Les données accumulées permettent désormais de formuler pour le syndrome de Widal une pathogénie impliquant l’effet conjoint d’une inflammation chronique entraînant une hyperactivité cellulaire non spécifique, particulièrement des mastocytes, basophiles et éosinophiles et d’une anomalie pharmacogénétique du métabolisme del’acide arachidonique. La combinaison de ces deux facteurs aboutit à une surproduction des médiateurs inflammatoires tels que les sulfidoleukotriènes et à une diminution de la prostaglandine antiinflammatoire PGE2. Ce concept permet d’expliquer la plupart des observations cliniques sur l’apparition et l’évolution du syndrome de Widal et offre une base rationnelle pour une approche thérapeutique.
Summary
Hypersensitivity to aspirin usually takes the form of a clinical syndrome combining chronic rhinitis, nasal polyposis and asthma attacks that are exacerbated by aspirin or other non steroidal anti-inflammatory drugs (NSAIDs). This syndrome, first described by Widal in 1922, is very frequent : it affects nearly 15 % of asthmatic patients and is usually associated with severe and sometimes fatal asthma. In other instances, hypersensitivity to NSAIDs manifests in the form of skin lesions, such as urticaria and angioedema. Until recently, the pathophysiological mechanism of NSAID hypersensitivity was somewhat mysterious. The fact that the main mediators involved are sulfidoleukotrienes (LTC4, LTD4, LTE4) and that the drugs responsible all inhibit cyclooxygenase-1 (COX-1), pointed to a pharmacogenetic abnormality of arachidonic acid metabolism. An immunopharmacological study of basophil activation (detected by flow cytometry), sulfidoleukotriene production in the presence of NSAIDs in vitro , and other related studies reviewed here have revealed that : a) basophils from patients with the Widal syndrome are hyperactivated in a non specific manner, probably related to chronic inflammation in the skin or airways ; b) these hyperactive basophils produce increased amounts of sulfidoleukotrienes but decreased amounts of PGE2 when exposed to NSAIDs in vitro . These observations led to the development of an
in vitro diagnostic test which, in many cases, can replace challenge tests. The pathogenic mechanism of the Widal syndrome now appears to involve the combined effects of chronic inflammation (causing non specific cellular hyper-reactivity, particularly of mast cells, basophils and eosinophils) and a pharmacogenetic abnormality of arachidonic acid metabolism in response to NSAIDs. This leads to sulfidoleukotriene overproduction and to a decrease in the anti-inflammatory prostaglandin PGE2. This concept is compatible with the onset and outcome of most cases of the Widal syndrome, and provides a therapeutic rationale.
INTRODUCTION
L’hypersensibilté à l’aspirine et aux autres médicaments anti-inflammatoires non stéroïdiens (AINS) est un syndrome bien connu, décrit pour la première fois par Widal en 1922 [1], et qui a particulièrement attiré l’attention au cours des dernières décades [2, 3]. Ce syndrome se manifeste soit dans les voies respiratoires, combinant une rhinite chronique, une polypose nasale et un asthme chronique exacerbé par l’ingestion d’aspirine ou autres AINS (la classique « triade »), soit par des manifes-
tations cutanées, telles que urticaire ou angioœdème. Ces deux formes de manifestations cliniques peuvent parfois coexister mais cela est assez rare.
La fréquence de l’hypersensibilité à l’aspirine et aux AINS a été estimée dans diverses études être environ 10-20 % des asthmatiques et 0.6 à 2.5 % dans l’ensemble de la population [2, 3, 4]. Ce syndrome représente une proportion importante, 20-25 %, de l’ensemble des réactions d’hypersensibilité aux médicaments [5].
À l’exception de quelques cas plus rares de choc anaphylactique, qui peuvent occasionellement être associés avec des IgE spécifiques [6, 7], il est généralement admis que l’hypersensibilité à l’aspirine n’est pas dûe à des IgE mais relève d’un autre mécanisme. Il a été proposé il y a près de 30 ans que la réaction découle de l’inhibition de la cyclooxygénase (COX) produite par l’aspirine et ses analogues dans les voies respiratoires ou la peau des patients sensibles [8, 9]. Cette théorie de base a été récemment restreinte à l’inhibition de la cyclooxygénase 1 (COX-1) puisque la plupart des patients sensibles à l’aspirine supporte sans dommage les médicaments inhibant spécifiquement la cyclooxygénase 2 (COX-2) [3]. Les inhibiteurs de la cyclooxygénase 1 diminuent la production de prostaglandin E2 (PGE2), qui agit normalement comme un frein à la production de sulfidoleukotriènes (sLT), aussi dénommées cysteinyl-leukotriènes (LTC4, LTD4, LTE4) et autres médiateurs par les mastocytes [10, 11]. Il y a également des observations indiquant que les patients hypersensibles aux inhibiteurs de la COX-1 produisent davantage de sLT, même avant administration d’aspirine ou de AINS [12, 13] et/ou pourraient avoir des récepteurs plus sensibles pour ces médiateurs. Un enzyme clé, la synthase C4 est surabondante dans la muqueuse bronchique de tels patients [14], ce qui a entraîné l’hypothèse de base d’une anomalie pharmacogénétique du métabolisme de l’acide arachidonique comme la cause principale de ce syndrome [15, 16]. Toutefois, la recherche d’un polymorphisme génétique associé au syndrome de Widal n’a produit jusqu’ici que des résultats contradictoires [17-19].
Il a été très souvent répété depuis plus de 30 ans qu’il n’existe pas de test biologique in vitro permettant de confirmer le diagnostic d’hypersensibilité aux AINS : seul un test de provocation, désagréable pour le patient et souvent dangereux, permet de confirmer ce diagnostic [2, 3]. Cette affirmation est devenue quasi un dogme parmi les allergologues, propagé également en France par les leaders de la spécialité [20].
En effet, la recherche d’IgE spécifiques est presque toujours négative et les tests cellulaires pratiqués jusqu’ici, particulièrement la libération d’histamine, sont peu convaincants [21, 22].
Il y a une dizaine d’années, mon groupe de Berne avait mis au point un nouveau test cellulaire de diagnostic en allergologie, basé sur la production de sLTs par les basophiles du sang périphérique en présence de l’allergène in vitro [23, 24]. Ce test, commercialisé ensuite sous le nom de CAST (Cellular Allergen Stimulation Test)*, * FLOW CAST et CAST COMBI, Laboratoires Bühlmann, Allschwil (Suisse) — BASOTEST, Becton-Dickinson, Orpegen, Heidelberg (Allemagne) — Coulter-Immunotech, Marseille (France).
a trouvé un certain nombre d’applications et d’indications cliniques, particulièrement dans certaines allergies par inhalation [25], dans les allergies aux venins d’hyménoptères [26]), au latex [27], dans les allergies alimentaires [28, 29] et dans les allergies médicamenteuses dues à des IgE spécifiques, telles que les réactions de type anaphylactique aux Bétalactamines [30] et aux analgésiques [31]. Ce test est apparu comme particulièrement utile pour éclaircir des cas complexes, particulièrement lorsqu’il y a discordance entre l’histoire clinique et les tests cutanés ou la recherche d’IgE spécifiques.
Les résultats du CAST dans l’hypersensibilité à l’aspirine et AINS sont mitigés.
Alors que certains auteurs décrivent dans des séries bien contrôlées des résultats positifs avec une sensibilité de 60-70 % et une spécificité de 95-100 %, d’autres, y compris les résultats présentés ici, font état d’une sensibilité nettement plus faible de 20-30 % et une étude est même totalement négative (Tableau 1). Quatre études additionnelles, sans décrire l’analyse de résultats individuels, ont confirmé que les groupes de patients cliniquement sensibles à l’aspirine produisent en réponse à l’aspirine et/ou au dérivé du complément C5a in vitro davantage de sLTs que les groupes contrôles [54, 58, 66, 68]. Une étude attentive des résultats publiés révèle que les conditions techniques de réalisation du test CAST ont malheureusement varié considérablement d’une étude à l’autre, tant en ce qui concerne les doses d’allergène utilisées que les critères de positivité choisis [32] ; cela peut peut-être expliquer les discordances et des divergences d’interprétation. Quoi qu’il en soit, certaines études positives semblaient bien confirmer in vitro la constatation bien établie in vivo selon laquelle les patients hypersensibles aux AINS produisent plus de sLT en présence d’aspirine et d’AINS que les patients tolérants. De plus, ces résultats suggéraient que les basophiles, en plus des mastocytes et des éosinophiles, sont également impliqués dans ces réactions d’hypersensibilité.
Au cours de ces dernières années, un nouveau test biologique cellulaire a pris une importance croissante en diagnostic allergologique, le test d’activation des basophiles détectée par cytométrie de flux. Ce test est en quelque sorte l’aboutissement du vieux test classique de dégranulation des basophiles [34], test abandonné de puis plusieurs années en raison de son manque de fiabilité. Le test d’activation des basophiles par cytométrie de flux (BAT ou FAST), dont il existe actuellement trois versions commerciales* est basé sur la détection des basophiles par un marqueur de membrane spécifique (e.g détecté par anticorps anti-IgE ou anticorps 203c) et d’un marqueur d’activation cellulaire, telle que la protéine CD63 [35]. Cette technique a été utilisée pour la première fois pour le diagnostic allergologique en France dès 1994 par les groupes d’Alfred Sabbah [36] et de Jean Sainte-Laudy [37], ainsi que Francisque Leynadier [38] mais ce n’est que depuis quelques années que des études systématiques et bien contrôlées ont définitivement montré sa valeur dans nombre d’indications telles que les allergies aux pneumallergènes [39], les allergies aux venins d’hyménoptères [40], au latex [27, 41], les allergies alimentaires [28] et les allergies médicamenteuses, par exemple aux Bétalactamines [42], aux myorelaxants [43, 44] et aux analgésiques.[31]
AINS#.
aux é ypersensibilit l ’ h dans CAST sur é s li pub ts r é sulta des é é sum R — 1.
ABLEAU T
Dans l’hypersensibilité aux AINS, à part quelques observations anecdotiques [45, 46], il n’y avait pas eu jusqu’ici d’étude systématique validée par tests de provocation et utilisant aussi bien l’activation des basophiles que la production de sLT en présence de divers AINS in vitro .
Les résultats obtenus présentés brièvement ici et qui sont publiés en détail ailleurs [32, 33] permettent non seulement d’établir de manière crédible la validité diagnostique de tels tests mais également de formuler une nouvelle hypothèse pathogénique intégrant de manière rationnelle les divers aspects de l’hypersensibilité aux AINS.
MÉTHODOLOGIE DES TESTS BIOLOGIQUES CAST ET FAST
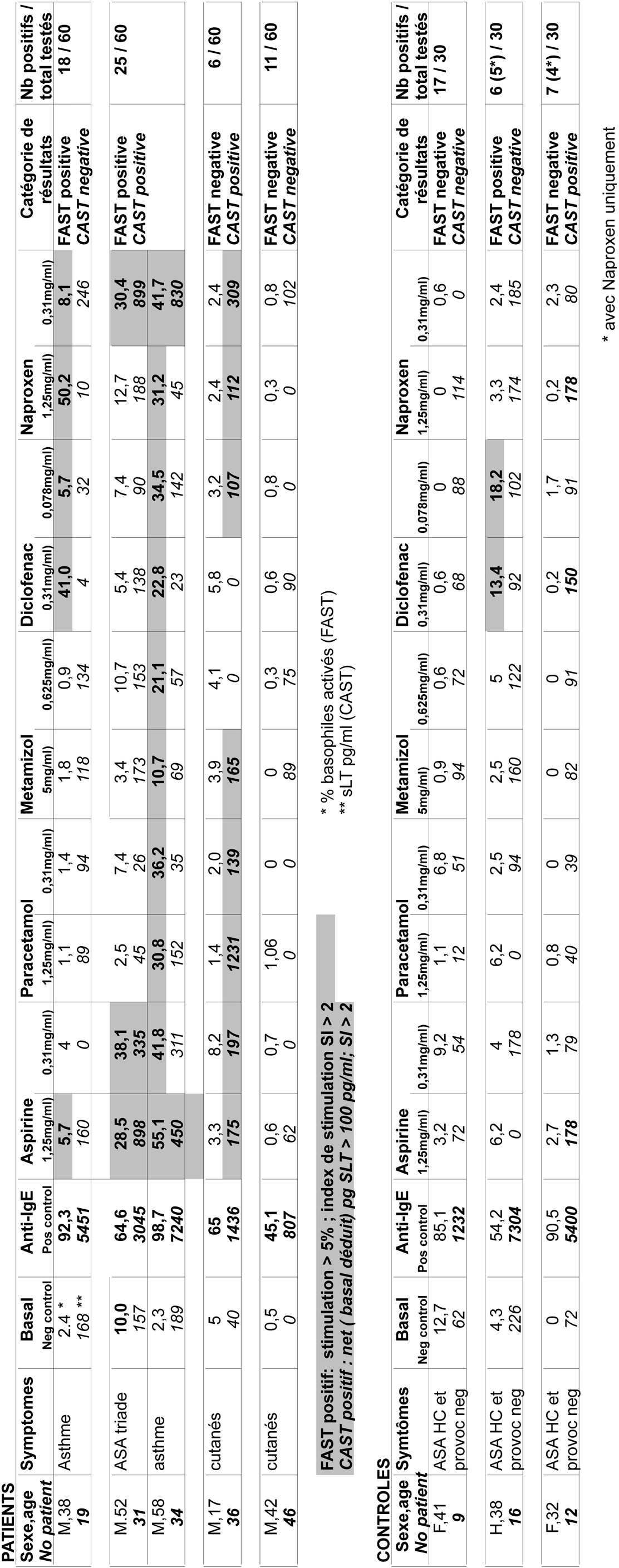
Pour l’étude résumée ici, 60 patients présentant une histoire clinique bien documentée d’hypersensibilité à l’aspirine et/ou AINS (23 hommes, 37 femmes, âge moyen 44.1 ans) ont été sélectionnés. 38 patients présentaient des symptômes cutanés (urticaire / angioœdème), 20 des symptômes respiratoires (rhinite, polypose, asthme) et 2 des symptômes combinés. Tous les patients ont souffert de symptômes dans l’heure suivant l’administration d’AINS. Lorsque le patient a documenté au moins deux épisodes ou davantage consécutifs à la prise d’au moins deux médicaments AINS faisant partie de groupes pharmacologiques différents, le diagnostic a été considéré comme établi. Lorsqu’il n’y avait qu’un épisode ou que plusieurs épisodes n’avaient été causés que par un seul médicament, le diagnostic a été confirmé par un test de provocation pratiqué avec un autre AINS que celui ayant occasionné la réaction. 30 patients tolérant aspirine et AINS, parmi lesquels 15 asthmatiques et 21 atopiques ont été sélectionnés comme contrôles.
Le test d’activation des basophiles (FLOW CAST) a été pratiqué sur des leucocytes isolés du buffy coat. Incubés pour 40 minutes à 37° C en présence d’aspiryl-lysine (1.25 et 0.3 mg/ml), paracetamol (1.25 et 0.3 mg/ml), metamizol (5 et 1 mg/ml), diclofenac (0.3 et 0.08 mg/ml) et naproxen (1.25 et 0.3 mg/ml). Pour chaque test, un contrôle négatif (milieu sans allergène) et un contrôle positif (anticorps antiFcER1) sont inclus. Après incubation, les surnageants sont recueillis pour analyse des sLTs par CAST-ELISA (voir ci-dessous) et les cellules traitées par anticorps fluorescents anti-IgE.-FITC et anti-CD63-PE pour analyse par cytométrie de flux.
Pour plus de détails techniques, voir réf 32 et 33 Les résultats sont exprimés en pourcentage d’activation des basophiles ; le seuil de positivité déterminé par courbes ROC a été fixé à 5 % avec un index de stimulation > 2.
La détermination des sLTs CAST) par ELISA a été pratiquée conformément aux indications du fabricant. Le seuil de positivité a été fixé à 100 pg/ml net (valeurcontrôle négatif) et un index de stimulation >2. Pour plus de détails techniques, voir réf. 32 et 33.
L’intervalle entre la dernière réaction clinique aux AINS et la prise de sang a varié entre 1 mois et plusieurs années (voir détails dans réf 32 et 33). Cet intervalle, comme discuté ci-dessous, semble influencer les résultats.
RÉSULTATS
Quelques exemples des résultats individuels obtenus pour patients et contrôles et groupés par catégories de réactions à FAST et CAST, sont montrés (Tableau 2). On peut y constater que :
— les patients sont fréquemment positifs à plus d’un AINS, — la positivité de FAST coïncide parfois à celle de CAST mais pas toujours, — les contrôles pour FAST sont la plupart du temps négatifs, à part le Naproxen.
Une récapitulation de tous les résultats pour FAST, CAST et la combinaison des deux tests en termes de sensibilité et spécificité se trouve dans le Tableau 3 . Il est manifeste que FAST est de loin le test le plus sensible et qu’il est très spécifique. Les valeurs de prédiction positives (VPP) et négatives (VPN) pour le test FAST oscillent autour de 100 % pour VPP et 99 % pour VPN pour aspirine, paracétamol et metamizol [33]. Pour diclofenac et naproxen, la VPP est nettement plus faible (2-8 %) si on la calcule sur la base d’une prévalence de 1 % dans la population, comme un test de dépistage global. Mais la VPN reste supérieure à 90 % si on la calcule logiquement sur la base d’une prévalence de 40 % dans la population sélectionnée testée sur la base d’une anamnèse suspecte d’hypersensibilité aux AINS [33]. L’addition de CAST au FAST comme test biologique dans cette indication permet d’augmenter légèrement la sensibilité, qui passe de 66.7 à 73.3 % mais au détriment de la spécificité qui décroît de 93.3 à 71.4 % pour l’ensemble de 4 AINS.
Il semble particulièrement important pour obtenir une bonne sensibilité de tester non seulement l’aspirine mais également d’autres AINS, en particulier diclofenac.
Dans ces cas, de nombreux patients présentent deux ou plus tests positifs, ce qui n’est pas le cas pour les contrôles (Tableau 4). Si, pour des raisons pratiques et/ou financières, on limite les tests biologiques au FAST avec aspirine et diclofenac à deux concentrations, la sensibilité décroît légèrement à 58.3 % (35/60) mais la spécificité reste élevée à 93.3 %.Le naproxène semble être un cas spécial car à des concentrations plus élevées, il est un stimulant obligatoire pour les basophiles, même chez les contrôles [32]. Aux concentrations utilisées ici, il est encore positif dans un nombre non négligeable de contrôles mais nettement plus souvent chez les patients (Tableau 3). Par conséquent, un test positif au naproxène isolé doit être interprété avec prudence mais peut confirmer le diagnostic si associé à des tests positifs à d’autres AINS.
Un facteur pouvant influencer le résultat des tests est le temps écoulé depuis la dernière administration et réaction clinique à un AINS. Parmi les 13 patients testés dans l’espace d’un mois après une provocation positive, 10 (76.9 %) on montré un test FAST positif. Alors que parmi 35 patients testés 12 mois ou plus après la dernière réaction et administration d’AINS, seuls 20 (57.1) % ont montré une réaction positive.
 .
.
les ô contr et tients pa chez CAST et AST F viduels indi ts r é sulta de emples Ex — 2.
ABLEAU T .
.
AINS aux é ypersensibilit l ’ h dans CAST et AST F de é cit fi é ci Sp et é Sensibilit — 3.
ABLEAU T
Une analyse détaillée ne montre pas de différences significative de sensibilité et spécificité pour les divers AINS utilisés entre les patients avec symptômes cutanés ou lea patients avec symptômes respiratoires. Une analyse plus détaillée des résultats est décrite ailleurs [32, 33].
DISCUSSION
Les résultats sommairement présentés ici sur un groupe de patients bien défini et cliniquement validés démontrent que les basophiles des patients hypersensibles à l’aspirine et aux AINS possèdent également une hyperréactivité in vitro à ces médicaments, qui se traduit par une activation membranaire et parfois, par une production anormale de sLTs. La participation des basophiles ä l’hypersensibilité aux AINS est confirmée par une observation récente de l’hyperproduction de 15-HETE des leucocytes de patients hypersensibles en présence d’aspirine in vitro [47]. Ces phénomènes peuvent former la base d’un test diagnostique in vitro , même si la sensibilité n’est pas optimale. La spécificité élevée, de même que l’étroite association avec une provocation positive, rendent le test FAST utile dans des cas individuels : valeur de prédiction positive oscillant suivant les associations d’AINS entre 100 % et 99.1 % et la valeur de prédiction négative oscillant entre 100 % et 98.2 %) [33]. Il permettra dans de nombreux cas d’éviter un test de provocation dangereux et éthiquement contestable. Certes, ces résultats doivent encore être confirmés par d’autres groupes ; une étude multicentrique dans le cadre du groupe ENDA de l’Académie Européenne d’Allergie est actuellement en cours.
Mais ces résultats doivent également nous donner à réfléchir en ce qui concerne la pathogenèse de ce syndrome d’hypersensibilité aux AINS. Pour ce faire, il est nécessaire de se remémorer un autre fait fréquemment passé sous silence : les basophiles des patients hypersensibles aux AINS ne sont pas seulement hyperréactifs aux AINS, ils le sont également à un certains nombre de stimulants non spécifiques. Un des stimulants non spécifiques des basophiles les plus connus est le peptide C5a du complément qui a souvent été utilisé pour définir l’état d’hyperréactivité des basophiles [48], par exemple l’augmentation de réactivité faisant suite au contact avec IL-3 [48] ou IL-5 [49]. Or il s’avère que l’hyperréactivité à C5a est une propriété quasi constante des basophiles de patients hypersensibles aux AINS [54, 61, 65] . L’addition de C5a aux AINS in vitro augmente la production de sLTs, mais cela uniquement pour les basophiles des patients hypersensibles, pas pour les basophiles normaux (Tableau 1) et [50, 58, 65, 68], Cette observation est consistante avec la notion que la réaction augmentée et anormale aux AINS ne se produit que si les basophiles se trouvent déjà dans un état d’hyperexcitabilité non spécifique.
Cela explique peut-être aussi notre observation que l’intervalle écoulé entre la dernière réaction clinique et le test des basophiles aux AINS semble jouer un rôle ;
l’hypersensibilité inflammatoire non spécifique est essentiellement fluctuante et son
TABLEAU 4. — Mode de réactivité à divers AINS chez les patients hypersensibles et les contrôles.
Nombre de tests positifs*
Patients n = 60
Contrôles n = 30 1 16 1 2 7 1 3 6 4 5 5 1 6 2 7 0 8 1 déclin avec le temps ou sous des influences thérapeutiques (par ex. stéroïdes) peut expliquer la diminution de la réactivité aux AINS in vitro et in vivo . Il faut se rappeler que les provocations positives aux AINS sont nettement plus fréquentes lorsque les patients sont encore symptomatiques [71].
La théorie actuelle d’une simple anomalie pharmacogénétique de ces patients dans leur métabolisme de l’acide arachidonique ne semble pas à elle seule pouvoir expliquer nombre d’observations cliniques :
— l’hypersensibilité à l’aspirine n’existe pas à la naissance ; elle se manifeste rarement durant l’enfance et n’apparaît le plus souvent qu’à la 3ème ou 4ème décade de la vie.
— l’hypersensibilité aux AINS n’est pas toujours établie une fois pour toutes ; elle est fluctuante et les tests de provocation répétés inconstants [51].
— une hypothèse strictement pharmacologique et génétique a du mal à expliquer pourquoi certains patients manifestent uniquement des symptômes cutanés et d’autres respiratoires.
Pour expliquer l’hypersensibilité aux AINS uniquement sur une base génétique et pharmacologique, il faudrait admettre des facteurs épigénétiques puissants encore inconnus.
Ces incohérences apparentes deviennent par contre explicables si l’on admet que la cause première dans l’hypersensibilité aux AINS est le développement d’une inflammation chronique, au niveau de la peau ou au niveau des voies respiratoires. Cette inflammation chronique se manifeste particulièrement au niveau des mastocytes tissulaires, qui deviennent hyperréactifs et produisent davantage de sLTs. Le rôle primaire d’une inflammation chronique localisée peut expliquer également la localisation ultérieure des symptômes déclenchés par les AINS. L’origine de cette inflammation chronique peut être variable ; l’hypothèse d’infections virales chroniques a été avancée [52] et en partie démontrée par l’effet occasionnel de médicaments anti-viraux sur l’hypersensibilité aux AINS. [53]. Bien que le rôle pathogénique
primaire soit probablement celui de cellules locales, telles que les mastocytes, il n’y a pas d’obstacle théorique à ce que le phénomène inflammatoire local déborde sur des cellules circulantes du sang, telles que éosinophiles et basophiles et que celles ci deviennent également impliquées dans le phénomène d’hyperréactivité inflammatoire. Par exemple, la présence de basophiles hyperéactifs, entre autres au C5a, a été bien démontrée dans l’asthme [54], l’urticaire chronique [55] et la dermatite atopique [56].
Mais alors, pourquoi tous les patients atteints de rhinite chronique, d’asthme ou d’urticaire ne sont ils pas hypersensibles aux AINS ? Il faut bien admettre qu’un ou des facteurs additionnels, probablement génétiques et métaboliques, viennent se greffer sur le fond d’hyperréactivité causé par l’inflammation chronique. Malgré une recherche intense, les mécanismes moléculaires et enzymatiques par lesquels les AINS causent une stimulation des basophiles et une libération des médiateurs, particulièrement de sLTs, ne sont pas encore élucidés [3]. S’agit-il d’une action directe sur la synthèse de LTC4, par exemple d’une expression augmentée de la synthase C4 [14] ou d’un effet indirect par inhibition de la synthèse de PGE2 ? Il est en effet bien connu que PGE2 a un effet anti-inflammatoire inhibant la synthèse de LTC4 et autres médiateurs, aussi bien in vivo que in vitro [2, 3, 57]. L’effet inhibiteur de PGE2 sur la production de sLTs par les basophiles in vitro a été récemment confirmé [58]. Un déficit en PGE2 consécutif à l’inhibition de COX-1 par les AINS peut suffire à déclencher une activation de basophiles normaux, comme le montre notre observation d’une activation spontanée quasi-obligatoire par de fortes concentrations de naproxène [32].
Chez les sujets hypersensibles aux AINS, un déséquilibre et une relation inverse entre production de sLTs et de PGE2 sont également documentés [59]. La nature exacte des altérations du métabolisme de l’acide arachidonique qui différencient les sujets hypersensibles aux AINS des sujets normaux reste donc encore à préciser ;
s’agit-il de différences simplement quantitatives ou qualitatives, éventuellement sur base génétique ? Il est également possible que des différences se manifestent à d’autres niveaux que celui de la synthèse des sLTs, par exemple dans la synthèse des lipoxines, qui ont également un effet anti-sLTs [60] ou dans l’expression cellulaire des récepteurs de LTC4 [61]. Il apparaît toutefois comme certain que ces différences ne se manifestent que lorsque les cellules on été « préactivées » et sensibilisées par un processus de stimulation non spécifique.
L’élément nouveau dans la compréhension du syndrome d’hypersensibilité aux AINS est qu’il nécessite pour son déclenchement une succession d’événements multifactoriels, dont le premier est essentiellement acquis et variable (inflammation chronique localisée), alors que le deuxième est probablement constitutionnel et génétiquement déterminé. Un tel concept est illustré ci-après (Figure 1). Il peut venir s’y ajouter quelques facteurs additionnels mineurs, tels que l’activation du complément par l’aspirine avec production de C3a et C5a, phénomène transitoire qui a été décrit in vitro [62] et in vivo [63] mais qui est encore controversé [64].
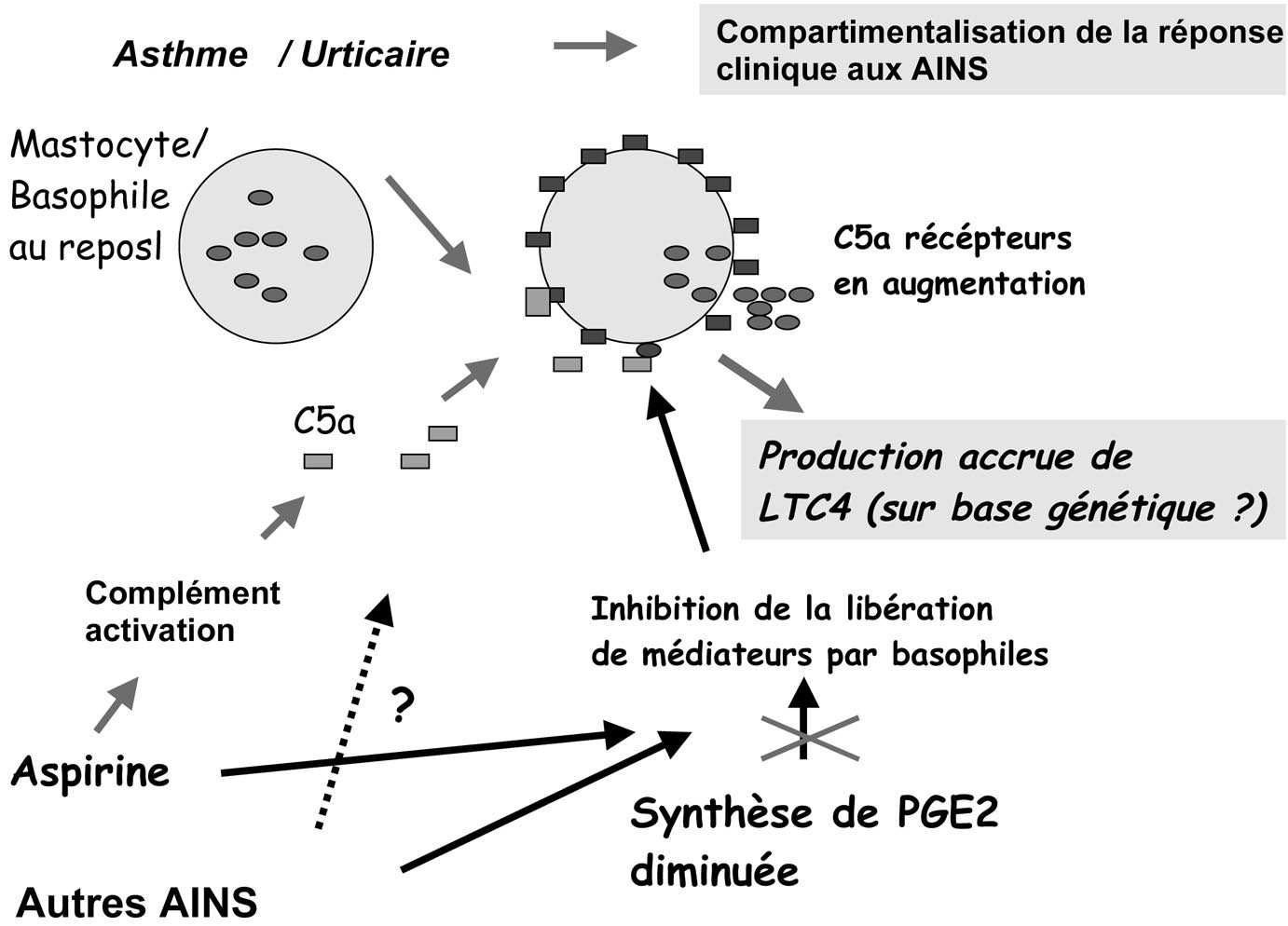
FIG. 1. — Conception multifactorielle de l’hypersensibilité uux AINS.
La condition première est une inflammation chronique au niveau de la peau ou des voies respiratoires entraînant une hyperréactivité de divers types cellulaires tissulaires, en particulier des mastocytes, et de cellules sanguines telles que basophiles et éosinophiles. Cette hypersensibilité est non spécifique et se manifeste entre autres par une hyperréactivité au peptide C5a du complément activé. Il vient s’y greffer une hyperréatictivité aux AINS manifestée par une augmentation de la synthèse des sLTs, et augmentée par une diminution de la synthèse de PGE2 sous l’effet pharmacologique des AINS. La production de C5a par activation du complément pourrait ajouter un facteur aggravant (controversé).
Les conséquences pratiques de ce concept sont d’une part la possibilité nouvelle d’établir des tests de diagnostic in vitro , sur la base de la réactivité cellulaire accrue de diverses cellules sanguines aux AINS, particulièrement basophiles et éosinophiles. La sensibilité de tels tests ne sera toutefois probablement jamais optimale, puisque la réactivité des cellules circulantes n’est que le reflet d’une inflammation locale plus ou moins intense et fluctuante. D’autre part, une thérapie causale de l’hypersensibilité aux AINS devrait avoir pour cible première l’inflammation chronique qui est à la base du syndrome. C’est bien la raison pour laquelle une des traitements les plus efficaces de ce syndrome sont les corticostéroïdes [2, 3].
REMERCIEMENTS
Ce travail est dédié à la mémoire de Jacques CHARPIN, membre de l’Académie nationale de médecine, grand maître de l’allergologie française, décédé en septembre 2003.
BIBLIOGRAPHIE [1] WIDAL M.F., ABRANI P., LERMOYEZ J. — Anaphylaxie et idiosyncrasie.
Presse Méd ., 1922, 30 , 189-192 — Nachdruck in :
Allergy Proc ., 1993, 14 , 373-376.
[2] SZCZEKLIK A., STEVENSON D. — Aspirin-induced asthma : Advances in pathogenesis, diagnosis and management. J. Allergy Clin. Immunol. , 2003, 111 , 913-921.
[3] SZCZEKLIK A., STEVENSON D.D. — Aspirin-induced asthma : Advances in pathogenesis and management. J. Allergy. Clin. Immunol. , 1999, 104 , 5-13.
[4] KASPER L., SLADEK K., DUPLAGA M., BOCHENEK G., LIEBHARD J., GLADYSZ U., MALOPEPSZY J., SZCZWKLIK A. — Prevalence of asthma with aspirin hypersensitivity in the adult population of Poland. Allergy , 2003, 58 , 1084-1066.
[5] FAICH G.A. — Adverse drug reaction monitoring.
N. Engl. J. Med. , 1986, 314 , 1589-1592.
[6] SAINTE-LAUDY J. — Nine cases of suspected IgE-mediated anaphylaxis induced by aspirin.
ACI
Internationa l, 2002, 14 , 220-222.
[7] BLANCA M., PEREZ E., GARCIA J.J. et al . — Angioedema and IgE antibodies to aspirin : a case report.
Ann. Allerg. , 1989, 62 , 295-298.
[8] SZCZEKLIK A., GRYGLEWSKI R.J., CZERMAVSKA-MYSIK G. — Relationship of inhibition of prostaglandin biosynthesis by analgesics to asthma attacks in aspirin-sensitive patients. Br. Med J ., 1975, 1 , 67-69.
[9] SZCZEKLIK A. — The cyclooxygenase theory of aspirin-induced asthma.
Eur. Respir. J., 1990, 3, 588-593.
[10] FISCHER A.R., ROSENBERG M.A., LILLY C.M., CALLERY J.C., RUBIN P., COHN J., WHITE M.V., IGARASHI Y., KALINER M.A., DRAZEN J.M., ISRAEL E. — Direct evidence for a role of the mast cell in the nasal response to aspirin in aspirin-sensitive asthma. J. Allergy. Clin. Immunol. , 1994, 94 , 1046-1056.
[11] O’SULLIVAN S., DAHLEN B., DAHLEN S.-E., KUMLIN M. — Increased urinary excretion of the prostaglandin D2 metabolite 9α, 11β-prostaglandin F2 after aspirin challenge supports mast cell activation in aspirin-induced airway obstruction. J. Allergy. Clin. Immunol. , 1996, 98 , 421-432.
[12] BOCHENEK G., NAGRABA K., NIZANDOWSKA E., SZCZEKLIK A. — A controlled study of 9α, 11β-PGF2 (a prostaglandin D2 metabolite) in plasma and urine of patients with bronchial asthma and healthy controls following the aspirin challenge. J. Allergy. Clin. Immunol ., 2003, 111 , 743-749.
[13] LEE T.H., SMITH C.M., ARM J.P., CHRISTIE P.E. — Mediator release in aspirin-induced reactions. J. Allergy. Clin. Immunol. , 1991 , 88 , 827-829.
[14] COWBURN A.S., SLADEK K., SOJA J., AADAMEK L., NIZANKOWSKA E., SZCZEKLIK A., LAM B.K., PENTROSE J.F., AUSTEN K.F., HOLGATE S.T., SAMPSON A.P. — Overexpression of leukotriene C4 synthase in bronchial biopsies from patients with aspirin-intolerant asthma . J. Clin. Invest. , 1998, 101 , 834-846.
[15] SANAK M., SIMON H-U., SZCZEKLIK A. — Leukotriene C4 synthase promoter polymorphism and risk of aspirin-induced asthma. Lancet, 1997, 350 , 1599-2000.
[16] SANAK M., SZCZEKLIK A. — Genetics of aspirin induced asthma.
Thorax , 2000, 55 (Suppl 2),
S45-S47.
[17] TORRES-GALVAN M.J., ORTEGA N., SANCHEZ-GARCIA F., BLANCO C., CARILLO T., QUIRALTE J.
— LTC4-synthase A-444C polymorphism : lack of association with NSAID-induced isolated periorbital angioedema in a Spanish population Ann. Allergy. Asthma. Immunol. , 2001, 87 , 506-510.
[18] VAN SAMBECK R., STEVENSON D.D., BALDASARO M., LAM B.K., ZHAO J.L., YOSHIDA S., YANDORA C., DOS J.M., PENROSE J.F. — 5′Flanking region polymorphism of the gene encoding leukotriene C4 synthase does not correlate with the aspirin-intolerant asthma phenotype in the United States. J. Allergy. Clin. Immunol. , 2000, 106 , 72-76.
[19] KAWAGASHI Y., MITA H., TANIGUCHI M., MARUYAMA M., OSAKI R., HIGASHI N., KASHII T., KOBAYASHI M., AKYAMA K. — Leukotriene C4 synthase promoter polymorphism in Japanese patients with aspirin-induced asthma. J. Allergy Clin. Immunol. , 2002, 109 , 936-942.
[20] DEMOLY P. — Mise au point sur l’intolérance à l’aspirine et aux AINS.
Allergologie Pratique , 2003 , 4 , No 66.
[21] CZECH W., KAPP A., KOWNATZKI E., SCHOPF E. — Die Bedeutung der in vitro -induzierten
Histaminfreisetzung aus isolierten Leukozyten für die Diagnostik pseudo-allergischer Reaktionen auf Azetylsalizylsäure. Allergologie , 1990, 13 , 201-204.
[22] LEBEL B., MESSAAD B., KVEDARIENE V., RONGIER M., BOUSQUET J., DEMOLY P. — Cysteinylleukotriene release test (CAST) in the diagnosis of immediate drug reactions. Allergy , 2001, 56 , 688-692.
[23] DE WECK A.L., STADLER B.H., URWYLER A., WECHSNER H.U., BUHLMANN R.P. — Cellular antigen stimulation test (CAST) : a new dimension in allergy diagnosis. Allergy. Clin. Immunol., News, 1993, 5, 9-14.
[24] DE WECK A.L. — Zellulärer Allergen De Stimulierungs-Test (CAST). Eine Uebersicht und kritische Auswertung der klinischen Anwendung in der Allergiediagnose. Allergologie , 1997, 20 , 487-502.
[25] FERRER M., SANZ M.L., PRIETO I., OEHLING A. — In vitro antigen-specific sulphidoleukotriene production in patients allergic to Dermatophagoides pteronyssinus. Clin. Exp. Allergy , 1998, 28 , 709-714.
[26] MALY F.E., MARTI-WYSS S., BLUMER S., CUHAT-STARK I., WUHTRICH B. — Mononuclear blood cell sulfidoleukotriene generation in the presence of interleukin-3 and whole blood histamine release in koney bee and yellow jacket venom allergy. J. Invest. Allergol.Clin. Immunol ., 1997, 7, 217-224.
[27] SANZ M.L., GAMBOA P.M., GARCIA-AVILES C., VILA L., DIEGUEZ I., AANTEPARA I., DE WECK A.L. — Flow-cytometric cellular alllergen stimulation test in latex allergy. Int. Arch. Allergy Immunol. , 2003, 130, 33-39.
[28] MONERET-VAUTRIN D., SAINTE-LAUDY J., KANNY G., FREMONT S. — Human basophil activation measured by CD63 expression and LTC4 release in IgE-mediated food allergy. Ann. Allergy Asthma Immunol., 1999, 82 , 33-4.
[29] VILA L. SANZ M.L., SANCHEZ G., UASUF G., FERRER M., BARRIO M., DIEGUEZ I. — Study of the in vitro sulphidoleukotriene production in food allergic patients. J. Investig. Allergol. Clin.
Immunol ., 2001, 11, 247-254.
[30] SANZ M.L., GAMBOA P.M., DE WECK A.L. — Clinical evaluation of in vitro diagnostic tests in diagnosis of immediate allergic reactions to β-lactam antibiotics.
ACI International , 2002, 14 , 185-193.
[31] GAMBOA P.M., SANZ M.L., CABALLERO M.R., ANTEPARA I., URRUTIA I., JAUREGUI I., GONZALES G., DIEGUEZ I., DE WECK A.L. — Use of CD63 expression as a marker of in vitro basophil activation and leukotriene determination in metamizol allergic patients.
Allergy , 2003, 58 , 312-317.
[32] SANZ M.L., GAMBOA P., DE WECK A.L. — A new combined test with flowcytometric basophil activation (FAST) and determination of sulfidoleukotrienes (CAST) is useful for in vitro diagnosis of hypersensitivity to aspirin and other non steroidal anti-inflammatory drugs (NSAIDs ). Int. Arch. Allergy Immunol., 2004 (in press).
[33] GAMBOA P., SANZ M.L., CABALLERO M.R., URRUTIA I., ANTEPARRA I., DE WECK A.L. — The flowcytometric determination of basophil activation induced by aspirin and other non steroidal antgi-inflammatory drugs (NSAIDs) is useful for in vitro diagnosis of the NSAID hypersensitivity syndrome.
Clin. Exp. Allergy., 2004 (in press).
[34] BENVENISTE J. — The human basophil degranulation test as an in vitro method for diagnosis of allergies.
Clin. Allergy , 1981, 11 , 1-11.
[35] KNOL E.F., MUL F.P.J., JANSEN H., CALAFAT J., ROOS D. — Monitoring human basophil activation via CD63 monoclonal antibody 435 . J. Allergy clin. Immunol ., 1991, 88 , 328-338.
[36] SABBAH A. — Étude préliminaire du test d’activation des basophiles à l’aide d’anticorps membranaires par cytométrie de flux dans l’allergie médicamenteuse. Allergie Immunologie , 1995, 27, 274-276.
[37] SAINTE-LAUDY J., VALLOON C., GUERIN J.C. — Analyse de l’expression membranaire du marqueur CD63 par activation du basophile humain. Application au diagnostic allergologique.
Allergie et Immunologie , 1994, 26 , 211-214.
[38] GANE P., PECQUET C., CRESPEAU H., LAMBIN P., ABUAF N., LEYNADIER F., ROUGER P. — Flow cytometric monitoring of allergen induced basophil activation. Cytometry , 1995, 19 , 361-365.
[39] SANZ M.L., SANCHEZ G., GAMBOA P.M., VILA L., UASUF C., CHAZOT M., DIEGUEZ I., DE WECK A.L. — Ag-induced basophil activation : CD 63 cell expression detected by flow cytometry in allergic patients to Dermatophagoides pteronyssinus and Lolium perenne . Clin. Exp. Allergy., 2001, 31 , 1007-1013.
[40] SAINTE-LAUDY J., SABBAH A., DROUET M., LAURET M.G., LOIRY M. — Diagnosis of venom allergy by flow cytometry. Correlation with cinical history, skin tests, specific IgE, histamine and leukotriene C4 release. Clin. exp. Allergy , 2000, 30 , 1166-1171.
[41] EBO D.G., LECHKAR B., SCHUERWEGH A.J., BRIDTS C.H., DE CLERK L.S., STEVENS W.J. — Validation of a two-color flow cytometric assay detecting in vitro basophil activation for the diagnosis of IgE-mediated natural rubber latex allergy.
Allergy , 2002, 57, 706-712.
[42] SANZ M.L., GAMBOA P.M., UASUF C., VILA L., GARCIA-AVILES C., CHAZOT M., DE WECK A.L., — Flow-cytometric basophil activation test by detection of CD63 expression in patients with immedate type reactions to Beta-lactam antibiotics. Clin. Exp. Allergy ., 2002, 32 , 277-286.
[43] ABUAF N., RAJOELY B., GHAZOUANI E., LEVY D.A., PECQUET C., CHABANE H., LEYNADIER F. — Validation of flow cytometry assay detecting in vitro basophil activation for the diagnosis of muscle relaxant allergy.
J. Allergy clin. Immunol . 1999, 104, 411-418.
[44] MONNERET G., BENOIT Y., DEBARD A.L., GUTOWSKI M.C., TOPENOT I., BIENVENU J. — Monitoring of basophil activation using CD63 and CCR3 in allergy to muscle relaxant drugs.
Clin. Immunol ., 2002, 102 , 192-199.
[45] SABBAH A., SAINTE-LAUDY J., DROUET M., LAURET M.G., LOIRY M. — Réactions anaphylactiques ou anaphylactoïdes au paracétamol. À propos de 3 cas. Allergie et Immunologie , 1997, 29, 60-62.
[46] SAINTE-LAUDY J. — Intérêt de l’étude in vivo et in vitro des leucotriènes. Application au cas particulier de l’aspirine.
Rev. Fr. Allergol ., 1977, 30 , 28-35.
[47] KOWALSKI M.L., PTASINSKA A., BIENKIEWICZ B., PAWLICZAK R., DU BUSKE L. — Differential effects of aspirin and misoprostol on 15-hydroxyeicosa-tetraenoic acid generation by leukocytes from aspirin-sensitive asthmatic patients. J. Allergy. Clin. Immunol. , 2003, 112 , 505-512.
[48] KURIMOTO Y., DE WECK A.L., DAHINDEN C.A. — The effect of interleukin 3 upon IgEdependent and IgE-independent basophil degranulation and leukotriene generation. Eur. J.
Immunol. , 1991, 21 , 361-368.
[49] BISCHOFF S.C., BRUNNER T., DE WECK A.L., DAHINDEN C.A. — Interleukin 5 modifies histamine release and leukotriene generation by human basophils in response to diverse agonists. J. Exp. Med. , 1990, 172 , 1577-1583.
[50] MAY A., WEBER A., GALL H., KAUFMANN R., ZOLLNER T.M. — Means of increasing sensitivity of an in vitro diagnsotic test for aspirin intolerance. Clin. Exp. Allergy. , 1999, 29 , 1402- 1411.
[51] PLESKOW W.W., STEVENSON D.D., MATHISON D.A., SIMON R.A., SCHATZ M., ZEIGER R.S. — Aspirin-sensitive rhinosinusitis / asthma : spectrum of adverse reactions to aspirin. J. Allergy.
Clin. Immunol. , 1983, 71 , 574-579.
[52] SZCZEKLIK A. — Aspirin-induced asthma as a viral disease.
Clin. Allergy. , 1988 , 18, 15-20.
[53] NAKAGAWA H., YOSHIDA S., NAKABAYASHI M., AAKAHORI K., SHOJI T., HASEGAWA H., AMAYASU H. — Possible relevance of virus infection for development of analgesic idiosyncrasy.
Respiration , 2001, 68 , 422-424.
[54] ABRAHAMSEN O., HAAS H., SCHREIBER J., SCHLAAK M. — Differential mediator release from basophils of allergic and non-allergic asthmatic patients after stimulation with anti-IgE and C5a. Clin. Exp. Allergy., 2001, 31 , 368-378.
[55] KIKUCHI Y., KAPLAN A.P. — A role for C5a in augmenting IgG-dependent histamine release from basophils in chronic urticaria. J. Allergy.Clin. Immunol. , 2002, 109 , 114- .
[56] JAMES J.M., KAGEY-SOBOTKA A., SAMPSON H.A. — Patients with severe atopic dermatitis have activated circulating basophils . J. Allergy. Clin. Immunol. , 1993, 81, 1155-1162.
[57] OKASAKA T., ILEA V.S., ROSARIO N.A., RRISMAN R E., ARBESMAN C.E., LEE J.R., MIDDLETON E.
— Regulatory role of prostaglandin E in allergic histamine release with observations on the responsiveness of basophil leukocytes and the effect of acetylsalicylic acid. J. Allergy. Clin.
Immunol. , 1977, 60 , 360-366.
[58] CELIK G., BAVBECK S., MISIRLIGIL Z., MELLI M. — Release of cysteinyl leukotrienes with aspirin stimulation and the effect of prostaglandin E2 on this release from peripheral blood leukocytes in aspirin-induced asthmatic patients. Clin. Exp. Allergy. , 2001, 31 , 1615-1622.
[59] SCHAFER D., SCHMID M., GODE U.C., BAENKLER B.W. — Dynamics of eicosanoids in peripheral blood cells during bronchial provocation in aspirin-intolerant asthmatics. Eur. Respir. J. , 1999, 13, 638-646.
[60] SANAK M., LEVY B.D., CLISH C.B., CHIANG N., GRONERT K., MSTALERZ L., SERHAN C.N., SZCZEKLIK A. — Aspirin-tolerant asthmatics generate more lipoxins than aspirin-intolerant asthmatics. Eur. Respir. J., 2000, 16 , 44-49.
[61] SOUSA A.R., PARKIH A., SCADDING G., CORRIGAN C.J., LEE T.H. — Leukotriene receptor expression on nasal mucosal inflammatory cells in apsirin-sensitive rhinosinusitis. N. Engl. J.
Med. , 2002, 347 , 1493-1499.
[62] HANSCH G.M., ROMER W., VOIGTLANDER V, ROTHER U. — Effect of salicylates onj the complement system : generation of mediators in vivo and in vitro . Clin. Immunol. Immunopathol. , 1981, 21 , 228-236.
[63] VOIGTLANDER V., HANSCH G.M., ROTHER U. — Effect of aspirin on complement in vivo. Int.
Archs. Allegy. Appl. Immunol. , 1980, 61 , 145-149.
[64] PLESKOW W.W., CHENOWETH D.E., SIMON R.A., STEVENSON D.D., CURD J.G. — The absence of detectable complement activation in aspirin-sensitive asthmatic patients during aspirin challenge. J. Allergy. Clin. Immunol. , 1983, 72 , 462-468.
[65] CZECH W., SHOPF E., KAPP A. — Release of sulfidoleukotrienes in vitro : ITS relevance in the diagnosis of pseudoallergy to acetylsalicylic acid.
Inflamm. Res ., 1995, 44 , 291-295.
[66] BRUNNER B., EBERLEIN-KOENIG B., PRYZBILLA B. — Histamine and sulfidoleukotriene release from peripheral blood leukocytes (PBL) of patients with anaphylactoid reactions provoked by acetylsalicylic acid (ASA) J.Allergy. Clin. Immunol ., 1996, 97 , 344.
[67] WEDI B., KAOO A. — Aspirin induced adverse skin reactions : new pathophysiological aspects.
Thorax, 2000, 55 (Suppl 2), S70-S71.
[68] MEWES T., RIECHELMANN H., KLIMEK L. — Increased in vitro cysteinyl leukotriene release from blood leukocytes in patients with asthma, nasal polyps and aspirin intolerance.
Allergy, 1996, 51 , 506-510.
[69] WOLANCZYK-MEDRALA A., MATOLEPZY J., MEDRALA W., LIEBHART J., LINVA M., PIETRZAK M.
— CAST-ELISA test in diagnosis of aspirin-idiosyncrasy in aspirin-induced asthma. Allergy , 1995, 50 (Suppl . 26), 246.
[70] KUBOTA Y., IMAYAMA S., TOSHITANI A., MIYAHARA H., TANAHASHI T., UEMURA Y., KOGA T., SUGAWARA S., KURIMOTO F., HATA K. — Sulfidoleukotriene release test (CAST) in hypersensitivity to nonsteroidal anti-inflammatory drugs. Int. Arch. Allergy Immunol ., 1997, 114 , 361- 366.
[71] BUSSE A., CZECH W., SCHOPF E., SIMON J.C. — Der CAST-ELISA in der Diagnostik von pseudoallergischen Reaktionen gegen Nahrungsmitteladditiva und Azetylsalizylsäure. Allergologie , 2000, 23 , 110-115.
[72] PIERZCHALSKA M., MASTALERZ L., SANAK M., ZALULA M., SZCZEKLIK A. — A moderate and unspecific release of cysteinyl leukotrienes by aspirin from peripheral blood leukocytes precludes its value for aspirin sensitivity testing in asthma. Clin. Exp. Allergy. , 2000, 30 , 1785- 1791.
DISCUSSION
M. Roger NORDMANN
A-t-on observé des anomalies de l’agrégation plaquettaire chez les patients présentant cette hypersensibilité ? A-t-on recherché des anomalies métaboliques inverses (de celles que vous avez observées chez ces patients) dans le cas de sujets présentant une résistance à l’aspirine (sujets chez lesquels l’aspirine n’exerce pas son effet inhibiteur sur l’agrégation plaquettaire et semble donc dépourvue d’effet protecteur vis-à-vis des accidents cardiovasculaires) ?
Diverses anomalies plaquettaires ont effectivement été décrites, en particulier du métabolisme de l’oxygène, chez les patients atteints d’hypersensibilité à l’aspirine mais certains de ces effets, en particulier sur la chemoluminescence plaquettaire sont encore controversés. Je ne suis pas au courant d’études similaires chez les patients résistant à l’aspirine.
M. Jacques ROCHEMAURE
Les antileucotriènes actuellement disponibles ne me semblent pas avoir fait la preuve d’une grande efficacité. Je souhaite connaître l’opinion de l’auteur.
Il existe plusieurs rapports confirmant l’effet inhibiteur des anti-leucotriènes sur les symptômes survenant à la suite d’une exposition à l’aspirine chez les sujets hypersensibles. C’est du reste un des arguments pour affirmer le rôle prépondérant des leucotriènes dans l’hypersensibilité aux NSAIDs. Mais ils ne sont pas les seuls médiateurs en cause (histamine, etc.) libérés par mastocytes et éosinophiles, d’où un effet seulement partiel.
M. Charles-Joël MENKÈS
Un nouvel anti-inflammatoire, en cours de développement, le licopehone inhibe à la fois PGE2 et leucotriène. Peut-on envisager un tel produit, sans crainte, chez un malade qui a un syndrome de Widal ?
Il est difficile de faire des prédictions car il s’agit d’un équilibre délicat. L’inhibition des PGE2 favorise la stimulation cellulaire et l’apparition de symptômes ; l’inhibition des leucotriènes devrait les prévenir.
M. Claude MOLINA
Peut-on tirer de ces résultats une information sur le pronostic et la sévérité de l’asthme, composante fondamentale du syndrome de Widal ? Le test peut-il prévoir l’efficacité ultérieure de la corticothérapie, dont l’efficacité est, on le sait, très controversée.
Nous n’avons pas encore suffisamment de résultats répétés dans le temps ou coordonnés avec des examens fonctionnels ou la thérapie pour pouvoir répondre à cette question. Je doute toutefois que cela ne soit jamais le cas car les basophiles sanguins investigués ne sont pas les cellules principalement impliquées dans l’asthme et ne sont donc qu’un épiphénomène M. François-Bernard MICHEL
Ce test de diagnostic in vitro est-il utilisable en pratique quotidienne, ou bien réservé aux centres spécialisés ? Merci de justifier. L’hypersensibilité à l’aspirine et aux antiinflammatoires non stéroïdiens se manifeste à la fois par l’appareil respiratoire et la peau.
Votre test est-il plus ou moins performant dans l’une ou l’autre forme ? Vous avez évalué la capacité diagnostique de votre test. Est-il également performant dans la recherche d’une alternative, c’est-à-dire l’usage d’anti-inflammatoire bien toléré chez de tels intolé- rants ?
Le test en lui-même peut être effectué par n’importe quel laboratoire habitué aux manipulations cellulaires et disposant d’un cytomètre de flux. Son indication et son interprétation, par contre, devraient être réservées aux spécialistes. En ce qui concerne
son efficacité pour les manifestations cutanées ou respiratoires de l’hypersensibilité aux NSAIDs, il n’y a pas de différence entre les deux, ce qui est logique puisque des études récentes montrent également qu’il n’y a pas de différence de mécanismes pathophysiologiques. Quant à une valeur prédictive éventuelle pour la recherche d’un NSAID toléré, nous n’avons pas encore assez de données pour pouvoir répondre à cette question.
* Membre associé étranger de l’Académie nationale de médecine. Fondation Gérimmun, Beaumont 18, CH-1700, Fribourg (Suisse) e-mail : alain.dew@bluewin.ch ** Département of Allergology and Clinical Immunology, University of Navarra, Pamplona (Espagne). *** Division of Allergology, Hopital Basurto, Bilbao (Espagne). Tirés-à-part : Professeur A. de WECK à l’adresse ci-dessus. Article reçu le 8 mars 2004, accepté le 11 octobre 2004.
Bull. Acad. Natle Méd., 2005, 189, no 6, 1201-1220, séance du 14 juin 2005


