Résumé
Des cellules neurales particulières ont été caractérisées récemment dans le système nerveux central des rongeurs et de l’homme. Baptisées « cellules souches », elles présentent des propriétés de multipotence, c’est-à-dire qu’elles peuvent, dans certaines conditions de différenciation, générer les trois types cellulaires majeurs du système nerveux : les neurones, les oligodendrocytes et les astrocytes. Cette découverte pose la question de leur rôle dans le fonctionnement du cerveau. Elle ouvre également de nouvelles perspectives thérapeutiques, en offrant des solutions originales pour la réparation des régions lésées. Nous étudions les conséquences fonctionnelles de l’intégration des néo-neurones dans les circuits du cerveau adulte. En particulier, nous cherchons à comprendre le rôle de cette jouvence pour nos capacités cognitives, et plus généralement, à définir le potentiel d’adaptation des structures nerveuses qui reçoivent les nouveaux neurones. Nos travaux les plus récents montrent que cette neurogenèse contribue à l’ajustement progressif, et à long terme, du cerveau mature. Néanmoins de nombreuses questions restent posées. Dans quelle mesure pouvons-nous distinguer, comparer ou regrouper la production neuronale chez l’embryon et celle de l’adulte ? Comment une cellule nerveuse nouvellement générée chez l’adulte migre-t-elle pour trouver sa cible ? Comment choisit-elle son devenir cellulaire ? En cherchant les corrélats entre, d’une part, les capacités régénératrices du cerveau adulte et, d’autre part, certaines fonctions cognitives, nos travaux offrent de nouvelles stratégies thérapeutiques visant à mettre à profit cette neurogenèse. Il s’agit ici de la thérapie cellulaire qui repose sur l’emploi de cellules souches nerveuses endogènes. C’est un nouvel espoir pour les traitements des pathologies concernant les maladies neurodégénératives ou résultants d’accidents vasculaires ou traumatiques.
Summary
Neural stem cells have recently been found in the central nervous system of adult rodents and humans. In defined conditions, these multipotent cells can generate the three major cell types of the nervous system (neurons, oligodendrocytes and astrocytes). These findings raise questions on the functional role of neural stem cells in the adult brain, and point to the possibility of novel therapeutic approaches. We have been investigating the functional consequences of neural stem cells for the adult circuits of the olfactory system. We are currently investigating this unexpected juvenile characteristic for cognitive functions. For instance, we are exploring the potential of brain adaptation brought into play by adult neurogenesis. Our most recent studies show that neurogenesis contributes to long-term adjustment of the mature brain. Many questions remain to be answered, however. To what extent can we distinguish and compare neuronal production during embryogenesis and adulthood ? How does a newborn cell migrate and find its target ? How is cellular fate decided ? By showing correlations between the regenerative capacities and cognitive functions of the adult brain, our results have interesting implications for the use of endogenous neuronal stem cells for brain repair in patients with neurodegenerative diseases or brain injury due to stroke or trauma.
ASPECTS HISTORIQUES
En considérant la capacité du cerveau adulte à générer de nouveaux neurones, la communauté des neurobiologistes a vu naître ces dernières années une nouvelle façon d’appréhender les processus de plasticité cérébrale. Les régions concernées demeurent cependant peu nombreuses. L’hippocampe et le bulbe olfactif sont les deux principales régions capables d’intégrer, de façon constitutive, une fraction non négligeable de nouveaux neurones. Historiquement, cette prise de position émergea avec difficulté, et la reconnaissance tardive dont elle bénéficia lui assura un caractère quelque peu révolutionnaire dans les domaines spécialisés.
C’est en raison de trois objections récurrentes majeures que l’émergence du concept de neurogenèse adulte fut plusieurs fois différée. Ces raisons furent d’ordre épisté- mologique, conceptuel et technique . Les éléments épistémologiques tiennent beaucoup à l’influence considérable des idées de Santiago Ramon y Cajal dans les domaines de la morphologie et de la plasticité du système nerveux. En effet, les observations du Prix Nobel espagnol lui permirent d’émettre nombre de postulats fondamentaux parmi lesquels le cerveau adulte est un organe immuable . L’immense influence de Ramon y Cajal dans le développement des Neurosciences au tournant du XXe siècle érigea cette hypothèse en dogme central. Pourtant, dès les années 1960, les premiers arguments d’une activité mitotique au sein du cerveau adulte furent apportés [1-3]. Sur le plan conceptuel, les réticences à considérer notre cerveau comme organe capable de se régénérer furent aussi très fortes. Les dilemmes ne manquaient pas. Par exemple, comment conserver si précisément des traces mnésiques si le support neurobiologique qui contribue au stockage de l’information est appelé à être renouvelé ? Enfin, en raison de limites techniques, l’absence de critères
morphologiques tangibles attestant de la nature neuronale ou gliale des cellules marquées par la thymidine tritiée empêcha longtemps toute démonstration définitive d’une véritable production neuronale [4]. Michael Kaplan s’illustra à son tour dans une série d’études confirmant les premiers travaux d’Altman sur la neurogenèse dans le cerveau adulte de rat. Ses efforts ne suffirent cependant pas à ébranler le scepticisme de l’époque. Kaplan eut dès lors la ferme conviction que seule la démonstration de l’existence de neurones nouvellement générés dans un cerveau de primates était susceptible de changer les esprits. Bien qu’une fois encore, il apportât des observations majeures en faveur d’une production neurale chez l’adulte, rien ne changea [5]. Les objections offertes à Kaplan tiennent beaucoup à l’entrée en scène dans ce domaine d’un acteur déjà très présent à l’époque, Pasko Rakic du Centre Médical de Yale. Au cours d’une conférence en 1984, Rakic exposa les arguments le conduisant à minimiser l’existence et la portée d’une neurogenèse adulte dans le cerveau des mammifères [6]. Pour ce chercheur, les taux rapportés de neurones néo-formés dans le cerveau adulte de rat s’avéraient trop faible pour garantir une quelconque signification fonctionnelle. Aussi, il avança l’idée selon laquelle la neurogenèse adulte n’était qu’une propriété ancestrale héritée des processus de régénérescence largement répandus chez les vertébrés inférieurs. Rakic déplora également la faiblesse des critères ultrastructuraux utilisés par Kaplan pour désigner les cellules mitotiques comme étant des neurones. L’année suivante, Rakic et ses collègues rapportèrent, après l’examen minutieux de cerveaux de macaque, qu’aucune cellule ayant incorporé de la thymidine tritiée, ne présentait de critères morphologiques permettant une identification neuronale univoque [7]. La publication de cette étude eut un impact non négligeable. Elle renforça les convictions des sceptiques, et mit un coup d’arrêt aux travaux visant à rendre compte de l’existence d’une neurogenèse secondaire chez les mammifères.
Le renouveau prit naissance lorsque, pour la première fois, des cellules souches neurales furent identifiées au sein du cerveau adulte [8]. Finalement, l’introduction du bromodeoxyuridine, un analogue synthétique de la thymidine, utilisé comme marqueur mitotique, l’emploi de vecteurs viraux pour marquer puis suivre le devenir des progéniteurs neuraux et l’avènement de marqueurs spécifiquement gliaux ou neuronaux, donnèrent un nouveau souffle aux recherches dans ce domaine. En particulier, ces outils offrirent la possibilité d’une approche immunohistochimique couplée à une analyse stéréologique. Leurs généralisations consacrèrent la reconnaissance des premières observations rapportées par Altman et Kaplan. Ces techniques permettent aujourd’hui d’attribuer à toutes les espèces de mammifères étudiées, l’homme compris, l’existence de processus neurogéniques dans le cerveau adulte [9-14].
Les spécialistes s’accordent aujourd’hui pour considérer qu’il existe dans le cerveau adulte deux principales régions germinatives qui fournissent en permanence des nouveaux neurones. Il s’agit de la zone sous-ventriculaire (ZSV) située sur les parois des ventricules latéraux (Fig. 1) et de la zone sous-granulaire (ZSG) du gyrus denté de l’hippocampe (Fig. 2). Les avancées récentes dans l’étude de l’architecture,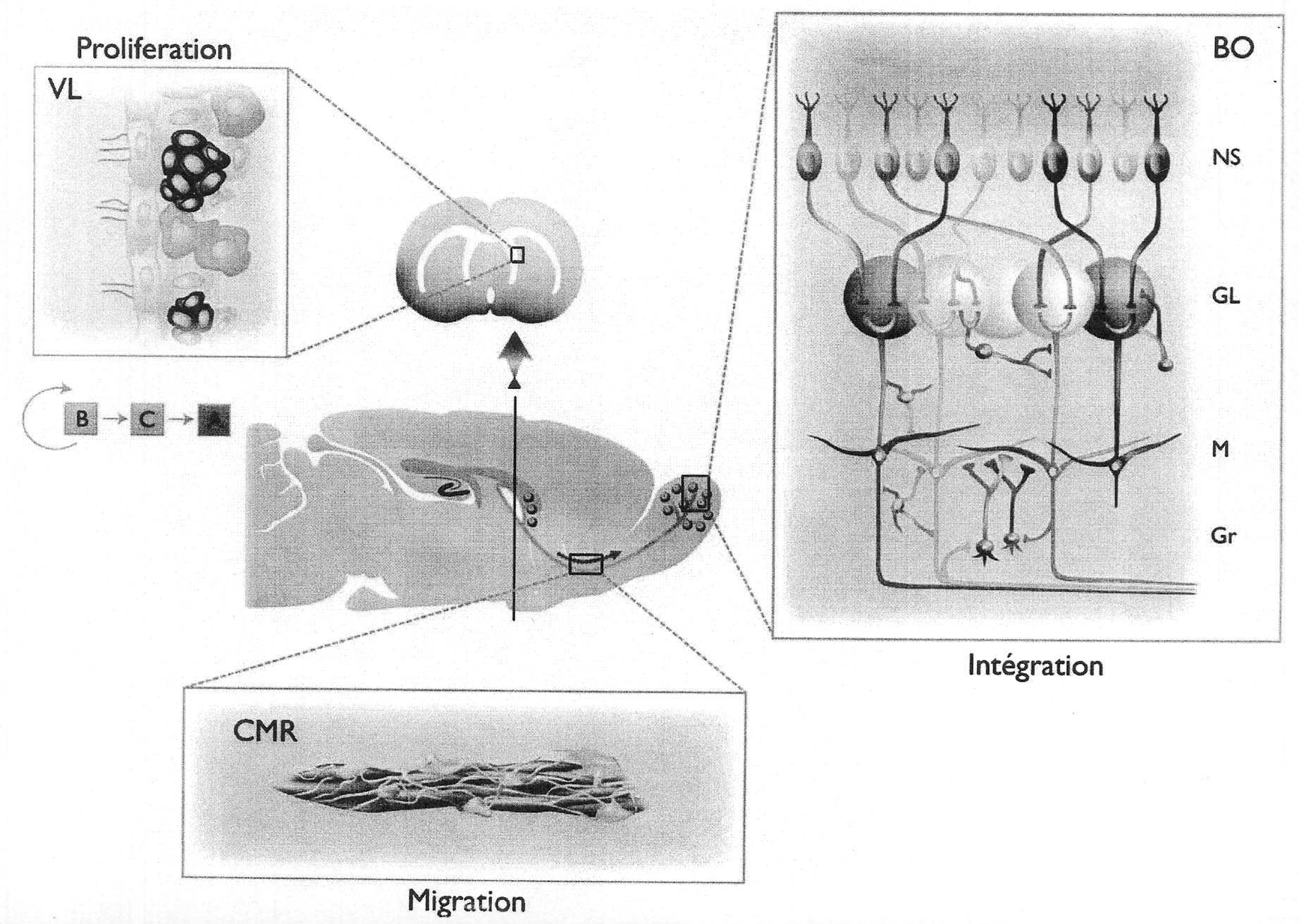
FIG. 1. — Coupe sagitale de cerveau de rongeur adulte illustrant les processus de prolifération, migration et intégration des neurones nouvellement produits. La zone sous-ventriculaire (ZSV) borde la paroi des ventricules latéraux 1. Prolifération . Par division asymétrique, les cellules souches astrocytaires B (violet) sont capables de s’auto-renouveler et donnent naissance à des progéniteurs neuronaux à division rapide, les cellules de type C (orange) qui à leur tour produisent des neuroblastes ou cellules de type A (vert). 2. Migration . Les neuroblastes forment des chaînes homotypiques et migrent tangentiellement en direction du bulbe olfactif (BO) au sein d’un tunnel formé par des cellules de type B. 3. Intégration . Dans la partie bulbaire du courant de migration rostral (CMR), les neuroblastes s’individualisent, achèvent leur différenciation et migrent radiairement pour atteindre leur position finale au sein de la couche des cellules granulaires (Gr) ou au sein de la couche glomérulaire (GL). NS : Neurones sensoriels olfactifs ; M : couche des cellules mitrales.
l’organisation et le fonctionnement de ces zones germinatives conduisent à penser que ces régions particulières tirent leurs propriétés uniques du micro-environnement cellulaire et moléculaire local dans lequel les cellules souches sont abritées [15-17].
Cet environnement local est appelé niche , terme emprunté à l’écologie, pour signifier l’importance des interactions entre les différents types cellulaires, les molécules membranaires, les substances solubles, et autres matériels extracellulaires présents à proximité des cellules souches. Au cours du développement, les cellules souches et la niche dans laquelle évoluent ces cellules ont une existence temporaire. En revanche, au sein du cerveau adulte, la ZSV et la ZSG sont deux niches capables de perdurer toute la vie d’un individu. Nous verrons que les propriétés respectives de ces niches sont fort distinctes.
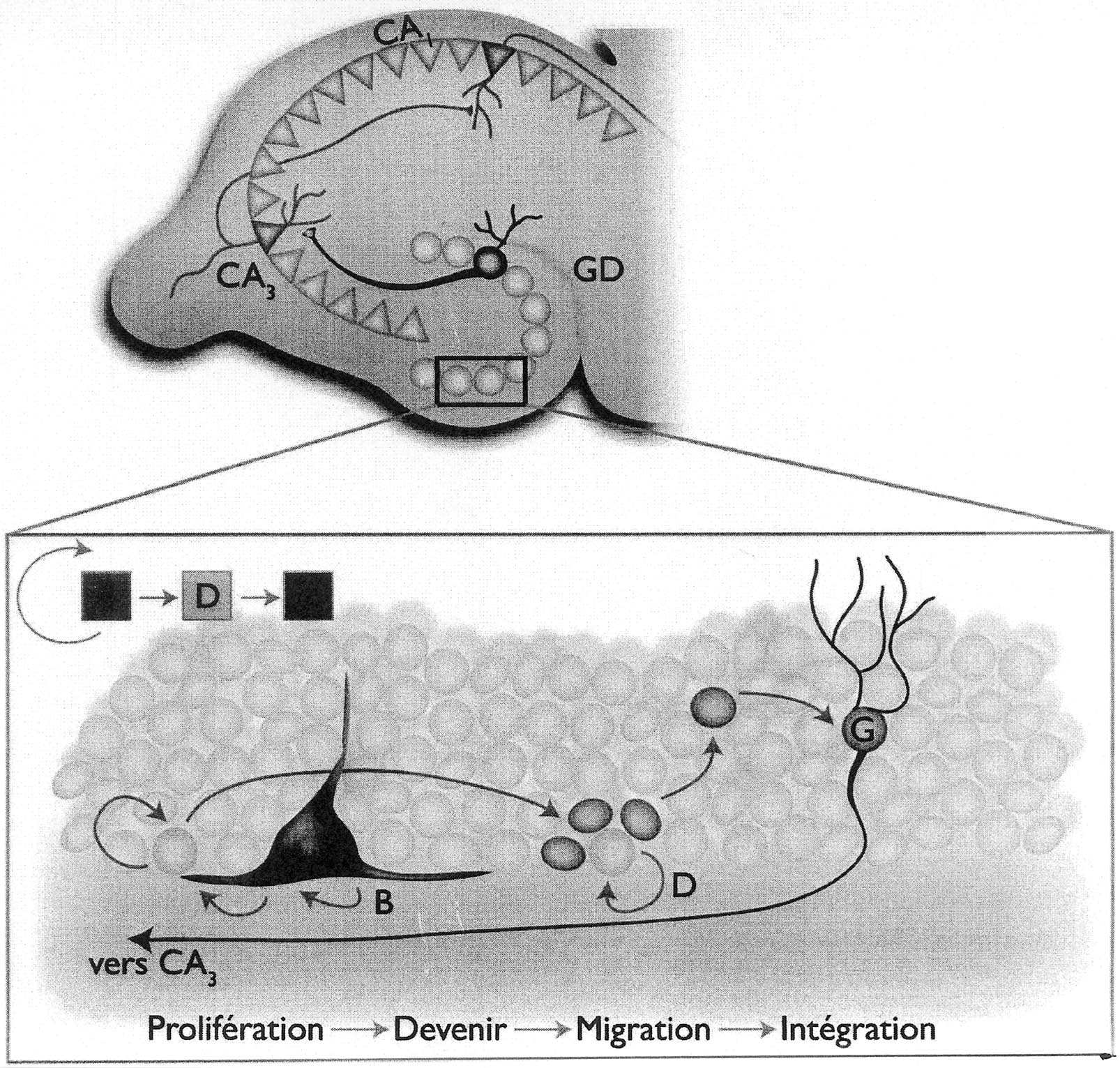
FIG. 2. — Organisation synaptique de l’hippocampe. Dans le gyrus denté, les cellules souches de type B (bleu) de la zone sous-granulaire donnent naissance aux précurseurs neuronaux, les cellules D (orange). Ces précurseurs sont à l’origine des neuroblastes qui se différencient en cellules granulaires, les cellules G (rouge). Les neurones immatures migrent sur quelques micromètres dans la couche granulaire. Après maturation, ils étendent leurs projections dans la région CA3 de l’hippocampe.
LES ZONES NEUROGÉNIQUES DU CERVEAU ADULTE
Durant la vie adulte, les cellules issues de la ZSV empruntent un courant de migration avant d’atteindre le bulbe olfactif où elles se différencient en interneurones (Fig. 1). Dans le cas de l’hippocampe, les neurones générés à partir de la ZSG effectuent une migration sur un plus court trajet avant d’intégrer le circuit neuronal du gyrus denté (Fig. 2). Une des observations les plus surprenantes de cette dernière décennie fut de découvrir la nature gliale et plus exactement astrocytaire des cellules souches neuronales [18-21]. Le caractère neurogénique de la ZSV et de la ZSG est principalement déterminé par un ensemble de signaux moléculaires strictement restreints à ces deux régions du cerveau antérieur. Les techniques de transplantation ont largement contribué à étayer cette idée. La transplantation de cellules de la ZSV
d’un animal donneur à la ZSV d’un receveur se traduit par l’acquisition et le développement de nouveaux neurones sans changement phénotypique chez l’hôte.
De la même manière, des cellules de la ZSG ré-introduites chez un hôte ne modifient pas leur devenir phénotypique. En revanche, les greffes hétérotypiques de progéniteurs transplantés dans des territoires non-neurogéniques montrent que les nouvelles cellules produites se transforment en cellules gliales et non neuronales. Enfin, la transplantation hétérotypique de cellules de la ZSG dans le courant de migration rostral conduit à la production de véritables nouveaux neurones bulbaires et non hippocampiques [22]. Ces données conduisent à attribuer deux propriétés fondamentales aux niches : elles constituent un environnement permissif au maintien de la zone neurogenique chez l’adulte (propriétés issues des divisions asymétriques), et instructif puisqu’elles possèdent le potentiel d’induire la différenciation de précurseurs en un sous-type de neurone bien défini.
LA ZONE SOUS-VENTRICULAIRE
Origine des neurones nouvellement générés
La zone située prés des ventricules latéraux constitue la source de production la plus importante du cerveau chez l’adulte avec plusieurs dizaines de milliers de cellules générées quotidiennement [23]. Quatre types cellulaires ont été décrits dans la ZSV (Fig. 1) : 1) les cellules ciliées épendymaires qui participent à la formation de la paroi des ventricules latéraux (cellules de type E) ; 2) des cellules souches (type B) caractérisées par un cycle lent de division ; 3) des cellules dotées d’un cycle plus rapide de division (type C) et enfin, 4) des neuroblastes qui s’engagent dans un processus de différenciation neuronale tout en migrant vers le bulbe olfactif (type A). Dans cette région, les cellules astrocytaires de type B établissent des contacts intimes avec l’ensemble des autres types cellulaires. Elles sont considérées in vivo comme les précurseurs primaires des neuroblastes et présentent in vitro les caracté- ristiques de cellules souches neuronales dotées d’une capacité d’autorenouvellement [18, 24]. Les cellules B donnent naissance aux cellules de type C qui à leur tour produisent des cellules de type A. Les cellules B s’assemblent aussi pour constituer une gaine indispensable à la migration des neuroblastes. Enfin, il faut noter que l’ensemble de la ZSV est intimement associé à la présence d’une lame basale périvasculaire riche en collagène, en laminine, en fibroblastes et autres macrophages [25]. Par son apport constant en cytokines et autres facteurs de croissance, la lame basale joue un rôle crucial dans le maintien des propriétés singulières des cellules souches.
Migration tangentielle et migration radiale des neuroblastes bulbaires
Grâce à l’expression de molécules PSA-NCAM, les neuroblastes forment, depuis la ZSV, des chaînes homotypiques isolées par une gaine astrocytaire (Fig. 1). Chez les rongeurs, ces neuroblastes migrent le long d’un courant en direction rostrale [23].
Chez l’homme, cette organisation architectonique n’est pas retrouvée [26]. La migration rostrale des neuroblastes repose en partie sur la production de facteurs diffusibles répulsifs au niveau du septum, de la zone ventriculaire et du courant de migration [27-29]. L’expression d’un facteur émanant du bulbe olfactif et exerçant une attraction sur les neuroblastes reste en discussion [30, 31]. Lorsque les neuroblastes ont atteint le bulbe olfactif, ils se détachent et amorcent une migration radiaire leur permettant d’atteindre les couches granulaires et périglomérulaires du bulbe olfactif (Fig. 1). Deux protéines de la matrice extracellulaire exprimées dans le bulbe adulte, la Reeline et la Tenascine, constituent deux acteurs privilégiés de la migration radiaire. Reeline et Tenascine concourent au détachement individuel des neuroblastes [32, 33]. La Tenascine offre de plus la particularité d’attirer et orienter la migration des nouveaux neurones lorsqu’ils se présentent à l’entrée bulbaire.
L’expression de Tenascine par des cellules greffées le long du courant de migration permet de détourner une partie des neuroblastes de leur trajet naturel [33]. Cette glycoprotéine est donc nécessaire et suffisante pour séparer les neuroblastes des chaînes et les attirer vers les territoires qui produisent la Tenascine. Enfin, la production de cette protéine est dépendante de l’activité métabolique et électrique qui règne au sein du bulbe comme en témoignent les expériences de privation sensorielle qui s’accompagnent d’une forte diminution de l’expression de Tenascine [33].
Maturation et intégration fonctionnelle des néo-neurones bulbaires
Un examen quantitatif du taux de survie des neuroblastes révèle que près de 50 % d’entre eux sont éliminés quelques semaines après leur arrivée [34, 35]. L’utilisation de vecteurs lentiviraux, permettant de marquer les progéniteurs, montre que la mort cellulaire affecte la plupart des neurones matures arrivés dans le bulbe olfactif. Le taux de survie des neurones nouvellement générés est d’autant plus faible que l’activité des afférences bulbaires est réduite, soulignant encore ici la dépendance des processus de survie cellulaire vis-à-vis de l’activité globale du réseau [35]. Lorsqu’ils survivent, les neuroblastes développent une arborisation dendritique et se différencient en interneurones GABAergiques (environ 93 %) ou dopaminergiques (prés de 5 %).
On distingue cinq stades reflétant le degré de maturation des neuroblastes [35, 36].
D’abord, les neuroblastes issus de la ZSV atteignent le bulbe olfactif entre deux à sept jours ( stade-1 ). Ils entament leur migration radiaire dans les deux jours qui suivent ( stade-2 ) puis investissent la couche granulaire du bulbe olfactif, neuf à onze jours après leur naissance ( stade-3 ). Près de deux semaines plus tard, les neurones développent une arborisation dendritique élaborée qui s’étend vers les neurones cibles ( stade-4 ). Enfin, la plupart des néo-neurones achèvent leur maturation au terme d’une trentaine de jours ( stade-5 ). Cette maturation s’accompagne de l’acquisition de propriétés physiologiques bien précises. Nous avons montré que les capacités cérébrales à produire de nouveaux neurones relèvent de mécanismes uniques adaptés au cerveau adulte. Ceux-ci diffèrent des processus qui permettent au cerveau de
se développer durant l’embryogenèse. Pour la première fois, nous avons montré comment une cellule gliale se transformait progressivement pour acquérir, après un mois, les propriétés électrophysiologiques d’un véritable neurone [36]. Cette étude révéle que les neurones nouvellement produits sont non seulement capables de s’intégrer dans un réseau pré-existant, mais aussi et surtout, qu’ils apportent de nouvelles fonctions au réseau neuronal qui les reçoit. Curieusement, les neurones nouvellement générés n’expriment aucun potentiel d’action avant d’avoir atteint leur stade final de maturation et établi des connexions avec leurs cibles [36]. Une fois matures et différenciés les nouveaux neurones témoignent d’une expression de gènes d’activité précoce démontrant par là même leur véritable intégration fonctionnelle au sein de l’organisation synaptique bulbaire [37, 38].
LA ZONE SOUS-GRANULAIRE DE L’HIPPOCAMPE
Origine des neurones nouvellement générés dans la ZSG
Ici encore les cellules souches neuronales correspondraient à une population particulière de cellules astrocytaires comparable à celle des cellules de type B identifiées dans la ZSV (Fig. 2). Ces cellules B sont à l’origine de cellules progénitrices désignées type D. Ces dernières donnent naissance à des neuroblastes qui se diffé- rencient ultérieurement en cellules granulaires [21]. Le taux de production quotidienne en cellules granulaires demeure inférieur à une dizaine de milliers chez le rat [39, 40] et environ deux cents chez le macaque [13].
Migration des neuroblastes hippocampiques
Contrairement aux neurones nouvellement générés dans la ZSV, les neuroblastes de l’hippocampe migrent sur une courte distance qui les conduit depuis la ZSG à la zone granulaire (quelque dizaine de micromètres, Cf. Fig. 2). Ils développent rapidement des extensions axonales le long des zones de projection des fibres moussues avant d’atteindre la couche des cellules pyramidales de la région CA3 [39, 40]. Ces mécanismes de guidage et de migration cellulaires restent encore mal connus. À ce jour, seuls quelques facteurs d’attraction exprimés dans la ZSG sont connus [40].
Maturation et intégration fonctionnelle des nouveaux neurones hippocampiques
Environ 60 % des cellules nouvellement produites dans le gyrus denté meurent dans la semaine suivante [41, 42]. L’étude des caractéristiques physiologiques des cellules juvéniles montre qu’elles sont plus susceptibles de développer la potentialisation à long terme que les cellules matures [43]. En premier lieu, les nouveaux neurones reçoivent des contacts synaptiques GABAergiques puis glutamatergiques. Cette intégration est bien fonctionnelle puisque l’entraînement des animaux dans une tâche dépendante de l’hippocampe s’accompagne de l’induction de gènes d’activité précoce [44].
RÉGULATION DE LA NEUROGENÈSE ADULTE : CAS DE LA NEUROGENÈSE BULBAIRE
Nombre de facteurs impliqués dans la régulation de la neurogenèse ont été identifiés, améliorant ainsi notre compréhension des mécanismes de prolifération cellulaire, de migration, de spécification phénotypique et de survie chez l’adulte. Des facteurs de croissance, comme l’EGF et le FGF, stimulent la prolifération des progéniteurs neuraux et ont des effets variables sur la spécification neurale [45].
Chez l’adulte, la spécification neuronale est très majoritaire par rapport à la spécification gliale. Cette situation distincte de celle de l’embryon, résulte en partie du blocage des récepteurs aux protéines morphogéniques osseuses (BMPs) par Noggin [46]. Nous venons de montrer que deux facteurs de transcription, Pax6 et Olig2, favorisent la spécification neuronale et gliale, respectivement [47]. L’effet proneuronal intrinsèque de Pax6 est primordial car le blocage de son activité endogène empêche la formation des neuroblastes et par conséquent l’arrivée des nouveaux neurones dans le tissu cible. La migration vers le bulbe est permise grâce aux facteurs Slit1 et Slit2 qui, libérés par le septum, repoussent les neuroblastes vers la partie antérieure du cerveau [48]. Notons aussi que le bulbe olfactif synthétise des facteurs attractifs qui facilitent la migration des neuroblastes [49, 50]. Enfin, nous avons montré que la survie des nouveaux neurones une fois intégrés au réseau bulbaire dépendait, en grande partie, du niveau de stimulation olfactive [51, 52]. Cette action de l’activité sur la survie se ferait en partie par l’intermédiaire du glutamate libéré par les neurones excitateurs recevant les nouvelles cellules [53].
VERS UNE UTILISATION DES CELLULES SOUCHES NEURALES EN CLINIQUE ?
Si le renouvellement neuronal à partir de progéniteurs de la ZSV adulte se restreint au bulbe olfactif dans des conditions physiologiques normales, il concerne aussi un certain nombre de régions cérébrales perdant des neurones de façon massive (Fig. 3). Ces régions normalement non-neurogéniques peuvent accueillir de nouveaux neurones durant l’instauration de maladies neurodégénératives, après un accident vasculaire ou lors d’un trauma. Différents modèles lésionnels offrent des conditions favorables pour étudier cette neurogenèse réactive . L’équipe de Macklis a mis au point une technique permettant d’induire une perte neuronale par photolyse des neurones corticaux. Selon cette méthode, ils ont mis en évidence la production de nouveaux neurones cortico-thalamiques [54] puis ultérieurement de motoneurones cortico-spinaux [55], qui survivent plusieurs mois et contactent les régions appropriées. La majorité de ces nouveaux neurones semblent être issue de la ZSV.
Toutefois, si ces résultats restent intéressants, le modèle lésionnel dans lequel ces observations ont été rapportées présente de sévère limitations. Rappelons que les lésions utilisées durant ces expériences n’atteignent que les neurones de projection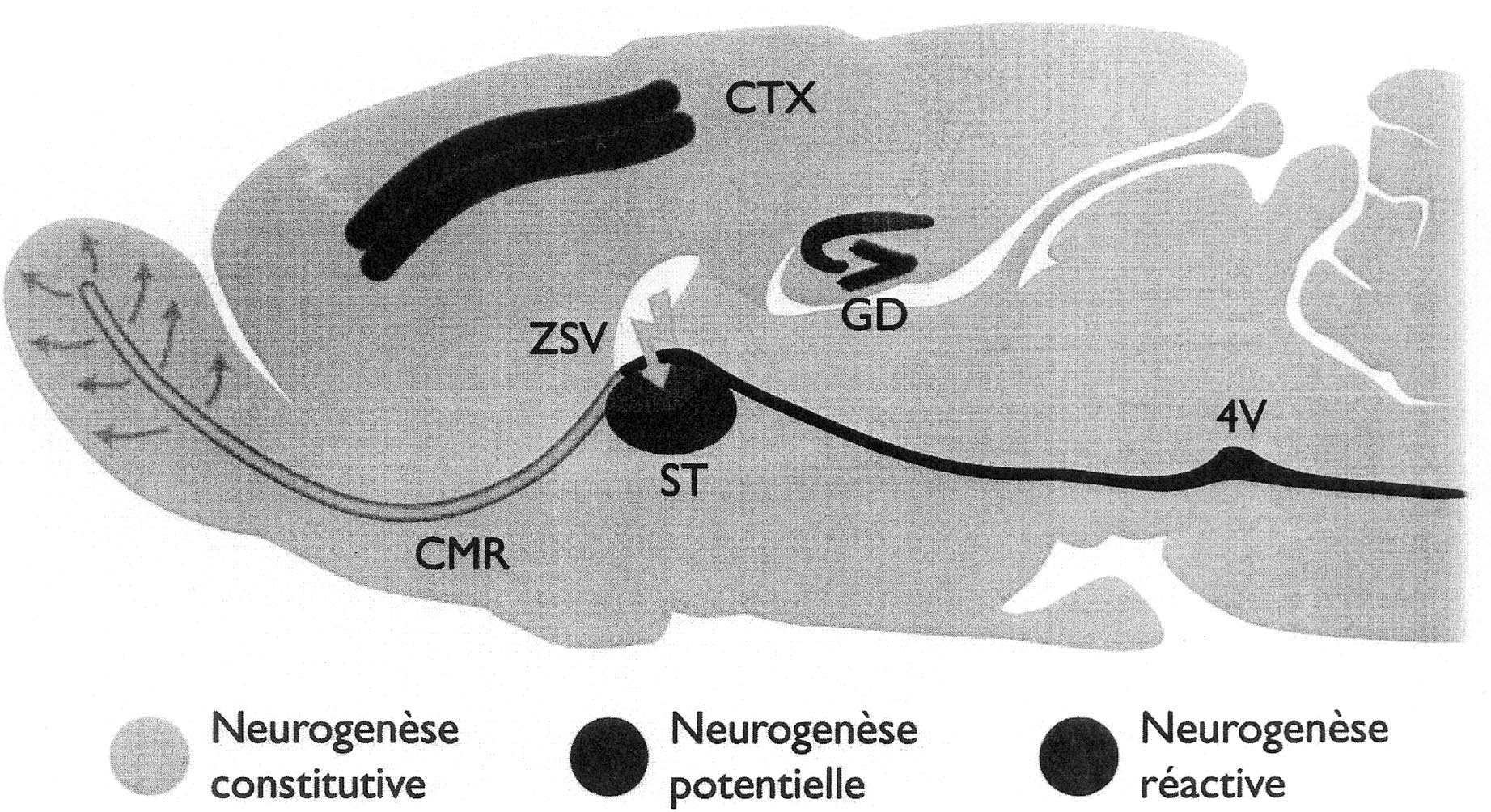
FIG. 3. — Schéma d’une coupe sagittale de cerveau de rongeur montrant chez l’adulte : les zones neurogéniques constitutives (neurogenèse permanente ; en vert), les zones capables de fournir de nouveaux neurones in vitro (neurogenèse potentielle ; en rouge), et les zones qui accueillent des nouveaux neurones en cas de lésions (neurogenèse réactive ; en bleu). BO : bulbe olfactif ;
CMR : courant de migration rostral ; CTX : cortex ; ST : Striatum ; 4V : 4e ventricule ; ZSV :
zone sous-ventriculaire.
sans affecter les cellules gliales et autres interneurones. Une autre étude récente montre que la production de neurones striataux épineux est possible après une ischémie transitoire chez le rongeur [56]. De nouveau, c’est la ZSV qui produit le type neuronal désiré. Il semble donc que le cerveau mature soit bien capable de remplacer certaines catégories de neurones, dans des conditions de lésions où la mort cellulaire est massive. Ce remplacement cellulaire se ferait essentiellement par recrutement des précurseurs de la ZSV grâce aux modifications microenvironnementales que produit la lésion [57] (Fig. 4).
L’ensemble de ces études présentent néanmoins une limitation majeure : la proportion de nouveaux neurones produits est extrêmement faible si l’on tient compte du nombre de neurones disparus [54-56]. De plus, concernant l’ischémie expérimentale, non seulement une grande partie des progéniteurs neuraux se différencie en astrocytes, mais la majorité des nouveaux neurones meurt très rapidement [56]. Il est donc évident que des stratégies de stimulation de la prolifération, du recrutement, de la spécification en un sous-type neural précis, mais aussi de la survie cellulaire, doivent être envisagées de façon concertée pour que la récupération fonctionnelle soit significative.
Deux facteurs de croissance, le EGF et le TGF, ont été utilisés dans cette optique et ont donné des résultats saisissants. Les afférences dopaminergiques striatales provenant de la substance noire ont été lésées par la 6-hydroxydopamine afin de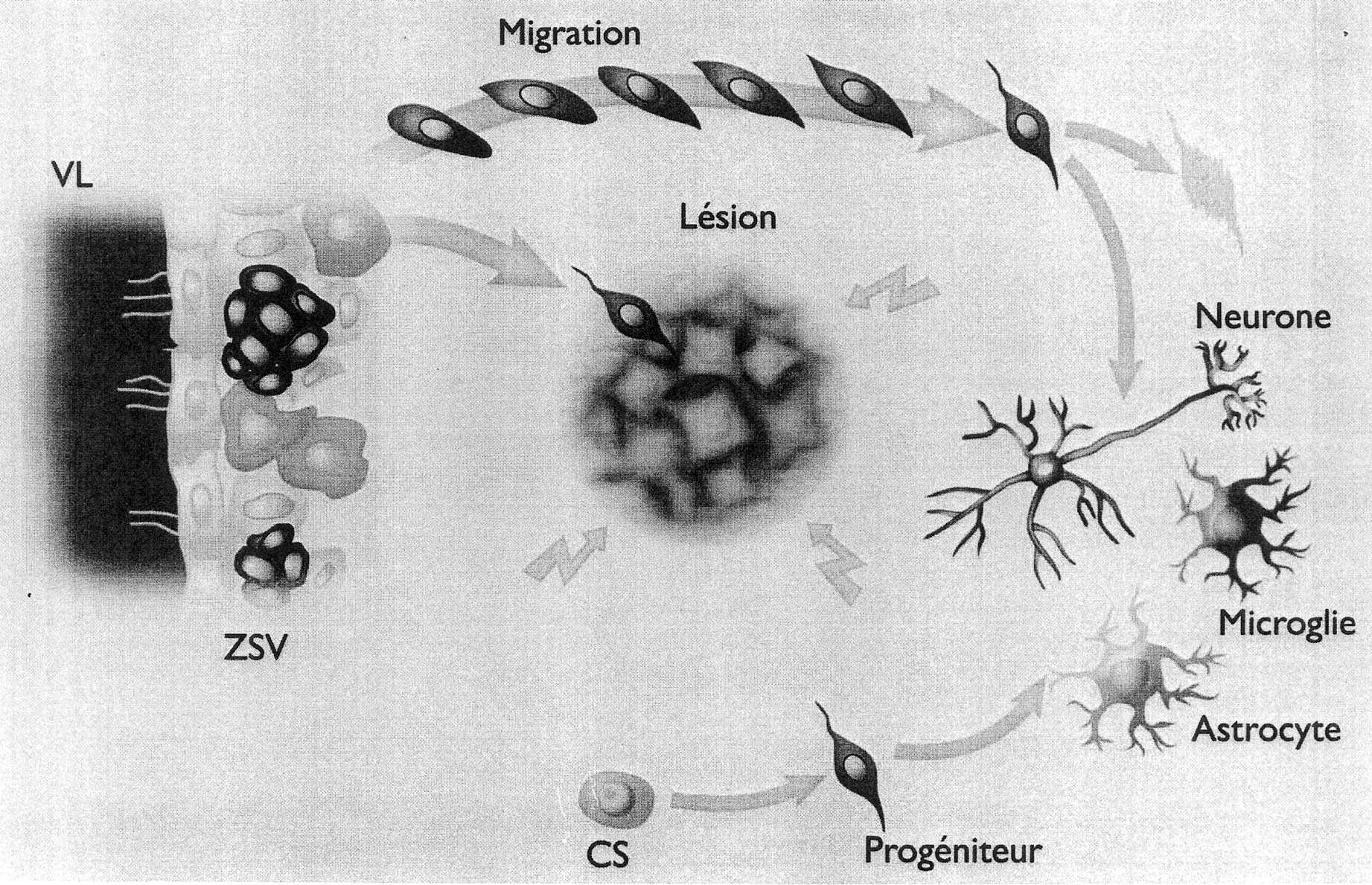
FIG. 4. — Schéma montrant comment la neurogenèse constitutive de la ZSV (représentée en haut par la grande flèche) peut-être détournée pour reconstituer un tissu nerveux perdant des neurones.
Ce remplacement est d’autant plus efficace que la perte neuronale est massive, rapide et s’effectue à proximité de la ZSV. Au centre, le halo représente les modifications microenvironnementales qui permettent l’arrivée des neuroblastes et leur intégration dans le réseau neuronal existant.
reproduire chez la souris les lésions caractéristiques de la maladie de Parkinson. Le TGF, un ligand endogène du récepteur à l’EGF, a été infusé dans le striatum. Les auteurs de ce travail déclarent observer une nette amélioration du comportement locomoteur lorsque les précurseurs neuronaux de la ZSV arrivent dans le striatum pour se différencier en neurones dopaminergiques [58]. L’effet prolifératif et attractif des facteurs de croissance sur les précurseurs de la ZSV est bien connu [45]. En revanche, la différenciation des progéniteurs en neurones dopaminergiques est surprenante puisque aucun neurone à dopamine ne réside dans cette structure, au moins dans des conditions physiologiques normales. D’ailleurs, l’équipe du Dr.
Isacson, en tentant de reproduire ces résultats, a confirmé le recrutement de précurseurs de la ZSV dans le striatum mais n’observe pas de différenciation dopaminergique [59]. La production de neurone à dopamine, à partir des précurseurs de la ZSV, reste donc un sujet controversé.
Enfin, Nakatomi et ses collaborateurs [60] ont examiné l’effet d’une infusion combinée de FGF et d’EGF dans le ventricule latéral de rat adulte. Ils montrent que l’induction d’une ischémie globale conduit à la dégénérescence sélective des neurones pyramidaux hippocampiques de la région CA1. Sans facteurs de croissance,
cette régénération est négligeable et aucune amélioration fonctionnelle n’est observée. À l’inverse, une forte augmentation de la prolifération des progéniteurs endogènes et le recrutement de plus de 40 % des neurones de la région CA1 sont observés chez les animaux ayant reçu les facteurs de croissance. Ces nouveaux neurones migrent à partir de la région caudale de la ZSV. Fait notable, ces auteurs montrent que les nouveaux neurones pyramidaux survivent au moins six mois et que l’amé- lioration des fonctions hippocampiques est importante [60].
CONCLUSION
Malgré ces résultats encourageants, il est certain que les facteurs de croissance à eux seuls ne sont pas les candidats idéaux pour induire une quelconque réparation. Ils exercent des effets multiples et encore mal définis. Par exemple, ils sont susceptibles d’entraîner la formation de nodules hyperplasiques sur les parois ventriculaires [59], et agissent de façon non contrôlée sur des cellules postmitotiques. Il est donc indispensable d’approfondir les connaissances en matière de régulation de la neurogenèse adulte afin d’élaborer de meilleures stratégies reposant sur des techniques de réparation cérébrale mieux contrôlées, plus efficaces et dépourvues d’effets délétè- res.
Il semble aussi très important de considérer les raisons étiologiques qui conduisent à la perte neuronale avant d’envisager un quelconque bénéfice de cette neurogenèse.
En particulier, la localisation de la dégénération influe de manière importante sur le remplacement neuronal. Si la lésion est trop éloignée de la ZSV, l’apport en nouveaux neurones ne semble pas avoir lieu [56]. D’autre part, la dimension temporelle est également un facteur important à considérer. Les dégénérations rapides sont très efficaces pour recruter les neuroblastes alors que les modèles plus lents, proches des maladies neurodégénératives humaines, ne montrent qu’un faible rendement. Une mort cellulaire massive, et rapide, semble donc plus efficace pour altérer les signaux micro-environnementaux qui s’opposent à l’acheminement et le recrutement des neuroblastes [54]. Enfin et surtout, on ne sait pas encore si les avancées réalisées sur les modèles animaux sont directement transposables au cerveau humain. Chez l’homme, bien que la neurogenèse hippocampique soit présente [61] et que l’on puisse isoler des cellules souches de la ZSV humaine [62], la preuve définitive d’une production de neurones in vivo reste à fournir.
La régénération nerveuse par remplacement cellulaire à partir des précurseurs neuraux endogènes en est à ses débuts. Cette approche présente des avantages évidents et supérieurs aux stratégies thérapeutiques basées sur l’emploi des cellules souches embryonnaires ou fœtales. Elle évite les problèmes à la fois éthiques, de rejet immunologique par l’hôte et de mutations génétiques qui peuvent apparaître durant le maintien en culture [63]. La recherche des facteurs endogènes régulant la neurogenèse secondaire permettra certainement d’améliorer substantiellement le recrutement, la survie et la différenciation des progéniteurs neuraux générés dans la ZSV.
Aussi, les travaux les plus récents devraient enrichir nos connaissances dans le domaine des mécanismes et des fonctions réparatrices du système nerveux central, et offrir sur le plan thérapeutique, de nouvelles stratégies visant à transplanter ou détourner depuis leur zone germinative des neurones nouvellement formés. Bien sûr, nombre de questions restent encore en suspens. Comment une cellule neuronale nouvellement générée migre-t-elle pour trouver sa cible ? Comment choisit-elle son destin cellulaire ? Autant de nombreuses et importantes questions auxquelles nous tentons actuellement de répondre.
BIBLIOGRAPHIE [1] ALTMAN J. — Are neurons formed in the brains of adult mammals ?
Science , 1962, 135 , 1127-1128.
[2] ALTMAN J. — Autoradiographic investigation of cell proliferation in the brain of rats and cats.
Anat. Rec ., 1963, 145 , 573-591.
[3] ALTMAN J., DAS G.D. — Autoradiographic and histological studies of postnatal hippocampus neurogenesis in rats. J. Comp. Neurol. , 1965, 124 , 319-336.
[4] KAPLAN M.S. — Environment complexity stimulates visual cortex neurogenesis : death of a dogma and a research career. T.I.N.S. , 2001, 24 , 617-620.
[5] KAPLAN M.S. — Prolifération of subependymal cells in the adult primate CNS : differential uptake ofDNA labelled precursors. J. fur Hirnforshcung , 1983, 24 , 23-33.
[6] RAKIC P. — DNA synthesis and cell division in the adult primate brain.
Ann. New York Acad.
Sci., 1985, 457 , 193-211.
[7] RAKIC P. — Limits of neurogenesis in primates.
Science , 1985, 227 , 1054-1056.
[8] REYNOLDS B.A., WEISS S. — Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous sytem. Science , 1992, 255 , 1707-1710.
[9] GAGE F.H., COATES P.W., PALMER T.D., KHUN H.G., FISHER L.J., Suhonen, J.O., Peterson, D.A., Suhr, S.T., Ray, J. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl Acad. Sci., USA , 1995, 92 , 11879-11883.
[10] KHUN H.G., DICKINSON-ANSON H., GAGE F.H. — Neurogenesis in the dentate gyrus of the adult rat : age-related decrease of neuronal progenitor proliferation. J. Neurosci., 1996, 16 , 2027-2033.
[11] GOULD E., TANAPAT P., MC EWEN B.S., FLUGGE G., FUCHS E. — Proliferation of granule cell precursors in the dendate gyrus of adult monkeys is diminished by stress. Proc. Natl Acad. Sci., USA , 1998, 95 , 3168-3171.
[12] GOULD E., REEVES A.J., FALLAH M., TANAPAT P., GROSS C.G., FUCHS E. — Hippocampal neurogenesis in Old World primates. Proc. Natl Acad. Sci., USA , 1999, 96 , 5263-5267.
[13] KORNACK D.R., RAKIC P. — Continuation of neurogenesis in the hippocampus of the adult macaque monkey. Proc. Natl Acad. Sci. USA , 1999, 96 , 5768-5773.
[14] ERIKSSON P.S., PERFIBLIEVA E., BJORK-ERIKSSON T., ALBORN A.M., NORDBORG C., PETERSON D.A., GAGE F.H. — Neurogenesis in the adut human hippocampus. Nat. Med., 1998, 4 , 1313-1317.
[15] DOETSCH F. — A niche for adult neural stem cells. Curr. Opin. Genet. Dev., 2003, 13 , 543-550.
[16] FUCHS E., TUMBAR T., GUASCH G. — Socializing with the neighbors : stem cells and their niche.
Cell , 2004, 116 , 769-778.
[17] ALVAREZ-BUYLLA A., LIM D.A. — For the long run : maintaining germinal niches in the adult brain. Neuron , 2004, 41 , 683-686.
[18] DOETSCH F., CAILLÉ I., LIM D.A., GARCIA-VERDUGO J.M., ALVAREZ-BUYLLA A. — SUBVENTRICULAR ZONE ASTROCYTES ARE NEURAL STEM CELLS IN THE ADULT MAMMALIAN BRAIN. Cell , 1999, 97 , 703-716.
[19] IMURA T., KORNBLUM H.J., SOFRONIEW M.W. — The predominant neural stem cell isolated from postnatal and adult forebrain but not early embryonic forebrain expresses GFAP. J Neurosci ., 2003, 23 , 2824-2832.
[20] LAYWELL E.D., RAKIC, P., KUKEKOV V.G., HOLAND E.C., STEINDLER D.A. — Identification of a multipotent astrocytic stem cell in the immature and adult mouse brain. Proc. Natl Acad. Sci.
USA , 2000, 97 , 13883-13888.
[21] SERI B., GARCIA-VEDUGO J.M., MC EWEN B.S., ALVAREZ-BUYLLA A. — Astrocytes give rise to new neurons in the adult mammalian hippocampus. J. Neurosci., 2001, 21 , 7153-7160.
[22] SUHONEN J.O., PETERSON D.A., RAY J., GAGE F.H. — Differentiation of adult hippocampusderives progenitors into olfactory neurons in vivo . Nature , 1996, 383 , 624-627.
[23] LOIS C., ALVAREZ-BUYLLA A. — Long-distance neuronal migration in the adult mammalian brain. Science , 1994, 264 , 1145-1148.
[24] ALVAREZ-BUYLLA A., GARCIA-VERDUGO J.M., TRAMONTIN A.D. — A unified hypothesis of the lineage of neural stem cells. Nat. Rev. Neurosci. , 2001, 2 , 287-293.
[25] MERCIER F., KITASAKO J.T., HATTON G.I. — Anatomy of the brain neurogenic zones revisited : fractones and the fibroblast/macrophage network. J. Comp. Neurol ., 2002, 451 , 170-188.
[26] SANAI N., TRAMONTIN A.D., QUINONES-HINOJOSA A., BARBARO N.M., GUPTAN ., KUNWAR S., LAWTON M.T., MC DERMOTT M.W., PARSA A.T., GARCIA-VERDUGO J.M., BERGER J., ALVAREZ-BUYLLA A. — Unique astrocyte ribbon in adult human brain contains neural stem cells but lacks chain migration. Nature , 2004, 427 , 740-744.
[27] HU H. — Chemorepulsion of neuronal migration by Slit2 in the development mammalian forebrain. Neuron , 1999, 23 , 703-711.
[28] WU W., WONG K., CHEN J.H., JIANG Z.H., DUPUIS S., WU J., RAO Y. — Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature , 1999, 400 , 331-336.
[29] NGUYEN-BA-CHARVET K.T., PICARD-RIERA N., TESSIER-LAVIGNE M., BARON-VAN EVERCOOREN A., SOTELO C., CHEDOTAL A. — Mutiple roles for Slits in the control of cell migration in the rostral migratory stream. J. Neurosci ., 2004, 24 , 1497-1506.
[30] KIRSCHENBAUM B., DOETSCH F., LOIS C., ALVAREZ-BUYLLA A. — Adult subventricular zone neuronal precursors continue to proliferate and migrate in the absence of the olfactory bulb. J.
Neurosci ., 1999, 19 , 2171-2180.
[31] LIU G., RAO Y. — Neuronal migration from the forebrain to the olfactory bulb requires a new attractant persistent in the olfactory bulb. J. Neurosci ., 2003, 23 , 6651-6659.
[32] HACK I., BANCILA M., LOULIER K., CARROLL P., CREMER H. — Reelin is a detachment signal in tangential chain-migration during postnatal neurogenesis. Nat. Neurosci., 2002, 10 , 939-945.
[33] SAGHATELYAN A., DE CHEVIGNY A., SCHACHNER M., LLEDO P.M. TENASCIN-R. — mediates activity-dependent recruitment of neuroblasts in the adult mouse forebrain. Nat. Neurosci ., 2004, 7 , 347-356.
[34] WINNER B., COOPER-KHUN C.M., AIGNER R., WINKLER J., KHUN H.G. — Long-tem survival and cell death of newly generated neurons in the adult olfactory bulb. Eur. J. Neurosci. , 2002, 16 , 1681-1689.
[35] PETEANU L., ALVAREZ-BUYLLA A. — Maturation and death of adult-born olfactory bulb granule neurons : role of olfaction. J. Neurosci ., 2002, 22 , 6106-6113.
[36] CARLETON A., PETREANU L., LANSFORD R., ALVAREZ-BUYLLA A., LLEDO P.M. — Becoming a new neuron in the adult olfactory bulb. Nat. Neurosci., 2003, 6 , 507-518.
[37] CARLEN M., CASSDIY R.M., BRISMAR H., SMITH G.A., ENQUIST L.W., FRISEN J. — Functional integration of adult-born neurons. Curr. Biol., 2002, 12 , 606-608.
[38] HUANG L., BITTMAN E.L. — Olfactory bulb cells generated in adult male golden hamsters are specifically activated by exposure to estrous females. Horm. Behav., 2002, 41 , 343-350.
[39] CAMERON H.A., MCKAY R.D. — Adult neurogenesis produces a large pool of new granule cells in the dendate gyrus. J. Comp. Neurol ., 2001, 435 , 406-417.
[40] ABROUS D.N., KOEHL M., LE MOAL M. — Adult neurogenesis : from precursors to network and physiology. Physiol Rev., 2005, 85 , 523-69.
[41] RAO M.S., SHETTY A.K. — Efficacy of doublecortin as a marker to analyse the absolute number and dendritic growth of newly generated neurons in the adult dentate gyrus. Eur. J. Neurosci ., 2004, 19 , 234-246.
[42] DAYER A.G., FORD A.A., CLEAVER K.M., YASSAEE M., CAMERON H.A — Short-term and long-term survival of new neurons in the rat dentate gyrus. J. Comp. Neurol., 2003, 460 , 563-572.
[43] SCHMIDT-HIEBER C., JONAS P., BISCHOFBERGER J. — Enhanced synaptic plasticity in newly generated granule cells of the adult hippocampus. Nature , 2004, 429 , 184-187.
[44] JESSBERGER S., KEMPERMANN G. — Adult-born neurons mature into activity-dependent responsiveness. Eur. J. Neurosci., 2003, 18 , 2707-2712.
[45] GAGE FH. — Mammalian neural stem cells.
Science , 2000, 287 , 1433-1438.
[46] LIM DA., TRAMONTIN AD., TREVEJO JM., HERRERA DG., GARCIA-VERDUGO JM., ALVAREZBUYLLA A. — Noggin antagonizes BMP signaling to create a niche for adult neurogenesis.
Neuron , 2000, 28 , 713-26.
[47] HACK MA., SAGHATELYAN A., DE CHEVIGNY A., PFEIFER A., ASHERY-PADAN R., LLEDO PM., GOTZ M. — Neuronal fate determinants of adult olfactory bulb neurogenesis. Nat. Neurosci .
2005, 8 , 865-72.
[48] LIE D.C., SONG H., COLAMARINO S.A., MING G.L., GAGE F.H. — Neurogenesis in the adult brain : new strategies for central nervous system diseases. Annu. Rev. Pharmacol. Toxicol., 2004, 44, 399-421.
[49] MURASE S., HORWITZ AF. — Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream.
J. Neurosci. , 2002, 22 , 3568-3579.
[50] LIU G, RAO Y. — Neuronal migration from the forebrain to the olfactory bulb requires a new attractant persistent in the olfactory bulb. J. Neurosci. 2003, 23 , 6651-9.
[51] ROCHEFORT C, GHEUSI G., VINCENT JD., LLEDO PM. — Enriched odor exposure increases the number of newborn neurons in the adult olfactory bulb and improves odor memory. J. Neurosci.
2002, 22 , 2679-89.
[52] SAGHATELYAN A., ROUX P., MIGLIORE M., ROCHEFORT C., DESMAISONS D., CHARBEAU P., SHEPHERD GM,. LLEDO PM. — Activity-dependent adjustments of the inhibitory network in the olfactory bulb following early postnatal deprivation. Neuron , 2005, 46 , 103-16.
[53] FISKE BK., BRUNJES PC. — NMDA receptor regulation of cell death in the rat olfactory bulb.
J.
Neurobiol. 2001, 47, 223-32.
[54] MAGAVI SS., LEAVITT BR., MACKLIS JD. — Induction of neurogenesis in the neocortex of adult mice. Nature , 2000, 405 , 951-5.
[55] CHEN J., MAGAVI SS., MACKLIS JD. — Neurogenesis of corticospinal motor neurons extending spinal projections in adult mice. Proc. Natl Acad. Sci. USA , 2004, 101 , 16357-62.
[56] ARVIDSSON A., COLLIN T, KIRIK D, KOKAIA Z, LINDVALL O. — Neuronal replacement from endogenous precursors in the adult brain after stroke. Nat. Med. , 2002, 8 , 963-70.
[57] JIN K., MAO XO., SUN Y., XIE L., GREENVERG DA. — Stem cell factor stimulates neurogenesis in vitro and in vivo . J. Clin. Invest. , 2002, 110 , 311-9.
[58] FALLON J., REID S., KINYAMU R., OPOLE I., OPOLE R., BARATTA J., KORC M., ENDO TL., DUONG A., NGUYEN G., KARKEHABADHI M., TWARDZIK D., PATEL S., LOUGHLIN S. — In vivo induction of massive proliferation, directed migration, and differentiation of neural cells in the adult mammalian brain. Proc. Natl Acad. Sci. USA , 2000, 97 , 14686-91.
[59] COOPER O., ISACSON O. — Intrastriatal transforming growth factor alpha delivery to a model of Parkinson’s disease induces proliferation and migration of endogenous adult neural progenitor cells without differentiation into dopaminergic neurons. J. Neurosci. , 2004, 24 , 8924-31.
[60] NAKATOMI H., KURIU T., OKABE S., YAMAMOTO S., HATANO O., KAWAHARA N., TAMURA A., KIRINO T., NAKAFUKU M. — Regeneration of hippocampal pyramidal neurons after ischemic brain injury by recruitment of endogenous neural progenitors. Cell , 2002, 110 , 429-41.
[61] ERIKSSON PS., PERFILIEVA E., BJORK-ERIKSSON T., ALBORN AM., NORDBORG C., PETERSON DA., GAGE FH. — Neurogenesis in the adult human hippocampus. Nat. Med. , 1998, 11 , 1313-7.
[62] SANAI N., TRAMONTIN AD., QUINONES-HINOJOSA A., BARBARO NM., GUPTA N., KUNWAR S., LAWTON MT., MCDERMOTT MW., PARSA AT., MANUEL-GARCIA VERDUGO J., BERGER MS., ALVAREZ-BUYLLA A. — Unique astrocyte ribbon in adult human brain contains neural stem cells but lacks chain migration. Nature , 2004, 427 , 740-4.
[63] MITCHELL BD., EMSLEY JG., MAGAVI SS., ARLOTTA P., MACKLIS JD. — Constitutive and induced neurogenesis in the adult mammalian brain : manipulation of endogenous precursors toward CNS repair. Dev. Neurosci. , 2004, 26, 101-17.
DISCUSSION
M. Georges SERRATRICE
La vitesse de neurogenèse est-elle identique dans toutes les régions cérébrales, ou particulière aux modèles sensoriels — en particulier olfactif — que vous avez envisagés ? A ce propos, le chiffre de trente mille neurones produits par jour par le cerveau adulte ne devrait-il pas être différencié selon la région productrice ?
La vitesse de migration des neurones dépend de l’environnement dans lequel les cellules se déplacent. Elle n’est donc pas constante, mais dépend plutôt des régions dans lesquelles les nouvelles cellules migrent. Le nombre de cellules parvenant à s’intégrer, puis à survivre, dans un réseau neuronal dépend étroitement du niveau d’activité électrique. Il existe donc des variations marquées entre les territoires concernés par la neurogenèse.
M. Bernard LECHEVALIER
Ma question concerne la mise en jeu du processus de réparation qui naît dans la ZSV, après une lésion à distance, par exemple : cortico-sous-corticale. La lésion provoque-t-elle à distance une modification environnementale du site, que vous appelez « niche » d’où il
résulte un apport de facteur de croissance au niveau de ZSV ? Ou bien la lésion envoie-t-elle un signal électro-physiologique vers ZSV par les innombrables fibres d’associations de la substance blanche hémisphérique ?
Les signaux que nous commençons à identifier sont chimiques et diffusibles. Les chemokines, par exemple, sont des facteurs capables d’attirer à distance de nouveaux neurones.
D’autres, comme les facteurs trophiques, participent plutôt à la survie locale des neurones nouvellement intégrés.
M. Jean-Jacques HAUW
Vous avez suggéré que la neurogenèse était importante dans le système olfactif, en réponse aux agressions que subissent les récepteurs olfactifs dans la muqueuse olfactive. La neurogenèse olfactive est-elle modifiée dans l’espèce humaine au cours des maladies neurodégé- nératives comme la maladie d’Alzheimer ou de Parkinson où les lésions du bulbe olfactif sont très précoces ?
Nous savons aujourd’hui que la forme soluble du précurseur de la protéine amyloïde (APP) est nécessaire à la prolifération des progéniteurs neuronaux du cerveau adulte. En conséquence, un défaut de la neurogenèse du bulbe olfactif peut être observé durant l’évolution de la maladie d’Alzheimer. Concernant la maladie de Parkinson c’est un défaut en dopamine qui est responsable d’une diminution de la prolifération des progé- niteurs neuronaux dans la zone sous-ventriculaire.
M. Francis GALIBERT
L’exposition des neurones olfactifs à un odorant est rapidement perçue. En revanche, si l’exposition est continue, on observe assez rapidement une inhibition de la perception. Lors de l’exposition des animaux à un ou des odorants, on observe une augmentation de la neurogénèse. L’exposition était-elle continue ou discontinue ?
En effet, pour limiter les phénomènes de désensibilisation, il convient de présenter les odeurs de façon intermittente. Aussi, pour créer un environnement olfactif ‘‘ enrichi ’’, les odeurs doivent être remplacées, chaque jour, dans la cage des rongeurs, et ceci durant quarante jours.
M. René MORNEX
En fonction de l’âge des animaux sur lesquels vous avez travaillé, pouvez-vous préciser le moment auquel les cellules souches peuvent entrer en action : très précoce ou au fil du temps ? En outre, l’importance du développement axonal impliquant une synthèse de tubuline, avez-vous étudié l’influence de l’environnement hormonal, thymidine en particulier ?
La production de nouveaux neurones diminue avec l’âge d’un sujet, mais reste malgré cela importante tout au long de la vie d’un individu. Il est vrai que cette production varie selon l’état central d’un sujet, et en particulier en fonction du niveau hormonal. Par exemple, les hormones du stress sont de puissants inhibiteurs alors que la prolactine ou la progestérone sont des activateurs très efficaces de la prolifération cellulaire dans la zone sous-ventriculaire.
M. Pierre RONDOT
Les cellules souches cérébrales ne feraient-elles pas courir le risque de transformation tumorale ?
C’est la raison pour laquelle les cellules souches prélevées chez l’adulte sont préférables.
Les cellules souches prélevées chez l’embryon, contrairement à celles qui sont obtenues chez l’adulte, ont un pouvoir de transformation tumorale non négligeable.
M. Claude-Henri CHOUARD
L’ORL côtoie quatre des cinq fonctions sensorielles qui permettent à l’individu de prendre connaissance de son environnement extérieur, et vos travaux soulignent deux particularités de l’olfaction : l’absence d’organe sensoriel anatomiquement identifiable (si ce n’est le mucus nasal), et la particularité de son premier neurone (que vous qualifiez de neurone sensoriel sur votre schéma) d’être le seul neurone en contact direct avec le monde extérieur.
En quoi, structurellement, ce premier neurone olfactif se différencie-t-il des premiers neurones qui connectent aux centres les bourgeons du goût, les cellules ciliées de l’oreille interne, voire les corpuscules du toucher ou les éléments de la rétine ?Est-il prouvé aujourd’hui que ce renouvellement quotidien des premiers neurones olfactifs est déterminé par leur destruction épigénétique permanente au contact de l’environnement extérieur ?
Le premier étage de l’organe sensoriel de l’olfaction est constitué d’une seule catégorie de cellules sensorielles qui cumulent les fonctions de réception du stimulus, de transduction et de transmission du message sensoriel périphérique vers le système nerveux central. Ces neurones dont le corps cellulaire est contenu dans l’épithélium olfactif possèdent des dispositions anatomiques très particulières, que l’on ne rencontre pas chez les autres systèmes sensoriels. Leur unique dendrite encastré dans les cellules de soutien se termine par un renflement qui porte de longs cils. Cette particularité anatomique permet d’augmenter la surface utile de la cellule. Ce sont donc des neurones directement exposés à l’environnement. Aussi, ce qui constitue l’originalité majeure de ces neurones est leur durée de vie limitée à quelques semaines et l’existence d’une neurogenèse permanente à partir de cellules souches qui permet le remplacement de neurones sensoriels dégénérés.
Or, on sait aujourd’hui que le renouvellement de ces neurones dépend étroitement de leur degré d’exposition à l’environnement extérieur.
* Laboratoire ‘‘ Perception et Mémoire ’’, Institut Pasteur, CNRS URA 2182, 25 rue du Dr. Roux, 75 724 Paris cedex 15. Tirés à part : Professeur Pierre-Marie LLEDO, même adresse. Article reçu le 15 novembre 2005, accepté le 19 décembre 2005.
Bull. Acad. Natle Méd., 2006, 190, no 2, 385-402, séance du 28 février 2006


