Résumé
La mobilité pelvienne est cruciale chez la femme en terme de fonctions urinaires, digestives, et de reproduction comme au cours de l’accouchement. Elle est liée à un système complexe de suspension et de soutènement des différents organes. Des pathologies vont apparaître en cas d’hypomobilité mais surtout d’hypermobilité comme le prolapsus génital. Cette pathologie touche une femme sur trois tous âges confondus et peut être invalidante. Sa prise en charge chirurgicale présente malheureusement un taux d’échec important, en grande partie dû à une mauvaise connaissance du système de soutènement des organes, notamment du système ligamentaire difficilement discernable. Nous proposons un modèle numérique 3D de la cavité pelvienne construit à partir d’images IRM et un outil d’évaluation quantitatif de ce modèle afin de localiser, de manière non destructive, les ligaments pelviens. Ceci permet d’optimiser la configuration du système ligamentaire sur des critères topologiques. Nous obtenons alors un modèle anatomique et fonctionnel cohérent, permettant une compréhension de la physiologie de la mobilité pelvienne de la femme. Ce travail représente une première étape pour la création d’un outil de localisation et de caractérisation de la cause d’un déséquilibre pelvien chez une patiente pathologique. Des applications sont présentées en terme de physiopathologie, et des perspectives d’applications thérapeutiques et en terme de prévention exposées grâce à l’individualisation du modèle.
Summary
Female pelvic mobility is crucial for urinary, bowel and sexual function and for vaginal delivery. This mobility is ensured by a complex organ suspension system composed of ligaments, fascia and muscles. Impaired pelvic mobility affects one in three women of all ages and can be incapacitating. Surgical management has a high failure rate, largely owing to poor knowledge of the organ support system, including the barely discernible ligamentous system. We propose a 3D digital model of the pelvic cavity based on MRI images and quantitative tools, designed to locate the pelvic ligaments. We thus obtain a coherent anatomical and functional model which can be used to analyze pelvic pathophysiology. This work represents a first step towards creating a tool for localizing and characterizing the source of pelvic imbalance. We examine possible future applications of this model, in terms of personalized therapy and prevention.
INTRODUCTION
Les troubles de la statique pelvienne de la femme posent de nombreux défis aux médecins et scientifiques tentant d’en élucider les mécanismes de survenue. Sa physiopathologie est complexe et multifactorielle. Sur le plan mécanique, il existe une mobilité physiologique importante du système pelvien et essentielle à la réalisation des fonctions urinaires et rectales mais également de la fonction reproductrice et des rapports sexuels. Cette mobilité est liée à des contraintes mécaniques dont les valeurs sont mal évaluées, que ce soit en position debout, lors des activités physiques ou encore des différentes fonctions physiologiques. Par ailleurs, les tissus de cette région sont des tissus mous et hyper-élastiques dont les propriétés sont mal connues.
Enfin, cette région est, par ailleurs, soumise à des contraintes exceptionnelles lors des accouchements, mais est également le lieu de nombreuses chirurgies plus ou moins mutilantes qui viennent en perturber l’équilibre.
La mobilité des différents organes dans la cavité pelvienne est liée aux tissus mous qui les composent mais également à un réseau dense de tissus conjonctifs, élastine et fibres musculaires entourant tous ces organes dans des structures diffuses et planes, les fascias, suspendus à la paroi pelvienne par des structures densifiées, les ligaments.
De très nombreux ligaments ont été décrits afin de suspendre les différents organes, vessie, rectum, vagin, utérus. L’anatomie fonctionnelle de cette région est encore sujette à de multiples théories, l’importance relative de ces différentes structures faisant l’objet de nombreux débats. Des situations pathologiques peuvent diminuer ces mobilités comme dans les processus infiltratifs endométriosiques ou cancérologiques ou les augmenter comme dans la situation qui nous intéressera plus particulièrement de prolapsus génitaux. De très nombreuses interventions chirurgicales ont été décrites afin de corriger ces troubles de manière souvent empiriques et connaissent des taux d’échecs préoccupants pouvant atteindre plus de 30 à 50 %.
Le prolapsus génital féminin se définit comme une saillie partielle ou totale de la paroi vaginale et provient d’une défaillance du système de soutènement des organes pelviens. Il concerne approximativement une femme sur trois tous âges confondus [1] et plus de 60 % des femmes de plus de 60 ans [2]. Cette pathologie constitue un problème majeur pour les chirurgiens gynécologues. Devant le vieillissement de la population féminine, la demande de prise en charge chirurgicale est de plus en plus importante en vue d’une amélioration de la qualité de vie, pour atteindre un taux d’intervention de 11,8 % à l’âge de 80 ans.
Sa prise en charge est essentiellement chirurgicale afin de rétablir une reconformation et rigidification du système pelvien. Deux stratégies sont possibles soit l’utilisation des tissus autologues qui sont « refixés » aux ligaments pelviens existants soit par interposition de matériau prothétique, solution privilégiée actuellement. Au cours de ces dernières années, un travail important a été entrepris pour caractériser le comportement des tissus pelviens par des méthodes destructives [3-7] afin de définir le comportement cible des implants. Il n’existe pas à ce jour de consensus permettant de définir le dispositif de soutènement du système pelvien, en particulier de l’ensemble ligamentaire, il existe parfois un décalage entre anatomie topologique et anatomie fonctionnelle, la part relative des différents éléments de suspension étant sujette à controverse.
Afin de remédier à ce problème, nous proposons de développer un modèle numérique dédié de simulation des mobilités de la cavité pelvienne, basé sur la méthode des éléments finis. Le modèle est construit à partir d’images d’Imagerie par résonnance (IRM) statique spécifique à chaque patiente qui permet de reconstruire l’ensemble des éléments de la cavité pelvienne : vagin, rectum, vessie, utérus, plancher pelvien et bassin osseux. En revanche, les dispositifs ligamentaires, qui sont les acteurs principaux de la statique pelvienne, ne sont pas, ou peu, observables sur IRM. Ce modèle est alors optimisé topologiquement, par comparaison à un champ de déplacements mesuré sur des images d’IRM dynamique. La comparaison entre simulations et mesures quantitatives des déplacements permet de localiser les principaux dispositifs ligamentaires responsables de la mobilité et de les introduire dans le modèle numérique. Cela permet de disposer d’un modèle numérique dédié qui soit anatomiquement et fonctionnellement conforme. Ces modèles permettent alors de réaliser des simulations afin de mieux appréhender les mobilités normales du système pelvien et la physiopathologie des prolapsus génitaux.
CONSTRUCTION D’UN MODÈLE NUMÉRIQUE DU SYSTÈME PELVIEN
Le modèle numérique de la cavité pelvienne que nous proposons est construit à partir d’images IRM d’une patiente saine volontaire. Une fois le modèle numérique défini, l’utilisation d’un code de calcul permet de quantifier l’intensité des déplacements des divers organes en fonction d’une sollicitation. Au cours de cette section, nous précisons la méthode de construction d’un modèle numérique dédié.
Modèle géométrique
Les géométries des organes pelviens (la vessie, le vagin, le rectum et l’utérus), du plancher pelvien et du bassin osseux sont obtenues par reconstruction de volumes à partir d’images IRM statiques. Ces dernières ont été acquises selon les trois plans d’incidence (sagittale, axiale et coronale) suivant le protocole Sigma HD [dT] 1,5T GEMS avec des coupes jointives d’épaisseur de 6 mm. La génération des surfaces des organes se fait par la méthode de segmentation des contours à l’aide du logiciel ARTIMED ® . Ces surfaces sont maillées par triangularisation, régularisées sous le logiciel BLENDER ® , converties en volumes grâce au logiciel SOLIDWORKS ® 2010 pour enfin être importées dans ABAQUS ® CAE (v 6.101).
Le plancher pelvien, est modélisé par une surface qualitative venant fermer le bassin au niveau du détroit inférieur tout en laissant des ouvertures pour le vagin et le rectum.
Tous les ligaments décrits dans la littérature ne sont pas observables en IRM. Les premières simulations sont donc réalisées sans ligaments. Par la suite, ils seront graduellement introduits. Dans ce cas, leurs positions sont postulées en accord avec la littérature relatant de l’anatomie du système pelvien. Ils sont modélisés par des éléments à deux nœuds.
Le modèle géométrique résultant est présenté figure 1.
Fig. 1 — Modèle géométrique (gauche : représentation 3D sans les ligaments, droite : vue en coupe avec les ligaments larges, ronds et utéro-sacrés) Modèle éléments finis
Le modèle géométrique est ensuite discrétisé en un ensemble d’éléments finis afin de permettre la résolution de l’ensemble des équations de la mécanique (équation d’équilibre, conditions de chargement et relation entre force et déplacement) qui définissent le mouvement des organes soumis à un effort et/ou un déplacement donné. Le modèle éléments finis développé comporte 4 300 éléments (2 220 nœuds, 11 867 degrés de liberté). Nous utilisons le code de calcul ABAQUS EXPLICIT (version 6.101) pour résoudre le problème et simuler les mobilités du système sous des conditions de chargement données.
La vessie, le vagin, le rectum et le plancher pelvien sont modélisés par des coques déformables. L’utérus et le bassin osseux sont considérés comme étant indé- formable.
Par la suite, nous chercherons à confronter les simulations numériques à des examens IRM. Ces examens IRM ont été réalisés en introduisant du gel de contraste dans le rectum et le vagin. Afin de modéliser la présence de gels de contraste dans le rectum et la vessie au cours des examens IRM, nous avons défini ces deux organes sous la forme de cavité de fluide. Le fluide est considéré comme quasiincompressible ce qui permet des transformations iso-volumiques.
Lorsqu’ils sont pris en compte, les ligaments sont modélisés par des ressorts non linéaires de sorte à ce que ceux-ci aient une raideur nulle en compression et une loi de comportement linéaire en traction.
Propriétés mécaniques
Soumis à un effort, les tissus se déforment, la relation entre les efforts et les déplacements, ou plus précisément les contraintes liées aux efforts et les déformations liées aux déplacements, est la loi de comportement qu’il convient de définir.
Pour définir les lois de comportement des tissus pelviens, nous nous sommes basés sur nos études récentes dans ce domaine [8, 9]. Elles sont considérées, en première approximation, comme élastiques isotropes en grandes transformations. Les épaisseurs des coques, pour les organes, et les diamètres des ressorts, pour les ligaments, sont basés sur des considérations anatomiques [11].
Le tableau suivant rassemble les propriétés mécaniques des tissus utilisées.
Tableau 1. — Propriétés mécaniques Objet
Module de Young (Mpa)
Épaisseur/Diamètre (mm)
Rectum 3.6 3 Vagin 15 4 Vessie 2.4 3 Ligament Utéro-sacré 71.7 8 Ligament Rond 45.1 4 Ligament Large 19.5 4 Plancher Pelvien*
3 10 * : données qualitatives Les tissus sont considérés comme peu compressibles car ils ont une forte teneur en eau. Nous avons donc utilisé un coefficient de Poisson égal à 0,45 pour les coques déformables.
Conditions de chargements et de déplacements
Les éléments (les organes pelviens) d’un système mécanique (le système pelvien) dont les propriétés mécaniques sont connues (par l’intermédiaire des lois de comportement) se déplaceront s’ils subissent des sollicitations mécaniques c’est à dire des déplacements ou des efforts imposés.
Le pourtour du plancher pelvien est considéré comme fixe pour simuler sa fixation au bassin.
Le col de l’utérus est collé à la terminaison supérieure du vagin. De même, les parties inférieures du vagin et du rectum sont solidaires du plancher pelvien. Les autres contacts entre les objets du modèle sont considérés comme parfaits sans frottements.
Afin d’étudier les mobilités du système pelvien et de pouvoir les confronter à des données d’IRM dynamique, nous demandons aux témoins de simuler, dans l’enceinte d’une IRM, un effort de poussée ou de toux. Parallèlement, nous cherchons à simuler les déplacements induits par ces efforts. Ainsi, nous simulons un effort de poussée par une force surfacique inclinée à 45° par rapport à l’axe vertical de la patiente et appliquée sur les parties supérieures des organes [10]. Pour estimer l’amplitude de cette force, nous considérons la pression intra pelvienne en position couchée et au repos évaluée à environ 0,01 MPa [11]. En position debout, Kamina [11] estime que le poids des organes viscéraux multiplie par 3 la valeur de cette pression. Durant la toux, il estime qu’elle est multipliée par un facteur allant de 10 à 20. Nous estimons que la pression intra-pelvienne lors de l’effort de poussée est du même ordre de grandeur.
OUTIL D’ÉVALUATION DU MODÈLE NUMÉRIQUE
Comme cela a été évoqué, la définition d’un modèle numérique de simulation des mobilités d’un ensemble d’organes repose sur la définition de la géométrie des organes, du comportement mécanique des tissus constitutifs des organes et des conditions de chargements et de déplacements imposées.
Nous disposons de la quasi totalité des informations requises. Les seules informations manquantes portent sur la définition des conditions de déplacements. En effet, les ligaments étant difficilement observables via l’IRM, ils ne sont pas, dans un premier temps, définis dans le modèle numérique ce qui induira des erreurs sur les simulations.
Au cours de cette section, nous définissons des outils d’évaluation des simulations numériques.
Calcul des déplacements IRM
Afin de déterminer de manière quantitative l’intensité des déplacements sur des images IRM dynamiques, nous utilisons un algorithme d’estimation du flot optique implémenté dans Open CV. Cet algorithme permet, sur des IRM dynamiques en coupe sagittale de la patiente témoin acquise au cours d’un effort de poussée, de comparer les images à des instants différents pour déduire le flot optique permettant d’aller d’une image à l’autre. Le flot optique mesuré sur les contours des organes est assimilé à un champ de déplacement pour quantifier l’erreur du modèle. La figure ci-dessous représente le champ de déplacement mesuré pour une image donnée (figure 2).
Fig. 2 — Mesure du champ de déplacement sur les images IRM dynamiques par la méthode du flot optique.
Comparaison entre les images IRM et la réponse du modèle
Pour pouvoir comparer ce champ de déplacement avec la réponse du modèle numérique, nous avons extrait les contours des organes du modèle selon le même plan de coupe que les images IRM. Un sur-échantillonnage par interpolation et un algorithme de minimisation de la distance, sous MATLAB, permet un appariement entre les contours issus du modèle non déformé et les contours suivis sur les images IRM.
À chaque pas de temps numérique de la simulation, les contours des organes déformés selon le plan sagittal sont appariés avec les contours du pas de temps précédent. Cela permet de calculer un champ de déplacements des contours du
 modèle dans le plan de coupe sagittal similaire au champ de déplacements mesuré sur les images IRM (figure 3, (b)).
modèle dans le plan de coupe sagittal similaire au champ de déplacements mesuré sur les images IRM (figure 3, (b)).
Une mesure de l’écart des déplacements de type distance euclidienne donne une quantification de l’erreur du modèle au niveau de ces contours (figure 3, (c)). Cette mesure permet de disposer d’un outil quantitatif d’évaluation de la qualité d’un modèle numérique.
Fig. 3. — Comparaison du modèle avec les images IRM: (a) Déplacements mesurés sur les images IRM, (b) Déplacements des contours du modèle dans le plan sagittal, (c) Évaluation du modèle OPTIMISATION ET VALIDATION DU MODÈLE NUMÉRIQUE : IMPLÉ- MENTATION DES LIGAMENTS
Il existe de nombreux ligaments pelviens décrits en anatomie mais leur implication relative dans l’équilibre pelvien et le soutènement des organes reste mal définie. Le modèle élément finis de la cavité pelvienne développé et l’outil d’évaluation de ce modèle permettent de définir quels ligaments semblent jouer un rôle prépondérant dans la statique pelvienne. Le but est d’obtenir un modèle anatomiquement et fonctionnellement cohérent. L’objectif de cette étude n’est pas de définir un modèle anatomique exact, mais un modèle simplifié d’anatomie fonctionnelle à même de rendre compte des mobilités constatées sur imagerie IRM. Pour cela, des tissus conjonctifs (fascias et ligaments) ont été introduits progressivement, figure 4, de manière à réduire l’erreur mesurée et en accord avec les données anatomiques de la littérature.
Fig. 4. — Évolution du modèle figure de gauche : organes sans ligaments, figure du milieu : introduction des ligaments ronds, larges et utéro-sacrés, figure de droite : introduction des ligaments paravaginaux et ombilical.
Configuration 1 : une première simulation sans ligaments avec uniquement les organes observables par IRM a été réalisée. Une telle simulation conduit à des résultats aberrants avec une hyper mobilité de l’ensemble des organes. Ce résultat est tout à fait compréhensible, dans la mesure où l’utérus, en dehors de son accolement au vagin, n’est pas fixé et est donc libre de déplacement et que la vessie et le rectum sont également libres. Cette solution n’est donc pas satisfaisante.
• Configuration 2 : nous ajoutons les ligaments utéro-sacrés, qui sont considérés selon la littérature comme les acteurs majeurs du maintien de la statique pelvienne. Les simulations conduisent à des mobilités qui ne sont toujours pas réalistes : hyper mobilité de la vessie, du rectum et mobilité de l’utérus trop grande.
Cette solution n’est pas retenue.
• Configuration 3 : l’ajout des ligaments ronds, localisables lors de dissections, conduit toujours à des mobilités insatisfaisantes. On note une forte latéralisation de l’utérus. En effet, l’utérus n’apparait pratiquement plus dans le plan de coupe sagittal (figure 4) [3] ce qui ne correspond pas aux observations IRM. Ce modèle est également insuffisant.
• Configuration 4 : on incorpore également les ligaments larges également localisables lors de dissections. Pour la première fois les simulations peuvent être réalisées pour des pressions allant jusqu’a 0.15 Mpa, correspondant à l’ordre de grandeur de la pression intra pelvienne lors de la toux donnée par Kamina [11]. Ces simulations sont les premières permettant d’atteindre des niveaux de pression équivalents à ceux subit dans la région pelvienne. Nous pouvons donc confronter, qualitativement les résultats aux données IRM. Néanmoins, les mobilités de la vessie et du rectum demeurent aberrantes.
• Configuration 5 : une évaluation quantitative des déplacements sur des images
IRM dynamiques d’une patiente en effort de poussée, grâce à la méthode présentée préalablement, met en évidence deux zones fixes : la partie inférieure de la vessie au contact du pubis et l’arrière du rectum au voisinage du sacrum.
Nous bloquons, dans notre modèle numérique, les déplacements sur ces deux zones. Ce résultat se justifie anatomiquement par la présence de tissus conjonctifs qui accolent les organes au bassin. Nous ne sommes plus dans un cas de mobilités aberrantes. L’erreur moyenne est de 12,9 mm ce qui est assez satisfaisant.
Cependant, on peut toujours constater une latéralisation de l’utérus bien trop importante en comparaison des résultats acquis par l’analyse des déplacements IRM.
• Configuration 6 : afin de réduire la latéralisation de l’utérus, nous introduisons, toujours en accord avec les données anatomiques de la littérature, des ligaments para-vaginaux et fascias de part et d’autre de l’utérus et du vagin. La simulation révèle une déviation de l’utérus limitée. L’erreur moyenne en déplacement entre IRM et simulation est de 10,9 mm. Toutefois, la forme générale de la vessie déformée ne correspond pas aux constations IRM et laisse pressentir le manque d’un moyen de fixation à l’avant.
Configuration 7 : nous ajoutons pour finir le ligament ombilical qui améliore la pertinence de notre modèle. Le module de Young de ce dernier ligament est choisi arbitrairement égal à 60 Mpa. Les déformations des organes sont cohérentes et l’erreur moyenne de ce modèle est de 9.8 mm. Ce dernier modèle d’anatomie fonctionnelle est jugé, en l’état actuel des données, satisfaisant.
Fig. 5. — Configuration finale du système ligamentaire.
DISCUSSION
Le développement d’un modèle numérique anatomique des organes de la cavité pelvienne n’est pas en lui-même un processus original et nous l’avons déjà publié en 2010 [Rao]. Basé sur un contourage manuel des organes, il est fastidieux et permet d’obtenir une reconstruction anatomique de base. Il est essentiel de pouvoir rajouter les éléments de suspension semblant essentiels à la statique pelvienne, la plupart étant difficilement identifiables en imagerie conventionnelle.
Néanmoins ces éléments de suspension restent souvent mal décrits, font l’objet de controverses et aucun consensus anatomique clair n’existe concernant cet aspect fonctionnel de la suspension des organes. Ces suspensions sont de plus complexes, avec une partie de suspension par des ligaments clairement décrits mais également des zones de suspensions diffuses par des fascias mal identifiés en anatomie.
De plus les propriétés mécaniques des tissus sont caractérisées pour les ligaments classiques comme pour les organes mais certaines suspensions comme les suspensions para vaginales antérieures ne peuvent être caractérisées par des méthodes destructives classiques. Il est donc nécessaire de procéder à des simplifications fortes du modèle lors de son élaboration et il devient indispensable de vérifier que ces simplifications ne rendent pas le modèle inapproprié.
Nous avons développé une méthodologie de construction d’un modèle 3D à partir d’images IRM statiques puis une méthode de comparaison de ce modèle avec des images IRM dynamiques. Ceci représente une première étape encourageante.
Une optimisation du modèle, basée sur une évaluation quantitative de l’erreur, nous a permis de sélectionner des ligaments a priori importants dans la statique pelvienne en accord avec les cliniciens, les données anatomiques et les données expérimentales.
Ces résultats demandent à être confirmés sur des modèles issus d’un plus grand nombre de témoins pour pouvoir généraliser nos conclusions. Cependant, l’existence d’un tel modèle, même s’il est pour l’instant dédié à un seul témoin, permet à travers diverses simulations d’en montrer l’intérêt.
Définition d’un dispositif ligamentaire simplifié
Lors de l’optimisation du modèle numérique de sorte à ce que celui-ci coïncide au mieux aux mesures des champs de déplacements quantifiés sur IRM, nous constatons qu’il était nécessaire d’introduire un minium de ligaments.
Ce processus a permis de repérer des régions anatomiques ou les éléments de suspension décrits n’étaient pas suffisants. C’est le cas des régions rétro pubiennes et présacrées, mais également de l’ouraque pour la suspension de la vessie que nous n’avions pas pris en compte dans un premier temps. Il était également apparent que l’absence de suspension para vaginale antérieure ne permettait pas d’obtenir une mobilité correcte de la vessie dans notre modèle. Ces différents éléments ont donc pu être ajoutés progressivement au modèle permettant de se rapprocher des mobilités pelviennes normales de notre patiente témoin.
Les mobilités obtenues et autorisées dans le modèle actuel se rapprochent fortement des mobilités constatées et considérées normales chez une patiente témoin avec une différence maximale de moins de un cm pour l’ensemble des points. La faisabilité de ce modèle est donc avérée et permettra de développer secondairement un modèle pathologique de mobilité pelvienne. Ce modèle permet de valider en grande partie l’anatomie fonctionnelle de la cavité pelvienne mais également de le compléter en soulignant l’existence d’éléments de statique sous estimée.
Ce modèle présente bien entendu de nombreuses imperfections qui demanderont à être améliorées dans de futurs travaux. L’anatomie des muscles du plancher pelvien est encore trop simplifiée et la prise en compte des différents chefs musculaires permettra une évaluation périnéale plus pertinente. Nous manquons de données sur les contraintes subies par le système pelvien, mais aussi sur les frottements entre organes ainsi que sur les propriétés contractiles des muscles pelviens. Ces résultats demandent donc à être confirmés sur des modèles issus d’autres patientes témoins pour pouvoir généraliser nos conclusions. La procédure de l’examen IRM pourra être définie de manière plus précise pour les analyses à venir afin d’améliorer la pertinence d’une comparaison entre le modèle et les images IRM dynamiques. Par exemple il est nécessaire que l’examen dynamique ait lieu immédiatement après l’examen statique de manière à ce que la réplétion des organes ne change pas. Le but étant que les états au repos sur les deux séries de clichés IRM soient superposables.
être définie de manière plus précise pour les analyses à venir afin d’améliorer la pertinence d’une comparaison entre le modèle et les images IRM dynamiques. Par exemple il est nécessaire que l’examen dynamique ait lieu immédiatement après l’examen statique de manière à ce que la réplétion des organes ne change pas. Le but étant que les états au repos sur les deux séries de clichés IRM soient superposables.
Simulation de la pesanteur
La plupart du temps, les praticiens hospitaliers pour étudier les mobilités du système pelvien, et détecter d’éventuelles pathologies utilisent l’IRM. Malheureusement, la majorité des équipements IRM requiert de positionner les patientes en position allongée. Dans ce cas les forces de pesanteur, moteur important de la mobilité, ne s’exercent pas de la même manière qu’en situation physiologique.
La simulation numérique peut remédier à ce problème. En effet, numériquement, il est aisé de « tourner le bassin » et ainsi de simuler les situations de pesanteur perpendiculaire à l’axe principale du vagin ou parallèle à celui-ci comme le montre la figure 6.
Fig. 6. — Simulation de mobilité suite à un effort de poussée en position couchée et debout En observant, la figure 6, on peut aisément constater que la déformation de la vessie est très différente en fonction de la position du bassin par rapport à la verticale.
L’outil numérique permet également d’évaluer les intensités des efforts dans les différents ligaments au cours de l’effort de poussée en fonction de la position du bassin comme le montre la figure 7.
On constate en observant la figure 7 que les ligaments les plus sollicités en position debout et couché ne sont pas les mêmes. Dans la situation debout ce sont les ligaments Utéro-sacrés et ombilical alors qu’en situation couché ce sont les ronds et ombilical. Une revue de la littérature corrobore ces résultats. En effet, une étude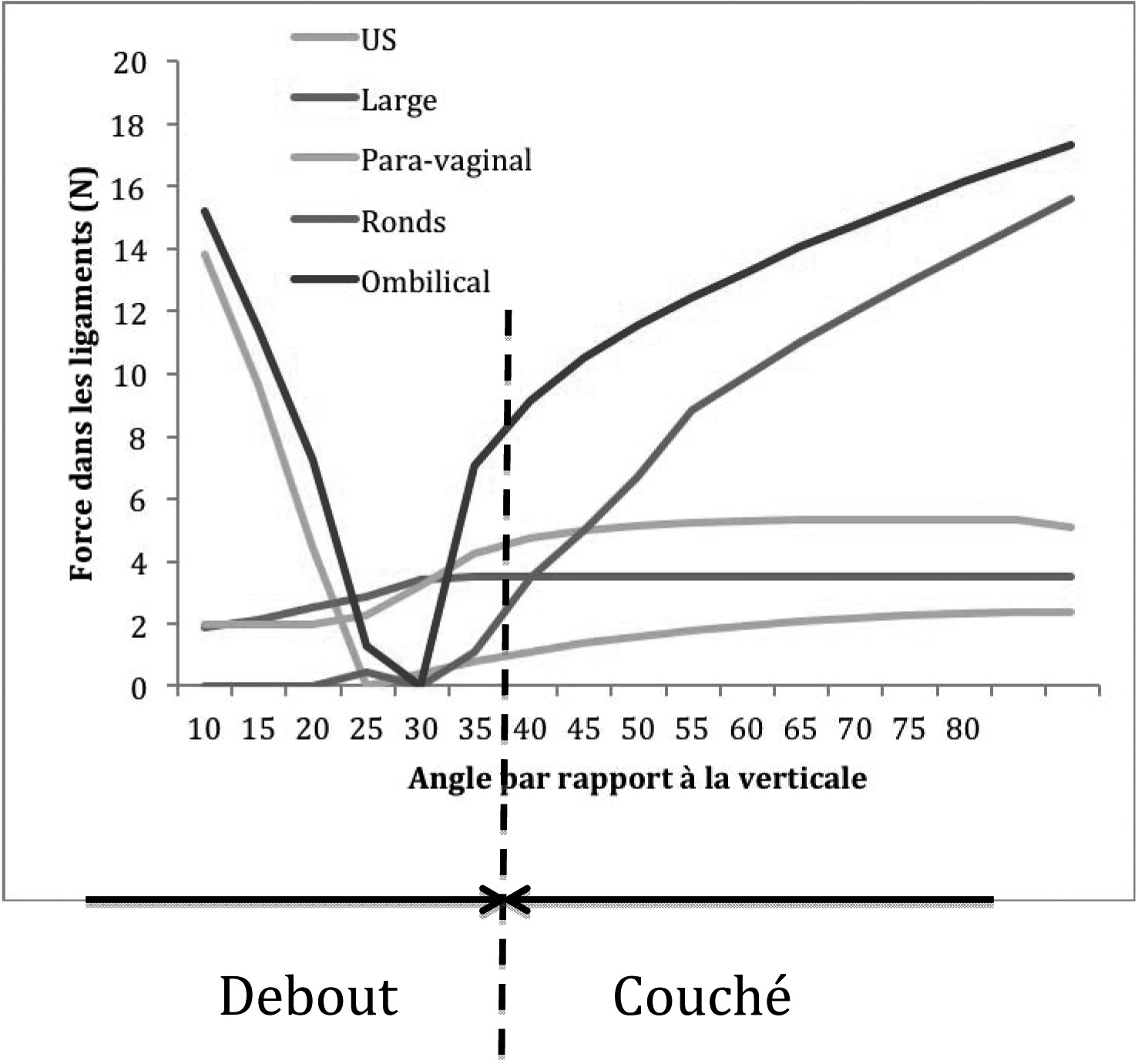
Fig. 7. — Intensité des efforts dans les ligaments en fonction de la position du bassin par rapport à la verticale purement anatomique sur bassin en position debout a conduit De Lancey [12] à supposer que les ligaments utéro-sacrés étaient des acteurs majeurs de la statique pelvienne. Les théories qu’il a formulé se voient confirmées par nos simulations. Par ailleurs, un travail d’anatomie comparé [13] permet de montrer que les quadrupèdes ne possèdent pas de ligaments utéro-sacrés. Cette constatation s’explique par sa contribution négligeable à la statique pelvienne dans cette situation comme le révèlent nos simulations.
CONCLUSIONS ET PERSPECTIVES
Nous disposons actuellement d’un modèle numérique de la cavité pelvienne, basé sur la méthode des éléments finis, en cohérence avec la littérature et sommes capable de quantifier l’erreur de ce modèle vis-à-vis des mobilités évaluées par corrélation des champs de déplacements sur des images IRM.
L’optimisation de ce modèle éléments finis, de manière à minimiser l’écart à la réalité définie sur les images IRM, permet une définition de la topologie du dispo- sitif de soutènement pelvien. Nous obtenons alors un modèle anatomiquement et fonctionnellement cohérent. La méthodologie développée permet de disposer d’un modèle dédié adaptable à toute patiente.
Une prochaine étape consistera à analyser la sensibilité des paramètres du modèle pour identifier ceux auxquels les chercheurs et cliniciens doivent porter une attention particulière. Nous pourrons ainsi par la suite proposer une meilleure interpré- tation des cas cliniques en dégradant les paramètres sensibles du modèle, qu’ils soient topologiques ou mécaniques. Le but à long terme sera de mieux comprendre les mobilités pelviennes et de pouvoir localiser la cause du déséquilibre pelvien à partir d’images IRM dynamiques.
Ce modèle permettra, à terme, d’avoir une meilleure compréhension de la physiopathologie des prolapsus génitaux et de proposer une simulation de correction personnalisée à chaque patiente.
En outre, compte-tenu des progrès réalisés aujourd’hui sur la compréhension des liens existants entre les propriétés mécaniques, histologiques et biochimiques des tissus, on peut espérer prochainement de pouvoir réaliser des simulations permettant de comprendre les problèmes d’endommagement dû au vieillissement et des conditions pathologiques induites pour à terme pouvoir envisager des stratégies de prévention BIBLIOGRAPHIE [1] Samuelsson E., Victor F., Tibblin G., Svardsudd K. — Signs of genital prolapse in a Swedish population of women 20 to 59 years of age and possible related factors. Am. J. Obstet. Gynecol ., 1999,
Vol. 180 , pp. 299-305.
[2] Swift S. — The distribution of pelvis organ support in a population of female subjects seen for routine gynecologic health care. Am. J. Obstet. Gynecol. , 2000, Vol. 183 , pp. 277-85.
[3] Ettema G.J., Goh J.T., Forwood M.R. — A new method to measure elastic properties of plastic-viscoelastic connective tissue. Med. Eng. Phys ., 1998, Vol. 20 , pp. 308-14.
[4] Goh J.T. — Biomechanical properties of prolapsed vaginal tissue in pre and postmenopausal women. Int. Urogynecol. J. Pelvic. Floor Dysfunct , 2002, Vol. 13 , pp. 76-9.
[5] Rubod C., Boukerrou M., Brieu M., Jean-Charles C., Dubois P., Cosson M. — Biomechanical properties of vaginal tissue : preliminary results. Int. Uro. J., 2008, Vol. 19 , Is. 6, pp. 811-816.
[6] Gabriel B., Rubod C., Brieu M., Dedet B., Delandsheere L., Delmas V., Cosson M. — Vagina, Abdominal skin and aponeurosis : Do they have similar biomechanical properties. I.
Uro. J. , 2011.
[7] Gilchrist A.S., Gupta A., Eberhart R.C., Zimmern P.E. — Biomechanical properties of anterior vaginal wall prolapse tissue predict outcome of surgical repair . J. Uro ., 2010, vol. 183 ,
Is. 3, pp. 1069-1073.
[8] Rivaux G., Rubod C., Dedet B., Brieu M., Gabriel B., De Landscheere L., Devos P., Delmas V., Cosson M. — Caractérisation biomécanique des ligaments utérins. Implication en statique, en pelvienne. Pelvi-périnéologie , 2010, 1-8.
[9] Clay J-C., Rubod C., Brieu C., Boukerrou M., Fasel J., Cosson M. — Biomechanical properties of prolapsed or non-prolapsed vaginal tissue : impact on genital prolapse surgery.
International Urogynecology Journal , 2010, 12 , 1535-1538.
[10] Rao G.V., Rubod C., Brieu M., Bhatnagar N., Cosson M. — Experiments and finite element modelling for the study of prolapse in the pelvic floor system. Computer Methods in Biomechanics and Biomedical Engineering , 2010, Vol. 13 , Is. 3, pp 349-357.
[11] Kamina P. — Anatomie Clinique, tome 4, Paris : Maloine, 2008.
[12] Wei J.T., De Lancey J.O. — Functional anatomy of the pelvic floor and lower urinary tract.
Clin. Obstet. Gynecol. , 2004, Mar. 47(1) , 3-17.
[13] Barone R. — Anatomie comparée des mammifères domestiques, tome 4, Paris, Vigot, 2007.
DISCUSSION
M. François-Bernard MICHEL
De vos travaux peut-on retirer une réponse à la question suivante : lors de l’hystérectomie, lorsque le choix est possible, faut-il privilégier l’exérèse partielle, plutôt que la totale, afin de conserver la statique pelvienne ?
Il est certain que l’importance des ligaments utéro sacrés est bien avérée dans notre modèle pour ce qui est de la mobilité du fond vaginal. Ceux-ci seront mieux préservés grâce à une hystérectomie subtotale. La simulation de l’hystérectomie n’a pas encore été faite sur notre modèle mais il s’agit bien entendu d’un objectif majeur qui sera étudié dans les mois à venir. L’intérêt principal de la simulation de l’hystérectomie subtotale ou totale sera plus intéressante étant appliquée à des situations cliniques personnalisée que sur le plan général, et c’est ce que nous chercherons à faire au cours des développements futurs de ce modèle de simulation biomécanique.
M. Gilles CRÉPIN
Est-on en mesure de comparer les données des IRM en fonction debout et les résultats fournis par le modèle ? Peut-on vérifier l’efficacité des différentes procédures de traitement chirurgical par la modélisation ?
Nous n’avons pas pu valider les résultats de la modélisation en position debout en les comparant à une IRM de témoins faite en position debout, car nous n’avons pas encore eu d’accès à une IRM en position debout ce que nous tenterons de faire dans les mois à venir. La simulation de l’efficacité des différentes procédures de traitement chirurgical n’a pas encore été réalisée pour des questions de temps mais fait partie de nos objectifs de l’année 2012. Ces simulations pourront être réalisées sur un modèle générique construit à partir d’une patiente témoin, mais également en situation réelle à partir d’IRM de patiente afin d’obtenir une réponse personnalisée à des situations cliniques spécifiques.
Bull. Acad. Natle Méd., 2011, 195, no 8, 1869-1883, séance du 22 novembre 2011




 •
• 