homeostasis. They regulate their metabolic activity through complex biological and biophysical interactions with the extracellular matrix (ECM). Some mechanotransduction mechanisms are known, while many others no doubt remain to be discovered. Various aspects of chondrocyte mechanobiology have been applied to tissue engineering, with the creation of replacement tissue in vitro from bioresorbable or non-bioresorbable scaffolds and harvested cells. The tissues are maintained in a near-physiologic mechanical and biochemical environment. This paper is an overview of both chondrocyte mechanobiology and cartilage tissue engineering.
INTRODUCTION
Une des propriétés fondamentales des tissus vivants est leur adaptation à l’environnement et aux mouvements. Ces mouvements sont à l’origine de contraintes mécaniques plus ou moins importantes en intensité et en direction (compression, cisaillement, élongation,…) et constituent des stimuli responsables de la modification du comportement biologique des cellules. En effet, il est admis que les contraintes mécaniques retentissent sur la fonctionnalité et le métabolisme cellulaire conduisant ainsi à un remodelage tissulaire adapté. Cette mécanoactivation cellulaire déclenche une cascade de réactions en chaîne ou processus de mécanotransduction qui constitue un signal d’adaptation cellulaire et tissulaire.
Les modifications induites par les forces mécaniques sont maintenant considérées comme déterminantes dans la compréhension de nombreux mécanismes physiopathologiques (arthrose, inflammation, athérosclérose…) mais également dans le déroulement des reconstructions tissulaires.
Aujourd’hui, la régénération de certains tissus de soutien comme l’os et le cartilage est le plus souvent proposée par thérapie cellulaire combinée à un biomatériau vecteur et/ou tuteur, concept encore appelé « ingénierie tissulaire ». Cependant, dans cette nouvelle approche thérapeutique, plusieurs questions restent sans réponse en particulier :
— Le tissu de réparation obtenu acquiert-il et/ou conserve-t-il les propriétés physico-chimiques et biochimiques du tissu natif lorsqu’il est soumis à des contraintes mécaniques ?
— Comment ces contraintes interviennent-elles sur la régulation de l’expression génique des cellules véhiculées dans le site lésionnel par le biomatériau ?
L’objectif de ce travail est d’apporter des éléments de réponse à ces questions dans le cadre de la régénération et de l’ingénierie du cartilage.
HOMÉOSTASIE DU CARTILAGE ARTICULAIRE
Le cartilage est un tissu conjonctif, non innervé dont la capacité de restauration reste faible voire inexistante. Soumis en permanence à des contraintes de pression, il
doit être capable de répondre aux exigences biomécaniques de l’appareil locomoteur.
Il se compose d’une matrice extracellulaire très hydratée formée de protéoglycannes, divers types de collagènes, de glycoprotéines et d’acide hyaluronique. Ces composants sont produits par les chondrocytes, qui représentent environ 10 % du volume cartilagineux. Dans le cartilage articulaire normal, les chondrocytes maintiennent un équilibre entre synthèse et dégradation de la matrice extracellulaire. L’homéostasie est influencée par des facteurs solubles (hormones, vitamines, cytokines, facteurs de croissance) et par l’environnement physico-chimique des chondrocytes et les contraintes mécaniques qui y sont associées. Lorsque cet équilibre est rompu, une dégradation plus ou moins importante du tissu est observée, et abouti à terme soit à des traumatismes accidentels soit à des pathologies dégénératives telles que l’arthrose.
LES CONTRAINTES MÉCANIQUES
Les pressions exercées à la surface des cartilages articulaires sont très variables en fonction du poids de l’individu, de sa tension musculaire et de son activité physique [1]. Des mesures in vivo ont montré qu’en position debout, la pression moyenne s’exerçant sur la hanche d’un patient est de 0,7 MPa (MégaPascal). Lors d’exercices physiques, cette contrainte atteint 5-10 MPa périodique au niveau de la hanche, soit une charge équivalente à 3-8 fois le poids du corps [2-4]. Enfin, cette contrainte peut dépasser 20 MPa lors de mouvements physiques plus intenses comme par exemple un saut [5].
Ces contraintes mécaniques résultent d’une combinaison complexe de mécanismes de tension, de forces de cisaillement et de compression ; le phénomène de compression étant le plus important au sein du cartilage [6]. Ces contraintes mécaniques agissent non seulement sur la matrice extracellulaire mais aussi sur le métabolisme des chondrocytes. Ainsi, il a été montré que dans des conditions extrêmes, telles que l’immobilisation, les capacités de synthèse des chondrocytes ainsi que l’épaisseur du cartilage diminuaient [7, 8]. De même, dans les zones soumises à des contraintes maximales, l’équilibre entre l’anabolisme et le catabolisme du cartilage peut être perturbé, ce qui conduit à l’apparition de pathologies dégénératives telle que l’arthrose [9]. Il est donc nécessaire que pour concevoir un tissu de réparation, il faille trouver un compromis entre l’intensité et la périodicité des contraintes imposées et le temps de mise en charge.
RÉPONSE DES CHONDROCYTES AUX CONTRAINTES MÉCANIQUES
Il est admis que les chondrocytes du cartilage articulaire utilisent les signaux mécaniques pour réguler leur activité métabolique. Des études récentes in vitro se
sont intéressées à la réponse de chondrocytes lorsqu’ils sont soumis à des contraintes mécaniques. Différentes étapes de la réponse des cellules ont été ainsi envisagées : le couplage mécanique et la déformation des chondrocytes, la mécanotransduction, les évènements intracellulaires et la réponse cellulaire.
Le couplage mécanique
Le couplage mécanique implique la transformation de la contrainte externe appliquée en des forces détectables par les cellules. Dans le cas du cartilage, la pression induit non seulement une déformation du tissu mais aussi une circulation de fluide et la naissance d’un potentiel électrocinétique. La compression du cartilage provoque une déformation de la matrice extracellulaire avec une orientation des fibres de collagène, mais aussi des modifications morphologique des cellules [10, 11]. Guilak et col. ont montré que lors d’une compression du cartilage, la taille et le volume des cellules variaient en fonction des contraintes locales [12]. Il a également été démontré une variation de la taille et du volume du noyau suggérant un lien entre la matrice extracellulaire et le noyau, permettant de convertir le signal mécanique en message intracellulaire [13]. D’autres modifications de l’environnement extracellulaire surviennent à la suite de l’application d’une contrainte mécanique avec mouvement de liquide, lequel induit des mouvements ioniques (apparition d’un potentiel électrocinétique) [14]. Tous ces signaux physiques sont détectables par les chondrocytes et peuvent influencer l’activité métabolique ainsi que l’expression des gènes (Figure 1).
Enfin, les mouvements de solutés induits par les contraintes mécaniques peuvent aussi modifier les concentrations locales en facteurs de croissance ou en cytokines au sein de la matrice extracellulaire conduisant ainsi à une modification du métabolisme cellulaire [15].
La mécanotransduction
La mécanotransduction est la transformation des signaux mécaniques ou physiques en un signal biochimique. Plusieurs voies de signalisation ont été identifiées au niveau de la membrane plasmique des chondrocytes : une voie purement mécanique, c’est la voie de signalisation matrice extracellulaire-intégrine-cytosquelette-noyau [16] et une voie non spécifiques via des méchanotransducteurs tels que les canaux ioniques, les protéines G, les récepteurs tyrosine kinase…[17-19]. Les intégrines sont considérées à la fois comme des mécanotransducteurs permettant l’activation de certaines voies de transduction du signal comme celle des FAK (Focal Adhesion Kinases), mais également comme mécanotransmetteurs. En effet, ces molécules sont capables d’enregistrer directement le signal de la déformation mécanique de la matrice extracellulaire et de transmettre, via le cytosquelette, l’information au noyau de la cellule [20]. Les processus de transport ionique sont également dépendants de la contrainte mécanique appliquée. Des études de mécanotransduction chez les chondrocytes et les fibroblastes ont montré que les ions Na+, les premiers à pénétrer dans la cellule, provoquent une dépolarisation de la membrane. Cette dépolarisation
est suivie d’une augmentation de la concentration intracellulaire en ions Ca2+, causant alors une hyperpolarisation de la membrane. Les canaux K+ sont alors activés afin de retrouver le potentiel de membrane basal [21]. Ces mouvements ioniques correspondent aux premiers évènements de transduction du signal et seraient stimulés par la déformation de la membrane au cours de contraintes mécaniques [22, 23].
Evènements intracellulaires
Les contraintes mécaniques peuvent influencer la synthèse d’un certain nombre de facteurs impliqués dans l’homéostasie de la matrice extracellulaire via des évènements intracellulaires. Ces derniers conduisent, par des mécanismes encore mal connus, à une activation transcriptionnelle. Il en résulte une synthèse ou une dégradation des protéines matricielles (Figure 1). Ainsi, une production de cytokines anti-inflammatoires mais aussi de médiateurs de l’inflammation (NO et PGE ) a 2 été observée en réponse à une compression, une pression hydrostatique, aux contraintes de cisaillement ou d’étirement [24, 25]. D’autres études ont également montré que les contraintes mécaniques pouvaient modifier l’expression des gènes du TGF-β (Transforming Growth Factor), de l’IL-1β, des métalloprotéases 1, 2, 3 et 9 (respectivement MMP-1, MMP-2, MMP-3 et MMP-9), de l’inhibiteur des MMP-2, de l’isoforme inductible de NO synthase (iNOS), de la cyclo-oxygenase II (COX-II) [26-28]. L’IL-1β et les MMP ont plutôt un effet pro-catabolique, alors que le TGF-β et les TIMP ont plutôt un effet bénéfique sur la production et la qualité des protéines matricielles néosynthétisées. Les contraintes mécaniques peuvent également induire l’expression de « heat shock protein 70 » (Hsp 70) [29]. Le groupe des Hsp 70 semble particulièrement intéressant car il est impliqué dans le contrôle qualité, l’assemblage et le trafic des protéines en voie de synthèse. Il semble alors avoir une grande importance dans la qualité de la matrice extracellulaire néosynthétisée.
Expression des protéines matricielles
Enfin, la dernière étape de la réponse des chondrocytes aux contraintes mécaniques est l’expression des protéines matricielles. Les premiers résultats réalisés sur des explants ont permis de montrer que les contraintes dynamiques avaient plutôt un effet anabolique sur la synthèse des protéines matricielles, alors que des contraintes statiques avaient systématiquement un effet catabolique [15, 30]. Puis les protocoles se sont affinés, permettant l’étude de l’influence de l’intensité et surtout de la fréquence d’une stimulation mécanique cyclique. Pour des fréquences élevées, on observe une diminution des phénomènes anaboliques (diminution de la production de protéines matricielles) à l’inverse des effets observés à des fréquences plus faibles.
Concernant la compression statique, quelle que soit l’intensité ou la durée, une inhibition ou une diminution des activités métaboliques, telles que la synthèse des protéoglycannes, des collagènes ou encore la synthèse d’ADN sont toujours obser-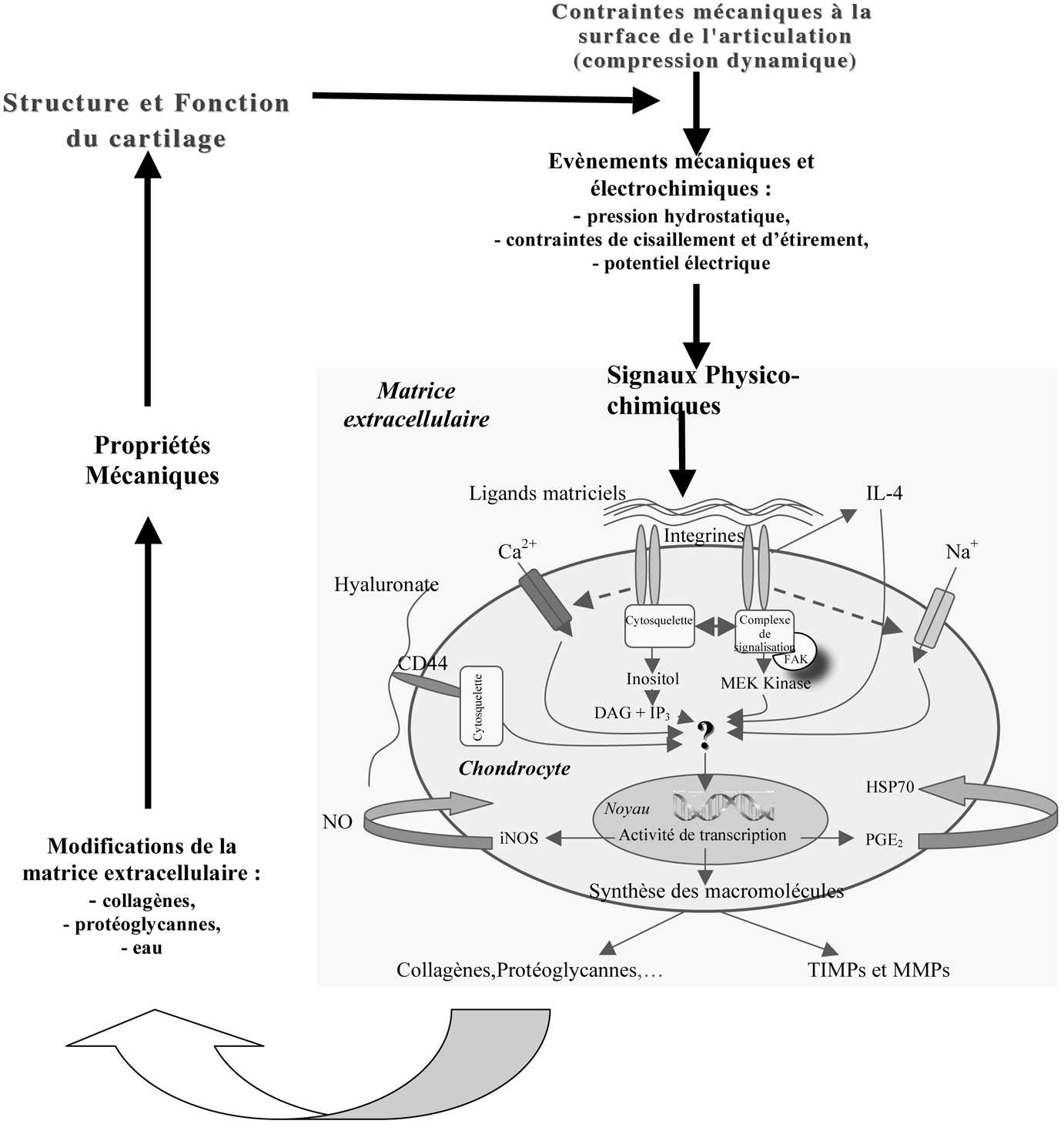
FIG. 1. — Relation entre la structure du cartilage, les signaux mécaniques et électrochimiques et les activités métaboliques des chondrocytes.
vées [31-33]. Le cartilage apparaît donc comme étant un tissu mécanosensible. Ainsi, il semble que les stimulations dynamiques soient plutôt bénéfiques alors que les stimulations statiques plutôt délétères pour la matrice extracellulaire. Des investigations plus poussées de la réponse des chondrocytes aux contraintes mécaniques sont encore nécessaires aussi bien pour la compréhension des phénomènes de dégénérescence du cartilage articulaire, que pour la conception de nouveaux biomatériaux chondro-réparateurs.
INGÉNIERIE TISSULAIRE DU CARTILAGE
Contexte et enjeux
Au cours de certaines atteintes articulaires (traumatismes accidentels ou pathologies dégénératives telles que l’arthrose) on assiste à une dégradation plus ou moins importante du cartilage, qui est incapable de se régénérer. Dans le cadre de lésions ostéochondrales sévères et profondes, le recours à un acte chirurgical est souvent envisagé, surtout lorsqu’il s’agit d’adulte jeune et sportif. Parmi ces traitements, nous pouvons citer les abrasions, les stimulations médullaires, les greffes chondrocytaires… L’objectif de ces techniques est de restaurer l’intégrité articulaire et de permettre un mouvement sans douleur aussi ample que possible. Or, ces techniques conduisent le plus souvent à la création d’un tissu de réparation fibrocartilagineuse dont la stabilité dans le temps est médiocre. D’autres restent encore marginales en raison de leur coût trop élevé et des compétences chirurgicales particulières qu’elles imposent (greffe chondrocytaire). A l’heure actuelle, de nombreuses recherches sont donc menées pour développer de nouveaux traitements des lésions ostéochondrales.
Les plus innovantes font appel au concept d’ingénierie tissulaire, qui consiste à ensemencer un biomatériau avec des chondrocytes ou des cellules progénitrices, pour préparer in vitro une matrice cartilagineuse réimplantable. Dans ce concept, le biomatériau doit avoir la capacité de s’intégrer parfaitement au cartilage situé en périphérie du site lésionnel. Il sert ainsi de tuteur à la synthèse du tissu de réparation.
Toutefois, la fonctionnalité de ce dernier est liée, d’une part, à l’apport exogène ou à la présence endogène de facteurs de croissance au niveau du site lésionnel, et d’autre part, aux propriétés mécaniques du biomatériau pour résister aux conditions de charge imposées par les mouvements de l’articulation. Cette nouvelle voie thérapeutique devrait permettre à terme de s’affranchir de certains problèmes, comme le manque de donneurs ou encore le risque de transmission virale.
Les biomatériaux
Le support idéal doit être entre autre biocompatible, non toxique, biofonctionnel, biodégradable et facile à concevoir. L’inclusion de chondrocytes cultivés en trois dimensions (3D) dans une matrice permet d’apporter un environnement propice à la différenciation cellulaire et d’assurer le maintien des cellules dans la lésion (Figure 2). Ainsi, différents supports d’origine synthétique, organique ou encore des biomatériaux hybrides ont été étudiés [34, 35]. Parmi les composés synthétiques, nous pouvons citer les polymères d’acides polylactique et polyglycolique. Les supports d’origine organique se composent de fibrine, de collagène (type I ou II). Les collagènes peuvent être utilisés soit sous forme d’hydrogels, soit sous forme d’éponge. Des études ont montré que des éponges de collagènes induisaient une prolifération cellulaire ainsi qu’une synthèse de collagène et de protéoglycanes supérieure aux hydrogels de collagène. Enfin un dernier type de biomatériau d’ori-
FIG. 2. — Principe de l’ingénierie tissulaire du cartilage.
gine organique peut être utilisé ; il s’agit des polymères polysaccharidiques tels que les hydrogels. Les hydrogels sont des matériaux constitués de polymères réticulés qui ont la particularité d’absorber une grande quantité d’eau. D’un point de vue mécanique, les hydrogels présentent l’avantage d’utiliser l’eau de la même façon que le cartilage [36]. Sous l’action de compression, l’eau sort de l’hydrogel, ce qui permet à ce dernier d’absorber le choc. Puis, une fois la contrainte relâchée, l’eau reprend sa place dans le matériau et celui-ci retrouve son volume initial. D’un point de vue biologique, les hydrogels offrent un environnement 3D suffisamment poreux pour permettre la prolifération cellulaire ainsi que le transport des nutriments.
Parmi les hydrogels, les hydrogels d’alginate de sodium (Alg) constituent un modèle de référence pour des études de morphologie cellulaire, de synthèse des protéoglycannes et de collagènes [37] mais aussi, de mécanobiologie des chondrocytes articulaires [38, 39]. Bien que l’alginate de sodium ne soit pas un composant naturel de la matrice extracellulaire, il présente une structure similaire à celle des glycosaminoglycannes du cartilage. Dans de précédentes études, nous avons décrit cet hydrogel comme étant un matériau idéal pour le maintien du phénotype chondrocytaire [40-42].
En ingénierie du cartilage, l’un des problèmes majeur à résoudre est de disposer d’un biomatériau avec des caractéristiques biomécaniques optimales. Dans ce cadre, plusieurs domaines de recherche peuvent être menés :
— la biomécanique cellulaire, notamment l’étude des réactions des chondrocytes aux diverses stimulations mécaniques rencontrées dans l’articulation ou encore l’étude de la biologie de l’inflammation en présence de biomatériaux…
— le développement de matériaux nouveaux possédant des groupements susceptibles d’interagir avec les cellules…
Les cellules
Plusieurs types de cellules ont été décrits pour leur application potentielle en ingénierie tissulaire du cartilage telles que les cellules matures (les chondrocytes) ou des cellules plus précoces (cellules souches embryonnaires ou cellules souches mésenchymateuses). Chacun de ces types cellulaires possède des avantages et des inconvénients dans leur utilisation (propriétés biologiques intrinsèques, problèmes d’éthique).
Ainsi, l’utilisation de chondrocytes autologues dans la réparation du cartilage pose le problème de leur dédifférenciation au cours de l’amplification ex-vivo . Cette nécessité de cultiver en monocouche les cellules afin de les multiplier est à l’origine de la perte du phénotype chondrocytaire vers un phénotype fibroblastique. Afin d’éviter ce phénomène de dédifférentiation, les études récentes sur l’ingénierie tissulaire du cartilage utilise des cellules plus précoces : les cellules souches mésenchymateuses (CSM). Ces cellules sont capables de se différentier en de nombreux tissus dont l’os, le cartilage, les tendons, les muscles… [43]. Les mécanismes de différentiation des CSM en chondrocytes restent mal connus. Cependant, plusieurs études ont montré l’intérêt des facteurs de croissance tels que le TGF-β1 dans des cultures en monocouches mais aussi des BMP-2, —6 et —7 [44, 45]. Angele et col. ont également montré l’effet bénéfique des contraintes mécaniques sur les CSM dans la chondrogénèse d’une part ainsi que dans la qualité de la matrice néoformée d’autre part [46].
CONCLUSION
L’objectif de ce travail était d’étudier la mécanobiologie des chondrocytes, cellules soumises à différentes contraintes mécaniques in vivo . A travers les différentes études réalisées sur le cartilage articulaire, il est maintenant admis que ces contraintes agissent non seulement sur la synthèse de la matrice extracellulaire mais aussi sur la fonctionnalité des cellules via un phénomène de mécanotransduction. Ces stimulations mécaniques représentent donc un paramètre fondamental pour le développement de l’ingénierie tissulaire, puisqu’elles conditionnent la qualité de la matrice cartilagineuse néo-synthétisée.
D’autre part, l’évolution constante des matériaux-supports, associant diverses disciplines (biomécanique, physique, chimie, biologie moléculaire…) fournit une structure tridimensionnelle et un site d’adhésion cellulaire propices au dépôt d’une matrice extracellulaire de type cartilagineuse. Ces supports doivent améliorer la durabilité de la zone réparée et la protéger des chocs liés aux mouvements de l’articulation.
BIBLIOGRAPHIE [1] KIVIRANTA I., TAMMI M., JURVELIN J., SAAMANEN A.M., HELMINEN H.J. — Moderate running exercise augments glycosaminoglycans and thickness of articular cartilage in the knee joint of young beagle dogs. J. Orthop. Res ., 1988, 6, 188-195.
[2] BERGMANN G., DEURETZBACHER G., HELLER M., GRAICHEN F., ROHLMANN A., STRAUSS J.
et al. — Hip contact forces and gait patterns from routine activities. J. Biomech ., 2001, 34, 859-871.
[3] AFOKE N.Y., BYERS P.D., HUTTON W.C. — Contact pressures in the human hip joint. J. Bone
Joint. Surg. Br ., 1987, 69 , 536-541.
[4] ADAMS D., SWANSON S.A. — Direct measurement of local pressures in the cadaveric human hip joint during simulated level walking. Ann. Rheum. Dis ., 1985, 44 , 658-666.
[5] HODGE W.A., CARLSON K.L., FIJAN R.S., BURGESS R.G., RILEY P.O. et al. — Contact pressures from an instrumented hip endoprosthesis.
J. Bone Joint. Surg. Am ., 1989, 71 , 1378-1386.
[6] FRANK E.H., JIN M., LOENING A.M., LEVENSTON M.E., GRODZINSKY A.J. — A versatile shear and compression apparatus for mechanical stimulation of tissue culture explants. J. Biomech ., 2000, 33 , 1523-1527.
[7] AROKOSKI J.P., HYTTINEN M.M., LAPVETELAINEN T., TAKACS P., KOSZTACZKY B. et al. —
Decreased birefringence of the superficial zone collagen network in the canine knee (stifle) articular cartilage after long distance running training detected by quantitative polarised light microscopy. Ann. Rheum. Dis ., 1996, 55 , 253-264.
[8] SAAMAMEN A.M., KIVIRANTA I., JURVELIN J., HELMINEN H.J., TAMMI M. — Proteoglycan and collagen alterations in canine knee articular cartilage following 20 km daily running exercise for 15 weeks. Connect.. Tissue Res ., 1994, 30 , 191-201.
[9] DIEPPE P., KIRWAN J. — The localization of osteoarthritis.
Br. J. Rheumatol ., 1994, 33 , 201-203.
[10] KAAB M.J., RICHARDS R.G., ITO K., GWYNN I., NOTZLI H.P. — Deformation of chondrocytes in articular cartilage under compressive load : a morphological study. Cells Tissues Organs ., 2003, 175 , 133-139.
[11] LEE D.A., KNIGHT M.M., BOLTON J.F., IDOWU B.D., KAYSER M.V., BADER D.L. — Chondrocyte deformation within compressed agarose constructs at the cellular and sub-cellular levels. J.
Biomech ., 2000, 33 , 81-95.
[12] GUILAK F. — Volume and surface area measurement of viable chondrocytes in situ using geometric modelling of serial confocal sections.
J. Microsc ., 1994, 173 , 245-256.
[13] GUILAK F. — Compression-induced changes in the shape and volume of the chondrocyte nucleus. J. Biomech ., 1995, 28 , 1529-1541.
[14] WANG C.C., GUO X.E., SUN D., MOW V.C., ATESHIAN G.A., HUNG C.T. — The functional environment of chondrocytes within cartilage subjected to compressive loading : a theoretical and experimental approach. Biorheology , 2002, 39 , 11-25.
[15] O’HARA B.P., URBAN J.P., MAROUDAS A. — Influence of cyclic loading on the nutrition of articular cartilage. Ann. Rheum. Dis ., 1990, 49 , 536-539.
[16] LUCCHINETTI E., BHARGAVA M.M., TORZILLI P.A. — The effect of mechanical load on integrin subunits alpha5 and beta1 in chondrocytes from mature and immature cartilage explants. Cell Tissue Res ., 2004, 315 , 385-391.
[17] WRIGHT M., JOBANPUTRA P., BAVINGTON C., SALTER D.M., NUKI G. — Effects of intermittent pressure-induced strain on the electrophysiology of cultured human chondrocytes : evidence for the presence of stretch-activated membrane ion channels. Clin. Sci. (Lond), 1996, 90 , 61-71.
[18] YELLOWLEY C.E., JACOBS C.R., DONAHUE H.J. — Mechanisms contributing to fluid-flowinduced Ca2+ mobilization in articular chondrocytes. J. Cell Physiol ., 1999, 180 , 402-408.
[19] WILKINS R.J., BROWNING J.A., URBAN J.P. — Chondrocyte regulation by mechanical load.
Biorheology, 2000, 37 , 67-74.
[20] MILLWARD-SADLER S.J., SALTER D.M. — Integrin-dependent signal cascades in chondrocyte mechanotransduction. Ann. Biomed. Eng ., 2004, 32 , 435-446.
[21] SUGIMOTO T., YOSHINO M., NAGAO M., ISHII S., YABU H. — Voltage-gated ionic channels in cultured rabbit articular chondrocytes. Comp. Biochem. Physiol. C. Pharmacol. Toxicol. Endocrinol ., 1996, 115 , 223-232.
[22] GUILAK F., ZELL R.A., ERICKSON G.R., GRANDE D.A., RUBIN C.T. et al . — Mechanically induced calcium waves in articular chondrocytes are inhibited by gadolinium and amiloride.
J.
Orthop. Res ., 1999, 17 , 421-429.
[23] D’ANDREA P., VITTUR F. — Ca2+ oscillations and intercellular Ca2+ waves in ATP-stimulated articular chondrocytes. J. Bone Miner. Res ., 1996 a, 11 , 946-954.
[24] SALTER D.M., MILLWARD-SADLER S.J., NUKI G., WRIGHT M.O. — Differential responses of chondrocytes from normal and osteoarthritic human articular cartilage to mechanical stimulation. Biorheology , 2002, 39 , 97-108.
[25] MILLWARD-SADLER S.J., WRIGHT M.O., LEE H., NISHIDA K., CALDWELL H. et al. — Integrinregulated secretion of interleukin 4 : A novel pathway of mechanotransduction in human articular chondrocytes. J. Cell Biol ., 1999, 145 , 183-189.
[26] FUJISAWA T., HATTORI T., TAKAHASHI K., KUBOKI T., YAMASHITA A., TAKIGAWA M. — Cyclic mechanical stress induces extracellular matrix degradation in cultured chondrocytes via gene expression of matrix metalloproteinases and interleukin-1. J. Biochem ., 1999, 125 , 966-975.
[27] GASSNER R., BUCKLEY M.J., GEORGESCU H., STUDER R., STEFANOVICH-RACIC M. et al. — Cyclic tensile stress exerts antiinflammatory actions on chondrocytes by inhibiting inducible nitric oxide synthase. J. Immunol ., 1999, 163 , 2187-2192.
[28] XU Z., BUCKLEY M.J., EVANS C.H., AGARWAL S. — Cyclic tensile strain acts as an antagonist of IL-1 beta actions in chondrocytes. J. Immunol ., 2000, 165 , 453-460.
[29] KAARNIRANTA K., ELO M., SIRONEN R., LAMMI M.J., GOLDRING M.B. et al. — Hsp70 accumulation in chondrocytic cells exposed to high continuous hydrostatic pressure coincides with mRNA stabilization rather than transcriptional activation. Proc. Natl. Acad. Sci., U S A. 1998, 95 , 2319-2324.
[30] GRAY M.L., PIZZANELLI A.M., GRODZINSKY A.J., LEE R.C. — Mechanical and physiochemical determinants of the chondrocyte biosynthetic response. J. Orthop. Res ., 1988, 6 , 777-792.
[31] LI K.W., FALCOVITZ Y.H., NAGRAMPA J.P., CHEN A.C., LOTTMAN L.M. et al. — Mechanical compression modulates proliferation of transplanted chondrocytes.
J. Orthop. Res ., 2000, 18, 374-382.
[32] RAGAN P.M., BADGER A.M., COOK M., CHIN V.I., GOWEN M. et al. — Down-regulation of chondrocyte aggrecan and type-II collagen gene expression correlates with increases in static compression magnitude and duration. J. Orthop. Res ., 1999, 17 , 836-842.
[33] LEE D.A., BADER D.L. — Compressive strains at physiological frequencies influence the metabolism of chondrocytes seeded in agarose. J. Orthop. Res ., 1997, 15 , 181-188.
[34] CANCEDDA R., DOZIN B., GIANNONI P., QUARTO R. — Tissue engineering and cell therapy of cartilage and bone. Matrix Biol ., 2003, 22 , 81-91.
[35] CORKHILL P.H., FITTON J.H., TIGHE B.J. — Towards a synthetic articular cartilage.
J. Biomater.
Sci. Polym. Ed., 1993, 4 , 615-630.
[36] HAUSELMANN H.J., AYDELOTTE M.B., SCHUMACHER B.L., KUETTNER K.E., GITELIS S.H., THONAR E.J. — Synthesis and turnover of proteoglycans by human and bovine adult articular chondrocytes cultured in alginate beads. Matrix, 1992, 12 , 116-129.
[37] WONG M., SIEGRIST M., WANG X., HUNZIKER E. — Development of mechanically stable alginate/chondrocyte constructs : effects of guluronic acid content and matrix synthesis. J.
Orthop. Res ., 2001, 19 , 493-499.
[38] RAGAN P.M., CHIN V.I., HUNG H.H., MASUDA K. THONAR E.J. et al. — Chondrocyte extracellular matrix synthesis and turnover are influenced by static compression in a new alginate disk culture system. Arch. Biochem. Biophys ., 2000, 383 , 256-264.
[39] FRAGONAS E., VALENTE M., POZZI-MUCELLI M., TOFFANIN R., RIZZO R. et al . — Articular cartilage repair in rabbits by using suspensions of allogenic chondrocytes in alginate.
Biomaterials , 2000, 21 , 795-801.
[40] GIGANT-HUSELSTEIN C., DUMAS D., HUBERT P., BAPTISTE D., DELLACHERIE E. et al. — Influence of mechanical stress on extracellular matrixes synthezed by chondrocytes seeded onto alginate and hyaluronate-based 3D biosystems. JMMB , 2003, 3 , 59-70.
[41] OERTHER S., LE GALL H., PAYAN E., LAPICQUE F., PRESLE N. et al . — Hyaluronate-alginate gel as a novel biomaterial : mechanical properties and formation mechanism.
Biotechnol. Bioeng ., 1999, 63 , 206-215.
[42] MIRALLES G., BAUDOIN R., DUMAS D., BAPTISTE D., HUBERT P., STOLTZ J.F., DELLACHERIE E. et al. — Sodium alginate sponges with or without sodium hyaluronate : in vitro engineering of cartilage.
J. Biomed. Mater. Res ., 2001, 57 , 268-278.
[43] ROUFOSSE C.A., DIREKZE N.C., OTTO W.R., WRIGHT N.A. — Circulating mesenchymal stem cells. Int. J. Biochem. Cell. Biol., 2004, 36 , 585-597.
[44] SEKIYA I., COLTER D.C., PROCKOP D.J. — BMP-6 enhances chondrogenesis in a subpopulation of human marrow stromal cells. Biochem. Biophys. Res. Commun ., 2001, 284 , 411-418.
[45] SCHMITT B., RINGE J., HAUPL T., NOTTER M., MANZ R. et al. — BMP2 initiates chondrogenic lineage development of adult human mesenchymal stem cells in high-density culture.
Differentiation , 2003, 71 , 567-577.
[46] ANGELE P., YOO J.U., SMITH C., MANSOUR J., JEPSEN K.J. et al. — Cyclic hydrostatic pressure enhances the chondrogenic phenotype of human mesenchymal progenitor cells differentiated in vitro . J. Orthop. Res . 2003, 21 , 451-457.
DISCUSSION
M. Jacques BATTIN
On connaît nombre d’éléments intervenant dans la prolifération des chondrocytes du cartilage de croissance, dont les gènes du développement. Mais on a des difficultés à
comprendre l’inégalité d’activité du cartilage selon les os longs. Avez-vous réfléchi à cette question ?
Je ne peux répondre avec précision à cette question car la majorité des études de mécanobiologie publiées sont centrées sur le cartilage articulaire (tête fémorale en particulier). Bien entendu, des expériences vérifiant le rôle des gènes du développement seraient intéressantes M. Michel BOUREL
Quel procédé pour obtenir ‘‘ la contrainte ’’ (modification ou pression en milieu de culture ?) Quelles différences en fonction de l’origine des chondrocytes (articulaire, costal, oreilles) ? Quel apport de la culture des chondrocytes en trois dimensions ?
Nous avons appliqué trois types de contraintes : compression standardisée et contraintes de cisaillement dans des équipements conçus au laboratoire et entrechoquement de structures 3D (type lit fluidisé). Il faut remarquer que, contrairement à d’autre cellules, l’effet de contraintes de cisaillement est faible. On peut donc penser que la circulation de fluide lors de la compression n’est pas un élément déterminant dans les processus de mécanotransduction . Comme pour la question précédente, la majorité des études utilise des chondrocytes d’origine articulaire. Très peu d’études ont été réalisées sur d’autre type de chondrocyte et aucune à ma connaissance sur le cartilage de l’oreille. La culture de cellules en 3D est fondamentale afin d’éviter des modifications phénotypiques.
M. Louis AUQUIER
Dans une séance consacrée à la mécanotransduction à l’institut de rhumatologie à l’hôpital Cochin, il a été montré que le chondrocyte était sensible, dans son développement normal, à une pression moyenne, ni trop, ni trop peu, ce qui n’est pas sans conséquence sur les traitements envisagés sur le cartilage dans diverses situations pathologiques. Existe-t-il un moyen de mesurer de cette pression optimale ?
Effectivement, une absence de pression (immobilisation ; cosmonautes) ainsi qu’une compression élevée (supérieur 20 MPa) ont des effets délétères. Il en est de même des fréquences élevées ou d’une compression statique. Quelques études chez l’animal reportent des résultats sur la mesure de pression in vivo par incorporation d’un capteur de pression avec télétransmission. Chez l’homme des mesures ont été effectuées en Allemagne sur des prothèses de hanches, mais dans ce cas, l’étude avait pour but de suivre la consolidation de prothèse.
M. Jean-Pierre NICOLAS
Y a-t-il des modifications du comportement des chondrocytes sous contrainte mécanique au cours de l’arthrose ?
Oui des modifications de comportement du chondrocyte sont observées au cours de l’arthrose (en particulier, propriétés de synthèse de la matrice). Des modifications phé- notypiques ont été également décrites.
Mme Monique ADOLPHE
Avez-vous comparé vos résultats avec les essais effectués sur les cosmonautes ?
Malheureusement non, mais je n’ai pas de connaissance de travaux dans ce domaine sur les cosmonautes.
M. Pierre GODEAU
Comment intervient le rôle de l’os sous chondral (exemple : arthrose du genou) dans les contraintes mécaniques imposées aux chondrocytes ? Le rôle favorable de l’activité physique avec appui plantaire pour éviter l’ostéoporose n’est-il pas pris en contradiction avec le rôle défavorable sur le cartilage ?
Quelques études ont été réalisées sur l’adaptation de l’os sous chondral dans l’arthrose.
Des travaux récents ont décrit un phénomène d’adaptation de l’os sous chondral et une tendance à la sclérose de celui-ci.
M. Charles-Joël MENKÈS
Le cartilage obtenu au laboratoire peut-il s’intégrer facilement au cartilage articulaire normal ? Peut-on stériliser sans problème le produit obtenu ? Y a-t-il un risque de contamination ?
En principe, oui mais cela doit dépendre de la matrice support de départ. Pour la production, les services de thérapie cellulaire ayant une autorisation AFSSAPS de niveau 3 pourraient préparer un tel tissu. Le problème sera surtout réglementaire en particulier pour la validation des produits thérapeutiques annexes utilisés (matrice initiale, milieux de culture…) M. Jean DUBOUSSET
Avez-vous expérimenté des variations de fréquence entre genou et dépression quelles ont été leurs conséquences sur la culture des chrondrocytes ?
Non mais il s’agit d’une suggestion intéressante que nous ne manquerons pas d’envisager.
M. Jean-Baptiste PAOLAGGI
Dans le cadre de l’arthrose, il est certain que les contraintes mécaniques jouent un rôle, en particulier par exemple, dans l’hypertension que subit le cartilage dans les dysplasies de hanche. Par contre, comment admettre que les contraintes mécaniques puissent être responsables des nodosités arthrosiques des doigts ? D’autres mécanismes peuvent être en cause.
Bien entendu, les facteurs conduisant à l’arthrose sont multiples et dans l’exemple que vous citez les facteurs mécaniques ne doivent pas être prédominants.
Bull. Acad. Natle Méd., 2005, 189, no 8, 1803-1816, séance du 29 novembre 2005


