Résumé
Le but de l’étude a été d’évaluer les variations de l’expression immunohistochimique de la protéine PTEN sur prélèvement de l’endomètre effectué pour métrorragies, afin d’identifier les néoplasies endométriales monoclonales débutantes au stade intra-épithélial. La détection immunohistochimique de l’anti PTEN a été effectuée sur coupes en paraffine. La quantification de l’immunomarquage a été prise en compte uniquement dans les cellules épithéliales bordant les structures glandulaires. La technique immunohistochimique utilisée est standardisée sur automate Ventana Benchmark anticorps primaire anti PTEN (2-8 H6). L’étude rétrospective a porté sur 45 échantillons d’endomètre normal prolifératif, 42 néoplasies glandulaires intra-épithéliales, 55 carcinomes de l’endomètre dont 30 orthoplasiques endométrioïdes, 10 à cellules claires, 5 séreux papillaires, 5 adénosquameux et 5 tumeurs mixtes. Les résultats montrent une très forte positivité nucléaire dans les cellules épithéliales de l’endomètre normal prolifératif et une disparition ou réduction significative de l’immunomarquage, dans 40/42 néoplasies glandulaires intra-épithéliales, 23/30 carcinomes endométriaux orthoplasiques, alors qu’une positivité persistante a été observée dans la majorité des carcinomes non endométrioïdes (23/25). Ces résultats montrent une forte spécificité de la perte ou d’une forte réduction de l’expression de la protéine PTEN dans les proliférations endométriales néoplasiques débutantes (néoplasies glandulaires intraépithéliales/hyperplasies atypiques) et carcinomes endométriaux endométrioïdes orthoplasiques (adénocarcinomes de type I). De ces résultats, il ressort que ( i ) l’expression immunohistochimique sur coupes de tissu de la protéine PTEN constitue un outil diagnostique très spécifique (p < 0.001) permettant de distinguer les néoplasies endométriales monoclonales débutantes, des hyperplasies simples liées à une stimulation oestrogénique incontrôlée, outil d’autant plus pertinent en pratique diagnostique que les critères morphologiques courants ne permettent pas d’assurer un diagnostic reproductible des néoplasies glandulaires intra-épithéliales. (ii) l’association des critères morphologiques sur colorations standard (augmentation du rapport glandes/stroma, démarcation des anomalies architecturales et cytologiques) à la perte ou réduction de l’expression PTEN permettent un diagnostic plus précis et reproductible, permettant une meilleure prise en charge des patientes, comme cela l’a été récemment proposé [1]. MOTS CLÉS : HYPERPLASIE ENDOMETRE. MÉNOPAUSE. IMMUNOHISTOCHIMIE.
Summary
We examined immunohistochemical PTEN protein expression in endometrial samples obtained from perimenopausal women with uterine bleeding in order to diagnose early endometrial neoplasia. Paraffin sections of endometrial samples (biopsies, endometrium resection, hysterectomy) were reviewed and tested for immunocytochemical PTEN expression by epithelial cells. Immunohistochemical studies were performed with the Ventana Benchmark device and the immunoperoxidase technique with monoclonal anti-PTEN (6H2.1/Cascade Biosciences). We studied 45 samples of proliferative endometria, 42 samples of atypical hyperplasia (neoplasia), and 55 samples of endometrial carcinomas (30 endometrioid, 5 serous papillary, 10 clear cell, 5 adenosquamous, and 5 MMMT). A strong positive PTEN immunoreaction was observed in all 45 normal proliferative endometria, 2/30 endometrioid carcinomas, and 23/25 non endometrioid carcinomas. In contrast, PTEN immunoexpression was negative or weak in 40/42 atypical hyperplasia and 28/30 endometrioid carcinomas. Negative or weak PTEN expression correlated with endometrial neoplasia (atypical proliferation) (p < 0.001). Thus ( i ) PTEN immunoexpression in endometrial paraffin sections is a new diagnostic tool, distinguishing PTEN-positive cyclic abnormal monoclonal proliferative endometrium (anovulatory, non atypical, simple and complex hyperplasia) from PTEN-negative (or decreased) endometrial neoplasia, and especially early endometrial neoplasia (atypical simple and complex hyperplasia, in situ carcinoma, superficial carcinoma with focal invasion). ( ii ) Given the lack of reproducibility of histological identification of atypical (precancerous invasive) and non atypical (precancerous non invasive) endometrial hyperplasia, the new criteria (PTEN-negative crowded glands, gland/stroma ratio > 55 %, nuclear pleomorphism, in areas > 1 mm) recently proposed to diagnose early endometrial neoplasia appear to be clinically relevant [1]. KEY WORDS (Index Medicus) : ENDOMETRIAL HYPERPLASIA. MENOPAUSE. IMMUNOCYTOCHEMISTRY.
INTRODUCTION
Les carcinomes de l’endomètre sont de deux types [1]. Le type I (orthoplasique, endométrioïde) se développe chez les femmes en périodes pré et périménopausique, coexiste ou est précédé le plus souvent d’une hyperplasie endométriale complexe et
atypique. Il est lié à une stimulation oestrogénique, et il est en général de bas grade.
Le type II correspond au carcinome de type non endométrioïde, le plus souvent représenté par l’adénocarcinome à cellules claires, les carcinomes papillaires ou séreux qui se développent chez les femmes plus âgées, en période postménopausique. Le type Il est de haut grade et sans lien avec une stimulation oestrogénique. Le type I est plus fréquemment rencontré que le type II. Son diagnostic est posé sur les biopsies de l’endomètre dirigées au cours d’hystéroscopies effectuées pour métrorragies. Le diagnostic microscopique du carcinome de l’endomètre orthoplasique de type endométrial pur, glandulaire et/ou papillaire bien différencié, est de diagnostic difficile au stade précoce contrairement au diagnostic des carcinomes à cellules claires ou des carcinomes séreux papillaires. En effet, sa morphologie est proche de l’endomètre prolifératif non néoplasique. Le carcinome de l’endomètre de type I est souvent associé à une hyperplasie atypique de l’endomètre sur pièces d’hystérectomie, et se développe chez des patients où une hyperplasie atypique a été antérieurement diagnostiquée sur biopsie. De ce fait, l’hyperplasie atypique a été considérée comme précurseur du cancer de l’endomètre invasif [1, 6, 8]. Le diagnostic d’hyperplasie endométriale est cependant difficile, et peu reproductible [9], ce qui est préjudiciable pour les patientes qui risquent d’être soustraitées. Mais inversement, un sur-diagnostic par défaut de critères stricts peut induire des faux positifs suivis des sur-traitements qui pourraient être évités, induisant un préjudice psychologique et des coûts de prise en charge des patientes. C’est pourquoi les critères de malignité autres que la morphologie simple sont utiles au diagnostic, permettant de mieux différencier les proliférations monoclonales (ou néoplasies) à un stade débutant. Des tests immunohistochimiques s’ajoutant aux paramètres morphologiques, architecturaux et cytologiques résultant de l’examen microscopique standard ont été préconisés. Des travaux récents de la littérature ont montré que les cellules endométriales normales se transforment en carcinome endométrial du fait d’altérations moléculaires parmi lesquelles l’instabilité des microsatellites et les mutations du gène PTEN , du gène k RAS et de la β cathénine [3]. Les carcinomes non endométrioïdes sont quant à eux associés à des altérations du gène P53 avec une perte d’hétérozygotie sur plusieurs chromosomes [1, 3-7].
L’hyperplasie atypique résulte [3, 9] d’une prolifération monoclonale dans laquelle la mutation de PTEN, et une instabilité des microsatellites avec d’autres anomalies génomiques peuvent être détectées par hybridation comparative du génome. Ces anomalies sont observées dans les carcinomes endométrioïdes, montrant que les clones mutés induisaient une néoplasie endométriale très précoce détectable à un stade initial sous forme de petits amas de EIN (‘‘ Endometrial Intra-épithelial Neoplasia ’’ ou ‘‘ Néoplasie Intra-épithéliale Endométriale ’’) et par la suite, à un stade plus tardif, sous forme de néoplasie invasive [1, 5, 8]. A cet égard, l’immunodétection de l’expression de la protéine PTEN qui est réduite ou qui disparaît au cours des mutations PTEN (1, 3, 5, 8), apparaît comme un outil nouveau et adéquat pour améliorer la reproductibilité du diagnostic de la néoplasie endométriale débutante, en association aux critères morphologiques standard, redéfinis selon une nouvelle terminologie incluant (i) une densité augmentée des glandes par rapport au
stroma endométrial (rapport supérieur à 55 %) [1, 8], (ii) des atypies cellulaires et des anomalies nucléaires rassemblées en zones clairement démarquées de l’endomètre adjacent non néoplasique, (iii) rassemblées en foyer d’au moins 1 mm [8]. Le but de la présente étude est d’évaluer un large échantillon (n = 120) de prélèvements d’endomètre par variations d’expression de la protéine PTEN entre l’endomètre normal prolifératif, l’hyperplasie atypique endométriale ou néoplasie intraépithéliale glandulaire (EIN), en parallèle avec l’évaluation stricte de critères architecturaux (augmentation de la densité des glandes) et des anomalies cytonucléaires (pléïomorphisme nucléaire) visibles dans des zones nettement démarquées mesurant plus de 1-2 mm.
MATÉRIEL ET METHODES
Matériel
Les fragments tissulaires ont tous été fixés au formol tamponné, et colorés à l’HPS.
La sélection a été faite par étude rétrospective des archives du service hospitalier sur les quatre dernières années. Les critères de sélection des néoplasies intra-épithéliales endométriales ont été faites rétrospectivement, après réévaluation du matériel tissulaire, en appliquant les critères récemment publiés [2, 5, 8], à savoir sur les colorations standard, (i) une augmentation du rapport glandes/stroma, (ii) des atypies cytonucléaires, (iii) nettement démarquées sur une zone identifiable à faible grossissement, mesurant 1 à 2 mm. Les lésions sélectionnées dans l’étude ont été diagnostiquées de 1999 à 2002 et correspondent à des endomètres prolifératifs sans hyperplasie (n = 45), des néoplasies intra-épithéliales endométriales ou hyperplasies atypiques (n = 42) et 55 carcinomes de l’endomètre incluant les carcinomes orthoplasiques endométrioïdes (n = 30), des adénocarcinomes à cellules claires (n = 10), des carcinomes séreux papillaires (n = 5), des carcinomes adénosquameux (n = 5), des tumeurs mixtes mullériennes malignes homologues ou hétérologues (n = 5). Les lésions ont été classées selon les classifications internationales de l’OMS [9]. Parmi les 120 fragments tissulaires testés, 66 correspondent à des biopsies effectuées sous hystéroscopie pour métrorragies, 30 correspondent à des fragments d’endométrectomie effectuée pour métrorragies persistantes résistantes aux progestatifs et 24 sur pièces opératoires (hystérectomies avec annexectomies bilatérales).
Immunohistochimie
La protéine nucléaire est détectée par l’anticorps primaire anti PTEN, anticorps de souris monoclonal dilué au 1/100 reconnaissant la protéine humaine (clone 2-8 H6 Novocastra), révélée en immunoperoxydase, sur coupes en paraffine, par technique automatisée et standardisée sur automate Ventana Benchmark. (Ventana, Strasbourg, France). L’évaluation des résultats dans la série a été semi-quantitative par
lecture microscopique courante. Le marquage a été évalué en pourcentage de surface glandulaire marquée, les cellules épithéliales présentant une mutation étant négatives. Le pourcentage accepté résulte de la moyenne du score établi par trois observateurs (CC, LA, SCM), donc en triple lecture, après évaluation du coefficient de corrélation de Spearman en prétest sur une série de 50 endomètres non inclus dans la série étudiée (r = 0,816, p < 0,01). De même, la validation du test semiquantitatif a été évaluée par prétest par densitométrie sur analyse d’images SAMBA (SAMBA Technologies, Grenoble, France) montrant une excellente corrélation entre l’évaluation semi-quantitative et semi-automatisée par densitométrie sur image microscopique numérisée (r = 0.784, p < 0,01). Du fait de cette bonne corrélation entre les deux méthodes d’analyse, la méthode semi-quantitative beaucoup plus rapide et moins onéreuse, bien que fiable, a été utilisée par les trois observateurs. En effet, bien que précise, l’évaluation par densitométrie par analyse d’images, ne peut être entièrement automatisée car nécessite, par méthode interactive, une délimitation préalable à la quantification, des structures glandulaires puisque seule la composante épithéliale marquée ou non marquée est prise en compte, ce qui est plus long que par technique semi-quantitative. L’intensité du marquage est variable mais le plus souvent très forte. Seul le pourcentage de cellules épithéliales marquées est pris en compte, le calcul de score combinant l’intensité des surfaces n’apportant rien en terme de sensibilité et de spécificité du test, aussi bien pour l’anti PTEN que pour les autres marqueurs cytonucléaires.
Le comptage de l’immunomarquage, dans des glandes anormales mais dispersées dans un endomètre par ailleurs normal, n’a pas été pris en compte selon les recommandations de Mutter [2, 8]. En effet, la prolifération néoplasique précancé- reuse monoclonale se fait par contiguïté, le diagnostic de néoplasie intra-épithéliale étant acceptable au-delà de zones pathologiques (incluant des glandes morphologiquement normales et PTEN négatives) mesurant plus de 1 mm [2, 3, 8]. La morphologie anormale associée à une négativité immunohistochimique avec l’anti PTEN dans des glandes éparses, et non rassemblées dans des foyers de plus de 1 mm, permet de distinguer les vraies néoplasies intra-épithéliales glandulaires précancé- reuses des hyperplasies non précancéreuses, résultant d’une stimulation oestrogénique anormale.
RÉSULTATS
Répartition du marquage
Le marquage anti PTEN est identifiable au niveau des noyaux cellulaires, aussi bien épithélial que stromal. Dans la présente étude, seul le marquage glandulaire a été pris en compte, la composante stromale n’étant pas concernée dans les processus prolifératifs anormaux de type carcinomateux. De fait, la persistance du marquage stromal dans les néoplasies affaiblit la sensibilité du test si elle est prise en compte.
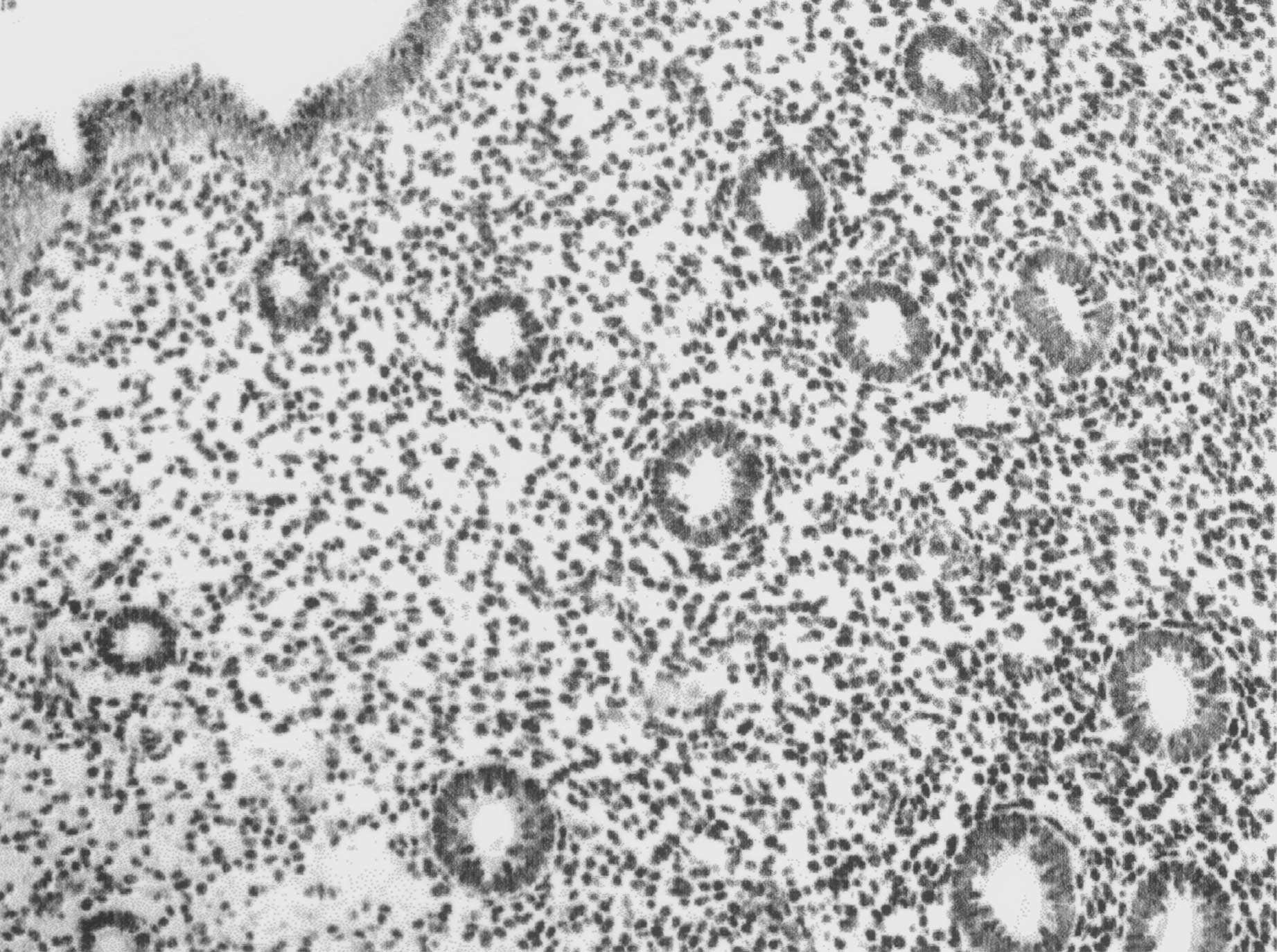
FIG. 1. — Endomètre de type prolifératif normal, sans hyperplasie : forte réactivité épithéliale glandulaire et stromale au niveau du noyau des cellules (100 % de marquage de forte intensité — x125, immunoperoxydase sur coupe en paraffine).
D’où la nécessité pour les observateurs de n’évaluer que le marquage intranucléaire dans les cellules épithéliales bordant les glandes. Dans l’endomètre prolifératif normal, on note en effet une forte positivité épithéliale et stromale (fig. 1) alors que dans les lésions carcinomateuses infiltrantes, on note une négativité dans les structures glandulaires avec persistance de la positivité stromale (fig. 2).
Résultats quantitatifs
Les résultats de l’analyse semi-quantitative mettent en évidence une positivité maximale dans l’endomètre prolifératif normal (100 %, n = 45) et une négativité épithéliale dans les carcinomes endométrioïdes orthoplasiques dans 23/30 cas. Par contre, 23/25 des adénocarcinomes non endométrioïdes (cellules claires, séreux papillaire, adénosquameux et mulleroblastome), l’expression de la protéine PTEN est préservée. Enfin, 40/42 des néoplasies intra-épithéliales endométriales sont PTEN négatives ou avec une réduction significative de l’immunomarquage (tableau 1, fig. 3, 4).
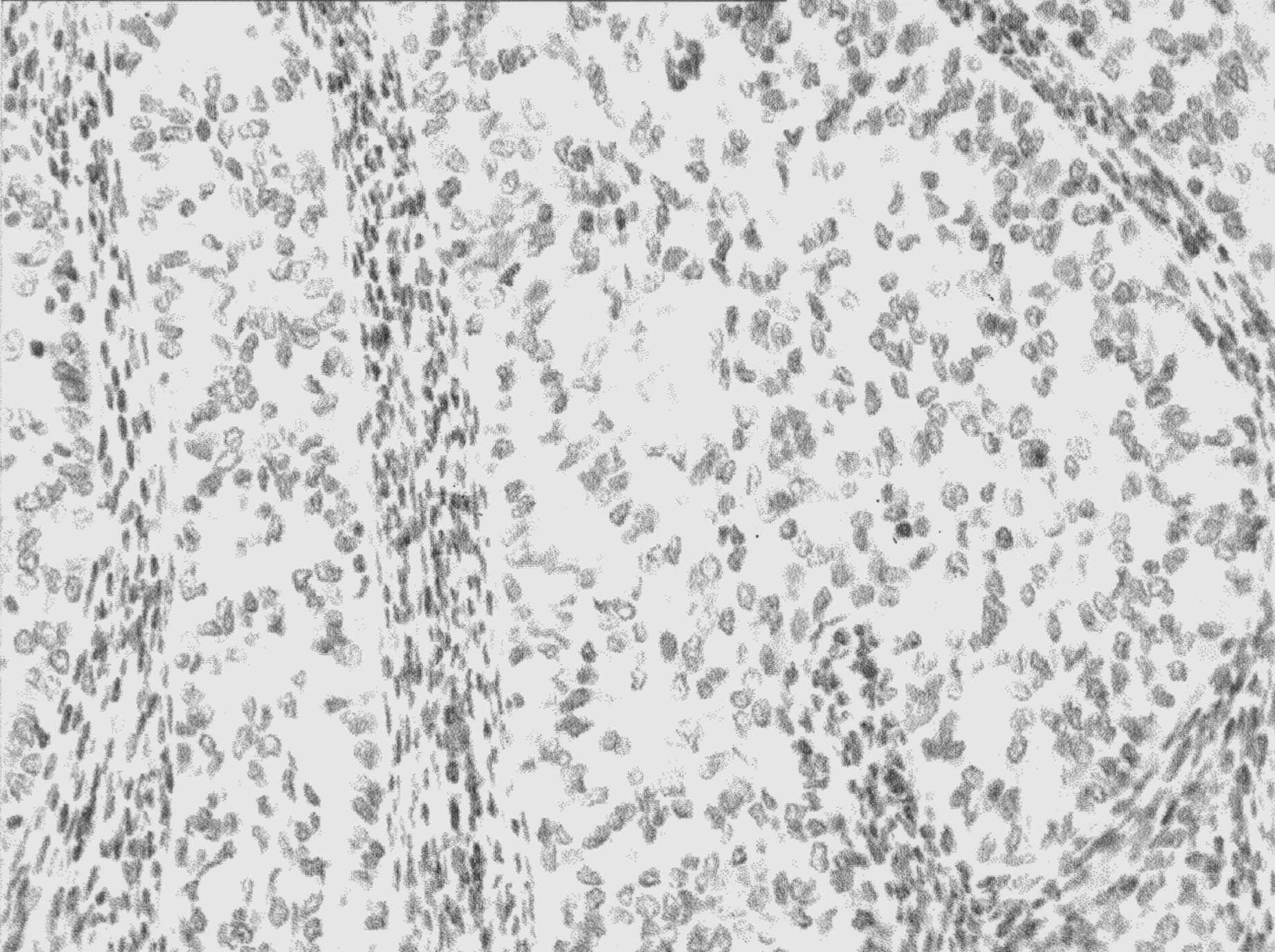
FIG. 2. — Carcinome de l’endomètre bien différencié, infiltrant, avec inflexion papillaire : absence de marquage épithélial liée à l’absence d’expression de la protéine PTEN secondaire à la mutation du gène. A noter la positivité des cellules stromales résiduelles servant de contrôle positif interne. (x 250, immunoperoxydase sur coupe en paraffine).
Les lésions morphologiquement anormales et PTEN négatives n’ont été retenues que dans les zones nettement démarquées des glandes normales avoisinantes mesurant plus de 1 mm. Les EIN présentent une perte totale de la positivité ou une réduction très significative par rapport à l’endomètre prolifératif normal. Les lésions mesurant moins de 1 mm ou sous forme de glandes dispersées, sans démarcation nette en foyers du parenchyme adjacent ont été récusées du diagnostic de EIN, de même que les zones morphologiquement anormales (architecture et cytologie) avec persistance de l’anti PTEN ou lésion avec persistance de la réactivité avec l’anti PTEN. Les carcinomes de l’endomètre sont dans la plupart des cas entièrement PTEN négatifs soit partiellement et légèrement positifs. De même, les EIN sont soit entièrement négatives soit présentent une réduction très significative de l’immunomarquage en surface et en intensité. Les glandes sécrétoires kystiques ou quiescentes présentes sur les zones adjacentes, des EIN se révèlent négatives ou très faiblement positives.
TABLEAU 1.
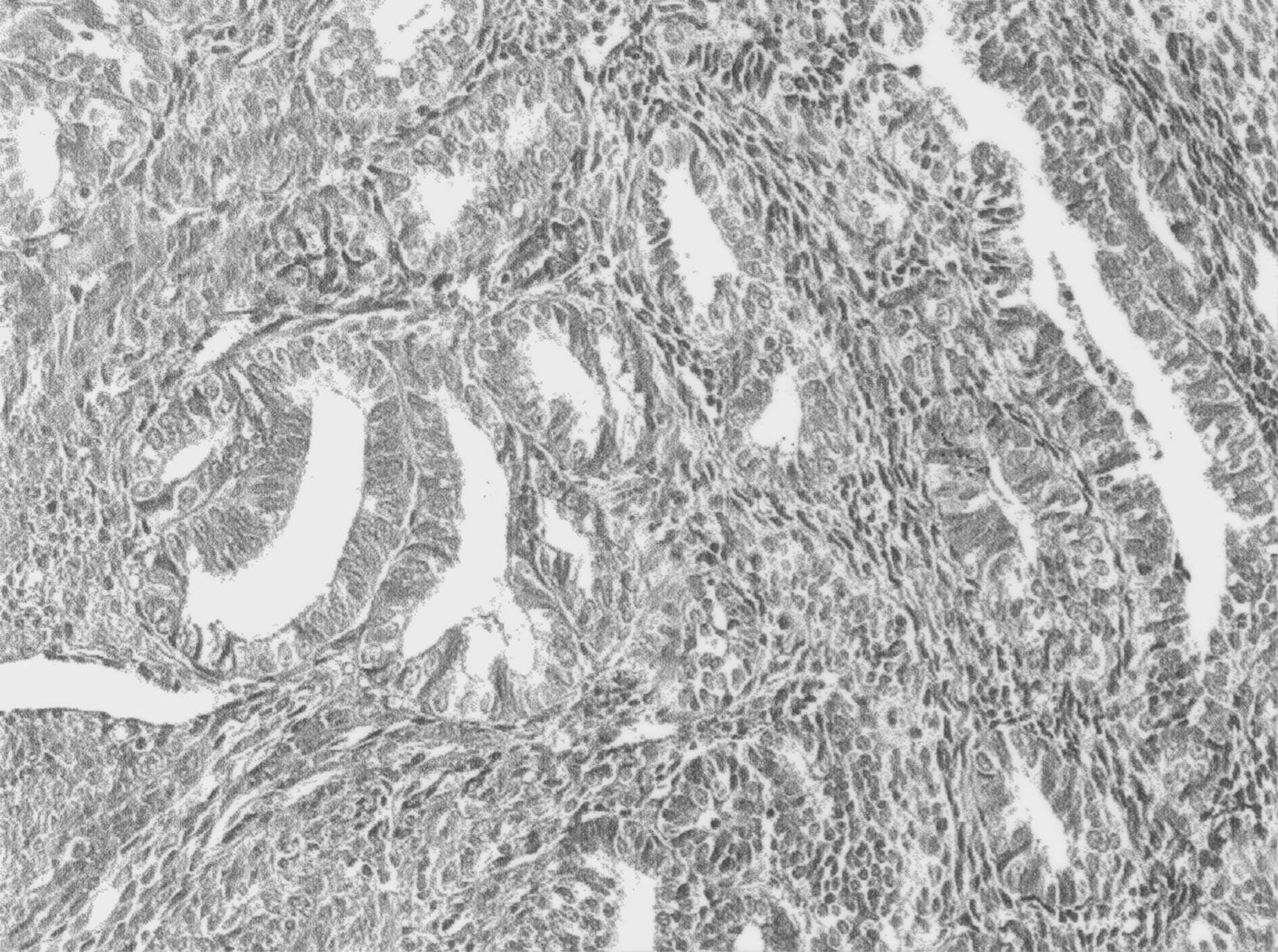
FIG. 3. — Hyperplasie atypique de l’endomètre, actuellement classée sous le terme de néoplasie glandulaire intra-épithéliale ou EIN (1) (x 250, coupe en paraffine avec coloration standard HPS).
DISCUSSION La classification de l’OMS des hyperplasies de l’endomètre (simples et complexes, atypiques et non atypiques) est en pratique difficile à utiliser [9]. C’est pourquoi la disparition ou la réduction de l’expression immunohistochimique du PTEN dans les néoplasies de l’endomètre, par comparaison à l’expression normale de l’endomètre prolifératif cyclique en période préménopausique constitue un nouveau critère diagnostique particulièrement pertinent [1, 3, 5, 8, 10]. Ces données de la littérature montrent que la protéine PTEN n’est détectable que dans l’endomètre de type prolifératif, alors que dans les endomètres de type sécrétoire, quiescent ou atrophique ou kystique, au cours de la ménopause, les cellules épithéliales n’expriment pas cet antigène sans pour autant être mutées. Ceci est très important en pratique pour l’interprétation des marquages qui doit se faire en fonction du contexte biologique et clinique (date du cycle, traitement, atrophie). Dans notre étude, nous avons effectivement observé que l’endomètre prolifératif, non néoplasique, cyclique exprimait très fortement la protéine PTEN dans les cellules épithéliales (et stromales) contrastant avec les glandes morphologiquement sécrétoires, atrophiques ou kystiques,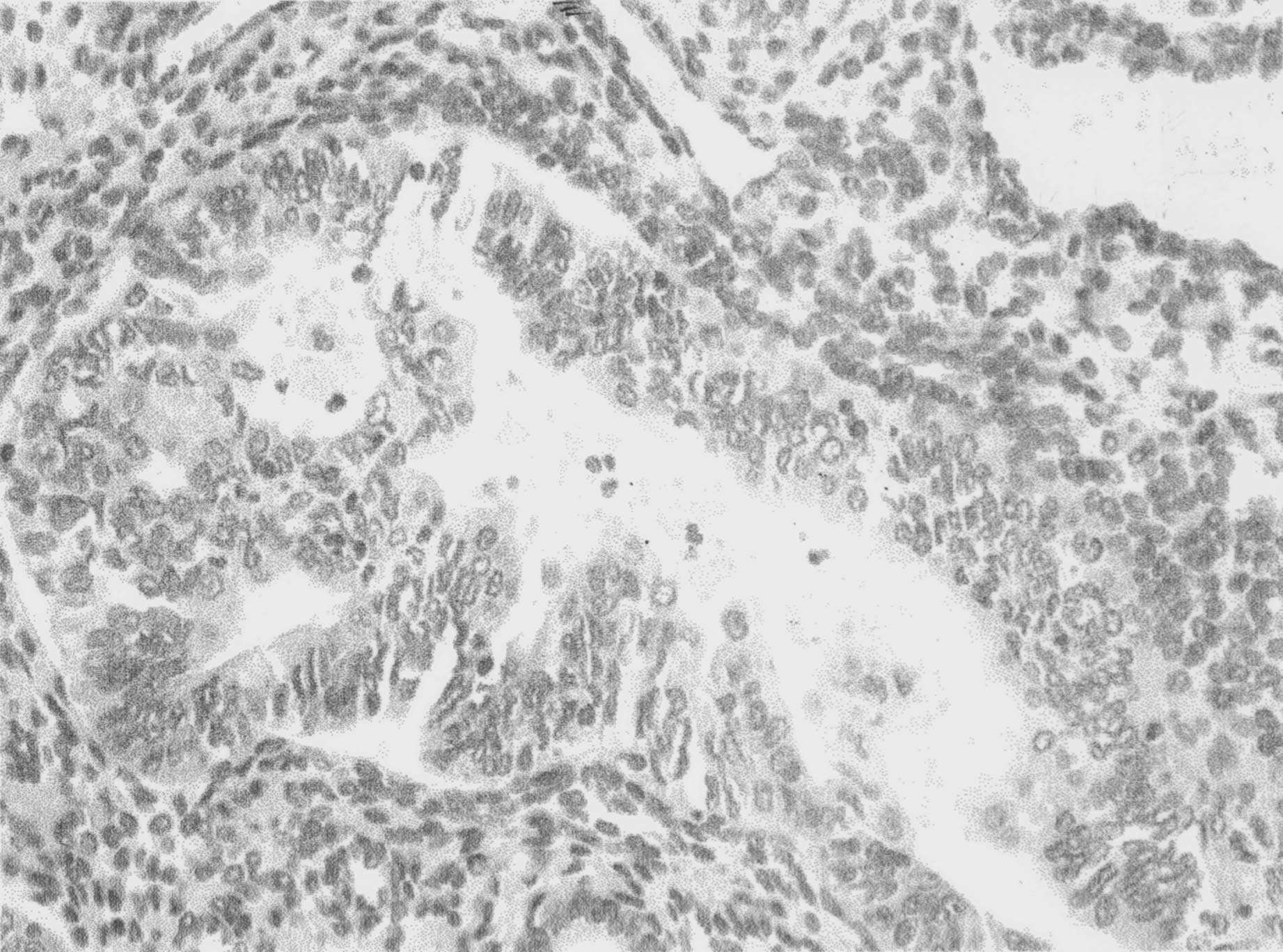
FIG. 4. — Hyperplasie atypique de l’endomètre ou néoplasie intra-épithéliale endométriale : absence d’immunomarquage avec l’anti PTEN témoignant de la mutation du gène PTEN dans les hyperplasies atypiques comme dans les carcinomes (cf. figure 2), (x 250, immunoperoxydase sur coupe en paraffine).
parfois visibles en périphérie des zones prolifératives sur les mêmes échantillons. Ces résultats nous ont permis de valider notre méthodologie et de standardiser nos tests immunohistochimiques, ce qui est un prérequis incontournable avant toute étude quantitative, notamment pour l’évaluation d’une réduction d’expression par réduction et coloration immunohistochimique avec l’anti PTEN. Dans notre étude aussi, nous avons observé que 23/30 carcinomes endométriaux invasifs ont une perte complète de l’expression immunohistochimique du PTEN avec une négativité totale de l’immunoréaction, alors que 5/30 expriment une simple réduction avec marquage hétérogène avec l’anti PTEN, par comparaison avec l’endomètre normal prolifératif adjacent aux zones carcinomateuses. Ces résultats montrent qu’environ 80 % des carcinomes de l’endomètre endométrioïde de type I sont identifiables par détection immunohistochimique, mettant en évidence une altération de l’expression du gène PTEN aboutissant à une perte totale ou partielle de l’expression protéique. Nos résultats sont totalement en accord avec les données de la littérature [2, 3, 9, 8, 10], bien que les 80 % de perte ou réduction d’expression de la protéine PTEN dans notre série, se situent dans la partie supérieure de la fourchette des pourcentages d’altérations observées, de 37 à 83 % suivant les études [3 et 5].
Ces résultats suggèrent que l’expression anormale de PTEN dans les cancers endométrioïdes de type I est un paramètre nouveau et performant pour le diagnostic de néoplasie endométriale (sensibilité 80 %, spécificité 100 % pour les néoplasies invasives orthoplasiques). Contrairement aux adénocarcinomes endométriaux orthoplasiques de type endométrioïde, nous avons observé que seulement 2/25 carcinomes non endométrioïdes (carcinomes séreux, tumeurs mixtes mullériennes malignes et carcinomes à cellules claires) présentaient une absence ou réduction de l’expression de PTEN. Nos données corrèlent bien celles de la littérature [1, 3, 5, 8, 10]. L’hyperplasie atypique de l’endomètre est associée à un carcinome endométrial sur pièce opératoire ou est retrouvée dans les antécédents des patients [11, 12] sur les biopsies antérieures des années avant le diagnostic du carcinome endométrial. C’est pourquoi, les critères d’hyperplasie atypique, considérés depuis des années comme lésions précancéreuses, nécessitent d’être précisés et clarifiés afin que les patientes porteuses de ces lésions soient mieux prises en charge [9, 13]. En particulier, les critères permettant de différencier l’hyperplasie atypique de l’endomètre prolifératif non néoplasique (anovulation ou de métaplasie endométriale), doivent être redéfinis afin de rendre le diagnostic histologique plus reproductible. Les lésions précancé- reuses sont initiées à partir de tissus présentant une mutation génétique et la progression vers le carcinome se produit à travers l’acquisition d’altérations génétiques supplémentaires. L’expansion clonale de ces altérations produit une zone progressivement croissante qui, à un certain stade, est identifiable à l’échelon microscopique, constituée de cellules mutées sur lesquelles vont se surajouter d’autres mutations [3, 5, 8]. Une stimulation oestrogénique non contrôlée, notamment par des progestatifs, stimule la croissance des cellules mutées. La transition du précancer au cancer se définit lorsque la lésion présente une agressivité certaine avec invasion et dissémination à distance. C’est pourquoi, il est admis que l’origine clonale du précancer anticipe la distribution focale des lésions précancéreuses qui se développent de proche en proche par une expansion par contiguïté des cellules qui se répliquent à partir d’un même clone. La prolifération monoclonale par contiguïté conduit précocément à des lésions microscopiques nettement démarquées du parenchyme adjacent dans lesquelles les zones endométriales néoplasiques contiennent des glandes tassées les unes sur les autres, (avec réduction du rapport glandes/ stroma), qui vont augmenter en densité progressivement et qui sont bordées de cellules épithéliales qui sont le siège d’anomalies cytonucléaires contrastant nettement avec l’endomètre avoisinant [8]. Cette démarcation claire des lésions précancéreuses est à ce stade mise en évidence par test immunohistochimique avec l’anti PTEN qui montre que ces zones sont PTEN négatives ou très faiblement positives, contrastant avec les zones adjacentes non néoplasiques très positives. Bien que le précancer soit latent [1, 5, 8], il peut être détecté par test immunohistochimique, mettant en évidence des cellules PTEN négatives au sein d’une prolifération monoclonale ou néoplasique considérée comme précancéreuse et à laquelle on se réfère actuellement sous le terme de néoplasie intra-épithéliale endométriale [‘‘Collaborative Group of Gynecopathologiste’’, 1, 5, 8] qui est recommandé et préféré à celui d’hyperplasie atypique (OMS) [9] lorsque la zone lésionnelle atteint une taille de 1 mm. Cette
lésion est un déterminant majeur de risque de cancer invasif. La gravité de la maladie évolue avec l’involution ou l’expansion des clones affectés par des processus codé- terminés, liés à des facteurs génétiques ou non génétiques (hormonaux) [1, 5, 8].
Selon ce modèle de développement tumoral de la néoplasie intra-épithéliale endométriale (ou EIN), il apparaît que cette dernière est un processus monoclonal [cf.
revue dans 8] qui diffère fondamentalement des remaniements secondaires à un traitement oestrogénique sans adjonction de progestatifs diagnostiqués comme simple hyperplasie sans caractère précancéreux ou comme simples désordres prolifératifs endométriaux. L’hyperplasie endométriale (non atypique), en effet, contrairement à l’EIN, n’est pas monoclonale et ne comporte pas d’anomalie génétique comme dans l’EIN, notamment pas d’anomalie de l’expression du PTEN. A cet égard, dans notre étude, nous avons montré que 2/45 des lésions classées comme EIN ne comportaient pas d’altération de l’immuno-expression du PTEN et ces lésions ont dû être reclassées. Ces résultats montrent bien l’intérêt pratique d’une telle investigation immunohistochimique en complément d’une évaluation microscopique, avec critères redéfinis. Et ceci a été effectué en accord avec les données de la littérature qui permettent de redéfinir et reclasser les hyperplasies à l’aide de tests immunohistochimiques, si tant est que ces tests soient standardisés. Inversement, des cas d’hyperplasie simple sous-évaluée et diagnostiquée comme telle peuvent être reclassés en EIN vraie après tests immunohistochimiques. C’est pourquoi, il peut être actuellement recommandé d’effectuer un test anti PTEN diagnostic dans un contexte de prolifération endométriale histologiquement anormale. En conclusion, nos résultats, en accord avec les données de la littérature, sur une série conséquente de néoplasies glandulaires intra-épithéliales, (et par comparaison avec les résultats observés dans l’endomètre prolifératif normal et dans les carcinomes de l’endomè- tre) s’accordent avec les données de la littérature récente, définissant les critères diagnostiques de l’EIN qui associe des désordres histologiques détectables sur coloration standard mettant en évidence : — une augmentation de la densité des glandes par rapport au stroma, — avec des atypies cytonucléaires nettement démarquées du tissu adjacent et — présentant une perte ou une réduction de l’immunoexpression anti PTEN, — sur des zones supérieures ou égales à 1 mm. Ces critères doivent permettre une meilleure reproductibilité diagnostique des lésions précancé- reuses et une prise en charge plus appropriée des patientes porteuses de ces lésions.
BIBLIOGRAPHIE [1] BOCKMAN J.V. — Two pathogenetic types of endometrial carcinoma.
Gynecology Oncology , 1983, 15 , 10-17.
[2] MUTTER G.L., LIN M.-C., FITZGERALD J.T., KUM J.B., BAAK J.P.A., LEES J.A., WENG L.-P., ENG C. — Altered PTEN expression as a diagnosis marker for the earliest endometrials precancers. J. Natl.Canc. Inst. , 2000, 92 , 924-931.
[3] MATIAS-GUIU X., CATASUS/., BUSSAGLIA E., LAGARDA H., GARCIA A., PON MUNOZ J., ARGUELLES R., MACHIN P., PRAT J. — Molecular pathology of endometrial hyperplasia and carcinoma.
Hum. Pathol. , 2001, 32 , 569-577.
[4] KOUL A., WILLE N.R., BENDAHL P.O., NILBERT M., BORG A. — Distinct sets of gene alterations in endometrial carcinoma in alternate odes of tumorigenesis. Cancer , 2002, 94 , 2369-79.
[5] MUTTER G.L., INCE T.A., BAAK J.P.A., KUST G.A., ZHU X.-P., ENG C. — Molecular identification of latent precancers in histologically normal endometrium. Cancer res. , 2001, 61 , 4311-4314.
[6] SALVENSEN H.B., MAC DONALD N., RYAN A., JACOBS I.J., LYNCH E.D., AKSLEN L.A., DAS S. — PTEN methylation is associated with advanced stage and microsatellite instability in endometrial carcinoma. Int J. Canc. , 2001, 1 , 22-26.
[7] FUJITA N., TSURUO T. — Survival-signaling pathway as a promising target for cancer chemotherapy. Cancer Chemother Pharmacol , 2003, 52 , 24-28.
[8] MUTTER G.L. — Histopathology of genetically defined endometrial precancers.
Int. J. Gynecol.
Path. , 2000, 19 , 301-309.
[9] BERGERON C., NOGALES F.F., MASSEROLI M., ABELER V., DUVILLARD P., MULLER-HOLZNER E., PICKARTZ H., WELLS M. — A multicentric european study testing the reproducibility of the WHO classification of endometrial hyperplasia with a proposal of a simplified working classification for biopsy and curettage specimens. Am. J. Surg. Path. , 1999, 23 , 1102-1108.
[10] SALVENSEN H.B., STEFANSSON I., KALENES M.B., DAS S., AKSLEN L.A. — Loss of PTEN expression is associated with metastatic disease in patients with endometrial carcinoma. Cancer , 2002, 94 , 2185-2191.
[11] KURMAN R., KAMINSKI P., NORRIS H. — The behavior of endometrial hyperplasia : a long terme study of ‘‘ untreated ’’ hyperplasia in 170 patients. Cancer , 1985, 56 , 403-412.
[12] SHERMAN A., BROWN S. — The Precursors of endometrial carcinoma.
Am. J. Obst. Gynecol. , 1979, 135 , 943-954.
[13] SCULLY R.E., BONIFAGLIO T.A., KURMAN R.J., SILVERBERG S.G., WILKINSON E.J. — International histological classification and typing of female genital tract tumours. 1994, New York — Springer-Verlag.
DISCUSSION
M. Christian NEZELOFF
Sur quelles bases ont été établies la monoclonalité des proliférations endométriales cancé- reuses. D’autre part, monnoclonalité ne signifie pas obligatoirement néoplasie ; comme le montre le caractère monoclonal des cellules de villosités intestinales normales.
La monoclonalité a été mise en évidence par les études du groupe de Mutter et col., publiées dans J.N.C.I. en 2001, montrant la monoclonalité des néoplasies intraendométriales après microdissection. Cette monoclonalité a été établie par la mutation ou délétion du gène PTEN (associées d’ailleurs à d’autres anomalies génomiques. Le caractère commun des carcinomes invasifs orthoplasiques endométriaux et des néoplasies intra-endométriales, se traduit par une perte de l’expression de l’antigène PTEN.
Selon ces auteurs, le caractère monoclonal dans l’endomètre signe l’initiation d’un processus malin évoluant ultérieurement sous l’influence des œstrogènes.
M. Michel BOUREL
Un résultat « négatif » porte toujours à discussion ; quelles différences entre perte, réduction, forte réduction du PTEN ? L’analyse comparée des coupes fraîches et des coupes en paraffine montre-t-elle une « réduction » du PTEN dans les manipulations du second type ?
L’analyse comparée sur les coupes ‘‘ fraîches ’’, c’est-à-dire sur tissu congelé et sur coupes en paraffine, montre les mêmes résultats avec une perte ou réduction de l’expression de l’antigène PTEN. Cette évaluation, permettant de garantir la validité de la méthodologie, avait été faite précédemment dans les différentes études publiées, notamment celles du groupe de Mutter à Boston. Nous avons pu vérifier notre technique et la valider en faisant la même comparaison, en utilisant d’une part, nos archives de tissus fixés au formol et inclus en paraffine, et d’autre part, des tissus congelés dans notre banque de tissus congelés (dans le Service d’Anatomie Pathologique Nord qui contient près de 7000 identités patientes porteuses de lésions tumorales de la sphère génitale et surtout du sein). La réduction ou la perte d’expression PTEN est évaluée par densitométrie et par analyseur d’images (logiciel d’analyse approprié) : Les densités optiques moyennes dans un cas donné sont comparées à celles du témoin interne (endomètre normal satellite) et de témoins externes (endomètre prolifératif normal). L’importance et significativité de la différence entre la normalité et les cas testés est établie par analyse statistique.
M. Henri LACCOURREYE
L’hyperplasie atypique a-t-elle remplacé le terme de dysplasie ?
Le terme de dysplasie, largement utilisé dans d’autres tissus, n’a jamais été utilisé dans l’endomètre à proprement parler. Par ailleurs, la classification de Richart, dans le col utérin par exemple, a remplacé le terme de dysplasie par le terme de néoplasie. Cette classification est actuellement consensuelle et fait partie des recommandations internationales et nationales (CIN : Néoplasie intra-épithéliale cervicale de grade 1, 2 et 3).
M. Jean-Daniel SRAER
Les données immunohistochimiques ont-elles été validées par des études par hybridation « in situ » ?
Les données immunohistochimiques ont découlé d’études de biologie moléculaire effectuées après microdissection, et incluant des études d’hybridation in situ notamment. Les anticorps commercialisés utilisés sont ceux des groupes qui ont validé la méthodologie (Mutter et collaborateurs JNCI 2001).
M. Gilles CRÉPIN
Dans votre lot de néoplasies inter-épithéliales, avez-vous repéré une incidence significative des traitements oestrogéniques ? Avez-vous exploité votre test dans deux situations particulières à incidence tumorale : le DES syndrome responsable d’adénocarcinome vaginal mais
également des lésions endo-utérines et les métrorragies chez les patientes traitées au long cours par le tamoxifène dans les cancers du sein ?
Le lot de tissus que nous avons testés correspondait soit à de l’endomètre normal cyclique, soit à des carcinomes et des néoplasies intra-endométriales. Notre étude cherchait à valider l’utilisation pratique du test anti PTEN pour identifier ces néoplasies intra-épithéliales. Nous n’avons pas sélectionné particulièrement de cas de patientes sous traitement hormonal, oestrogénique. Nous n’avons pas non plus testé de prélèvements connus pour entrer dans le cadre d’un syndrome DES au cours duquel les adénocarcinomes à cellules claires sont très fréquents. Néanmoins, nous avons inclus dans notre étude des carcinomes à cellules claires qui correspondent à des carcinomes non orthoplasiques de l’endomètre. Comme l’avaient déjà montré les données de la littérature, ces carcinomes ne subissent pas les mêmes types de mutation, notamment en ce qui concerne le gène PTEN. Ce test n’est utilisable que pour les néoplasies intra-épithéliales dotées d’un risque important de carcinome invasif ultérieur.
M. Jacques-Louis BINET
J’ai cru voir dans vos résultats que, sur vos quarante patientes, vous observiez quatre discordances selon votre méthode d’étude de l’antigène PTEN : comment avez-vous classé ces observations ? Néoplasies débutantes ou non ?
La littérature avait déjà montré que la perte de l’antigène PTEN ne s’observait que dans une majorité des adénocarcinomes de l’endomètre mais pas dans 100 % des cas. De même, les néoplasies intra-épithéliales perdent l’expression de cet antigène dans une majorité des cas mais pas dans 100 % des cas, d’où le fait qu’effectivement, dans notre série, un nombre réduit de néoplasies intra-endométriales ne montre pas de réduction
* Colette TARANGER-CHARPIN — Service d’Anatomie et de Cytologie Pathologiques — CHU Nord, Chemin des Bourrelly — 13915 Marseille Cedex 20 — Tél. : 04 91 69 88 63 — Fax : 04 91 69 89 53 — E-mail : colette.charpin@ap-hm.fr ** Service de Gynécologie Obstétrique, CHU Nord. Tirés-à-part : Professeur Colette TARANGER-CHARPIN, même adresse. Article reçu le 14 octobre 2003, accepté le 12 janvier 2004.
Bull. Acad. Natle Méd., 2004, 188, no 3, 415-429, séance du 9 mars 2004


