Résumé
Les voies de la vision sont mieux connues grâce aux progrès de l’IRM (1984-2004) qu’elles illustrent bien, par une nouvelle anatomie descriptive, in vivo et inoffensive, et, au-delà, par leur connaissance fonctionnelle. Bilan d’une expérience de 30 ans, ce travail résume, d’abord, les évolutions techniques de l’IRM et ses procédures modernes. Une deuxième partie de résultats expose et illustre, d’abord, les acquis en anatomie descriptive. L’IRM de la tête isole des structures encéphaliques invisibles jusqu’à présent, dans différents plans, sur les voies optiques horizontales « de la cornée à la scissure calcarine » (Plans Neuro-oculaire (PNO), Neuro-Oculaire Trans-hémisphérique Oblique (PNOTO) et Neuro-OculoBandelettique (PNOB)), dans leur organisation orthogonale aux voies de l’oculomotricité : tête et paquet axonal du nerf optique (deutoneurones visuels dans leurs méninges), bandelettes (ou « tractus ») optiques, corps genouillés latéraux, radiations optiques et scissure calcarine. L’anatomie comparée (macaccus rhesus) est mentionnée. Ensuite, la neuro-anatomie fonctionnelle (physiologie) bénéficie de la ciné-IRM pour l’oculo-motricité (IRMOD), la croissance, de l’observation de la myélinisation chez l’enfant, des circulations sanguine et liquidienne cérébro-spinale, de l’angiographie par résonance magnétique (ARM), de la mesure des volumes sanguins locaux, de l’imagerie de perfusion, de la quantification de la population neuronale et l’inflammation ou régénération de la myéline de la spectroscopie (SRM), de l’IRM « fonctionnelle » (IRM(f)) mesurant l’augmentation du débit local cortical par des paradigmes de stimulation, pour cartographie cérébrale. Dernière-née des imageries fonctionnelles, la tractographie (ou IRM en Tenseur de Diffusion (IRM TD)), basée sur l’IRM de diffusion, un calcul des vecteurs propres par tenseur de diffusion et la puissance des logiciels associés, pour un résultat morphologique de valeur statistique, représente la direction des faisceaux de projection, d’association ou commissures, tractus de la substance blanche. Des exemples normaux illustrent le propos et la discussion évoque des conséquences cliniques de cette approche en routine.
Summary
Advances in MRI technology have led to a better knowledge of visual pathways (1984- 2004), with a new descriptive anatomy and functional model. The authors first describe the technical development of MRI over the last thirty years, then describe and illustrate the new descriptive anatomy. Cephalic MRI reveals brain structures that were previously invisible, on different encephalic planes, in the optic pathways, horizontally from the cornea to the calcarin fissure (neuro-ocular plane (NOP), oblique trans-hemispheric neuro-ocular (OTNOP) and neuro-opto-tractal planes (NOTP)), in their orthogonal orientation upon the oculomotor pathways : head and axonal optic nerve pack (visual deutoneurons in their meninges), optic tracts, lateral geniculate bodies, optic radiations and the calcarian fissure. Comparative anatomy with the rhesus macaque is mentioned. Functional neuroanatomy (physiology) benefits from cine-MRI for ocular motricity (OD MRI), growth by the observation of myelinization in children, blood and CSF circulation by MR angiography, local blood volumes by perfusion imaging, neuronal quantification with inflammation or myelin regeneration by spectroscopy (MRS), brain mapping by functional MR ((f)MRI) measuring local CBF enhancement by paradigmatic stimulations. The recent functional imaging method, tractography (or diffusion tensor MRI (DTMRI)), using diffusion MRI techniques, natural vector calculations with diffusion tensor and software power for morphological and statistical directional results, represents the direction of projection, association and commissural white matter tracts. Normal examples are shown and some common clinical consequences are discussed.
Les voies de la vision, de l’IRM anatomique à la physiologie (IRM(f)) et IRM en tenseur de diffusion (IRMTD) ou tractographie
The visual pathways, from anatomical MRI to physiological with (f)MRI and tractography with diffusion tensor MRI (DTMRI)
Emmanuel Alain CABANIS *, Marie-Thérèse IBA-ZIZEN**, Thien Huong NGUYEN**, Luc BELLINGER*, Jean-Louis STIEVENART**, Masaki YOSHIDA***, Henry HAMARD****
En 1972, le scanner à Rayons X (RX) ajoute la puissance des détecteurs et du calcul informatique à l’utilisation des rayons X en radiologie (W.C. Röntgen, 1895, et G.N.
Hounsfield, 1972, tous deux Prix Nobel en 1901 et 1979). L’imagerie numérique en médecine est née. 500 fois plus sensible que le film photographique analogique et ses atomes de Bromure d’Argent, avec leurs 4 valeurs de densités (du blanc (os) au noir (air), avec gris clair (eau) et gris sombre (graisse)), le scanner RX offre 2000 valeurs de densités (échelle Hounsfield) en chaque volume élémentaire (voxel) de la matrice
calculée (512 × 512 p.ex.), sur 16 coupes adjacentes et fines (0,5mm d’épaisseur).
Deux limitations sont le caractère mono-paramétrique du phénomène d’absorption des RX (atténuation par la traversée des tissus) et l’irradiation (faible) délivrée aux tissus (cf grossesse évolutive) [1, 2].
En 1981, l’Imagerie par Résonance Magnétique (IRM) naît de l’application des calculs de reconstruction d’image au phénomène de Résonance Magnétique Nucléaire (RMN), découvert en 1946 par les américains F. Bloch et E.M. Purcell, Prix Nobel (1952). La source de l’image est la radio-fréquence réémise lors du retour à l’équilibre des noyaux Hydrogène H+ (protons, 70 % de H 0 = 70 % des tissus 2 biologiques comme l’encéphale), après mise en état de résonance par une radiofréquence quantique, au sein d’un champ magnétique élevé [1, 2].
La supériorité de l’IRM sur le scanner RX est triple : haute sensibilité (pondérations multi-paramétriques et complémentaires des séquences d’acquisition), exploration de tous les plans de l’espace (le scan RX est axial et transverse) et innocuité totale du champ magnétique et des radio-fréquences. La seule contre-indication est le maté- riel ferro-magnétique intra-corporel (corps étranger balistique ou matériel chirurgical ancien, ferro-magnétique), mobilisable par le champ magnétique. Avant, et plus que d’autres, cerveau et moelle épinière, ont bénéficié de l’IRM. Elle en a révolutionné l’anatomie et la physiologie, qu’il est désormais possible d’étudier « in vivo » [1, 2].
Le but de ce travail est de faire connaître les applications de l’IRM à l’anatomie et au fonctionnement de l’appareil de la vision , en nous fondant sur notre expérience, acquise auprès de 77.000 patients explorés en vingt ans. Après le rappel des évolutions de l’IRM, la description des résultats obtenus s’appuie sur l’iconographie.
ÉVOLUTION 1981-2004 DE L’IRM
Principes de l’IRM et rappels techniques
Certains noyaux atomiques sont « paramagnétiques », car ils se comportent en micro-aimants et micro-gyroscopes, du fait de leur rotation sur eux-mêmes (spin nucléaire) [1, 2]. Le phénomène RMN résulte de l’interaction entre l’atome (ici le proton H+, le plus abondant dans le corps humain) et l’émission d’une radiation électromagnétique, à fréquence déterminée. Le tunnel de la machine est celui de l’électro-aimant supra-conducteur, qui crée un champ magnétique statique B0 (1,5 Tesla ou 15.000 Gauss, 30.000 fois supérieur au B terrestre). Celui-ci oriente la 0 population protonique. Une antenne (ou bobine) de radio-fréquence (RF) émet un champ tournant perpendiculaire au premier. A une radio-fréquence quantique de valeur connue, proportionnelle au B , la population nucléaire entre en état de 0 précession (résonance), d’état énergétique élevé. L’arrêt de l’émission RF du champ tournant provoque un retour à l’équilibre de la population nucléaire. Une réémission énergétique en résulte. Elle est proportionnelle au tissu biologique exploré.
Cette radiofréquence, détectée par les antennes précédemment émettrices, est le « signal », source du calcul de l’image en chaque point de la coupe. Le vecteur gyro-magnétique résultant, représentation d’un proton, revient à l’équilibre selon deux projections, horizontale (OXZ), dite « T2 » (temps de relaxation T2, spin-spin) et verticale (OXY), dite « T1 » (temps de relaxation T1, spin-réseau), modèle analogique simplifié.
En pratique, le patient est introduit dans le tunnel d’un aimant supra-conducteur, tapissé des antennes (bobines) de gradients de localisation spatiale d’émission et de réception haute fréquence, sélectionnant, en particulier, les plans de coupe. Les séquences d’excitation adaptent les Temps d’Echo (TE) et de Répétition (TR) à l’anatomie de l’organe, à sa pathologie, au contraste recherché (ou intensité du signal), au phénomène exploré (anatomique descriptif, circulatoire, de diffusion…).
Par nature, on l’a vu, l’IRM est multi-paramétrique, les TE et TR, affichés en ms, pondérant le T1, le T2 (spin-spin) ou le Rhô (densité protonique). A l’étage encéphalique, une variation des contrastes en résulte. La « pondération T1 » montre la substance blanche « blanche » (haut signal), la substance grise « grise » et le liquide cérébro-spinal « noir » (sans signal, du fait de son très long T1). Une « pondération T2 » isole la substance blanche « grise » (signal intermédiaire), la substance grise « blanche » (haut signal) et le liquide cérébro-spinal « très blanc » (très long T2, comme tous les liquides biologiques, vitré, urine, etc.).
Évolution des systèmes et matériels d’acquisitions et de traitements
L’expérience acquise, depuis décembre 1983, résume l’évolution des systèmes et l’accélération informatique : électro-aimants résistif à 0,15 Tesla (83-88), supraconducteur à 0,5 Tesla (85-87), supra-conducteur à 1,5 T. (1988, renouvellement 1998), à 3 T. (en cours) [3]. General Electric Medical Systems (GEMS, Milwaukee, USA et Buc, F), premier constructeur mondial, produit des systèmes IRM, dont le 1,5 T (« Signa LX ») est exploité ici (service de neuro-imagerie du Centre Hospitalier National d’Ophtalmologie des XV-XX). Il est connecté en réseau avec un scanner RX (« Light Speed »), un poste de radiologie numérisée, des stations de travail d’images (« Advantage Windows » GEMS, V 4.0 et V 4.1) et des imprimantes couleur Xerox, H.P., Fuji et Codonics.
La vitesse résume le sens du progrès des matériels. Autrefois, la lenteur de l’imagerie
RM (durée des acquisitions et sensibilité au mouvement) interdisait l’examen des traumatisés et des enfants, du fait de leurs mouvements. Aujourd’hui, l’imagerie « rapide », par « hypergradients » (nombre élevé de milliTesla par mètre) et ajout de gradients « bi-polaires » pour la diffusion, par les types de séquences (« Echoplanar »), mode de calcul de l’image dans l’espace de Fourier, voire par le doublement de l’intensité du champ magnétique B (3 T.), offre un facteur de réduction du 0 temps d’acquisition dépassant 50 à 80 %. En résultent les accès au phénomène de diffusion, à la cartographie d’une anisotropie intra-voxellienne et à la tractographie
(cf infra). Au progrès dans l’acquisition s’ajoute celui du traitement, du stockage et de la circulation des images numériques.
L’évolution des techniques
Le nombre et le type des séquences de l’examen céphalique se sont enrichis en peu d’années. Les séquences classiques dites en Spin Echo « SEpT1 et SEpT2, Spin Echo ou Inversion Récu-pération », rapides ou non, avec éventuelle injection de contraste paramagnétique (Gadolinium) en T1, sont dites « anatomiques ». Pratiquées en 2D ou 3D (reconstructions et dissections), elles sont synchronisables avec le rythme cardiaque, pour reconstruire les flux (sang et Liquide Cérébro-Spinal, LCS).
D’autres séquences reflètent les modifications tissulaires, comme le Transfert d’Aimantation (dysplasies corticales), la séquence FLAIR (signal de l’œdème ou de la gliose), l’
Echo de Gradient T2 étoile (T2*) (hémosidérine, calcium), l’ Echo Planar (Diffusion et perfusion, accidents vasculaires cérébraux). Les séquences de spectroscopie (SRM) , mono- ou multi-voxels, approchent l’anabolisme ou le catabolisme tissulaires (principaux pics du N-acetyl-aspartate (NAA), Créatine (Cr), de la choline (Cho), du Myo-inositol (Myo), voire des lipides et des Lactates [1, 2]). Les séquences « en Temps de Vol » ou « Contraste de Phase » de l’angiographie par RM (ARM) , en 2D ou 3D, reconnaissent les troncs vasculaires. La sémiologie commande le choix de ces séquences, compromis permanent temps-efficacité.
L’IRM fonctionnelle (IRM(f)) met en œuvre les séquences « EPI BOLD » qui enregistrent les effets de la stimulation du cortex cérébral.
L’IRM en Tenseur de Diffusion (IRMTD) et anisotropie, ou « tractographie », dernière née des techniques IRM, isole la direction de faisceaux de la substance blanche encéphalique à partir des principes et techniques de diffusion. Ceux-ci ont été largement initiés par Denis Le Bihan [8]. Une nouvelle imagerie cérébrale naît de ce progrès en acquisition et traitement du signal.
FIG. 1 — Schémas : à gauche, ellipsoïde de diffusion anisotrope des molécules d’eau entre les axones et, à droite, reconstruction, de proche en proche, de la direction du vecteur propre dominant ; le trajet reconstruit dessine la direction où la diffusion des molécules d’eau est la plus probable. Ce trajet est proposé comme représentant un faisceau de fibres (tractus). La variabilité de cette représentation est illustrée.
Rappelons-en le principe . Dans l’encéphale, et à l’échelle moléculaire, les molécules de l’eau libre, intra-cellulaire et extra-cellulaire interstitielle, sont animées d’un mouvement brownien. En milieu aqueux, ce mouvement est dépourvu de direction préférentielle : la diffusion est dite « isotrope ». Les structures tissulaires qui définissent l’anatomie loco-régionale, tels les axones des faisceaux de la substance blanche, constituent des obstacles au mouvement des molécules d’eau. Elles les contraignent dans des directions préférentielles, telles celles des axones et faisceaux de la substance blanche. La diffusion devient « anisotrope » (Fig. 1). En IRM, la diffusion apparaît comme un déphasage entre les protons (abaissant l’intensité du signal réémis), suivi de leur rephasage, s’il n’y a pas eu déplacement dans cette direction. En pratique, les gradients bi-polaires permettent cette mesure. Ils introduisent un déphasage des spins suivi de leur rephasage, s’il n’y a pas eu déplacement dans leur direction (i.e. immobilité). La comparaison des signaux recueillis sans (S ) 0 puis avec (S) hypergradients (séquences de diffusion de Stejskal et Tanner [4]) quantifie donc le mouvement des molécules d’eau selon la direction de chacun des gradients. L’atténuation du signal en T2* permet la quantification de ce déplacement ou « diffusibilité du milieu » selon le Coefficient de Diffusion Apparente (« ADC » ou Apparent Diffusion Coefficient), exprimé en mm2/s. Dès 1989, Denis Le Bihan publie les valeurs des ADC des fibres de la substance blanche : axiales = 0,64 fi 0,06 mm2/s, transverses = 0,64 fi 0,05 mm2/s et corps calleux = 0,22 fi 0,022 mm2/s [4]. Le signal s’atténue d’autant plus que le pouvoir de déphasage et la diffusibilité sont grands.
Aujourd’hui, gradients bi-polaires et imagerie rapide en « Echoplanar » offrent une cartographie de l’anisotropie intra-voxellienne en routine [5] . Le déphasage provoqué par application des gradients bi-polaires se fait à facteur de gradient b = 0 s/mm2 puis b = 1000 s/mm2, dans 6 directions de l’espace, à 3 mm d’épaisseur. Les voxels mesurent 2,7 × 2,7 × 3 mm3. Sept volumes de 39 coupes couvrent l’encéphale entier.
Le premier volume correspond à une acquisition en pondération T2 classique, sans pondération de diffusion (b = 0). Les 6 autres volumes de coupes sont acquis dans les 6 directions différentes du codage de la diffusion. Au total, la séquence d’acquisition dure 5 m. et 58 s. L’immobilité du patient, avec contention, est indispensable.
La mesure de l’atténuation du signal, voxel à voxel, dans les six directions de l’espace, conduit à une cartographie de l’anisotropie. En effet, après un temps d’observation, le volume contenant la molécule d’eau n’est plus une sphère, mais une ellipsoïde (Fig.1). Celle-ci est caractérisée par ses trois diamètres, 0X, 0Y et 0Z. Les mesures de diffusion directionnelle sont rangées dans un tableau à neuf cellules, symétriques selon sa diagonale, le Tenseur de Diffusion (TD), qui permet le calcul de ces 3 valeurs. La mesure tensorielle, de proche en proche, effectue le tracé de la direction préférentielle de la diffusion selon les vecteurs propres du plus grand module dans chaque voxel (Fig.1). Ce trajet construit une « tractographie », coïncidant avec celui d’un ensemble d’axones ou faisceaux de substance blanche (« tractus » en nomenclature anatomique internationale ou « tracts » en anglais). En pratique, 300 examens récents sont acquis en IRM(TD), dans 4 séquences et 5 plans d’orientation
(3 orthogonaux et 2 obliques), chez des patients dont l’exploration est considérée comme normale ou la pathologie est connue, avec traitement tractographique. Les couleurs rouge, vert et bleu, ou d’autres, affichent les directions orthogonales vectorielles OX, OY et OZ [5 à 12].
La construction cartographique [5, 10] est réalisée en 5 étapes. 1°. Correction de la distorsion résultant des mouvements du patient, accentuée par la rapidité des séquences d’acquisition EPI (logiciel « Functool 2® », G.E.M.S . ) , 2°. normalisation des données en voxels cubiques (logiciel Statistical Parametric Mapping SPM’99®, the Wellcome Dept of Cognitive Neurology, Institute of Neurology, University College, London, UK), 3°. compilation des volumes (logiciel VolumeOne®, Image Computing and Analysis Laboratory, Dept of Radiology, the University of Tokyo Hospital), 4°. extraction des directions axonales supposées (logiciel dTV®, Image Computing and Analysis Lab., Dept of Radiology, the University of Tokyo Hospital), 5°. choix manuel de la région d’intérêt (ROI) dont on veut déterminer la traversée fasciculaire, enfin, se suivent. Cette méthode de reconstruction rejoint celles d’une littérature abondante [6 à 12].
DESCRIPTION DES RESULTATS NEURO-ANATOMIQUES ET DISCUSSION
L’iconographie résume en 5 planches (Pl. 1 à 5) les données d’anatomie descriptive et fonctionnelle, vasculaire , normale et pathologique. Les documents sélectionnent des observations dans la cohorte des patients examinés par IRM en routine clinique.
L’examen est conduit sur des indications neurologiques, neuro-ophtalmologiques ou ophtalmologiques [2].
Anatomie sectionnelle IRM des voies visuelles antérieures et plans céphaliques
Le Plan Neuro-Oculaire (PNO) axial, ou plan des voies visuelles d’avant en arrière, « de la cornée à la scissure calcarine » du scan RX, à partir des deux nerfs optiques en position primaire du regard, retrouve le « plan visuel » de Broca, orientation constante de l’encéphale dans l’espace jusqu’aux primates, en anatomie comparée [1, 2, 13]. Le Plan Neuro-Oculaire Trans-hémisphérique Oblique (PNOTO), vertical (Pl. 1d), contient la continuité des 4 segments, intra-oculaire, intra-orbitaire, intracanalaire puis intra-crânien, cisternal, du nerf optique, jusqu’à sa terminaison au chiasma. Un nouveau Plan Neuro-Opto-Tractal (PNOT), contient le tractus optique depuis le bord postérieur du chiasma jusqu’au corps genouillé externe (Pl.1 c,f). La tête du nerf optique (Pl.1 a à f), autrefois visible seulement sur sa surface antérieure, intra-oculaire (la papille mesure 1 mm de diamètre à l’ophtalmoscopie directe), devient visible en épaisseur pré- et rétro-laminaire (2 mm), en plus de l’approche coronale du « scanning laser ophtalmoscope » (SLO) ; l’augmentation rétrolaminaire (70 %) du diamètre (1,7 mm) des 1,5 millions deutoneurones visuels résulte de l’apposition de leur gaine de myéline, née dans la lame criblée. Le segment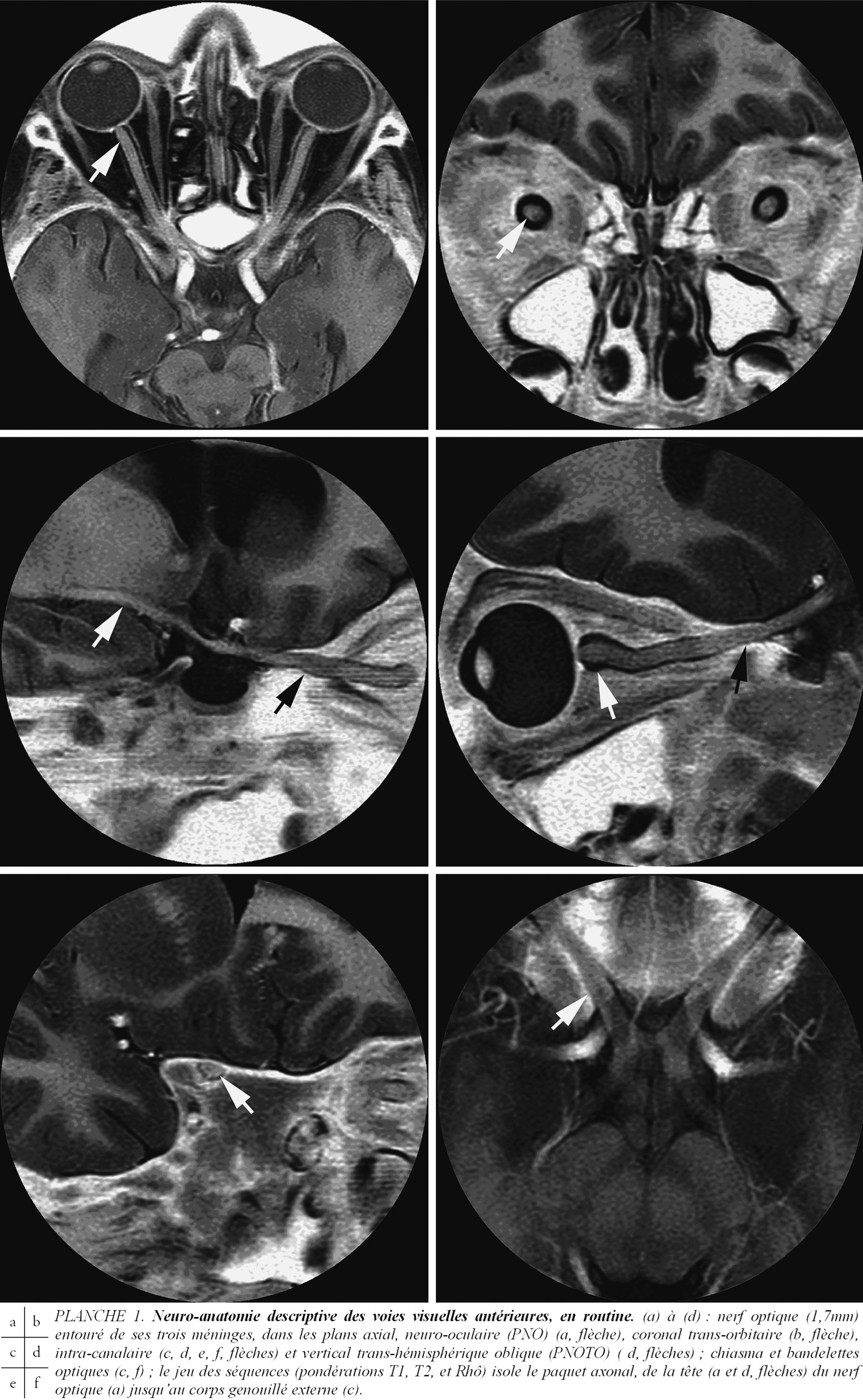
intra orbitaire du nerf optique entouré de ses méninges péri-optiques , pie-mère, arachnoïde avec espace sous arachnoïdien et dure-mère de signal différent (LCS de haut signal en pondération T2) jusqu’à l’apex (Pl. 1 a à d) devient observable.
Première conséquence de cette visualisation, une atrophie optique de la papille (de la pâleur à la blancheur au fond d’œil) nous apparaît accompagnée d’une réduction de diamètre du paquet axonal constituant le nerf optique. Cette réduction de diamètre des voies optiques pré- et rétro-chiasmatiques précède, parfois, l’atrophie clinique de la papille, comme dans le glaucome. En seconde conséquence , l’extension d’une tumeur ou de zones de haut signal (« plaques » de SEP, ischémie) devient corrélable à une atteinte du champ visuel ou des PEV.
La maturation est décelée en IRM par le haut signal de la myélinisation néo-natale , reconnue dès le stade post-fœtal (cf : IRM fœtale) [2]. La progression caudocrânienne de la myélinisation des radiations optiques est détectable pendant la première année, même si le terme est annexé à la seule stimulation corticale, l’IRM étant « fonctionnelle » par nature, on l’a vu (molécules de H2O, agitation brownienne, diffusion, circulation, perfusion…).
L’anatomie des mouvements oculaires ou « IRM oculaire dynamique » (IRMOD) est décrite et appliquée depuis 15 ans [1, 2, 14]. L’enregistrement « en boucle » de plusieurs regards binoculaires, orientés sur des cibles à la demande et fixés, offre une ciné-analyse des six muscles droits et obliques de l’orbite. Le diagnostic étiologique d’une atteinte musculaire (myosite basedowienne), d’un syndrome malformatif (orbitaire ou musculaire isolé), l’indication et/ou le suivi chirurgicaux musculaires (strabologie) bénéficient de l’IRMOD [14].
L’anatomie circulatoire du sang et du Liquide Cérébro-Spinal (LCS) relève d’une angiographie IRM (ARM) première . Adaptée, elle permet désormais l’étude anatomique de l’artère ophtalmique, de faible calibre ([dH] 1 mm), sur la majeure partie de son trajet, né de l’union des segments C2-C3 de l’artère carotide interne (Pl.2 a, b, c) [1]. Des interruptions de flux (thrombose) ou, surtout, des anévrysmes, de petit calibre, sont reconnus. Ailleurs (hypertension intra-cranienne), la circulation intraventriculaire du LCS est vue, en vitesse et sens des flux (V3, V4, aqueduc de Sylvius, foramen de Monro). Diagnostic étiologique et suivi thérapeutique d’une hydrocéphalie en bénéficient [2].
Plasticité corticale et IRM fonctionnelle des voies visuelles
La plasticité de la réponse corticale visuelle, après rééducation, est démontrée en IRM(f). Appliqués à la vision, dès ses débuts [I, , I], et avant l’envolée du « brain mapping » [I], les paradigmes de stimulation électro-physiologique se révèlent précieux dans l’étude corticale, notamment à visée thérapeutique.
Au-delà des exemples neurologiques connus de récupération après accident vaculaire cérébral, l’exploration des amblyopes démontre que la rééducation orthoptique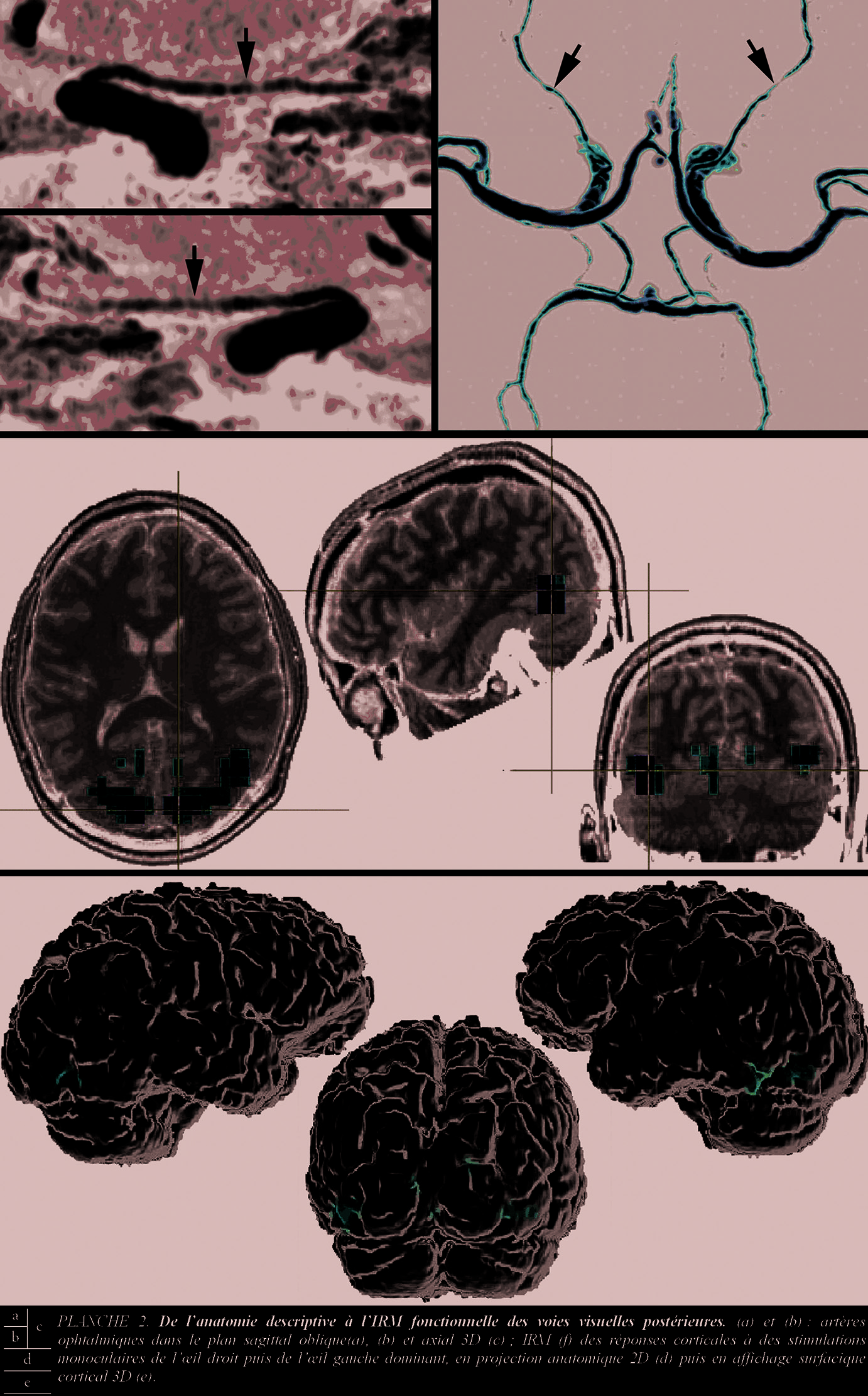
amène une « sur-réponse » corticale lors de la stimulation monoculaire. Ce nouvel exemple de plasticité cérébrale prouve et encourage les stratégies de rééducation en basse vision (Pl.2 d, e).
La sur-correction optique, expérimentale, d’un astigmatisme , autre exemple, se traduit par l’extension du volume de la réponse corticale [1]. Ces travaux complètent ceux, plus anciens, portant sur la commande corticale en oculo-motricité. Au plan physiologique, l’association de paradigmes de type « coin tournant » (rotating wedge) et de logiciel « d’étalement-applatissement du cortex » vérifient la somatotopie des aires visuelles V1 à V5 (Pl. 3 a et b) [1].
Anatomie axonale et fasciculaire en Imagerie RM tractographique (IRMTD)
L’IRMTD, objet d’une recherche mondiale foisonnante et rapide , où physique, mathé- matiques et statistiques se croisent [5 à 12], ne montre que la représentation vectorielle, statistique, des directions engendrées par la diffusion anisotropique de l’eau (et, non pas, l’image directe des faisceaux d’axones myélinisés). La trace, d’un diamètre apparent minimum de un demi-millimètre, a un contenu variable, le diamètre axonal variant de 1 à 15 µ et le voxel mesurant 27 mm3. Plusieurs axones sont nécessaires pour générer le signal suffisant au calcul d’une direction.
Limite technique en acquisition et calcul directionnel, le mouvement : un décalage des plans de coupes, à l’acquisition, interdit leur reconstruction. D’où l’immobilité stricte requise et des compromis minimisant la durée des séquences [5] et des logiciels de correction automatique pour les minimes déplacements inter-coupes. Deuxième limitation, l’acquisition et le traitement, limités à 6 directions spatiales . Une acquisition dans 30 directions de l’espace, avec champ B à 3T et gradients adaptés (cf 0 infra), surmontera cette limite. Le changement directionnel et les croisements axonaux sont une troisième limitation anatomique, normale et pathologique , à la repré- sentation fasciculaire. Un changement directionnel brutal provoque une « isotropisation » locale, avec suppression du vecteur dominant et sa représentation de proche en proche. Une forte densité axonale à faisceaux adjacents et directions variées exclut toute reconstruction . Un logiciel traitant un nombre plus élevé de directions d’acquisitions (jusqu’à 30) est l’espoir, même si le modèle du tenseur devient insuffisant. Un nouveau type de cartographie, traduisant les différences de diffusion linéaires, planaires ou sphériques, apparaît [11]. Autre limite, peu citée à notre connaissance , la densité vasculaire de la substance blanche sous-corticale, doit retentir sur le calcul [17, 18]. Enfin, une pathologie myélinique, inflammatoire, oedèmateuse ou tumorale interrompt ou refoule la reconstruction fasciculaire (Pl. 5) [9]. Ces limites doivent être signalées dans tout ouvrage.
La référence aux traités de l’anatomie classique est prudente. Le savoir neuropathologique du XIXe siècle, après R.Y. Cajal, relève des colorations cellulaires, axonales ou myéliniques, des contrôles, des techniques de dégénérescence et des dissections, références post-mortem. L ’Anatomie des centres nerveux (J. Déjerine)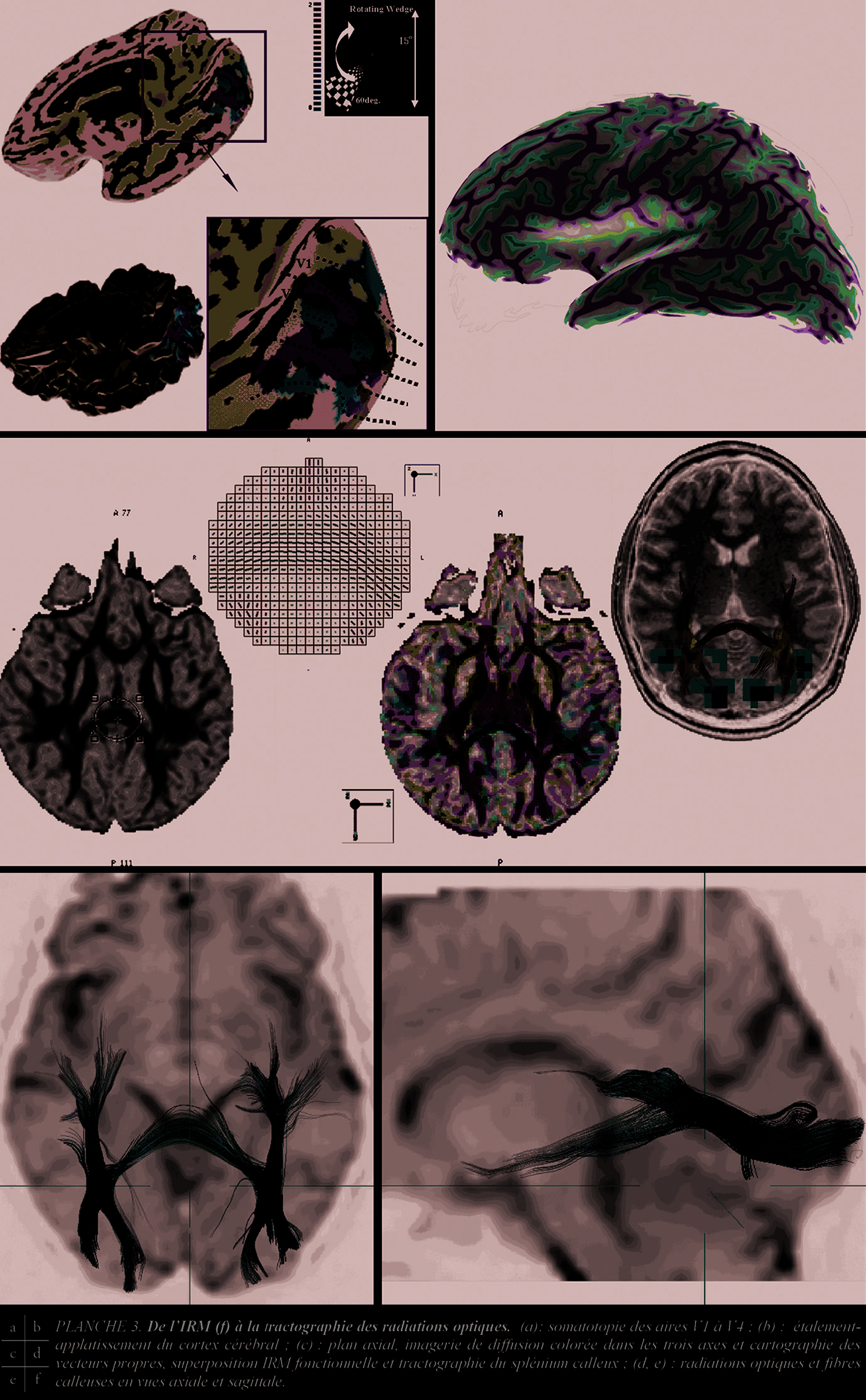
[19] précède d’autres références [20 à 25]. La réalité de trois types de fibres de la substance blanche, fibres de projection, commissurales et d’association reconnus dans le centre semi-ovale, tangent et supérieur au corps calleux, persiste.
Les fibres de projection relient le cortex et les centres sous-corticaux, comme le système fimbriafornix et hippocampe, les fibres cortico-striées et cortico-tegmentales, les composants importants de la capsule externe et la majorité des composants de la capsule interne. Les 4 segments de la capsule interne (Pl. 4), bras antérieur (pédoncule antérieur du thalamus et faisceau d’Arnold), genou (tractus cortico-nucléaire), bras postérieur (tractus cortico-spinal et cortico-rubrique) et partie rétro-lenticulaire (radiations optique et acoustique) sont mieux visibles que la capsule externe. Leur orientation tractale, incomplète, coïncide avec les schémas [25]. La corona radiata ( Pl. 4 e, f ) est partiellement analysable, du fait de l’intrication des tractus ascendants et descendants, associatifs et commissuraux. Les radiations optiques, bien isolables (proximité du tapetum et de la corne occipitale du ventricule), sont un enjeu [5, 7, 10, 12] (Pl. 3, c à f). Les fibres commissurales inter-hémisphériques du diencéphale et du télencéphale , chiasma et commissures hippocampique et antérieure, sont difficilement isolables (artefacts de proximité de la base du crâne). Le corps calleux, en revanche, étalé dans ses composants, du rostrum en avant aux genu, truncus puis splenium, en arrière, permet une vision de ses contingents de radiations frontales, pariétales et occipitales joignant les régions hémisphériques symétriques, traversant la couronne rayonnante jusqu’à proximité des fibres en « U » sous-corticales (Pl.4 a à c). L’isolement de fibres transversales et horizontales reste difficile (organisation tractale in vivo d’une densité ascendante encore mal connue). L’atrophie du splenium calleux (expériences de privation sensorielle chez les chatons nouveaux-nés en vision monoculaire) peut conduire à faire concorder les données IRM, IRM(f) et IRMTD dans l’amblyopie (Pl. 3 c, d). Les fibres d’association intra-hémisphériques des aires corticales sont mal visibles. Positionnement de la ROI et augmentation du nombre des directions sont essentiels. Les fibres associatives corticales courtes , n’atteignant pas la substance blanche et traversant la substance blanche sur un court trajet, ne sont pas reconnues. Les fibres longues, en faisceaux, sont isolées comme le Cingulum, les faisceaux unciné, occipito-frontal inférieur et supérieur, longitudinal supérieur et inférieur.
CONCLUSION
Les voies visuelles illustrent la complexité d’une organisation neuro-anatomique descriptive et fonctionnelle. Après le temps des localisations isotopiques en TEP, la diversification des techniques IRM, inoffensives, élargit sa place dans la compréhension de la physiologie visuelle, normale et pathologique. Déjà en routine clinique , et complétant l’anatomie IRM para-millimétrique des traités déjà classiques [26 à 28], l’IRM fonctionnelle et la tractographie, notamment, offrent des résultats prometteurs. Leur association accompagne le progrès des neurosciences avec une neuroanatomie nouvelle, celle de la connectivité . Des certitudes restent à acquérir dans la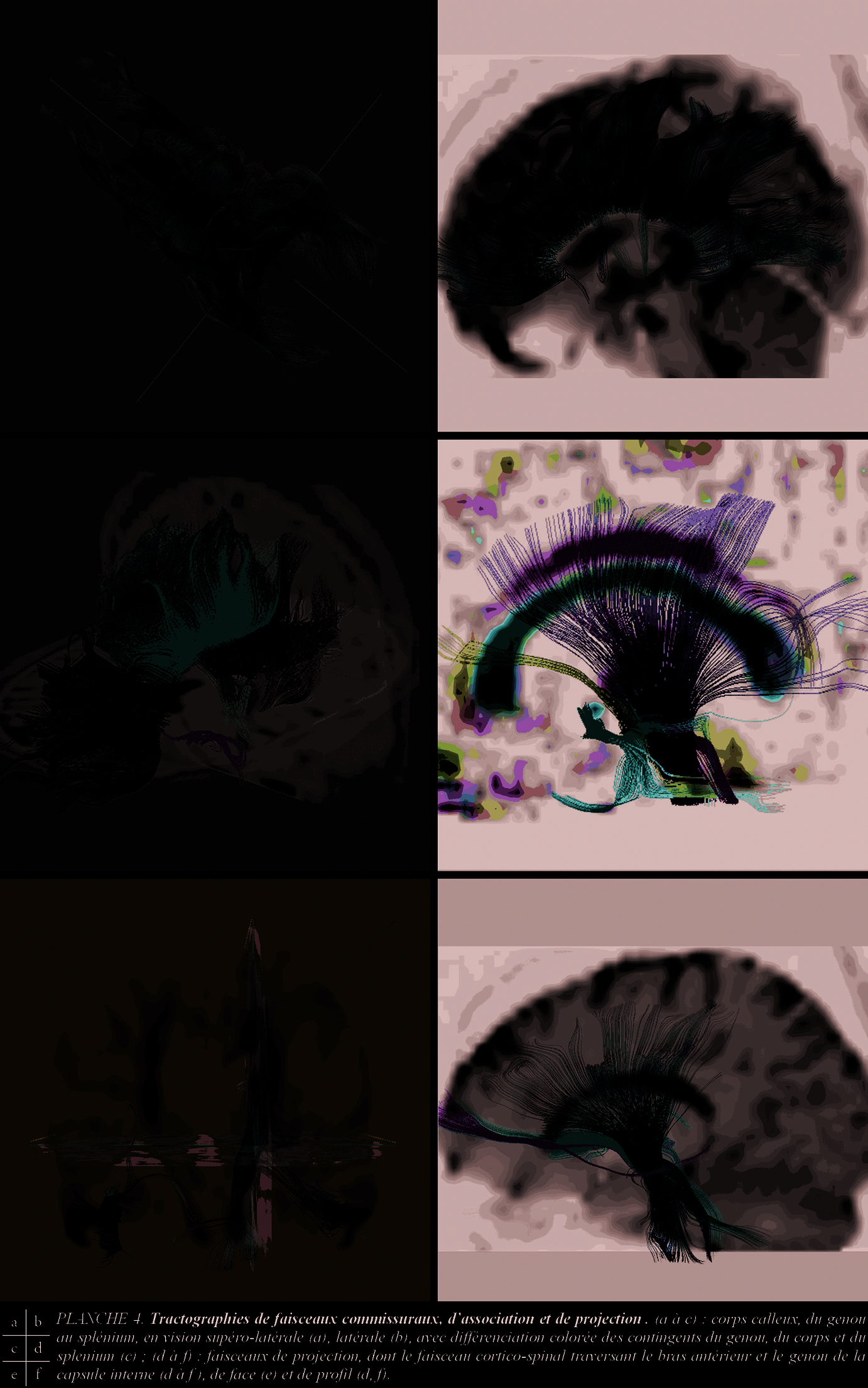
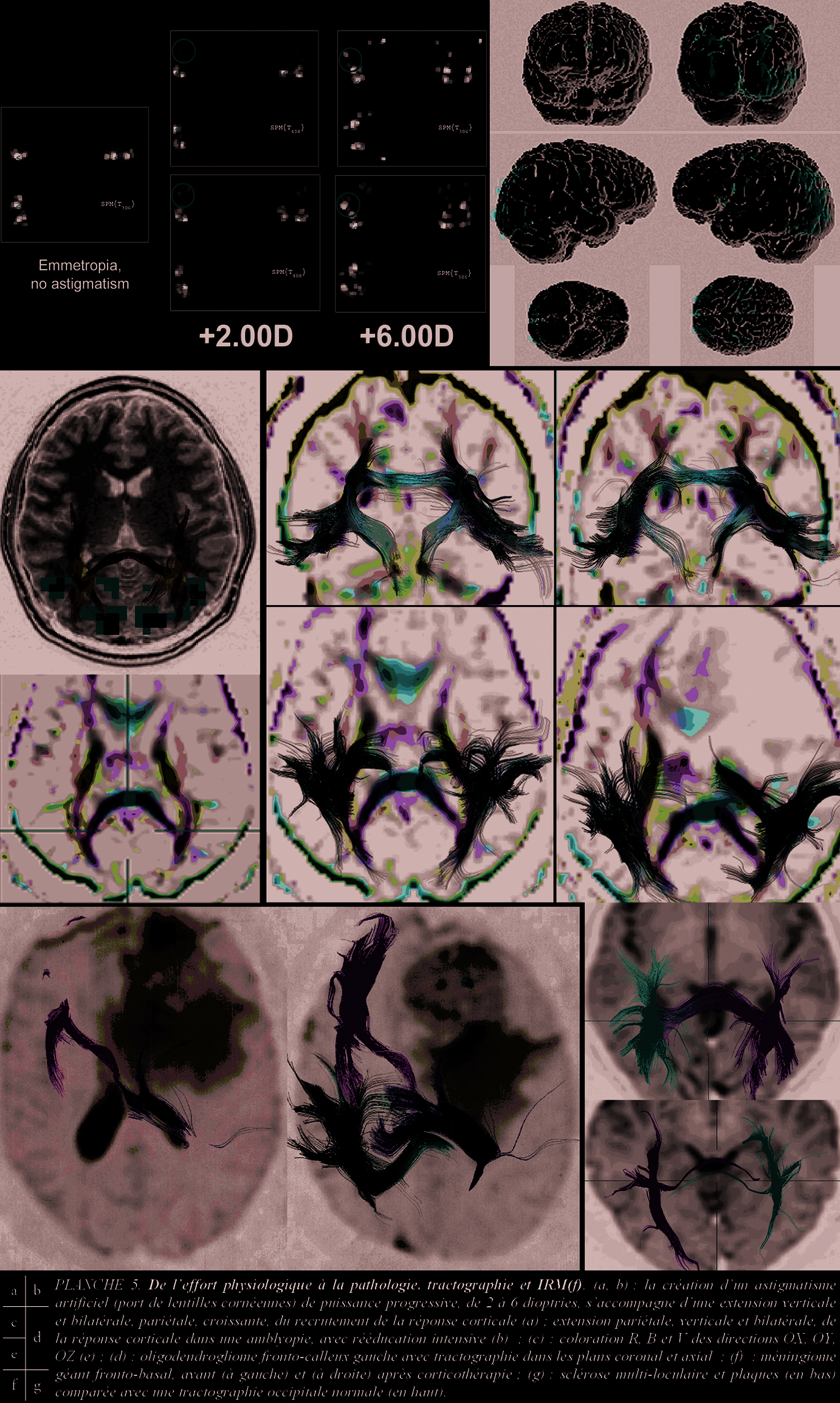
reconnaissance des faisceaux et des obstacles restent à contourner (mouvement, directions,…). Une « sémiologie » de la désorganisation des tractus débute (Pl. 5).
Raisonnée, une émotion naît de cette approche progressive de l’intimité du faisceau nerveux, observé in vivo , dans l’encéphale du patient observé [29].
BIBLIOGRAPHIE [1] CABANIS E.A., IBA-ZIZEN M.T., NGUYEN T.H., ISTOC A., STIEVENART J.L., THIBIERGE M., BELLINGER L., ABANOU A., CAVÉZIAN R., YOSHIDA M., SHIBA T., HABAS C., LAVAYSSIÈRE R., MAY F., ROTH A., KITAHARA K. — Neuro-anatomie et imagerie, partie 1, p. 3-64 in SAFRAN A.B., VIGHETTO A. LANDIS T., CABANIS E.A., rapporteurs et 84 coll., Rapport annuel, 110e Congrès de la Société Française d’Ophtalmologie, Paris (08-12.05.04), Masson, Paris, mai 2004 (812 p).
[2] CABANIS E.A., BOURGEOIS H., IBA-ZIZEN M.T. et 122 coll. — L’imagerie en ophtalmologie.
Rapport annuel, 103e Congrès de la Société Française d’Ophtalmologie (I), Paris, I4.05.96, Masson, Paris, 1996 (762 p).
[3] DE ZWART J.A., LEDDEN P.J., van GELDEREN P., BODURKA J., CHU R., DUYN J.H. — Signal-tonoise ratio and parallel imaging performance of a 16-channel receive-only brain coil array at 3.0 Tesla. Magn. Reson. Med ., 2004, 51, 22-26.
[4] LE BIHAN D., MANGIN J.F., POUPON C., CLARK C.A., PAPPATA S., MOLKO N. et al. — Diffusion tensor imaging : concepts and applications.
J. Magn. Reson. Imaging , 2001, 13, 534-546.
[5] NGUYEN T.H., IBA-ZIZEN M.T., BELLINGER L., YOSHIDA M., STIEVENART J.L., SHIBA T., ABANOU A., KITAHARA K., CABANIS E.A. — Restauration du trajet axonal des radiations optiques en pathologie tumorale après traitement : suivi évolutif en tractographie. Programme, 110e Congrès de la Société Française d’Ophtalmologie (SFO), 8-12 mai 2004, Paris, Journal Français d’Ophtalmologie , numéro spécial, no 102 , p. 169, Paris, 2004.
[6] BAMMER R., ACAR B., MOSELEY M.E. — In vivo MR tractography using diffusion imaging.
European journal of radiology , 2003, 45 , 223-234.
[7] CATANI M., JONES D.K., DONATO R., FFYTCHE D.H. — Occipito-temporal connections in the human brain. Brain , 2003, 126 , 2093-2107.
[8] GUYE M., PARKER G. J.M., SYMMS M., BOULBY P., WHEELERKINGSORTT C.A.M., SALEKHADDADU A., BARKER G.J., DUNCAN J.S.. — Combined functional MRI and tractography to demonstrate the connectivity of the human primary motor cortex in vivo . NeuroImage , 2003, 19 , 1349-1360.
[9] MASUTANI Y., AOKI S., ABE O., HAYASHI N., OTOMO K. — MR diffusion tensor imaging : recent advance and new techniques for diffusion tensor visualization. European journal of radiology , 2003, 46 , 53-66.
[10] WAKANA S., JIANG H., NAGAE-POETSCHER L.M., van ZIJIL P.C.M., MORI S. — Fiber tract-based atlas of human white matter anatomy. Radiology , 2004, 230 , 77-97.
[11] ZHANG S., BASTIN M.E., LAIDLAW D.H., SINHA S., ARMITAGE P.A., DEISBOECK T.S. — Visualization and analysis of white matter structural asymmetry in diffusion tensor MRI Data. Magn.
Reson. Med ., 2004, 51, 140-147.
[12] YOSHIDA M., IDA M., NGUYEN T.H., STIEVENART J.L., IBA-ZEZEN M.T., BELLINGER L., NAGAO T., KIKUCHI S., HARA T., KUBO H., SHIBA T., KANDATSU A., KITAHARA K., CABANIS E.A. — A case of cerebral haemorrhage demonstrating a degeneration of optic radiation with diffusion tensor magnetic resonance imaging. 2004, sous presse.
[13] CABANIS E.A., IBA-ZIZEN M.T., PINEAU H., COIN J.L., NEWMAN N., SALVOLINI U. — CT scanning in the ‘‘ neuro-ocular plane ’’ : the optic pathways as a ‘‘ new ’’ cephalic plane.
Neuro-ophthalmology , 1981, 1 , (4), 237-252.
[14] ROTH A., SPEEG-SCHATZ C. — Eye Muscle Surgery. Basic data operative techniques surgical strategy. English edition Swets & Zeitlinger Publishers, Lisse, 2001.
[15] BELLIVEAU J.W., KENNEDY D.N., MC KINSTRY R.C. et al . — Functionnal mapping of the human visual cortex by magnetic resonance imaging.
Science , II, 254 , 716-719.
[16] MAZZIOTTA J.C., TOGA A.W., FRACKOWIAK R.S.J. — Brain mapping. The disorders. Academic Press, San Diego, San Francisco, New York, Boston, London, Sydney, 2000.
[17] SALAMON G. et al . — Atlas de la vascularisation artérielle du cerveau chez l’homme. Sandoz,
Paris, 1971.
[18] SZIKLA G., BOUVIER G., HORI T., PETROV V., CABANIS E.A., FARNARIER P., IBA-ZIZEN M.T. — Angiography of the human brain cortex. Springer-Verlag, Berlin, 1997.
[19] DÉJERINE J. avec la collaboration de Mme DÉJERINE-KLUMPKE — L’Anatomie des centres nerveux. Première édition, Rueff et Cie, Paris, 1895, réédition, Masson, Paris, 1981.
[20] DELMAS A., PERTUISET B. — Topométrie cranio-encéphalique chez l’homme, Masson et Cie, Charles C. Thomas, Paris, Springfield, 1959.
[21] GLUHBEGOBIV N., WILLIAMS T.H. — The humain brain. A photographic guide. Harper and Row, Publishers, Inc., Hagerstown, 1980.
[22] TALAIRACH J., TOURNOUX P. — Co-planar stereotaxic. Atlas of the human brain. 3-dimensional proportional system : and approach to cerebral imaging. Georg Thieme Verlag, Stuttgart, 1988.
[23] DUVERNOIS H., CABANIS E.A., IBA-ZIZEN M.T., TAMRZA J., GUYOT J. — The human brain surface. Three-dimensional sectional anatomy and MRI. Springer-Verlag, Wien, 1991.
[24] DELMAS A. — Préface de la 12e édition, in ROUVIÈRE H., DELMAS A. — Anatomie humaine, descriptive, topographique et fonctionnelle, 4 tomes, 15ème éd., Masson, Paris, 2002.
[25] JOSEPH J.T., CARDOZO D.L. — Functional neuroanatomy. An interactive text and manual.
Willey, Indianapolis, 2004.
[26] ROSEN E.S., THOMPSON H.S., CUMMINGS W.J.K., EUSTACHE P. — Neuro-ophthalmology, Mosby, London, Philadelphia, 1998.
[27] TITARELLI R., SALVOLNI U., CARELLA E. — TC e RM in oftalmologia ; Società oftalmologica Italiana. Relazione al LXXIV Congresso, Roma, Novembre 1994, Casa Editrice Mattioli — Via Coduro 1/B Fidenza PR, 1994.
[28] TAMRAZ J., OUTIN C., FORJAZ SECCA M., SOUSSI B. — MRI principles of the head, skull base and spine. A clinical approach. Springer, Paris, Berlin, Heidelberg, 2002.
[29] FÉNELON G., CAMBIER J., WIDLÖCHER D. — Hallucinations, regards croisés. Eticom (Acanthe), Masson, Paris, 2002.
REMERCIEMENTS
Les auteurs remercient vivement, pour leur aide et leur contribution à ce travail, MM. Kenji Kitahara (Tokyo), Takuya Shiba (Tokyo), Jean-Jacques Hauw, Membre de l’Académie nationale de médecine, Gilbert Bereziat (Université Pierre et Marie Curie Paris VI) et la Compagnie General Electric Healthcare (GEHC), pour son assistance.
DISCUSSION
M. Philippe MONOD-BROCA
L’excellente communication d’Emmanuel Alain Cabanis et de son équipe m’incite à une réflexion et à deux questions. La réflexion est que ce travail clôt définitivement la controverse qui opposa il y a plus d’un siècle Paul Broca à Claude Bernard. Ce dernier soutenait qu’il n’y avait plus rien à tirer de l’anatomie du cerveau pour en mieux comprendre la fonction, c’est-à-dire la physiologie. Or Broca montra, peu d’années après, que l’anatomie et elle seule lui avait permis de localiser le centre du langage, l’aphasie de Broca, et plus encore que l’anatomie, et elle seule, lui avait permis d’individualiser le grand lobe limbique qui porte son nom et même d’en discerner la fonction. L’imagerie neuro-anatomique nous démontre aujourd’hui que l’anatomie et la fonction sont indissociables et que leurs progrès vont de pair.
Broca finalement était sur la bonne voie. Ma première question concerne les limites de la normalité. Les merveilleux progrès des techniques de neuro-dissection par IRM doivent conduire à des images où les anomalies sont si minimes qu’il doit être difficile de décider si elles sont pathologiques, mais tout à l’inverse, il doit bien exister des cas où des anomalies, même très minimes, peuvent être pathologiques mais comment les classer lorsqu’elles surviennent de façon imprévue et chez un sujet dont la maladie est encore totalement inapparente, et parfaitement latente. Votre équipe a-t-elle connu de telles difficultés ? La deuxième question touche aux progrès de l’IRM. Nous savons, depuis soixante ans, mettre en résonance magnétique les atomes d’hydrogène. Emmanuel Alain Cabanis peut-il nous dire si le moment approche où l’on saura mettre en résonance d’autres atomes, ce qui ouvrirait la voie aux diagnostics cliniques non invasifs, sans prélèvement de tissu ?
La première question, concernant les limites de la normalité, est difficile. S’agit-il d’une « variante individuelle de la normale » d’une micro-pathologie débutante, d’une microanomalie congénitale ou encore, chez le sujet âgé, d’un acquis de l’avance en âge ? En voici trois exemples : — une zone de haut signal encéphalique, en pondération T2, peut traduire une maladie démyélinisante « a minima » telle une plaque de SEP, ou bien un micro-accident vasculaire cérébral, asymptomatique. En cas de doute, un examen de contrôle évolutif, à distance, est la réponse de sécurité. — un deuxième exemple est celui d’un dysmorphisme discret de la ligne médiane, telle une agénésie partielle du corps calleux ou une discrète anomalie de la charnière cervico-occipitale. — La découverte fortuite de ce qui peut être un petit anévrysme, incite à approfondir le bilan (2ème examen avec multiplication des séquences) ou poursuivre l’exploration par une artériographie conventionnelle. Une autre source d’incertitude est la maladie latente ou inapparente. Un exemple : celui de la substance blanche « en apparence normale » au plan morphologique, alors que la SRM protonique est, elle, pathologique. Une réduction du rapport N-Acétyl-Aspartate/Créatine (NAA/Cr) (réduction de la population axonale) existe, avec rapport choline/créatine (Cho/Cr) également altéré. L’évolution a fait affirmer la primauté du désordre métabolique sur l’altération morphologique. Il en va de même pour l’adrénomyéloneurodystrophie (AMN) p.ex., avec baisse du rapport NAA/Cr et rapport myo-inositol/créatine (Myo/Cr) augmenté traduisant l’activité des cellules gliales. La deuxième question concerne les progrès de la RMN et la spectroscopie RM d’autres atomes que l’hydrogène. Rappelons que le phénomène RMN est d’abord exploité en spectroscopie liquidienne in vitro , sur les noyaux atomiques dits paramagné- tiques, dont l’hydrogène, le phosphore, le sodium, le fluor et le carbone. La pratique in vivo de la SRM protonique suit le progrès de la puissance des champs magnétiques,
explorant le métabolisme oxydatif anaérobie et la glycolyse, s’applique à l’accident vasculaire, aux tumeurs, aux muscles squelettiques, voir à l’étude de greffons rénaux. Une pause intervient, car l’abondance trop faible de l’atome exige un échantillon trop volumineux (3 × 3 × 3 cm) et une trop longue durée d’acquisition. La SRM protonique, avec cette cartographie métabolique reste le seul outil clinique de routine pour l’encéphale. Les autres noyaux relèvent des espoirs mis dans les hauts champs magnétiques, au delà des 3T, vers 7 Tesla. Le diagnostic biologique non invasif, sans prélèvement lésionnel, n’est, hélas, pas prévisible à court terme.
M. Roger NORDMANN
Qu’a apporté jusqu’ici la cartographie biochimique (portant notamment sur le N-AcétylAspartate) en complément des autres techniques ? Ces multiples nouvelles techniques d’imagerie sont-elles d’une innocuité totale ?
Cette « cartographie » biochimique par Spectroscopie en Résonance Magnétique (SRM) de l’encéphale in vivo , en routine clinique, relève du seul noyau 1H. Il représente 80 % de H2O et 70 % des tissus biologiques vivants, donc en abondance très supérieure à celles du 31P, du 23Na, du 13C ou du 19F. La SRM protonique de la substance blanche fait partie de nos protocoles d’examen, depuis huit ans. Sa riche sémiologie peut être résumée par les 4 pics principaux, du N-Acétyl-Aspartate (NAA) (2,01 à 2,6 ppm), reflet de la population neuronale, de la créatine-phosphocréatine (Cr) (3,03 à 3,94 ppm), constante dans le cerveau sain et dénominateur commun du rapport des métabolites, de la choline (Cho) (3,22 ppm), témoin de la synthèse ou de la dégradation des membranes cellulaires et du pic myo-inositol (Myo) (de 3,56 à 4,6 ppm), marqueur de la prolifération gliale, en plus de quelques autres pics (lactates, glutamates, pics pathologiques etc.). Outre l’exemple cité (substance blanche en apparence Normale ou SBAN), ce sont toutes les atteintes de la substance blanche, congénitales ou dégénératives, inflammatoires ou ischémiques, traumatiques ou métaboliques, qui méritent une SRM, preuve diagnostique et facteur pronostique majeur. A la question sur l’innocuité totale de ces multiples nouvelles techniques d’imagerie RM, la réponse est oui, dans l’état actuel de nos connaissances, et contrairement aux radiations des RX, pour l’œil en particulier.
M. Pierre RONDOT
L’IRM fonctionnelle permet-elle d’apporter un pronostic dans les traumatismes, les isché- mies ou les autres neuropathies du nerf optique ?
La réponse est oui « mais ». Une neuropathie optique, d’origine traumatique, ischémique ou inflammatoire se traduit d’abord par une altération du signal du nerf optique, sur l’un (ou plusieurs) de ses quatre segments, entre sa tête et sa terminaison au chiasma. La présence d’un haut signal spontané, soit en pondération T1 (hématome posttraumatique, urgences), soit en pondération T2 (souffrance axonale localisée, quelle qu’en soit l’étiologie), accompagne le diagnostic clinique de baisse visuelle. La présence de ce haut signal, avec ou sans atrophie neuro-opto-tractale, est reconnue à distance, parfois lointaine, du signe visuel initial. En ce qui concerne spécifiquement l’IRM(f), l’expérience acquise dans l’amblyopie démontre : — les modifications de la réponse corticale, dans le sens d’une extension pariétale, lors du stimulus visuel optimisé (damier), — la modification de cette réponse avec le temps, i.e. avec la répétition des
explorations, — l’efficacité de la réadaptation fonctionnelle des situations de basse vision, avec l’orthoptique. Il en résulte que, en théorie, le diagnostic clinique et morphologique IRM de neuropathie optique constitue une indication d’IRM fonctionnelle visuelle, répétée dans le temps, avec un intervalle calqué sur l’évolution clinique.
M. Gilles CRÉPIN
L’acquisition sensorielle se fait progressivement chez le fœtus à partir de la 25è semaine environ et, dans l’ordre, le toucher, l’audition, la vision et l’odorat. Nos connaissances grossières se font par les tests réactifs in utero et les études de myélinisation sur des fœtus d’âge croissant. Pensez-vous que l’IRM fonctionnelle permette d’affiner notre savoir sur le développement de la vision in utero ?
L’IRM offre la vision morphologique directe de la myélinisation encéphalique, dès la naissance (myélinisation médullo-bulbaire proche de l’étage du trou occipital). La myé- linisation se traduit par un haut signal en T2 (graisses membranaires) tranchant sur le signal hydrique de l’encéphale adjacent. On assiste à la progression de la myéline selon les schémas connus, dans le sens caudo-crânien, aux étages des myélencéphale (bulbe, moelle allongée), métencéphale, mésencéphale et diencéphale avec les capsules internes et les voies cortico-nucléaires, vers le cortex pyramidal. Dans notre expérience, les voies optiques bandelettiques (tractales) se myélinisent à partir de l’âge de 9-10 mois, pour atteindre le cortex calcarin vers 10-12 mois ou plus. L’approche physiologique de la myélinisation, elle, est plus difficile pour trois raisons. Première raison, l’IRM fœtale, aujourd’hui bien maîtrisée en France, par quelques équipes spécialisées, se concentre sur la difficile question de l’indication d’interruption de la grossesse, en particulier pour malformations congénitales de l’encéphale, détectées en échographie et analysées en IRM. La finesse de la résolution spatiale est, là encore, essentielle. Elle repose sur la très haute vitesse d’acquisition des séquences. Une deuxième raison tient à la technique de l’IRM(f) qui repose sur la variation du signal cortical provoquée par des stimulus visuels calibrés. Enregistrer cette variation de signal signifie immobiliser parfaitement la tête pendant quelques minutes et provoquer un stimulus visuel veut dire lui faire atteindre les rétines de l’enfant, à travers les enveloppes maternelles. Ces deux conditions ne sont pas encore réunies, à notre connaissance.
* Membre correspondant de l’Académie nationale de médecine. ** Service de neuro-imagerie et radiologie, centre hospitalier national des quinze-vingt, 28, rue de Charenton — 75571 Paris Cedex 12 — France. *** Department of ophtalmology (Pfr Kenji KITAHNARA) Jikeï University School of medicine. **** Membre de l’Académie nationale de médecine. Tirés à part : Professeur E.A. CABANIS, à l’adresse ci-dessus. Article reçu le 17 février, accepté le 7 juin 2004.
Bull. Acad. Natle Méd., 2004, 188, no 7, 1153-1172, séance du 12 octobre 2004


