Résumé
Les solutions de remplissage utilisées en thérapeutique (albumine, dextranes, gélatines modifiées, hydroxyéthylamidons) sont des substituts du plasma. Aucun ne peut assurer le transport de l’oxygène. Or l’importance clinique des globules rouges est telle que depuis plusieurs décennies, ils sont l’objet de nombreuses tentatives pour leur trouver des composés de substitution. Si ces recherches semblaient autrefois utopiques, elles apparaissent aujourd’hui plus réalistes puisqu’elles ont abouti à des substituts érythrocytaires potentiels prometteurs, en particulier pour les transporteurs d’oxygène sous forme de solutions d’hémoglobine (Hemoglobin Based Oxygen Carriers ou HBOC). Pourtant depuis 2000 leur développement se trouve ralenti par l’observation d’effets secondaires multiples lors des essais cliniques : élévation de la pression artérielle induite par un effet vasoconstricteur de l’hémoglobine libre dans le plasma, auto oxydation de l’hémoprotéine circulante avec formation de méthémoglobine inapte au transport de l’oxygène, génération de radicaux libres responsables d’un stress oxydant.
Summary
Volume loading solutions used therapeutically (albumin, dextrans, modified gelatins and hydroxylstarches) are simple plasma substitutes and cannot ensure oxygen transport. The search for erythrocyte substitutes initially seemed utopian, but this goal is now within our reach, in the form of hemoglobin-based oxygen carriers (HBOC) for example. The clinical development of HBOC has been slowed by adverse effects, including an increase in arterial pressure due to the vasoconstrictive effect of cell-free hemoglobin in plasma, haemoprotein autoxidation leading to methemoglobin formation, and free radical generation that creates oxidative stress.
Les solutions de remplissage utilisées en thérapeutique (albumine, dextranes, gélatines modifiées, hydroxyéthylamidons) sont des substituts du plasma incapables d’assurer le transport de l’oxygène.
Or l’importance clinique des globules rouges est telle que depuis plusieurs décennies, ils sont l’objet de nombreuses tentatives pour leur trouver des composés de substitution.
Quelle que soit la molécule, le substitut idéal doit pouvoir délivrer de l’oxygène aux tissus, provoquer un minimum d’effets secondaires, ne pas nécessiter de contrôle de compatibilité, avoir une demi-vie prolongée dans la circulation, rester stable durant toute la période de stockage, être facilement reconstitué et avoir un coût raisonnable.
A ce jour aucun des produits en cours d’évaluation ne réunit l’ensemble de ces qualités.
Deux axes de recherche faisant appel à deux classes pharmacologiques différentes sont développés. Ce sont les perfluorocarbures (PFC) et les transporteurs d’oxygène à base d’hémoglobine (HBOC pour Hemoglobin Based Oxygen Carriers) Si ces recherches semblaient autrefois utopiques, elles apparaissent aujourd’hui plus réalistes puisqu’elles ont abouti à des substituts érythrocytaires potentiels, en particulier pour les transporteurs d’oxygène sous forme de solutions d’hémoglobine (Hemoglobin Based Oxygen Carriers ou HBOC).
L’hémoglobine soustraite de son environnement naturel, par extraction du globule rouge, reste capable de transporter l’oxygène et cela n’induit pas un comportement antigénique. En revanche elle présente plusieurs inconvénients majeurs :
— la perte du 2,3 diphosphoglycérate se traduit par une augmentation de l’affinité pour l’oxygène de l’hémoglobine (P50 égale à 12 mmHg au lieu de 27 mmHg) qui rend difficile l’oxygénation tissulaire.
— l’absence de membrane érythrocytaire facilite l’altération de la structure tétramérique et favorise sa dissociation en dimères qui sont alors éliminés de la circulation par extravasation et filtration rénale [1].
— la perte des systèmes enzymatiques de lutte contre l’oxydation se traduit par une formation facilitée et irréversible de méthémoglobine non fonctionnelle [2].
L’état de l’art
Les substituts à l’étude à ce jour utilisent des hémoglobines d’origines différentes :
humaine, bovine, recombinante, …et même issues de vers de terre (Lumbricus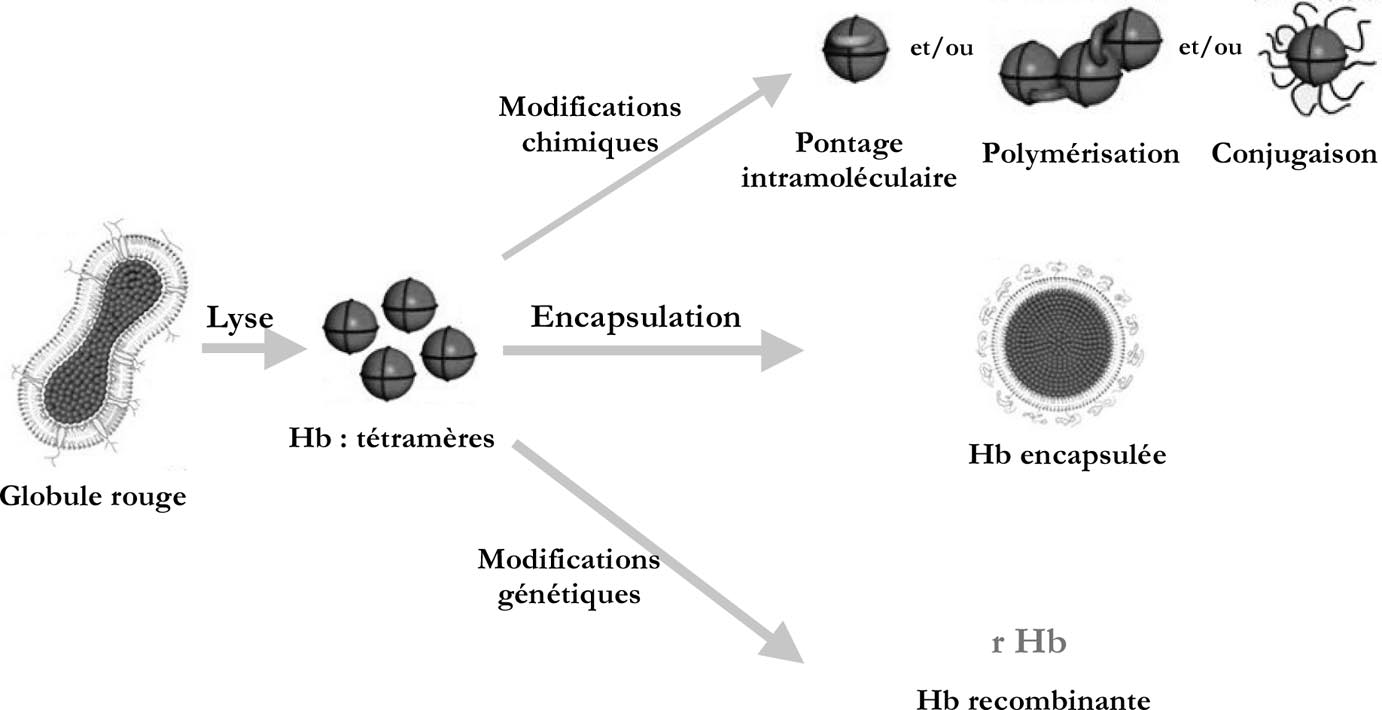
FIG. 1. — Les différents types de modifications apportées à l’hémoglobine tétramère [23] :
terrestris) ou marin (Arencola marina) généralement après avoir induit des modifications majeures à la molécule initiale (pontage intramoléculaire, polymérisation, conjugaison à des macromolécules, encapsulation, modifications de structure,…) (figure 1).
Toutefois, en dépit de la variété et de l’ingéniosité des procédés développés pour élaborer des HBOC adaptés aux besoins transfusionnels, les candidats substituts faisant encore l’objet d’essais pré-cliniques et cliniques sont en réalité très peu nombreux et la plupart d’entre eux résulte de modifications chimiques de la molé- cule naturelle (tableau 1).
Ce sont les nombreux effets secondaires observés lors des essais pré-cliniques et cliniques qui expliquent les abandons du développement de beaucoup d’entre eux.
Ces effets indésirables sont en effet multiples :
— apport conséquent de fer qui peut favoriser la croissance bactérienne [3, 4].
— saturation potentielle du système réticulo-endothélial par l’hémoglobine libre.
— induction possible d’une immunomodulation par libération accrue de cytokines pro-inflammatoires comme le TNF-alpha [5].
— Élévation importante de la pression artérielle induite par un effet vasoconstricteur de l’hémoglobine libre dans le plasma et constaté avec la plupart des hémoglobines modifiées [6-8].
— auto-oxydation de l’hémoprotéine circulante avec formation de méthémoglobine inapte au transport de l’oxygène [9].
— génération de radicaux libres responsables d’un stress oxydant in vitro et in vivo [10, 11].
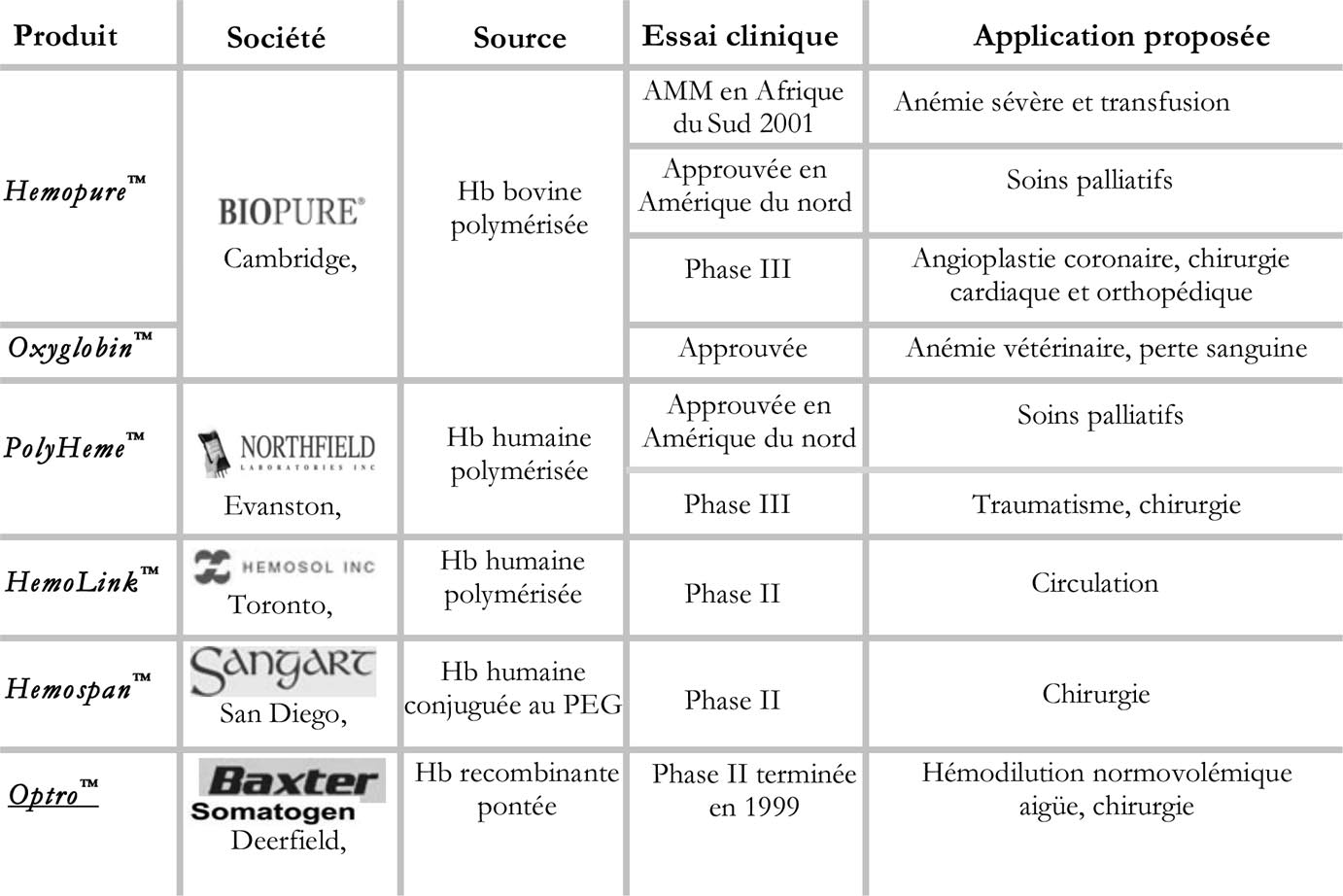
TABLEAU 1. — Les principaux HBOC en développement clinique :
Au total les différentes formes d’HBOC développés à ce jour n’ont pas fait la preuve clinique de leur capacité à remplacer le globule rouge sans induire des perturbations majeures. Elles se heurtent en premier aux difficultés de compréhension — et donc de correction palliative — des effets secondaires d’ordre hémodynamique et oxydatif, et accessoirement à la mise au point de procédés de production à l’échelle industrielle.
Ces effets sont observés quelles que soient la structure et l’origine de l’hémoglobine, mais avec une importance et une durée variables selon le type de l’HBOC étudié.
Les travaux de notre groupe sont réalisés avec trois solutions d’hémoglobines différentes par leur type de modification chimique : l’hémoglobine conjuguée au dextrane 10-benzène tétracarboxylate (Hb-Dex-BTC), l’hémoglobine pontée et polymérisée (Hémolink) et l’hémoglobine pontée au Diaspirine (DCLHb ou αα-Hb). Ils portent sur deux axes : l’étude des effets hémodynamiques et celle des mécanismes d’auto-oxydation L’hémoglobine des HBOC face aux mécanismes de la réactivité vasculaire
Par interaction directe ou indirecte de l’hémoglobine avec la paroi vasculaire, l’hé- moglobine des HBOC, vraisemblablement par un mécanisme de vasoconstriction, induit presque toujours une hypertension plus ou moins persistante qu’il conviendrait d’éliminer ou de pouvoir contrôler pour rendre leur emploi envisageable.
À l’aide d’un modèle d’échange transfusionnel partiel chez le lapin et/ou le cobaye anesthésié instrumenté d’une sonde Doppler et d’un cristal Wall Tracker disposés sur l’aorte abdominale, puis sur les artères fémorale et rénale, nous avons observé une hypertension importante — de l’ordre de 40 % pendant 120 à 180 minutes — associée à une augmentation de la résistance périphérique, elle aussi transitoire et induite par une vasoconstriction immédiate des artérioles périphériques (figure 2) [7, 8].
Ces effets presseurs, souvent rapportés comme limités à la seule interaction de l’hémoglobine avec le monoxyde d’azote (NO), sont en fait beaucoup plus complexes et encore mal compris. Ils sont toujours l’objet de grandes divergences d’opinion comme en témoignent les nombreux travaux publiés sur le sujet. Dans ces travaux, il a été montré que le type de la modification de l’hémoglobine et l’augmentation de l’affinité de celle-ci pour l’oxygène sont impliqués [6,12,13].
Pour tenter d’identifier les mécanismes impliqués dans l’effet vasoconstricteur, nous avons recherché les interactions des HBOC avec les cellules du sang, l’endothélium et la paroi vasculaire. Nos résultats montrent :
— l’absence quasi-totale d’interaction avec les cellules du sang [14-17].
— la présence constante d’hémoglobine dans la cellule endothéliale puis au niveau des cellules musculaires lisses de la média, puis au niveau de l’adventice alors que l’augmentation de la pression artérielle diminue puis disparaît (figure 3) [18, 19].
Or la pénétration de l’hémoglobine à l’intérieur de la paroi vasculaire met le substitut potentiel au contact des lieux de production et de libération d’agents vasoactifs (cellule endothéliale, espace interstitiel, cellule musculaire lisse).
— la contribution des complexes hémoglobine — haptoglobine dans la dimérisation du tétramère puis la disparition de l’hémoglobine du plasma par endocytose.
— l’implication de l’endocytose dans l’hypertension induite par l’hémoglobine libre dans le plasma et dans l’élimination de l’hémoglobine de la circulation sanguine.
Ce phénomène est cependant dépendant de la masse moléculaire des dérivés de l’hémoglobine [20].
— que les radicaux libres, le NO et le système de l’endothéline-1 ne sont pas les seuls mécanismes et systèmes impliqués dans l’induction ou la persistance de l’hypertension mais que d’autres systèmes tels que le système rénine-angiontensine et le système catécholaminergique peuvent être impliqués [21].
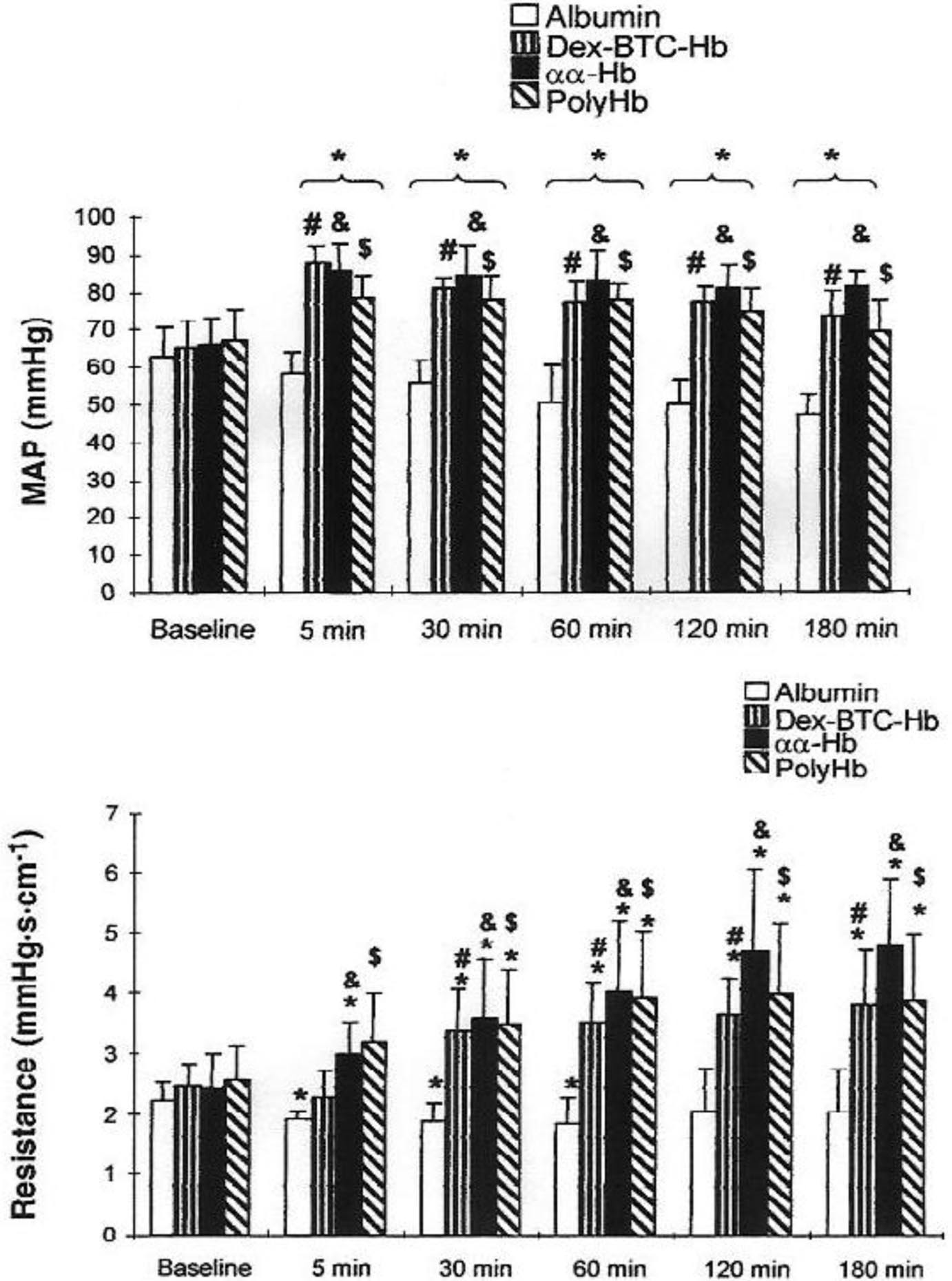
FIG. 2. — Variations de la pression artérielle moyenne (a) et de la résistance vasculaire (b) après un échange transfusionnel à 30 % chez le lapin avec albumine (n = 8), αα-Hb (n = 8) ou PolyHb (n = 6). Moyenne fi SE. Différences significatives, P<0,05 : * après échange transfusionnel vs valeurs de base. # Hb-Dex-BTC vs albumine. &αα-Hb vs albumine. $PolyHb vs albumine [7] :

FIG. 3. — Coupes transversales d’artère abdominale de cobaye prélevée avant le début d’échange transfusionnel à 50 % (a), 17 min (b), 60 min (c) et 180 min (d) après la fin de l’échange transfusionnel à 50 % avec l’Hb-Dex-BTC. ce : cellule endothéliale, cml : cellule musculaire lisse, lv : lumière vasculaire [19] :
L’auto-oxydation de l’hémoglobine des HBOC
L’absence de membrane érythrocytaire autour des HBOC et la perte ou l’absence — selon leur mode de préparation — des systèmes antioxydants et réducteurs (méthé- moglobine réductase, superoxyde dismutase, catalase, …) sont à l’origine du phénomène d’oxydation de l’hémoglobine et de son amplification par production de radicaux oxygénés très réactifs.
L’auto-oxydation de l’hémoglobine s’accompagne d’ailleurs de la production d’anions superoxyde également inducteurs d’hypertension par stimulation de la synthèse d’endothéline-1, elle-même inductrice de la densité des récepteurs à l’endothéline de type B [11].
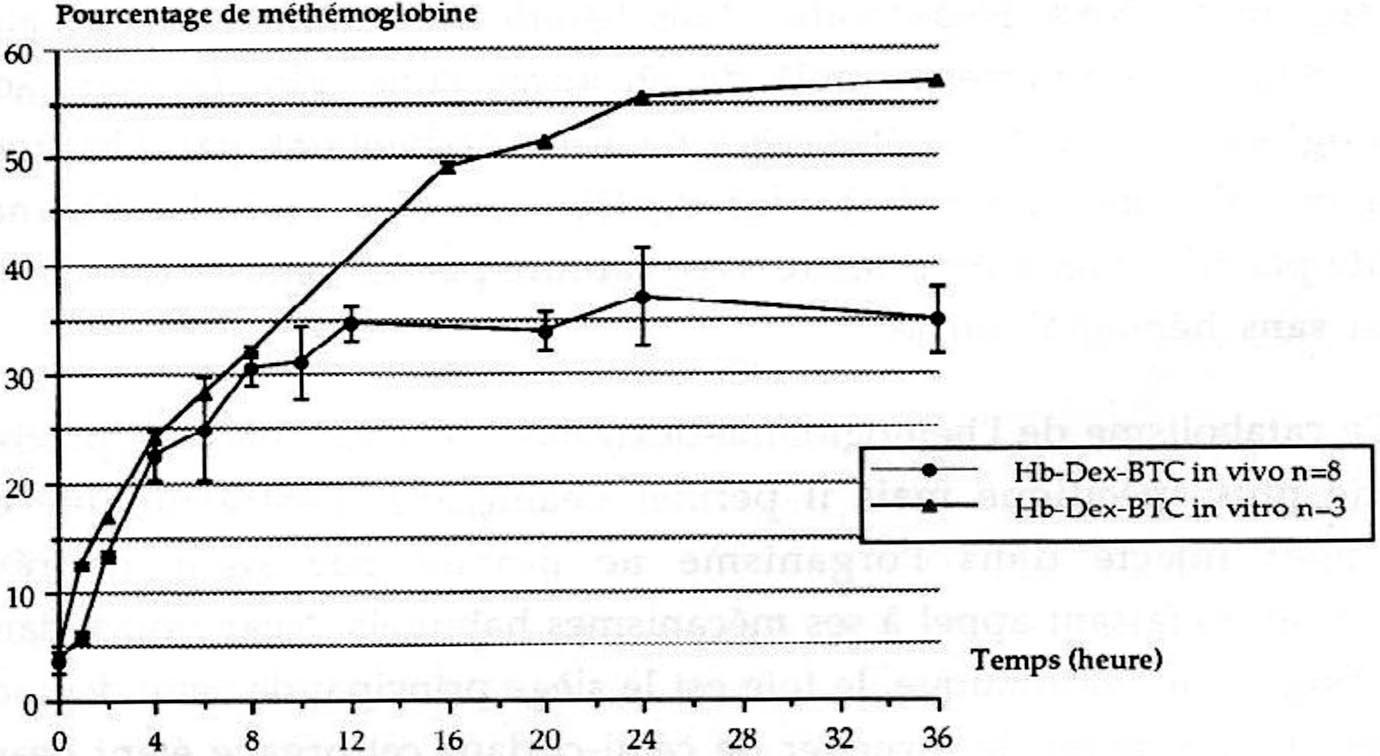
Notre étude de l’état d’oxydation d’un HBOC dans le lit vasculaire in vivo , au moyen du modèle d’échange transfusionnel à 50 % du volume sanguin chez le cobaye, a permis de mettre en évidence l’oxydation rapide du conjugué puis paradoxalement la stabilisation du taux de méthémoglobine (figure 4) [2].
FIG. 4. — Oxydation de l’Hb-Dex-BTC : in vivo dans le plasma chez le cobaye après un échange transfusionnel à 50 % du volume sanguin et in vitro en solution sous agitation douce à 37° C [2] :
Pour comprendre les mécanismes susceptibles d’expliquer cette stabilisation, nous avons aussi conduit des échanges transfusionnels partiels avec un HBOC totalement amené sous sa forme oxydée et en présence de molécules réductrices ou antioxydantes.
Les résultats montrent :
— la capacité de l’animal à réduire en 24 h environ 50 % de la méthémoglobine administrée.
— la confirmation de l’activité réductrice de composés comme l’acide ascorbique, le bleu de méthylène ou la riboflavine vis-à-vis de la méthémoglobine [9, 22].
— l’implication des globules rouges et en particulier le rôle de la membrane érythrocytaire dans cette fonction [22]. En effet, en marge du domaine de recherche des substituts érythrocytaires, nos résultats témoignent de l’existence de mécanismes réducteurs et/ou antioxydants dans le système vasculaire.
Au total depuis l’année 2000, le développement des HBOC [24] se trouve ralenti et stagne fortement en raison de l’observation réitérée d’effets secondaires multiples lors des essais cliniques (élévation de la pression artérielle induite par un effet vasoconstricteur de l’hémoglobine libre dans le plasma, auto-oxydation de l’hémo-
protéine circulante avec formation de méthémoglobine inapte au transport de l’oxygène, génération de radicaux libres responsables d’un stress oxydant) et par conséquence par l’abandon des essais cliniques par des acteurs industriels aussi importants que Baxter qui a arrêté toute recherche et développement sur les substituts érythrocytaires.
L’impossibilité d’éviter ou de bien contrôler les effets hypertenseurs des HBOC ajoutée à notre incapacité à bien maîtriser le maintien de l’hémoglobine sous sa forme fonctionnelle en dehors de l’hématie font que le souhait de réaliser un substitut érythrocytaire peut désormais apparaître comme une fausse bonne idée !
Le handicap majeur, aujourd’hui non surmontable à notre avis, réside dans l’interaction « obligatoire » de la molécule d’hémoglobine (tétramère ou dimère) libre dans le plasma avec la cellule endothéliale et les autres constituants de la paroi vasculaire.
Ceci ne veut toutefois pas dire que les recherches entreprises et les résultats observés auront été inutiles : les connaissances acquises à l’occasion de ces travaux devraient permettre de mieux comprendre les conséquences des hémolyses aiguës, mais aussi améliorer nos connaissances sur l’influence exercée par le globule rouge sur son environnement.
Cela ne veut pas dire non plus que les recherches pour obtenir un substitut érythrocytaire doivent être stoppées mais plutôt qu’elles doivent, avec moins d’ambition, se limiter dans un premier temps, à reproduire l’érythropoïèse in vitro et donc se diriger d’abord vers la production en masse d’hématies de phénotype connu.
Cela, par contre, démontre magistralement la nécessité minimale d’un « dispositif de protection », comme substitut de la membrane érythrocytaire, autour des HBOC …
BIBLIOGRAPHIE [1] AMBERSON W.R., JENNINGS J.J., RHODE C.R. — Clinical experience with hemoglobin-saline solutions. J. Appl. Physiol., 1949, 1 , 469-489.
[2] FAIVRE B., MENU P., LABRUDE P., VIGNERON C. — Hemoglobin autooxidation/oxidation mechanisms and methemoglobin prevention or reduction processes in the bloodstream. Literature review and outline of autooxidation reaction. Artif. Cells Blood Substitut Immobil.
Biotechnol. , 1998, 26(1) , 17-26.
[3] GRIFFITHS E., CORTES A., GILBERT N., STEVENSON P., MACDONALD S., PEPPER D. — Heamoglobin-based blood substitutes and sepsis. Lancet, 1995, 345 , 158-160.
[4] LANGERMANS J.A., BLEEKER W.K. — Haemoglobin-based blood substitutes and infection.
Lancet, 1995, 345 , 863-864.
[5] MCFAUL S.J., BOWMANN P.D., VILLA V.M., GUTIERREZ-IBANEZ M.J., JOHNSON M., SMITH D.
— Hemogobin stimulates mononuclear leucocytes to release interleukin-8 and tumor necrosis factor alpha. Blood, 1994, 84 , 3175-3181.
[6] ROHLFS R.J. et al. — Arterial blood pressure responses to cell-free hemoglobin solutions and the reaction with NO.
J. Biol. Chem., 1998, 273 , 12128-12134.
[7] CARON A., MENU P., FAIVRE-FIORINA B., LABRUDE P., ALAYASH AI., VIGNERON C. — Cardiovascular and hemorheological effects of three modified human hemoglobin solutions in hemodiluted rabbits. J. Appl. Physiol ., 1999, 86(2) , 541-548.
[8] CARON A., MENU P., FAIVRE-FIORINA B., LABRUDE P., ALAYASH A., VIGNERON C. — Systemic and renal hemodynamics after moderate hemodilution with HbOCs in anesthetized rabbits.
Am. J. Physiol. Heart Circ. Physiol., 2000, 278(6) , 1974-1983.
[9] FAIVRE B., MENU P., LABRUDE P., GRANDGEORGE M., VIGNERON C. — Methemoglobin formation after administration of hemoglobin conjugated to carboxylate dextran in guinea pigs. Attempts to prevent the oxidation of hemoglobin. Artif. Cells Blood Substit. Immobil.
Biotechnol., 1994, 22(3) , 551-558.
[10] JIA Y., WOOD F., MENU P., FAIVRE B., CARON A., ALAYASH A.I. — Oxygen binding and oxidation reactions of human hemoglobin conjugated to carboxylate dextran. Biochim. Biophys. Acta, 2004, 1672 , 164-173.
[11] SMANI Y., FIFRE A., LABRUDE P., VIGNERON C., FAIVRE B. — Pharmacological and physicochemical factors in the pressor effects of conjugated heamoglobin-based oxygen carriers in vivo . J.
Hypert., 2007, 25(3) , 599-608.
[12] WINSLOW R.M. — Current status of blood substitute research : towards a new paradigm.
J.
Intern. Med., 2003, 253, 508-517.
[13] TSAI A.G., CABRALES P., MANJULA B.N., ACHARYA S.A., WINSLOW R.M., INTAGLIETTA M. — Dissociation of local nitric oxide concentration and vasoconstriction in the presence of cell-free hemoglobin oxygen carriers. Blood, 2006, 108 , 3603-3610.
[14] MENU P., LONGROIS D., FAIVRE B., DONNER M., LABRUDE P., STOTLZ J.F., VIGNERON C. — Rheological behaviour of red blood cells suspended in hemoglobin solutions. In vitro study comparing dextran-benzene-tetra-carboxylate hemoglobin, stroma free hemoglobin and plasma expanders. Transfus. Sci., 1999, 20(1) , 5-16.
[15] TOUSSAINT M. et al. Effects of three Hb-based oxygen-carrying solutions on neutrophil activation in vitro : quantitative measurement of the expression of adherence receptors. Transfusion, 2001, 41(2), 226-231.
[16] TOUSSAINT M., LATGER-CANNARD V., CARON A., LECOMPTE T., VIGNERON C., MENU P. — Hemoglobin-based oxygen carriers do not alter platelet functions : study of three chemically modified hemoglobin solutions. Intensive Care Med ., 2003, 29(1) , 62-68.
[17] TOUSSAINT M et al. — Biological responses of human aortic endothelial cells exposed to acellular hemoglobin developed as potential blood substitutes.
Life Sci., 2003 ; 72(10), 1143- 1157.
[18] FAIVRE-FIORINA B. et al. — Presence of hemoglobin inside aortic endothelial cells after cell-free hemoglobin administration in guinea pigs.
Am. J. Physiol., 1999, 276(2) , H766-H770.
[19] SMANI Y., FAIVRE B., AUDONNET-BLAISE S., LABRUDE P., VIGNERON C. — Hemoglobin-based oxygen carrier distribution inside vascular wall and arterial pressure evolution : is there a relationship ? Eur. Surg. Res., 2005, 37(1) , 1-8.
[20] SMANI Y., FAIVRE B., FRIES I., LABRUDE P., VIGNERON C. — Potential mechanism of dextranconjugated hemoglobin penetration inside arterial wall. Arch. Mal. Cœur Vaiss., 2006a, 99(7/8) , 722-726.
[21] SMANI Y., et al. — Vascular reactivity towards cell-free hemoglobin. In international visions on blood substitutes. Hemoglobin-based oxygen carriers : from chemistry to clinic.
Comprising the 5th international symposium ‘‘ current issues in blood substitutes ’’ and the 4th international course ‘‘ from structural genomics to drug discovery ’’ . September 17th-20th, 2006b Parma, Italy pp 61.
[22] DUNNE J., et al. — Ascorbate removes key precursors to oxidative damage by cell-free haemoglobin in vitro and in vivo . Biochem. J., 2006 ; 399(3), 513-524.
[23] TSUCHIDA E., et al . — Artificial blood project. Waseda University 2002-2006.
[24] WINSLOW R.M. — Blood substitutes. Academic Press, 2006 ; 548 p.
DISCUSSION
M. Raymond ARDAILLOU
Quel est l’effet de l’hémoglobine sur le NO ?
L’hémoglobine libre dans le plasma, apportée en grande quantité par le substitut érythrocytaire de type HBOC, constitue un piège pour le NO et s’oppose de ce fait à l’action vasodilatatrice de cette molécule. L’interaction HBOC / NO induit alors, par inhibition de l’effet vasodilatateur, un effet vasoconstricteur important.
* Membre correspondant de l’Académie nationale de médecine ** Nancy-Université EA3452 Laboratoire d’Hématologie et CHU de Nancy Service Hématologie Biologique Tirés-à-part : Professeur Claude VIGNERON, même adresse
Bull. Acad. Natle Méd., 2007, 191, nos 4-5, 837-847, séance du 15 mai 2007


