Résumé
La transplantation pulmonaire est toujours le seul traitement curatif de l’insuffisance respiratoire chronique au stade terminal. Ses résultats restent néanmoins médiocres en raison du nombre insuffisant de donneurs, du rejet chronique et des complications liées aux immunosuppresseurs. La mise au point d’un poumon bio-artificiel régénéré à partir de cellules autologues pourrait apporter une solution majeure à ces problèmes non résolus. Nous avons démontré qu’il était possible d’obtenir une régénération in vivo épithéliale et cartilagineuse au niveau trachéo-bronchique en utilisant une matrice de tissu aortique. D’autres études ont permis une régénération trachéo-bronchique in vitro par ingénierie tissulaire ou in vivo après implantation hétérotopique d’une allogreffe. La problématique est encore plus complexe au niveau pulmonaire puisqu’il faut trouver une matrice élastique capable d’induire une régénération des différents éléments bronchiques, alvéolaires et vasculaires du poumon sur de plus une large surface permettant ainsi une ventilation, une perfusion et des échanges gazeux. Des études récentes ont démontré la possibilité de régénération des différents constituants du poumon in vivo et in vitro à partir de cellules autologues, en particulier de cellules souches. La recherche en ce domaine, qui en est à ses débuts, s’oriente aujourd’hui vers l’utilisation préférentielle d’une matrice pulmonaire décellularisée dont la recolonisation épithéliale et endothéliale in vitro est obtenue par utilisation de cellules autologues. L’implantation in vivo chez l’animal semble permettre l’obtention d’un poumon bio-artificiel fonctionnel. Ces premiers travaux laissent entrevoir une application chez l’homme dans dix à vingt ans d’après les prévisions les plus optimistes.
Summary
Lung transplantation is still the only curative treatment for end-stage pulmonary diseases. The results remain poor, however, because of the limited availability of lung donors, chronic rejection, and complications related to immunosuppressive therapy. The use of a bioartificial lung generated from autologous cells could offer a solution. We have demonstrated that in vivo epithelial and cartilage regeneration of the airways is feasible with the use of an aortic tissue matrix. Other studies show that in vitro and in vivo airway regeneration, respectively, can be obtained by using bio-engineering and heterotopic allograft implantation. A more complex challenge is the creation of an artificial lung. Indeed, this would require the use of an elastic matrix that can promote regeneration of the different lung components (airways, alveoli, vessels) over a large surface area, thus allowing ventilation, blood perfusion and gas exchanges. Recent studies have demonstrated the possibility of in vitro and in vivo regeneration of lung tissue from autologous cells, and especially stem cells. This emerging research field is currently dominated by the use of decellularized lung matrices and autologous epithelial and endothelial cells. Implantation of such a recellularized matrix in animals has proved the feasibility of a functional bio-artificial lung. The first human transplantation of a bio-artificial lung should be possible within 10-20 years.
Problématique
Cinquante millions de malades environ vivent dans le Monde avec une insuffisance respiratoire chronique au stade terminal, toutes causes confondues. Le seul traitement de cette affection engageant le pronostic vital est, dans des cas bien sélectionnés, la transplantation pulmonaire dont la première réalisation a été rapportée en 1963 [1]. Ses résultats restent néanmoins médiocres, principalement en raison du nombre insuffisant de donneurs, du rejet chronique et des complications liées aux immunosuppresseurs [2-8]. On compte également parmi les facteurs limitant l’âge, qui interdit à beaucoup de patients l’accès à ce traitement. Les nouvelles techniques explorées depuis quelques années (donneurs à cœur arrêté ou non battant, reconditionnement « ex-vivo » des greffons pulmonaires, donneurs vivants) posent encore des problèmes d’organisation, de législation et d’éthique, en particulier en France [2-8]. Enfin, les systèmes d’assistance respiratoire par circulation extra-corporelle ne représentent actuellement qu’une solution provisoire dans l’attente d’une transplantation ou d’une récupération dans le cadre de lésions pulmonaires aigues [9,10].
Leur utilisation comme véritable poumon artificiel sur une longue durée ne semble pas, aujourd’hui, envisageable du fait de leur caractère externe, non implantable et du risque de thrombose. Dans l’avenir, la mise au point d’un poumon bio-artificiel régénéré à partir de cellules autologues pourrait, par contre, apporter une solution à ces nombreux problèmes.
Régénération trachéo-bronchique
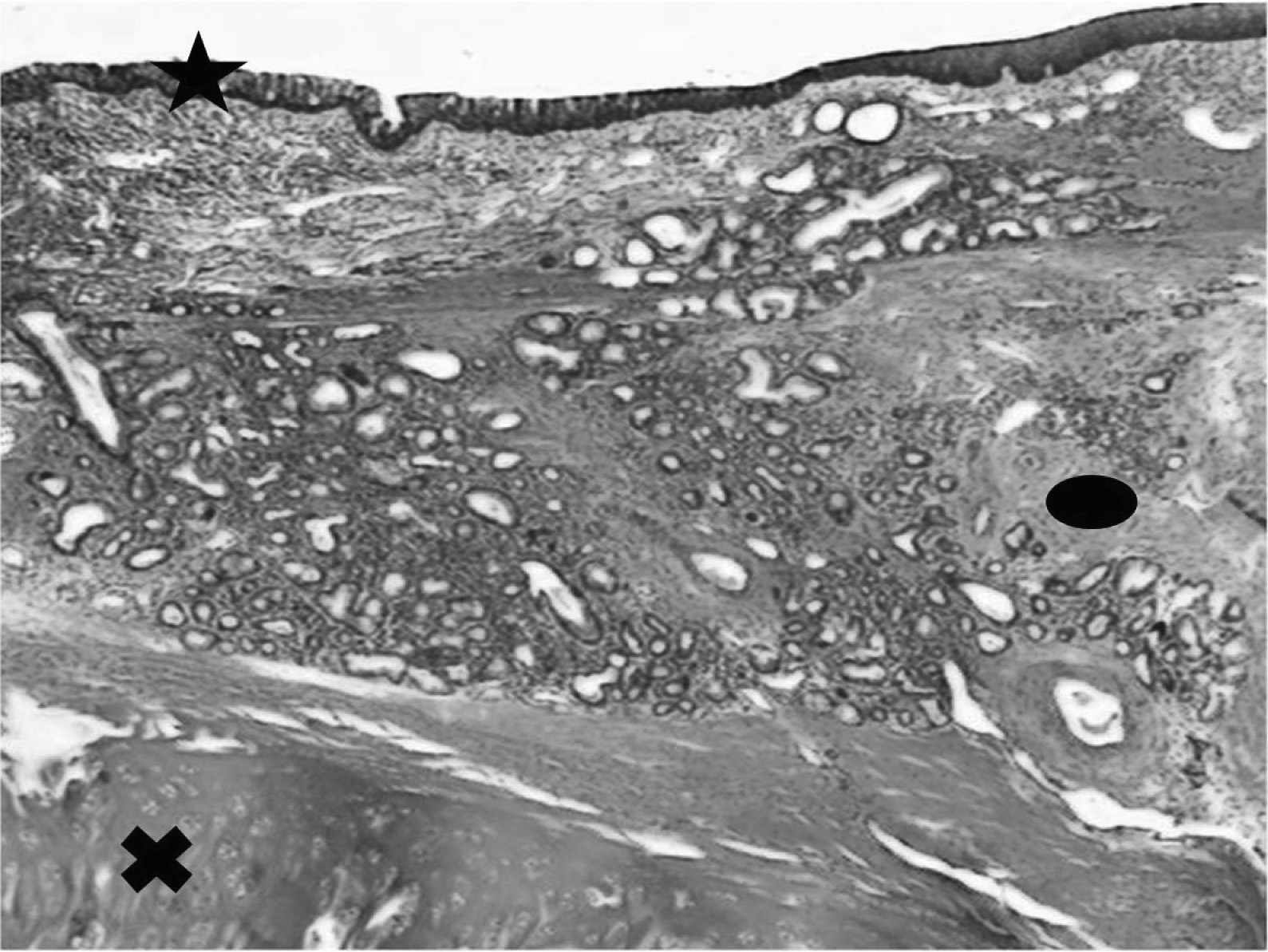
À l’heure de la transplantation d’organes, la greffe trachéo-bronchique reste un véritable défi chirurgical et biologique. En effet, plus de cinquante années de recherche n’ont pas permis de trouver un substitut idéal aux voies aériennes. Des échecs successifs ont été observés avec les prothèses synthétiques, les bioprothèses, les allogreffes trachéales et les autogreffes [11]. Nous avons proposé, à partir de 1997, l’évaluation du greffon aortique dans cette indication. Dans plusieurs études expé- rimentales, nous avons démontré que l’autogreffe aortique, l’allogreffe fraîche puis cryopréservée apportaient des résultats encourageants. Nous avons, en effet, observé une régénération tissulaire non seulement épithéliale mais aussi cartilagineuse, ces résultats ayant été confirmés par d’autres équipes [12-22]. Nos travaux actuels tentent de démontrer que cette régénération d’un tissu trachéal à partir d’une matrice aortique se fait à partir de cellules souches issues de la moelle osseuse.
La figure 1 illustre le potentiel de régénération trachéale à partir d’une matrice aortique (données personnelles, EM). Ces études ont conduit, chez l’homme, aux premières applications cliniques avec succès dans le cadre des cancers étendus de la trachée et de la chirurgie conservatrice du cancer pulmonaire [11, 23-25]. Ces résultats apportent de nouvelles perspectives dans la compréhension des mécanismes de régénération tissulaire et dans le traitement chirurgical de malades en impasse thérapeutique. D’autres auteurs ont pu induire une régénération trachéobronchique in vitro par ingénierie tissulaire ou in vivo après implantation hétérotopique au niveau de l’avant-bras d’une allogreffe trachéale et une phase transitoire d’immunosuppression [26-28].
Régénération pulmonaire et cellules souches 1 [29]
Dans le poumon, plusieurs types de cellules progénitrices locales, participant à la réparation cellulaire, ont été décrits à différents niveaux de l’appareil respiratoire.
On compte ainsi les cellules basales des canaux glandulaires, les cellules basales de l’épithélium de surface trachéo-bronchique, et les cellules de Clara variantes, pré- sentes dans les voies aériennes distales et ayant par ailleurs la capacité de sécréter des mucines [30, 31]. Quand on progresse vers les alvéoles, on a les cellules souches bronchiolo-alvéolaires, exprimant aussi bien des marqueurs de cellules de Clara que de cellules épithéliales [32] et les pneumocytes de type II. Ces dernières, ayant un phénotype épithélial bien défini, constituent les cellules progénitrices des pneumo1. Ce paragraphe est extrait en grande partie de la référence 29 publiée par le deuxième auteur (YU) de cet article.
Fig. 1. — Régénération trachéale à partir d’une matrice aortique (ovale) après 6 mois d’implantation. La régénération tissulaire concerne non seulement l’épithélium (étoile) que le cartilage (croix). La régénération épithéliale se fait à partir des berges de la trachée native, la régénération cartilagineuse à partir de cellules souches en cours d’identification.
cytes de type I, cellules impliquées dans les échanges gazeux. Enfin, dans cette catégorie de « cellules souches locales », ont été identifiées des cellules de la souspopulation « side population », qui ont des marqueurs de différenciation in vitro mimant des cellules mésenchymateuses stromales. Le rôle de ces cellules dans la réparation tissulaire a été essentiellement mis en évidence dans des modèles animaux d’agression épithéliale. On peut citer par exemple l’amélioration des lésions de fibrose observées après instillation intra-trachéale de pneumocytes de type II syngéniques sur des rats soumis à la bléomycine [33].
Kajstura et al. ont décrit pour la première fois l’existence de cellules souches pulmonaires résidentes, qui par définition sont multipotentes, capables d’autorenouvellement ainsi que de clonogénicité. Les caractéristiques phénotypiques et fonctionnelles de ces nouvelles cellules sont précisées in vitro et in vivo [34]. Identifiées par l’expression de c-kit, marqueur des cellules hématopoïétiques et des cellules souches cardiaques, ces cellules, présentes dans un microenvironnement particulier nommé « niche », seraient distribuées dans les voies aériennes distales avec une densité de 1/6 000 et 1/30 000 cellules respectivement dans les bronchioles et dans les alvéoles. Ces cellules étaient extraites à partir de tissus pulmonaires humains issus de dons d’organes non retenus pour une greffe, par technique de digestion enzymatique et de tri cellulaire en cytométrie en flux. Elles étaient ensuite marquées (infection par un lentivirus porteur d’une fluorescence verte) et injectées dans le thorax d’une souris dans le même temps qu’une lésion pulmonaire était réalisée.
Les auteurs rapportent non seulement une incorporation de ces cellules dans le tissu pulmonaire murin 10 à 14 jours après l’intervention, mais surtout une régénération du tissu lésé avec présence des cellules marquées dans les structures vasculaires, bronchiolaires et alvéolaires néoformées. Les cellules humaines c-kit positives issues de ce poumon de souris étaient ensuite récupérées par la même technique et réinstillées dans un autre poumon de souris et cette opération était répétée huit fois, confirmant une des propriétés essentielles des cellules souches, à savoir l’autorenouvellement. La partie régénérée du poumon de souris était composée de cellules alvéolaires humaines ainsi que de cellules bronchiolaires ou encore endothéliales humaines, caractérisées par un matériel chromosomique humain. La mise en évidence de ces cellules ne remet pas en question le rôle des cellules progénitrices locales dans les phénomènes de réparation épithéliale après lésion. Elle alimenterait plutôt la thèse d’une hiérarchie entre les différents types de cellules souches du poumon. On peut par ailleurs s’interroger sur le rôle respectif de ces cellules dans les défauts de réparation des tissus, impliqués dans la pathogénie de certaines maladies pulmonaires. Comme le souligne l’éditorial qui accompagne cet article, cette découverte offre des perspectives majeures dans le domaine de la régénération pulmonaire et notamment du bio-engineering du poumon, possible future alternative à la transplantation [35].
Le poumon contient par ailleurs des cellules souches mésenchymateuses spécifiques résidentes, récemment décrites et bien caractérisées [36-38]. Ces cellules ne participeraient pas directement au renouvellement épithélial mais elles établiraient une communication avec l’épithélium via des « gap-jonctions », assurant ainsi leur rôle cytoprotecteur local.
Enfin, de nombreuses études chez l’animal ont montré le rôle bénéfique des cellules souches mésenchymateuses exogènes issues de la moelle osseuse. Les effets observés dans l’œdème pulmonaire lésionnel, le sepsis, la dysplasie broncho-pulmonaire, l’hypertension pulmonaire voire la fibrose pulmonaire idiopathique ou encore l’emphysème ont conduit à des applications cliniques en cours d’évaluation [29]. Les propriétés immuno-modulatrices, anti-inflammatoires, anti-apoptotiques et angiogéniques des cellules mésenchymateuses placent en effet ces cellules au cœur de la réparation tissulaire. Contrairement à une hypothèse faite dans le passé, ces cellules ne semblent pas se différencier en cellules épithéliales alvéolaires et leur mode d’action ferait intervenir des mécanismes paracrines non encore tous élucidés. La figure 2 illustre l’effet protecteur des cellules souches mésenchymateuses issues de moelle osseuse sur le phénotype épithélial des cellules alvéolaires de rat en culture primaire soumises à l’hypoxie (données personnelles, YU et CP).
Fig. 2. — Co-immunomarquage ZO-1 / TTF-1 réalisé sur culture primaire de pneumocytes de rats en normoxie (A), en hypoxie (B) et en hypoxie en présence de cellules souches mésenchymateuses (C). Notez en hypoxie la modification de la taille des cellules avec la perte du facteur de transcription nucléaire TTF-1, marqueur de phénotype épithélial. En présence de cellules souches mésenchymateuses, les effets de l’hypoxie sont nettement atténués avec préservation des marqueurs épithéliaux. ZO-1: protéine de jonction intercellulaire (Zonula Occludens- 1) ;
TTF-1 : thyroid transcription factor — 1.
Le poumon bio-artificiel : un véritable défi
Nous disposons actuellement de deux articles originaux majeurs publiés par deux équipes différentes dans Nature (Ott HC et al. ) et Science (Petersen TH et al.) en juillet 2010 au sujet du poumon bio-artificiel [39, 40].
L’équipe du Massachusetts General Hospital (Harvard Medical School, Boston, USA) menée par Joseph P. Vacanti, déjà bien connue pour ses travaux sur la régénération trachéale par ingénierie tissulaire a mis au point un modèle de poumon bio-artificiel publié dans la revue Nature [39]. Les auteurs ont décellularisé un poumon de rat par perfusion d’un détergeant afin d’obtenir une matrice. Cette méthode a pu être reproduite sur le poumon de la brebis, du porc et du babouin. Des cellules épithéliales et endothéliales ont été injectées dans la matrice pulmonaire puis une incubation a été réalisée pendant cinq jours dans un bioréacteur. Des études morphologiques retrouvaient un aspect proche de celui du poumon natif au niveau alvéolaire (volume, nombre, taille). Des études physiologiques in vitro montraient que les capacités ventilatoire et d’échanges gazeux étaient également préservées. Une implantation in vivo du poumon bio-artificiel permettait une ventilation spontanée pendant 6 heures. Au-delà de ce terme, un œdème pulmonaire apparaissait. Les auteurs concluaient en donnant plusieurs voies de recherche afin de potentialiser leurs résultats dans l’avenir : amélioration de la différenciation et de la maturation des cellules injectées, durée d’incubation en bioréacteur plus longue, optimisation de la ventilation postopératoire. Les auteurs proposaient également de mieux étudier quel est le niveau de maturation nécessaire avant implantation du poumon bio-artificiel mais aussi quelles sont les possibilités de régénération in vivo par l’individu lui-même afin de compléter le processus issu de l’injection de cellules et de l’incubation dans le bioréacteur.
* L’équipe de l’Université de Yale (New Haven, USA) menée par Laura E. Niklason a mis au point un autre modèle d’ingénierie tissulaire pulmonaire publié dans la revue Science 40. Les auteurs ont décellularisé un poumon de rat par traitement chimique, en gardant seulement la charpente matricielle du poumon, c’est-à-dire l’architecture tridimensionnelle des voies aériennes, des vaisseaux ainsi que de la membrane basale comportant le collagène de type IV, la laminine et la fibronectine.
Ce poumon décellularisé était placé dans un bioréacteur utilisé pour mimer les conditions physiologiques du thorax avec une pression négative et une perfusion vasculaire pulsatile. Des cellules épithéliales issues de rats nouveau-nés étaient instillées par voie trachéale et des cellules endothéliales par voie vasculaire. Au terme de quatre à huit jours d’incubation, ce poumon était greffé à un rat de la même espèce. Les mesures de compliance étaient sensiblement différentes entre le poumon natif, le poumon décellularisé et le poumon issu de la bio-ingénierie avec des pressions d’ouverture plus fortes, reflétant un surfactant moins fonctionnel dans ce dernier. Néanmoins, il n’y avait pas d’élément évocateur de rigidité de la matrice, écartant ainsi une évolution fibrosante. En histologie, une ré-épithélialisation avec une distribution spatiale des différents types cellulaires ainsi qu’une ré-endothé- lialisation comparable au poumon natif étaient observés. Les échanges gazeux étaient par ailleurs assurés, attestant du caractère fonctionnel de ce poumon. Ce protocole était par la suite appliqué à un poumon humain décellularisé par le même procédé. La ré-épithélialisation était alors réalisée à l’aide de cellules de la lignée A549 et la ré-endothélialisation assurée par des cellules endothéliales issues de sang de cordon. Ce travail confirmait la reproductibilité du modèle sur poumon humain.
L’intégrité de la membrane basale était, selon les auteurs, un garant de la reconstitution de l’épithélium.
Ces premiers travaux ouvrent une voie prometteuse pour la mise au point d’un poumon bio-artificiel fonctionnel. Ils laissent entrevoir une application chez l’homme dans dix à vingt ans d’après les prévisions les plus optimistes. Néanmoins de nombreuses interrogations demeurent : — L’utilisation d’une matrice pulmonaire décellularisée est-elle la seule voie possible ? — Quelles cellules doit-on privilégier pour la recellularisation ? Des cellules souches mésenchymateuses ? Des cellules pulmonaires résidentes ? — L’utilisation de cellules souches autologues, en particulier résidentes pouvant participer à la pathogénie, ne risque-t-elle pas de pérenniser la maladie pulmonaire préexistante ? — Quelle est la durée optimale d’incubation dans un bioréacteur pour le poumon ? et enfin — Cette technique est-elle applicable au poumon humain dont la surface alvéolaire est très importante ? Les prochaines étapes de la recherche devront répondre à ces questions fondamentales qui laissent entrevoir de nombreux domaines d’exploration pour le futur.
BIBLIOGRAPHIE [1] Hardy J.D., Webb W.R., Dalton M.L. JR. — Lung homotransplantations in man.
JAMA 1963, 186 , 1065-72.
[2] Stern M., Souilamas R., Tixier D., Mal H. — Transplantation pulmonaire : la satisfaction des besoins en France. Rev. Mal. Respir ., 2008, 25 , 953-65.
[3] Reynaud-Gaubert M., Boniface S., Métivier A.C., Kessler R. — Quand le pneumologue doit-il envisager la greffe pulmonaire pour un de ses patients adultes ? Indications, critères de sélection, préparation à la greffe. Rev. Mal. Respir ., 2008, 25 , 1251-9.
[4] Mal H., Thabut G., Evrard P. — Quand le pneumologue doit-il envisager la transplantation pulmonaire pour un de ses patients ? Critères d’inscription en liste d’attente : BPCO, fibrose pulmonaire idiopathique. Rev. Mal. Respir ., 2009, 26 , 183-90.
[5] Philippe B., Dromer C., Mornex J.F., Velly J.F., Stern M. — Quand le pneumologue doit-il envisager la greffe pulmonaire pour un de ses patients ? Critères d’inscription en liste d’attente:
mucoviscidose, HTAP et maladies systémiques (sarcoïdose, histiocytose langerhansienne, lymphangioleïomyomatose et connectivites). Rev. Mal. Respir ., 2009, 26 , 423-35.
[6] Dumonceaux M., Knoop C., Rondelet B., Estenne M. — Complications de la transplantation pulmonaire : complications péri-opératoires, rejet aigu et chronique. Rev. Mal. Respir ., 2009, 26 , 639-53.
[7] Knoop C., Dumonceaux M., Rondelet B., Estenne M. — Complications de la transplantation pulmonaire: complications médicales. Rev. Mal. Respir ., 2010, 27 , 365-82.
[8] Quétant S., Rochat T., Pison C. — Résultats de la transplantation pulmonaire.
Rev. Mal.
Respir . 2010 , 27 , 921-38.
[9] Ota K. — Advances in artificial lungs.
J. Artif. Organs , 2010, 13 , 13-6.
[10] Patroniti N., Bellani G., Pesanti A. — Nonconventional support of respiration.
Curr. Opin.
Crit. Car e, 2011, 17, 527-32.
[11] Martinod E., Seguin A., Radu D., Marquette C.H., Carpentier A. — Advances in tracheal surgery: are we close to finding the ideal tracheal substitute? Rev. Mal. Respir., 2010, 27 , 554-64.
[12] Martinod E., Aupecle B., Zegdi R. et al . — Remplacement segmentaire de la trachee par une autogreffe aortique: la « trachee-artere ».
Presse Med., 1999, 28 , 1638.
[13] Martinod E., Zakine G., Fornes P. et al . — Metaplasia of aortic tissue into tracheal tissue.
Surgical perspectives CR
Acad. Sci. III , 2000, 323 , 455-60.
[14] Martinod E., Zegdi R., Zakine G. et al. — A novel approach to tracheal replacement: the use of an aortic graft . J. Thorac. Cardiovasc. Surg., 2001, 122 , 197-8.
[15] Martinod E., Azorin J., Carpentier A. — Tracheal replacement:new perspectives.
Rev. Mal.
Respir. , 2001, 18 , 639-43.
[16] Martinod E., Seguin A., Pfeuty K. et al. — Long-term evaluation of the replacement of the trachea with an autologous aortic graft.
Ann. Thorac. Surg ., 2003, 75 , 1572-8.
[17] Martinod E., Seguin A., Holder-Espinasse M. et al . — Tracheal regeneration following tracheal replacement with an allogenic aorta.
Ann. Thorac. Surg ., 2005, 79, 942-9.
[18] Jaillard S., Holder-Espinasse M., Hubert T. et al. — Tracheal replacement with allogenic aorta in the pig.
Chest , 2006, 130 , 1397-404.
[19] Seguin A., Martinod E., Kambouchner et al . — Carinal replacement with aortic allograft.
Ann. Thorac. Surg ., 2006, 81 , 1068-75.
[20] Seguin A., Radu D., Holder-Espinasse M. et al. — Tracheal replacement with cryopreserved, decellularized or glutaraldehyde treated aortic allografts.
Ann. Thorac. Surg ., 2009, 87 , 861-7.
[21] Makris D., Holder-Espinasse M., Wurtz A. et al. — Tracheal replacement with cryopreserved allogenic aorta.
Chest , 2010, 137 , 60-7.
[22] Radu D., Seguin A., Bruneval P., Fialaire-Legendre A., Carpentier A., Martinod E. — Bronchial Replacement with arterial allografts. Ann. Thorac. Surg ., 2010, 90, 252-8.
[23] Wurtz A., Porte H., Conti et al . — Tracheal replacement wit allogenic aorta . N. Engl. J. Med. , 2006, 355, 1938-40.
[24] Wurtz A., Porte H., Conti M. et al. — Surgical technique and results of tracheal and carinal replacement with aortic allografts for salivary gland-type carcinoma.
J. Thorac. Cardiovasc.
Surg ., 2010, 140 , 387-93.
[25] Martinod E., Radu D.M., Chouahnia K., Seguin A., Fialaire-Legendre A., Brillet P.Y., Destable M.D., Sebrane G., Beloucif S., Valeyre D., Baillard C., Carpentier A. — Human transplantation of a biologic airway substitute in conservative lung cancer surgery. Ann.
Thorac. Surg ., 2011, 91 , 837-42.
[26] Kamil S.H., Eavey R.D., Vacanti M.P., Vacanti C.A., Hartnick C.J. — Tissue-engineered cartilage as a graft source for laryngotracheal reconstruction: a pig model. Arch. Otolaryngol.
Head Neck Surg ., 2004 , 130 , 1048-51.
[27] Macchiarini P., Jungebluth P., Go T. et al. — Clinical transplantation of a tissue-engineered airway.
Lancet, 2008, 372 , 2023-30.
[28] Delaere P., Vranckx J., Verleden G., De Leyn P., Van Raemdonck D. — Tracheal allotransplantation after withdrawal of immunosuppressive therapy. N. Engl. J. Med ., 2010, 362, 138-45.
[29] Uzuhan Y. — Les cellules souches en pneumologie : de la thérapie cellulaire au bio-engineering du poumon. Rev. Mal. Respir., 2011, 3 , 8-14. In Press.
[30] Coraux C., Roux J., Jolly T., Birembaut P. — Epithelial cell-extracellular matrix interactions and stem cells in airway epithelial regeneration. Proc. Am. Thorac. Soc ., 2008, 5, 689-94.
[31] Maouche K., Polette M., Jolly T. et al. — Alpha 7 nicotinic acetylcholine receptor regulates airway epithelium differentiation by controlling basal cell proliferation.
Am. J. Pathol ., 2009, 175 , 1868-82.
[32] Kim C.F., Jackson E.L., Woolfenden A.E., Lawrence S., Babar I., Vogel S. et al . —
Identification of bronchioalveolar stem cells in normal lung and lung cancer.
Cell , 2005, 121 , 823-35.
[33] Serrano-Mollar A., Nacher M., Gay-Jordi G., Closa D., Xaubet A., Bulbena O. — Intratracheal transplantation of alveolar type II cells reverses bleomycin-induced lung fibrosis.
Am. J. Respir. Crit. Care Med ., 2007, 176, 1261-8.
[34] Kajstura J., Rota M., Hall S.R., Hosoda T., D’Amario D., Sanada F. et al. — Evidence for human lung stem cells.
N. Engl. J. Med ., 2011 , 364, 1795-806.
[35] Chapman H.A. — Toward lung regeneration . N. Engl. J. Med ., 2011, 364, 1867-68.
[36] Badri L., Walker N.M., Ohtsuka T., Wang Z., Delmar M., Flint A. et al. — Epithelial interactions and local engraftment of lung-resident mesenchymal stem cells.
Am. J. Respir. Cell Mol. Biol ., 2011, In Press.
[37] Chistiakov D.A. — Endogenous and exogenous stem cells: a role in lung repair and use in airway tissue engineering and transplantation. Journal of Biomedical Science , 2010, 17 , 92.
[38] Roomans G.M. — Tissue engineering and the use of stem/progenitor cells for airway epithelium repair. Eur. Cell Mat ., 2010, 19 , 284-99.
[39] Ott H.C., Clippinger B., Conrad C. et al . — Regeneration and orthotopic transplantation of a bioartificial lung.
Nature Medicine , 2010, 16 , 927-33.
[40] Petersen T.H., Calle E.A., Zhao L., Lee E.J., Gui L., Raredon M.B. et al. — Tissueengineered lungs for in vivo implantation. Science , 2010, 329 , 538-41.
Bull. Acad. Natle Méd., 2011, 195, no 7, 1677-1685, séance du 12 octobre 2011