Résumé
La mort subite est responsable de la disparition de 350 000 individus adultes chaque année en Europe soit 1 000 par jour, équivalent à la mortalité cumulée des cancers les plus meurtriers (sein, poumon et colon-rectum). Cette hécatombe est malheureusement assimilée à une mort naturelle par ‘crise’ ou ‘arrêt’ cardiaque, voire une fatalité, sans conscience de son caractère évitable. En effet, la mort subite est dans 80 % des cas liée à un emballement extrême du rythme cardiaque, littéralement une tornade électrique appelée fibrillation ventriculaire, engendrée par des foyers ectopiques ultra rapides, ou la propagation d’ondes chaotiques. Cette arythmie foudroyante peut être liée à un infarctus mais frappe majoritairement des individus au cœur intact ou peu altéré, conférant un caractère ‘illégitime’ à ces décès. Des anomalies génétiques affectant les canaux ioniques, micro-générateurs électriques à la surface des cellules, sont présentes dans 10 % des cas. Les fibrillations ventriculaires entraînent le décès instantané de l’individu en l’absence de massage cardiaque et de choc électrique délivré par un défibrillateur. Le défibrillateur implantable a constitué une innovation majeure mais reste cependant une solution palliative. Les cellules-sources géné- rant les impulsions déclenchantes (étincelles) ont pour origine le tissu de Purkinje soit une fraction infime (2 %) de la masse cardiaque. Leur responsabilité prouvée par thermo ablation locale éliminant l’arythmie, permet d’identifier une nouvelle cible pharmacologique pour le traitement. L’identification des sujets vulnérables est la condition indispensable à la prévention des morts subites. Elle a pour postulat la préexistence d’une dysharmonie sous jacente des forces/champs électriques, qui à un seuil critique, provoquera la tornade électrique. La mise en évidence de cette dysharmonie repose notamment sur la conception de systèmes de cartographie individuelle à haute résolution, par imagerie fonctionnelle ou traitement extrême des signaux électriques cardiaques. Ces progrès nécessitent une recherche interdisciplinaire alliant les techniques d’imagerie et électrophysiologie, l’analyse mathématique des signaux, et la modélisation-simulation des multiples paramètres pré- sents. Elle constitue un défi scientifique majeur par la complexité et la dynamique des phénomènes et leur spécificité individuelle.
Summary
Sudden death is responsible for 350 000 deaths each year in Europe, or 1000 deaths each day, equivalent to the combined mortality from the most lethal cancers (breast, lung and colorectal). Unfortunately, sudden death is widely considered to be ‘‘ natural ’’, being due to unknown but critical cardiac disorders leading to sudden arrest of cardiac activity. Awareness of its potential preventability is inadequate. Indeed, 80 % of cases of sudden death are associated with extremely rapid heartbeats, an ‘‘ electric tornado ’’ called ventricular fibrillation, caused by ultrarapid firing of ectopic foci or chaotic wave propagation. This arrhythmia strikes like lightning. Although it can be associated with myocardial infarction, most victims have structurally normal or slightly altered hearts. The cells which cause this ultrarapid firing originate from the Purkinje system, which constitutes just a fraction (2 %) of total cardiac mass. This is borne out by the fact that the risk of fatal arrhythmic events can be reduced by focal thermoablation. What is most important is to identify subjects at risk of such events. It has been suggested that there exists an unidentified subclinical electrical disharmony, which converts into a tornado of ultimately fatal clinical events at a certain threshold level. High-resolution bioelectrical cardiac mapping, functional imaging, and treatment of electrical field disorders are major scientific challenges given their complexity, intraindividual dynamics and interindividual variability.
INTRODUCTION
La mort subite est définie par l’OMS comme une mort naturelle, marquée par une perte brutale de conscience, dont la survenue est inattendue et se manifeste moins d’une heure après l’apparition d’éventuels symptômes.
Elle constitue un fléau méconnu du public en dépit des milliers de victimes. Sa survenue brutale et souvent sans signes prémonitoires sont les obstacles majeurs à l’amélioration de cette pathologie. Enfin les efforts de recherche qui lui sont dévolus sont insuffisants eu égard à son incidence et gravité, alors même que les moyens méthodologiques permettant l’exploration actuelle de la bioélectricité cardiaque sont extrêmement performants.
PRÉVALENCE
Chaque année près de 350 000 adultes meurent subitement en Europe soit 1 000 personnes par jour [1, 2]. Cette mortalité est égale à la mortalité cumulée des cancers les plus meurtriers — sein, poumon et colon-rectum — et du SIDA. La mort subite reste la cause médicale la plus commune de décès aux États-Unis. Sa contribution relative à la mortalité cardiaque a peu changé dans les vingt dernières années en dépit d’améliorations majeures dans les moyens de reperfusion coronaire, la réduction de la taille des infarctus et les nouvelles médications comme les bêtabloqueurs, les antagonistes de l’angiotensine ou de l’aldostérone, et les inhibiteurs de l’enzyme de conversion [3].
En France, 50 000 personnes meurent subitement chaque année. L’âge moyen au décès est de 65 ans, de sorte qu’une moitié des morts subites survient chez des sujets en âge d’activité professionnelle. 80 % des décès surviennent à domicile ce qui réduit considérablement les chances de ressuscitation par rapport à l’événement survenant en milieu public. La mort subite frappe des sujets au repos ou pendant leur sommeil dans 44 % des cas, pendant un effort dans 15 % des cas, pendant des activités quotidiennes banales dans 37 % des cas, sur le lieu de travail dans 2 % des cas.
Enfin, la mort subite survient sur un terrain de sport dans 1 % des cas, affectant environ 500 sportifs chaque année en France. Son incidence est environ deux fois plus fréquente que chez l’adulte non sportif mais l’impact sur les esprits est bien plus marqué par la diffusion télévisuelle des événements permise par la présence fré- quente de caméras.
De même, la mort subite du nourrisson n’affecte qu’un nombre réduit de sujets, environ 400 par an en France. Ce phénomène dont les causes sont très différentes de la mort subite de l’adulte, est aussi beaucoup plus présent dans l’esprit du public en raison de son exposition médiatique.
Rythme cardiaque associé à la mort subite
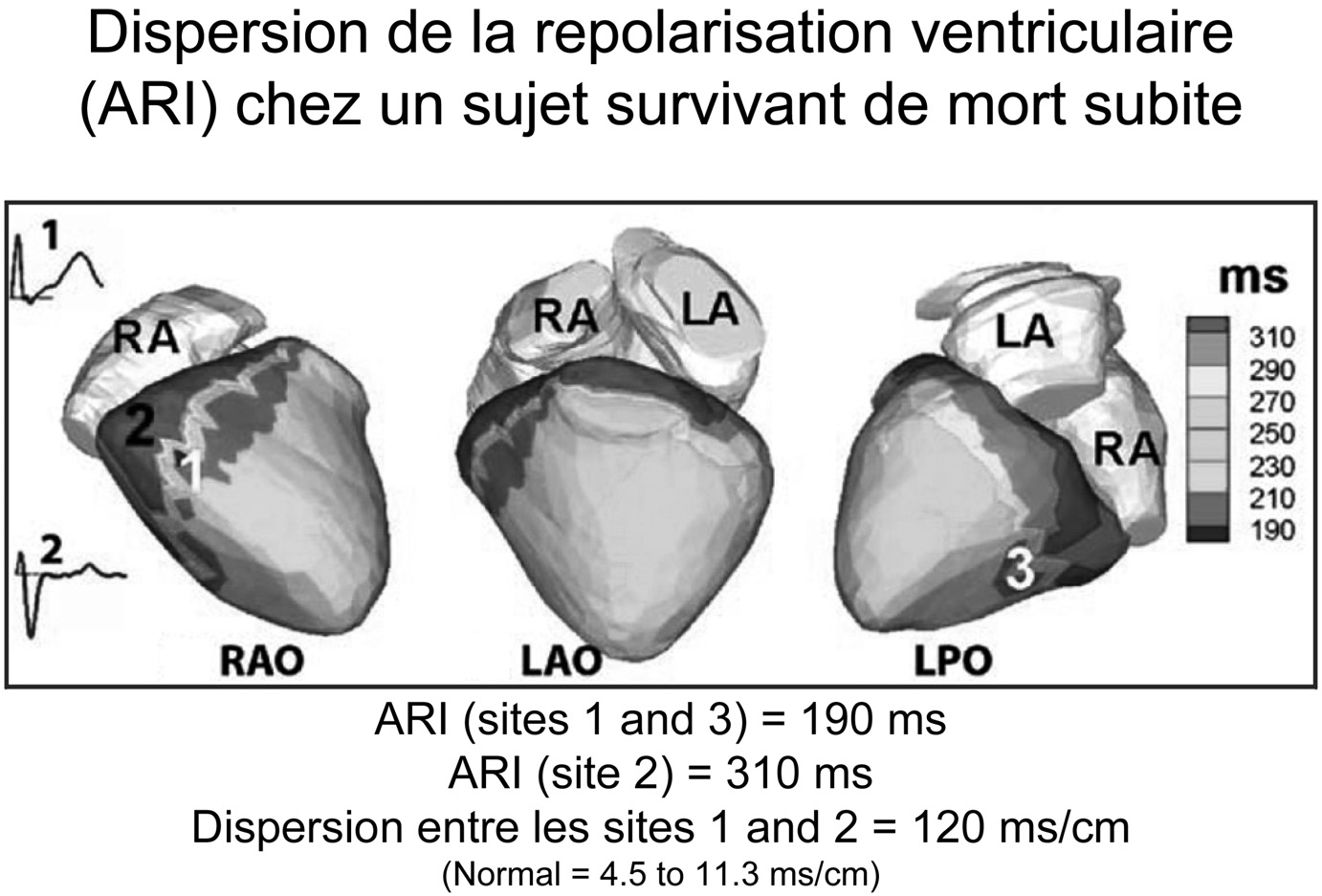
À partir de 1985, les patients vus en cardiologie ont pu être équipés d’appareil enregistrant l’électrocardiogramme pendant une à plusieurs journées. Parmi les millions de patients porteurs d’un tel équipement, certains sont décédés subitement permettant de reconstituer l’événement terminal en interrogeant la mémoire des appareils. La figure1 montre deux exemples d’activité électrique caricaturalement opposée au moment d’une mort subite, arrêt cardiaque ou fibrillation ventriculaire.
L’arrêt véritable de l’activité électrique n’est observé que dans 24 % des cas et le plus souvent la cause en est extracardiaque (hémorragie cérébrale, rupture d’ané- vrysme…).
Dans 76 % des cas la mort subite est liée à un emballement cardiaque exceptionnellement rapide, tachycardie ou fibrillation ventriculaire, analogue à une tornade électrique ; en contradiction avec le terme d’arrêt cardiaque admis en synonyme de mort subite. La fibrillation ventriculaire est la plus extrême des urgences médicales.
La rapidité du rythme ne permet pas au muscle cardiaque de se remplir ou contracter efficacement. Il en résulte un effondrement du débit cardiaque et de l’irrigation
Fig. 1.
cérébrale entrainant la perte de connaissance immédiate. La survie des patients dépendra tout d’abord de la pratique immédiate d’un massage cardiaque pour restaurer un débit sanguin et une oxygénation cérébrale, puis d’un choc électrique appliqué sur le thorax qui rétablira un rythme normal [4]. Ces deux conditions restent difficiles à obtenir car la victime peut être seule au moment de l’accident, car les témoins ont une éducation insuffisante en matière de secourisme, car l’arrivée d’un défibrillateur est tardive. Le taux de survie en Europe reste ainsi de 2 %. Des taux de survies entre 20 et 30 % sont rapportés dans certaines villes (Seattle) ayant des équipes en alerte permanente et des réseaux routiers spécifiquement dédiés aux véhicules sanitaires.
Mécanismes des fibrillations ventriculaires
Deux mécanismes fondamentaux expliquent la genèse des arythmies : des foyers naissant d’une source ectopique ou des circuits liés à une propagation aberrante des influx. Ces deux mécanismes peuvent s’illustrer de la manière suivante: un foyer produit des ondes électriques centrifuges semblables à la pierre jetée dans un plan d’eau ; un circuit s’apparente à un tourbillon qui peut être fixe ou mobile [5-8].
Les foyers sont un mécanisme peu commun de fibrillation car leur capacité de décharge (‘automatisme’ anormal ou ‘activité déclenchée’[9]), est limitée dans le temps. Les circuits sont considérés comme le mécanisme principal des fibrillations ventriculaires car le tourbillon une fois constitué, parvient à se perpétuer soit en se mouvant en permanence vers les régions les plus favorablement excitables, soit en se multipliant en plusieurs ondelettes-filles.
Le mécanisme des circuits est tributaire de l’architecture tissulaire et des caractéristiques electriques propres des cellules. Les anomalies touchant ces deux composantes sont le plus souvent associées en pathologie humaine mais chaque mécanisme élémentaire apparaît quand prédomine le désordre de l’architecture myocardique ou a contrario que l’anatomie soit normale mais les cellules fonctionnellement instables. Ainsi une cicatrice anatomique d’infarctus ou de cardiomyopathie peut constituer à elle seule soit l’élément central d’un mouvement circulaire (tachycardie) soit l’ancrage latéral d’un mouvement tourbillonnaire (fibrillation) comme cela a été montré respectivement sur des cœurs humains in vivo ou explantés. Dans les situations où le cœur est anatomiquement sain, c’est la disparité des propriétés cellulaires électriques (dépolarisation ou repolarisation) qui constituera le substrat de la mort subite. Physiologiquement les potentiels d’action sont inégaux à l’inté- rieur du muscle cardiaque en raison de canaux ioniques de concentration ou répartition différente. Cette disparité physiologique peut s’amplifier et atteindre un seuil critique où le ‘gradient’ électrique entre des cellules en phase opposé vont engendrer des forces électriques dans un espace limité. Spécifiquement les cellules repolarisées seront réactivées par les cellules voisines normales entrainant une réentrée puis un tourbillon ultrarapide (figure). Un tel phénomène a été montré sur Fig. 2. — À gauche, potentiel d’action épicardique physiologiquement plus court que le potentiel endocardique. La flèche verte indique l’effet repolarisant des courants précoces notamment Ito. À droite le courant repolarisant précoce a atteint un seuil critique qui raccourcit brutalement le potential d’action épicardique. Il en résulte la coexistence de potentiels courts et longs propices à un ‘court-circuit’ local, pouvant générer une fibrillation ventriculaire.
Fig. 3.
un plan purement théorique (simulation) puis observé en cartographie optique sur des tissus animaux ou humains. Ces différents mécanismes font l’objet de nombreuses études à la fois théoriques et expérimentales pour préciser les mécanismes ioniques et moléculaires de l’excitabilité de chaque cellule et de la propagation intercellulaire des potentiels.
Genèse des fibrillations ventriculaires chez l’homme
Les patients qui survivent à une fibrillation ventriculaire reçoivent un défibrillateur implantable qui permet de traiter de nouveaux épisodes. Certains de ces patients seront donc victimes de multiples épisodes (chocs répétés du défibrillateur), ce qui les conduit à des hospitalisations pour envisager une thérapie. Chez de tels patients, notre équipe a pu rapporter les premières cartographies chez l’homme de l’initiation des fibrillations ventriculaires [10]. La cartographie est très délicate en raison d’une fenêtre d’exploration limitée à quelques secondes avant la perte de connaissance du patient (qui impose sa défibrillation immédiate).
Dans la majorité des cas, les fibrillations ventriculaires sont initiées par des impulsions générées par le tissu de Purkinje. Ce tissu ne constitue que 2 % de la masse ventriculaire mais ses cellules peuvent délivrer des impulsions dont la fréquence instantanée de 300-400 /min, engendre instantanément le chaos électrique. Le rôle déclenchant des cellules de Purkinje a pu être confirmé dans une grande variété de substrats physiopathologiques allant des cœurs sains à des cœurs extrêmement altérés par infarctus ou cardiomyopathie. La preuve de leur responsabilité a pu être apportée par une destruction localisée (ondes de radiofréquence) qui fait disparaitre les arythmies, ceci étant formellement authentifiée par la mémoire des défibrillateurs. La responsabilité des cellules de Purkinje dans les fibrillations ventriculaires a pu être aussi affirmée chez l’animal. Ainsi chez le chien l’ablation chimique du tissu de Purkinje entraîne une interruption spontanée (!) des arythmies induites. Les cellules de Purkinje ont des propriétés ioniques, conductrices et moléculaires distinctes. Il existe des peptides spécifiques à ce tissu (Contactin-2 par exemple) qui pourraient permettre la mise au point de traitements pharmacologiques ciblés.
La reconnaissance des sujets à risque est un défi scientifique majeur
Les morts subites par fibrillation ventriculaire peuvent être liées à un infarctus aigu par occlusion d’une artère coronaire (40 % dans l’étude de Paris-Cochin). Ces patients ont souvent une douleur prémonitoire qui permet l’appel plus précoce des secours et une meilleure survie. Leur prévention est aussi distincte basé sur l’éviction des facteurs de risque connus : tabagisme, hypertension artérielle, diabète, hypercholestérolémie, faible activité physique.
De même, les patients ayant une cardiopathie avancée (infarctus ancien, cardiomyopathie hypertrophique ou dilatée, dysplasie graisseuse …) sont à plus haut risque de mort subite. De nombreux critères anatomiques ou électriques ont été évaluées dans le but d’améliorer la prédiction du risque. Il en est ainsi du nombre d’extrasystoles ventriculaires, des variations de la repolarisation en durée ou morphologie, de l’influence du système neurovégétatif sur la variabilité de fréquence, de micromodifications de l’ECG par analyse statistique ou amplification-moyennage [1]. L’intérêt initial pour ces critères a été déçu par des études ultérieures. Les recommandations scientifiques n’acceptent actuellement qu’un seul critère qui est la fraction d’éjection du ventricule gauche ; une valeur inferieure à 35 % indique une altération importante de la contraction cardiaque qui désigne un groupe à plus haut risque, d’environ 10 % de mort subite. Ce critère est ‘rudimentaire’ car n’impliquant aucune variable électrique et décevant à la fois en terme de sensibilité et de spécificité. Il est donc nécessaire de traiter par un défibrillateur préventif tous les patients exposés pour sauver un dizième d’entre eux. Le coût très élevé de ces appareils —15 000 euros— et leur suivi représente une charge financière énorme pour la société.
Quantitativement, le plus grand nombre de morts subites frappera cependant des individus au cœur intact ou peu altéré pour lequel le risque ne peut être reconnu avant l’événement. L’identification de ce risque léthal à fin de dépistage et prévention constitue un défi scientifique majeur. Le grand nombre de patients avec cardiopathie peu évoluée figure dans ce cadre. Les facteurs anatomiques ou électriques qui identifieraient la minorité des patients à risque restent méconnus.
Une anomalie génétique affectant les canaux électriques membranaires est responsable de la plupart des morts subites survenant avant 35 ans [11-19]. Ces syndromes souvent familiaux sont nommés par l’altération qu’elle provoque sur l’électrocar- diogramme : QT long, QT court, Brugada, repolarisation précoce. Il est estimé qu’environ 10 % des morts subites ont une mutation affectant un canal ionique ou une protéine du métabolisme calcique). Il existe probablement d’autres gènes de susceptibilité et certainement une multi génicité comme dans les autres pathologies.
Il y a ainsi plus de 70 gènes codant pour le canal potassique. Plusieurs études explorant le génome entier sont en cours pour rechercher d’autres marqueurs de prédisposition génétique. Des drogues pharmacologiques inhibant des canaux ioniques spécifiques sont utilisées en cardiologie pour révéler des altérations infracliniques notamment dans le cadre des bilans de mort subite familiale [16].
Plusieurs éléments cliniques sont à rechercher chez les sujets à risque de mort subite : les antécédents de mort subite chez les parents, et les syncopes. Dans une enquête prospective parisienne de 7 000 hommes suivis plus de 25 ans, les sujets dont l’un des parents avait fait une mort subite ont présenté deux fois plus de morts subites. Les hommes dont les deux parents étaient décédés subitement ont présenté neuf fois plus de morts subites au cours du suivi. De plus, il a été montré une corrélation positive des âges, c’est-à-dire que les hommes décédaient de mort subite à peu près aux mêmes âges que leurs parents. Les syncopes suspectes d’un trouble cardiaque grave ont pour spécificités de survenir sans aucun prodrome (qui permettrait de se prémunir d’une chute) et d’avoir un caractère vulnérant.
Avancées/espoirs dans la prédiction
L’effort de recherche en France (ou en Europe) est relativement modeste à l’égard du nombre considérable de victimes et aux possibilités qu’offriraient les outils scientifiques actuels [20, 21]. Certaines disciplines telles les mathématiques ou la simulation numérique sont des domaines d’excellence de notre pays mais sont peu appliquées à l’étude de la bioélectricité cardiaque. Des techniques majeures d’investigation comme les potentiels optiques, ou la cartographie organe entier ne sont pas encore disponibles.
Les études qui permettraient l’identification des sujets à risque doivent tout d’abord mieux élucider les phénomènes électriques sur différents modèles animaux et cardiopathies humains. Elles doivent ensuite permettre une exploration extrêmement fine de la structure anatomique et/ou fonctionnelle des ventricules, ses caractéristiques propres à l’arythmogènes en utilisant des méthodes de modélisation-simulation.
Les techniques d’imagerie par RMN ou PET Scan sont la voie principale d’exploration de l’architecture myocardique dans les cœurs altérés. Dans les cœurs sains, les recherches génétiques sur génome entier se poursuivent pour identifier des marqueurs de vulnérabilité. Le ‘phénotype’ électrique quant à lui, s’exprime par les signaux de l’électrocardiogramme. Ceux-ci cependant ne représentent que 30 % de ‘‘ l’énergie ’’ électrique générée par le cœur et nous avons de grands espoirs que de meilleures techniques d’extraction des signaux par les outils biophysiques et mathé- matiques devraient considérablement amplifier la valeur de cette information.
Notre équipe a ainsi rapporté en 2009 qu’un tiers des morts subites inexpliquées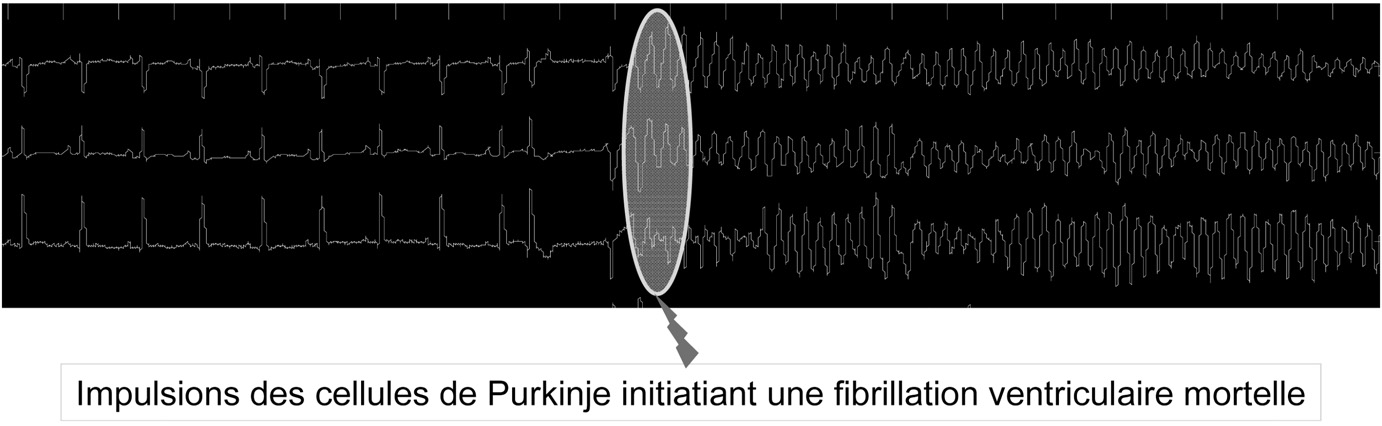
Fig. 4.
présentaient un signe électrocardiographique mineur (repolarisation précoce) qui s’amplifiait dans les minutes précédant l’éclosion des fibrillations ventriculaires [19, 22-24). Une exploration fine du signal électrique pourrait déceler une plus grande incidence de telle anomalie électrique, comme le montre la figure 3 illustrant un patient ressuscité d’une mort subite sur cœur sain. Le champ électrique étudié à très haute résolution par un appareil-prototype, montre des disparités de propriétés sur des zones contigües qui sont susceptibles de provoquer des ‘courts-circuits ‘ générateurs de l’événement.
CONCLUSION
La mort subite est due dans la majorité des cas à un emballement brutal et extrême du rythme cardiaque appelé fibrillation ventriculaire, et minoritairement à un arrêt véritable de l’activité cardiaque. Cette affection constitue la plus extrême des urgences médicales entraînant un décès instantané en l’absence de massage cardiaque et défibrillation électrique.
Il ne s’agit pas d’une mort naturelle ni d’une fatalité mais d’une pathologie électrique générée par des sources identifiées, provenant d’une part infime de la masse myocardique. Ces cellules-sources ont des propriétés moléculaires spécifiques qui permettraient des thérapeutiques ciblées.
L’identification des sujets menacés reste le problème majeur en raison de la faible fréquence des signes prémonitoires (syncopes, antécédents familiaux) et de l’insuffisance des critères actuels de prédiction. La cartographie fine du champ électrique cardiaque, à la recherche de zones de dynamique divergente, est une voie prometteuse qui requiert des innovations méthodologiques majeures dans le traitement du signal ou l’imagerie fonctionnelle. Si le cœur est anatomiquement altéré, l’imagerie à haute résolution de l’architecture myocardique pourrait apporter des critères additionnels. Les outils scientifiques d’exploration de la bioélectricité cardiaque offrent de réelles possibilités mais il n’existe pas de structure de recherche convergeant les disciplines nécessaires.
En raison du nombre considérable de victimes, des progrès même modestes dans le diagnostic et la thérapie des fibrillations ventriculaires, se traduiraient par un grand nombre de vies épargnées.
BIBLIOGRAPHIE [1] Zipes D.P., Camm A.J., Borgreffe M. et al . — Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden death — executive summary.
J. Am. Coll.
Cardiol ., 2006, 48 , 1064-1108.
[2] Corrado D., Basso C., Thiene G. — Sudden cardiac death in young people with apparently normal heart. Cardiovascular. Res., 2001, 50 , 399-408.
[3] Buxton A.E. — Implantable Loop Recorder in Survivors of Acute Myocardial Infarction: A Glimpse of Reality? Circulation, 2010 , 122 , 1255-1257.
[4] Marenco J.P., Wang P.J., Link M.S. et al. — Improving survival from sudden cardiac arrest:
the role of the automated external defibrillator. JAMA, 2001, 7 , 285(9), 1193-200.
[5] Gray R.A., Jalife J., Panfilov A.V. et al . — Mechanisms of cardiac fibrillation. Science , 1995, 270 , 1222-25.
[6] Janse M.J., Kleber A.G., Cappuci A. et al. — Electrophysiological basis for arrhythmias caused by acute ischemia. Role of the subendocardium . J. Mol. Cell Cardiol ., 1986, 18 , 339-55.
[7] Jalife J. — Ventricular Fibrillation: Mechanisms of initiation and maintenance. Ann. Rev.
Physiol., 2000, 62 , 25-50.
[8] Chen P.S. — Electrode mapping of ventricular fibrillation. In Cardiac Electrophysiology: From cell to bedside, ed DP Zipes, J Jalife, 2000 pp 395-404. WB Saunders, Philadelphia, USA.
[9] Friedman P.L, Stewart J.R., Wit A.L. — Spontaneous and induced cardiac arrhythmias in subendocardial Purkinje fibers surviving extensive myocardial infarction in dogs. Circ. Res ., 1973, 33 , 612-26.
[10] Haissaguerre M., Shoda A., JAIS P. et al. — Mapping and Ablation of Idiopathic Ventricular
Fibrillation.
Circulation, 2002, 106, 962-967.
[11] Moss A.J., Schwartz P.J., Crampton R.S., Locati E., Carleen A. — The long QT syndrome:
a prospective international study. Circulation , 1985, 71, 17-21.
[12] Brugada J., Brugada R., Brugada P. — Right bundle-branch block and ST-segment elevation in leads V1 through V3: a marker for sudden death in patients without demonstrable structural heart disease. Circulation , 1998, 97, 457-60.
[13] Leenhardt A., Glaser E., Burguera M., Nurnberg M., Maison-Blanche P., Coumel P. — Short-coupled variant of torsade de pointes. A new electrocardiographic entity in the spectrum of idiopathic ventricular tachyarrhythmias. Circulation , 1994 , 89, 206-215.
[14] Gussak I., Brugada P., Brugada J., Wright R.S., Kopecky S.L., Chaitman B.R., Bjerregaard P. — Idiopathic short QT interval: a new clinical syndrome. Cardiology, 2000, 94, 99-102.
[15] Gaita F., Giustetto C., Bianchi F., Wolpert C., Schimpf R., Riccardi R., Grossi S., Richiardi E., Borgreffe M., Short Q.T. — Syndrome ; A familial cause of sudden death.
Circulation 2003 , 108, 965-70.
[16] Antzelevitch C., Brugada P., Borgreffe M., Brugada J., Brugada R., Corrado D., Gussak I., Lemarec H., Nademanee K., Riera A.R.P., Shimizu W., Schulze-Bahr E., Tan H., Wilde A. — Brugada syndrome ; report of the second consensus conference . Circulation 2005 , 111 , 659-670.
[17] Potet F., Mabo P., Lecoq G., Probst V., Schott J.J., Airaud F., Guihard G., Daubert J.C., Escande D., Le Marec H. — Novel Brugada SCN5A mutation leading to ST segment elevation in the inferior or the right precordial leads. J. Cardiovasc . Electrophysiol. , 2003, 14, 200-203.
[18] Mehta M., Jain A.C., Mehta A. — Early repolarization . Clin. Cardiol ., 1999, 22 , 59-65.
[19] Haissaguerre M., Derval N., Sacher F. et al. — Sudden cardiac arrest associated with early repolarization.
N. Engl. J. Med ., 2008, 358, 2016-23.
[20] Rudy Y. — Systems Approach to Understanding Electromechanical Activity in the Human Heart: A National Heart, Lung, and Blood Institute Workshop Summary. Circulation, 2008, 118, 1202-1211.
[21] Gima K., Rudy Y. — Ionic current basis of electrocardiographic waveforms: a model study.
Circ. Res ., 2002, 90, 889-896.
[22] Yan G.X., Antzelevitch C. — Cellular basis for the electrocardiographic
J. wave. Circ. Res., 1990 , 93 , 372-9.
[23] Nabauer M., Beuckelmann D.J., Uberfuhr P., Steinbeck G. — Regional differences in current density and rate-dependent properties of the transient outward current in subepicardial and subendocardial myocytes of human left ventricle. Circulation, 1994.
[24] Bauer A., Becker R., Dreyhaupt J., Voss F., Kraft P., KelemenK, Senges-Becker J.C., Katus H.A., Schoels W. — Role of KATP channels in repetitive induction of ventricular fibrillation . Europace 2007, 9, 154-161.
DISCUSSION
M. Iradg GANDJBAKHCH
Les techniques modernes d’enregistrement externes que vous proposez, ont-elles remplacé l’électro physiologie endocavitaire ?
L’électrophysiologie par voie externe a pour objectif de saisir toute l’énergie électrique qui est initialement générée par l’activité cardiaque. Il y a en effet une atténuation considérable du signal cardiaque, de l’ordre de 70 % pendant sa traversée thoracique. Des techniques mathématiques sophistiquées de traitement du signal enregistré sur la poitrine devraient nous permettre de reconstruire les potentiels et les champs électriques initialement émis (le problème inverse, en langage mathématique).
M. Yves GROSGOGEAT
Peut-on assimiler les phénomènes de la torsade de pointes au mécanisme de la fibrillation ventriculaire que vous décrivez ? Quel mode de travail avez-vous pendant la procédure d’ablation qui peut durer plusieurs heures : travail en binôme ? La procédure a-t-elle une durée limite ?
La torsade de pointes est une variété de fibrillation ventriculaire qui survient dans le cadre nosologique des syndromes du QT long. Le QT long indique par définition que la repolarisation est très prolongée, en raison de mutations génétiques affectant les canaux potassiques et parfois le canal sodique ou en raison de facteurs acquis notamment l’influence d’une variété de drogues pharmaceutiques. A l’exception de ce terrain particulier, la torsade de pointes partage les mécanismes fondamentaux des fibrillations ventriculaires faisant intervenir les cellules de Purkinje comme élément initiateur (mais pas exclusivement) et des réentrées dans le myocarde. Vous soulignez, à juste raison, la charge de travail considérable et parfois exténuante de certaines procédures d’ablations.
La limite dépend de l’état du patient et des conditions hémodynamiques. Quant à nous, il arrive souvent que nous nous relayons pour les différentes étapes de cartographie ou ablation.
M. Jean-Paul BOUNHOURE
L’individualisation de zones arythmogènes servant de substrat aux fibrillations « ventriculaires » est possible pour des spécialistes électrophysiologistes très compétents comme vous-même. Dans votre expérience combien de fois avez-vous pu isoler, traiter et faire l’ablation de ces cellules ?
Notre expérience de l’ablation des cellules initiatrices des fibrillations ventriculaires est considérée, sans prétention aucune, comme la plus importante du monde. Environ 80 patients maintenant, quand les autres équipes rapportent des séries de 3 à 12 patients.
Nous avons rapporté le suivi à long terme des patients ayant un recul de cinq années au moins : l’interrogation des défibrillateurs apporte la preuve d’une efficacité thérapeutique dans 85 % des cas.
M. Christian NEZELOF
En tant que pathologiste, l’autopsie des sujets décédés de mort subite ne montre aucune lésion, malgré une étude scrupuleuse, confirmant les cœurs « intrinséquement normaux » que vous avez signalés. Et d’autre part, pourquoi les cellules de Purkinje échappent à la nécrose, en cas d’infarctus ?
Les études anatomopathologiques montrent 10 à 15 % de cœurs intrinsèquement normaux après mort subite. L’étude la plus ample a été rapportée par nos amis lyonnais Loire et Brion sur plus de mille sujets. Vous savez que l’on pratique actuellement des ‘autopsies moléculaires’ lorsque l’autopsie ne montre aucune lésion. Il est recherché des mutations génétiques affectant les canaux ioniques. On retrouve ainsi jusqu’à 30 % de mutations chez les femmes décédées de manière inexpliquée et seulement 4 % dans le cas des hommes. Cette divergence est retrouvée dans quatres études différentes. Les cellules de Purkinje échappent à la nécrose car leur disposition, très superficielle, dans l’endocarde, leur permet d’absorber l’oxygène sanguin ; comme les poissons rouges dans un bocal, si j’ose dire. La survie des cellules de Purkinje au milieu même d’un infarctus massif est attestée aussi bien chez l’homme que chez l’animal.
M. André VACHERON
Vous avez évoqué le rôle des canaux ioniques notamment potassiques dans la genèse des arythmies ventriculaires. Qu’en est-il du rôle des canaux sodiques dont on a dit qu’ils pourraient être bloqués par les acides gras omega3 qui réduisent le risque de morts subites après infarctus myocardique ?(Etudes Gissi)
Les canaux sodiques interviennent dans certaines formes génétiques de mort subite (syndrome de Brugada et long QT 3). Je n’ai pas de connaissance précise sur l’effet des omégas 3 sur les canaux sodiques. Quant à leur impact sur la mortalité post infarctus, je crois que persistent de nombreuses incertitudes. Néanmoins, les poissons gras restent une alimentation favorable contre l’athérosclérose que l’on peut recommander.
M. Patrice QUENEAU
J’ai vécu plusieurs tragédies par mort subite parmi mes proches : que conseillez-vous chez les trois fils d’un de mes amis victime d’une mort subite à 50 ans après son jogging ? La mort a été la même pour son frère et son père décédés au même âge, dans des circonstances à peu près comparables ? A noter que mon ami, son frère et son père étaient des sportifs amateurs habituels et que les efforts physiques qui avaient préludé à leur mort subite, étaient des efforts pour eux, habituels.
Triste histoire en effet. La survenue de morts subites à l’effort est statistiquement inhabituelle, la plupart des décès survenant au repos ou dans des circonstances normales de la vie quotidienne. Ces trois décès à l’effort suggèrent clairement des causes particulières. On peut probablement exclure une maladie coronarienne c’est-à-dire un infarctus dans les trois tragédies que vous mentionnez, car il y aurait eu des signes avant coureurs et des facteurs de risque significatifs. Il est hautement probable qu’existe des arythmies spécifiquement liées aux catécholamines, par exemple syndrome du QT long, ou TV catécholergique ou certaines cardiomyopathies. Ces pathologies ont l’avantage d’être détectables avec une haute sensibilité et spécificité des investigations actuelles. Je conseillerai aux enfants de pratiquer épreuves d’effort, échographie et bilan génétique.
En cas de doute persistant, une perfusion de catécholamines et une IRM pourront être effectuées. Notre équipe est à leur disposition s’ils le souhaitent.
M. Jacques BATTIN
La modestie de Michel Haissaguerre l’a empêché de dire qu’il était l’équipe cardiologique de France la plus primée, le prix lourd Jeantet de Genève en avril 2010 qui récompense pour la première fois un clinicien après des prix Nobel, le prix de l’Institut tout dernièrement. Il a aussi l’aval des autorités universitaires et régionales pour constituer un centre de recherche des arythmies. Est-il au stade de la recherche des équipes constituant ?
Merci pour le compliment. Effectivement, nous souhaitons créer une importante structure de recherche dévolue aux arythmies cardiaques et à la mort subite. L’idée est de recruter les spécificités scientifiques absentes de notre pays et de les associer aux équipes de cardiologie, d’imagerie et de sciences numériques déjà présentes à Bordeaux. Cette structure porterait le nom d’Institut de Rythmologie et Modélisation Cardiaque LYRIC.
Cette convergence de compétences en cartographie, biophysique, mathématique et imagerie serait unique en Europe et au-delà. Elle aurait à notre avis le potentiel de répondre aux défis majeurs que posent les maladies électriques cardiaques et leur impact sur la mortalité : l’identification des sujets menacés de mort subite, les cibles moléculaires dans les fibrillations, ou la thérapie électrique de l’insuffisance cardiaque. Nous avons eu des réponses très favorables de scientifiques étrangers dans l’hypothèse où le budget nous serait accordé dans le cadre des instituts hospitalo-universitaires. La soumission du projet est fixée au début novembre.
Bull. Acad. Natle Méd., 2010, 194, no 6, 983-995, séance du 29 juin 2010