Résumé
L’avènement de l’Imagerie par Résonance Magnétique (IRM) permet à présent de mesurer, au millimètre près, l’évolution de la taille d’un gliome de bas grade et de tracer, pour chaque patient, sa courbe de croissance du diamètre tumoral. L’interprétation de ces courbes nécessite de faire appel à des modèles mathématiques, afin de trouver le meilleur paramètre caractérisant chaque dynamique tumorale individuelle. Nous présenterons le modèle le plus couramment utilisé, reposant sur une équation de prolifération-diffusion. Nous montrerons comment ces efforts de modélisation mathématique font progresser notre compréhension de l’histoire naturelle de ces tumeurs et apporte un nouveau facteur à forte valeur pronostique. Enfin, ce travail ouvre de nouvelles pistes dans l’analyse de l’effet des traitements, ce qui pourrait conduire à une optimisation de ceux-ci dans un futur proche.
Summary
Magnetic resonance imaging can be used to quantify low-grade glioma growth with millimetric accuracy. Mathematical modeling helps to analyze individual glioma growth curves and tumor dynamics. Here we focus on the most extensively studied model, based on a proliferation-diffusion equation. We examine how this model offers a new quantitative approach to the natural history of low-grade glioma, including tumor kinetics and other well-known prognostic factors. This approach, based on quantitative imaging coupled with mathematical modeling, has the potential to help optimize treatment strategies.
INTRODUCTION
Les gliomes de grade II de la classification de l’OMS, plus communément appelés gliomes de bas grade, sont des tumeurs rares, se révélant le plus souvent par une crise d’épilepsie, survenant chez un adulte jeune sans déficit neurologique. Le diagnostic est très fortement suspecté sur les caractéristiques de la lésion à l’IRM : hyposignal T1, hypersignal T2 ou flair, absence de prise de contraste. Les nouvelles séquences d’IRM par spectroscopie et de perfusion ainsi que la Tomographie par Emission de Positrons (TEP) permettent d’affiner le diagnostic radiologique [21]. Le diagnostic de certitude repose sur l’examen anatomopathologique, aujourd’hui indissociable d’une étude moléculaire : les patients avec une tumeur présentant une mutation du gène TP53 ont un moins bon pronostic que les patients dont la tumeur montre une perte d’hétérozygotie des chromosomes 1p et 19q [21].
Malgré les progrès — aussi bien pour la survie que pour la qualité de vie — de la chirurgie oncologique fonctionnelle [6], de la chimiothérapie [25] et de la radiothérapie conformationnelle [1], les gliomes de bas grade restent une pathologie fatale, avec des médianes de survie aux alentours de 10-15 ans. Cependant, les gliomes de bas grade posent avant tout un vrai défi méthodologique : comment progresser dans la compréhension et la prise en charge thérapeutique de ces tumeurs compte tenu de leur rareté (difficultés pour unifier de petites séries sur plusieurs centres), de leur hétérogénéité histologique, génétique et cinétique (difficultés pour comparer les séries), et de leurs longues survies (difficultés pour élaborer des études prospectives randomisées) ? Tout au long de cet article, nous tenterons d’analyser quels peuvent être les apports de la modélisation mathématique à cette problématique.
La mesure quantitative en IRM
Si l’IRM permet de « voir » les tumeurs avec une résolution millimétrique, encore faut-il être capable de mesurer avec précision l’évolution d’un gliome de bas grade lors d’un suivi longitudinal. Le procédé le plus simple est de mesurer les trois plus grands diamètres dans les trois plans de l’espace sur deux IRM successives. Cependant, cette méthode — très pratique d’un point de vue clinique si bien qu’elle fut utilisée dans les premiers travaux — est trop approximative, et ce, principalement pour deux raisons : les plans de coupe ne sont pas les mêmes d’un examen à l’autre et les tumeurs ont une forme parfois très irrégulière (en particulier pour un résidu tumoral post-opératoire). Il est donc indispensable qu’un expert segmente, à l’aide d’un logiciel d’imagerie, l’ensemble du volume tumoral [12]. De nombreux travaux sont en cours pour tenter d’automatiser cette tâche, afin de gagner en temps et en fiabilité. Enfin, on utilisera une simple formule pour calculer un diamètre équivalent à partir du volume : D = (2V)1/3.
Fig. 1. — Courbe de croissance d’un patient fictif, pour lequel on dispose de deux mesures du diamètre, séparées de deux ans, respectivement 10 mm et 20 mm. Extrapolation de la croissance du diamètre à partir de ces deux points, dans l’hypothèse d’une croissance exponentielle (courbe pointillée) ou linéaire (courbe bleue).
Les enjeux de la modélisation mathématique
Dans sa définition mathématique, un modèle est une équation décrivant l’évolution dans le temps de la variable étudiée. Cette variable peut-être un nombre (nombre total de cellules, le volume de la tumeur) ou une fonction (densité de cellule en chaque point du cerveau). Des paramètres, dont les valeurs diffèrent pour chaque patient, sont introduits dans le modèle. Le modèle idéal doit permettre :
— de donner une interprétation biologique à ces paramètres (capacité migratoire, index de prolifération, …) — d’ajuster ces paramètres pour chaque patient, en sorte de reproduire au mieux leur courbe d’évolution.
— de trouver un intérêt clinique une fois les paramètres déterminés d’un patient (prédiction de l’évolution future, évaluation de l’effet des traitements, corrélation aux données moléculaires).
Afin d’illustrer le propos, considérons un patient fictif (voir Figure 1), pour lequel le diamètre tumoral moyen augmenterait de 10 mm à 20 mm sur les deux premières années. Dans l’interprétation habituelle de la croissance en oncologie, ceci correspondrait à une croissance exponentielle, avec un temps de doublement de deux ans.
On prédirait donc une taille de 40 mm deux ans plus tard. Cependant, comme nous le verrons plus loin, on pourrait tout aussi bien considérer que la croissance suive une loi linéaire. Dans ce cas, on prédirait une taille de 30 mm deux ans plus tard.
Ainsi faut-il choisir la bonne loi mathématique si l’on veut espérer extrapoler l’évolution future. Inversement, si l’on imagine maintenant que la troisième valeur est effectivement de 40 mm, les modèles exponentiels et linéaires correspondent à des interprétations différentes en terme de comportement biologique de la tumeur : dans le modèle exponentiel, on conclurait à une stabilité biologique au cours des quatre années d’évolution (coefficient de prolifération constant) alors que dans le modèle linéaire, la pente sur les deux dernières années est double par rapport à la pente sur les deux premières, c’est à dire que la tumeur aurait changé de comportement et serait devenu plus agressive (augmentation du coefficient de prolifération et/ou du coefficient de diffusion).Oncomprendainsi,surcetexempleunpeuthéorique,l’importance du choix de la de la loi mathématique que l’on va utiliser pour décrire les courbes de croissance du diamètre, tant pour faire des prédictions sur l’évolution future que pour interpréter les courbes en terme de comportement biologique tumoral.
Le choix d’un modèle
La nature des données à analyser va guider le choix d’un modèle mathématique. Si l’on cherche à modéliser des observations histologiques (en numérisant par exemple la position de chaque cellule sur une lame), on s’orientera vers les modèles d’automates cellulaires : chaque cellule est modélisée par sa position sur un maillage tridimensionnel, et à chaque itération temporelle (d’une durée correspondant à un cycle cellulaire), des règles décident du nouvel état de chaque cellule en fonction de son environnement (division, quiescence, apoptose, migration, …). L’avantage de ces méthodes est que les lois biologiques cellulaires sont tout naturellement intégrées au modèle. Le prix à payer réside dans la très grande puissance de mémoire et de calcul nécessaire à la simulation d’une tumeur réelle (environ 1010 cellules). De plus, le traitement quantitatif des données histologiques ne reste que très peu développé à ce jour. C’est sans doute la raison pour laquelle la plupart des études des dix dernières années se sont attachées à modéliser la dynamique tumorale en exploitant les images non invasives provenant des examens longitudinaux d’IRM. Paradoxalement, dans le modèle le plus répandu (modèle de prolifération-diffusion, voir infra ), la variable d’intérêt n’est pas directement mesurable par l’IRM, puisqu’il s’agit de la densité de cellules tumorales. Le lien avec l’anomalie de signal à l’IRM repose sur l’hypothèse que la tumeur est visible sur l’IRM seulement si la densité de cellules tumorales dépasse un certain seuil. L’absence de vérification expérimentale de ce lien ainsi que l’imprécision sur la valeur numérique exacte de ce seuil constituent la principale faiblesse du modèle actuel [12].
Le modèle prolifération-diffusion et ses prédictions
Au milieu des années 1990, une équipe américaine, associant un anatomopathologiste et des biomathématiciens, a proposé un modèle pour décrire la courbe de croissance radiologique d’un gliome [4, 29, 32]. L’équation cherche à prendre en compte le plus simplement possible les deux caractéristiques biologiques des tumeurs gliales : la prolifération et la migration cellulaire. Ainsi, en tout point du parenchyme cérébral, la variation par unité de temps de la densité cellulaire est la somme de deux termes : les cellules nouvellement créées par prolifération, et les cellules provenant par migration d’un point proche (et de densité supérieure). Ce qui donne mathématiquement :
Les premières simulations se faisaient en deux dimensions, et étaient comparées aux images séquentielles tomodensitométriques de gliomes de haut grade. C’est à partir de 2000, que les simulations vont devenir beaucoup plus réalistes, en utilisant l’atlas du MNI comme substrat « in silico », ce qui autorise non seulement des simulations tridimensionnelles, mais aussi d’affiner les paramètres, avec des capacités migratoires dans la substance blanche supérieures à celles de la substance grise [26-28]. Enfin, la version la plus complète prend également en compte l’anisotropie de la substance blanche, en se basant sur les séquences en tenseur de diffusion pour implémenter une migration cellulaire plus élevée parallèlement aux axones qu’orthogonalement [9].
Si ces modèles donnent de très beaux résultats pour simuler la croissance d’un gliome « in silico », ils ne sont malheureusement pas facilement applicables en pratique clinique : les paramètres D et ρ propres à chaque patient sont très difficiles à déterminer compte tenu du caractère incomplet des données dont on dispose (c’est à dire les IRM successives). Cependant deux approximations permettent de simplifier le modèle afin de le confronter aux données cliniques :
— on peut montrer que le front tumoral visible à l’IRM avance à vitesse constante, cette vitesse étant égale à 2√(Dρ). Autrement dit, la loi de croissance du diamètre est linéaire, avec une pente valant 4√(Dρ). Biensûr, lors d’un changement biologique de la tumeur, comme la transformation anaplasique, les paramètres D et ρ vont augmenter, ce qui va se traduire par une cassure de la pente de croissance, — une étude récente a confirmé que l’on retrouvait des cellules tumorales au-delà de la lésion visible en hypersignal T2 ou FLAIR sur l’IRM [25]. Dans le cadre du modèle, l’étendue spatiale de cette partie invisible de la tumeur est proportionnelle à exp(√(D/ρ)) (voir Figure 2).
Applications cliniques
Étude de la croissance spontanée C’est donc guidés par ce modèle que nous avons décidé de quantifier la croissance radiologique des gliomes de bas grade en suivant le diamètre [11], rompant ainsi avec les publications antérieures, focalisées sur le volume tumoral [2]. Sur une première série rétrospective de 27 patients pour qui une attitude de surveillance radiologique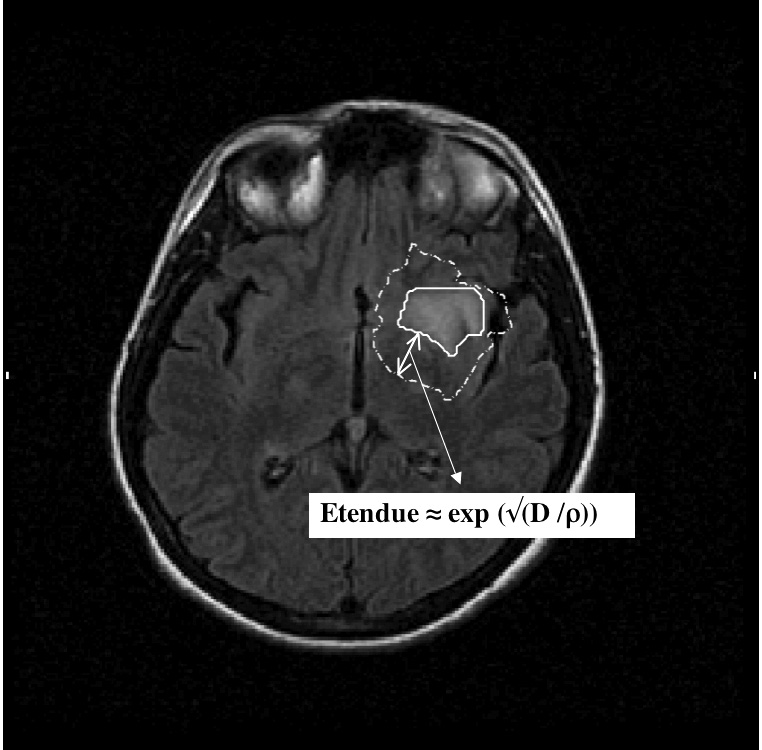
Fig. 2. — Estimation de la taille de la tumeur non visible à l’IRM en fonction des paramètres D et ρ de l’équation de prolifération-diffusion.
avait été retenue, la mesure du diamètre moyen sur les IRM successives va révéler des courbes individuelles tout à fait compatibles avec l’hypothèse d’une croissance linéaire du diamètre ainsi qu’une croissance moyenne de 4 mm/an (voir Figure 3).
Cependant, on constate une disparité très importante entre chaque patient : dans cette première étude les taux de croissance étaient déjà compris entre 2 et 8 mm/an.
Une seconde étude [16], menée sur 143 patients, va bien retrouver une distribution à peu près gaussienne, centrée sur 4 mm/an, mais aussi un petit nombre de patients (environ 15 %) avec des taux étalés entre 8 et 36 mm/an. On trouve donc une importante hétérogénéité des taux de croissance, qui semble bien correspondre à la grande hétérogénéité des durées de survie des patients porteurs d’un gliome de bas grade.
Il n’est pas inintéressant de noter que l’on retrouve la même valeur moyenne de croissance spontanée (4 mm/an) sur une série de patients pour lesquels le gliome de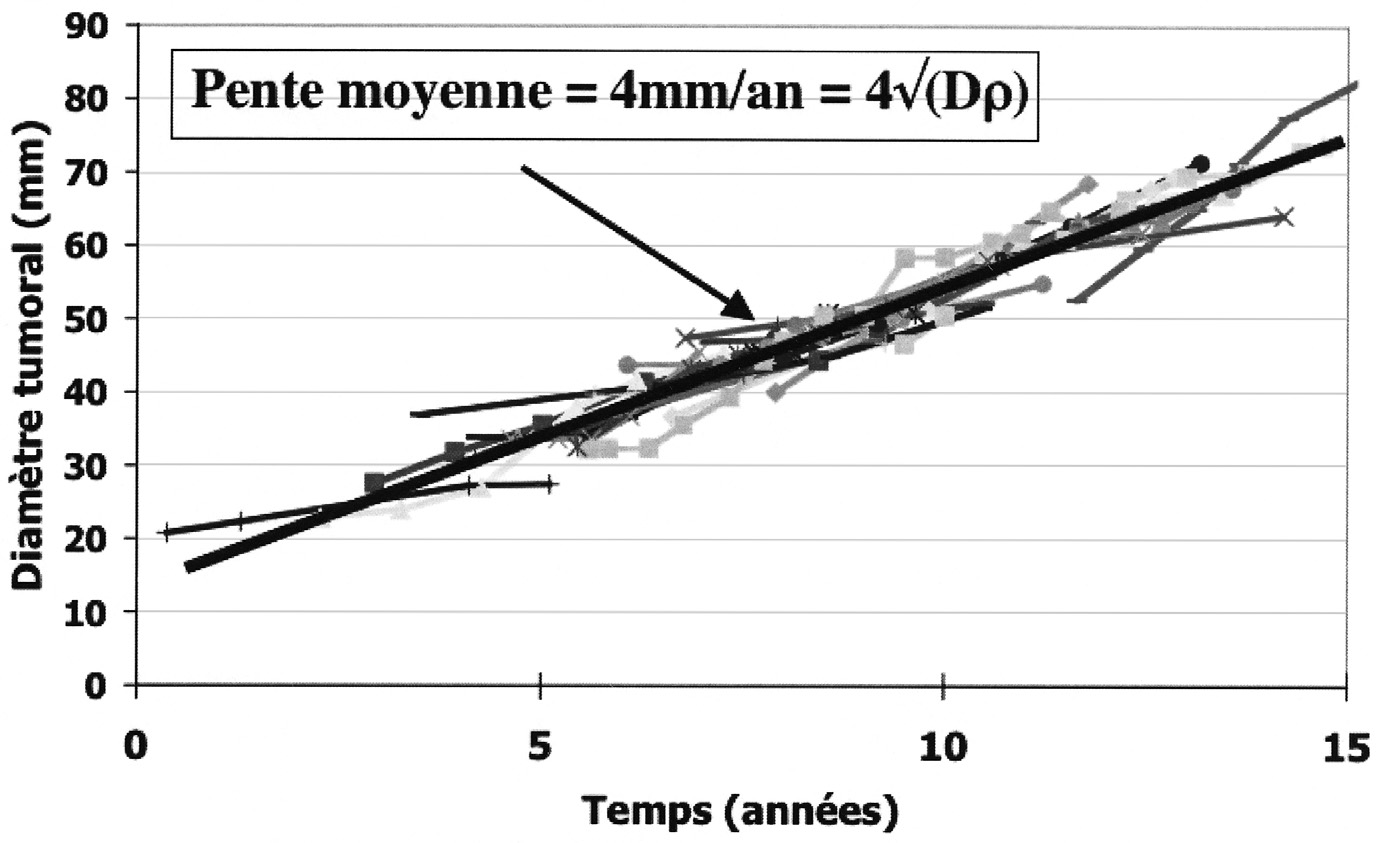
Fig. 3. — Courbes de croissance du diamètre sur une série de 27 patients. La pente moyenne est de 4 mm/an, ce qui permet d’estimer le produit Dρ.
grade II a été découvert fortuitement [17] (i.e. sur une IRM dont le motif de prescription n’était ni une crise convulsive, ni un déficit neurologique ou des signes d’hypertension intracrânienne). Ce résultat renforce l’idée que le taux de croissance du diamètre est un bon paramètre pour décrire la dynamique intrinsèque d’une tumeur, qui reste constante tout au long de la phase « bas grade ».
Le suivi quantitatif du diamètre tumoral a également permis de découvrir certains des facteurs qui peuvent influencer la croissance spontanée des gliomes de bas grade.
Tout d’abord, il semble que le phénotype histologique (oligodendrogliome versus astrocytome) n’influence pas la cinétique tumorale [3, 13, 16, 23]. En revanche, les caractéristiques moléculaires sont associées à différentes vitesses de croissance spontanée. Ainsi, il a été montré que la perte d’hétérozygotie des chromosomes 1p et 19q est associée une croissance plus lente [23]. A l’inverse, la surexpression de la protéine p53 est corrélée à des vitesses plus élevées [23]. Dans un autre registre, il a été démontré que la grossesse modifiait le taux de croissance radiologique [18] : sur une série de douze patients, le taux moyen passe de 3 mm/an avant la grossesse à 8 mm/an pendant la grossesse.
Enfin, et de façon non surprenante, nous avons montré que les patients ayant un taux de croissance spontanée élevé avaient un moins bon pronostic [16] (médiane de survie à cinq ou six ans versus quinze ans pour les patients avec des taux inférieurs à 8 mm/an). Ce résultat illustre la parfaite complémentarité entre les « grading » histologique (statique) et radiologique (cinétique). On peut en effet penser que ces patients avaient un « faux » diagnostic de grade II à l’histologie, soit parce qu’une tumeur de haut grade peut avoir un aspect de bas grade au tout début de son évolution, soit parce l’échantillonnage spatial des prélévements est passé à côté d’un foyer anaplasique. Ce pouvoir prédictif de la cinétique radiologique a été confirmé tout récemment par deux autres équipes [3, 7].
Une classification reposant sur l’étude de la cinétique radiologique apparaît donc aujourd’hui comme un complément indispensable à la classification histologique de l’OMS. Il reste à définir précisément les modalités de suivi pour mesurer avec fiabilité cette cinétique pré-traitement. Nous proposons actuellement l’attitude suivante, lors de la découverte d’un gliome ayant à l’IRM toutes les caractéristiques d’un bas grade :
— si le patient présente plusieurs des facteurs connus comme étant de mauvais pronostic [20], il semble prudent de refaire une IRM à 1 mois. Il ne sera pas rare alors de mesurer une croissance d’environ 1 mm, confirmant d’emblée qu’il s’agit bien d’un gliome de haut grade, et ce malgré les apparences.
— si le patient présente moins de deux facteurs de risque, un délai de 3 mois permettra dans l’immense majorité des cas de confirmer une croissance proche de 1 mm (soit un taux de croissance annuel de 4 mm/an). Exceptionnellement, une croissance supérieure à 2 mm invitera à considérer rapidement un traitement oncologique agressif, comme on le ferait pour un gliome de plus haut grade.
Étude de la cinétique après traitement À ce jour, la chirurgie est considérée comme le traitement de première intention des gliomes de bas grade [25] : même s’il n’existe pas de preuves de classe I, plusieurs études prospectives récentes ont montré le bénéfice d’une exérèse chirurgicale aussi complète que possible [5, 14, 24] (c’est à dire respectant les zones essentielles au fonctionnement cérébral). Lorsque l’exérèse n’est pas totale, il est à nouveau possible de suivre radiologiquement l’évolution du résidu et de mesurer ainsi la cinétique suite à la chirurgie. À noter qu’en raison des formes souvent irrégulières des résidus, une segmentation tridimensionnelle est nécessaire pour obtenir une estimation fiable du volume, et donc du diamètre tumoral. Il a été montré, sur une série rétrospective de 54 patients, que la distribution des vitesses moyennes de croissance des résidus post-opératoires est une gaussienne, centrée sur 4,2 mm/an [13]. Cette étude confirme donc l’idée selon laquelle, à l’échelle d’une population, l’efficacité de la chirurgie est liée à une cytoréduction, sans décélération de la dynamique tumorale intrinsèque. Cependant, pour une vingtaine de patients, il a été possible de faire une comparaison entre la cinétique avant et après chirurgie. Ceci a permis de montrer que, si pour une large majorité de patients la chirurgie ne vient pas modifier la cinétique de croissance (voir cas illustratif de la Figure 4), on observe un ralentissement de la croissance pour deux patients. Il serait très intéressant de corréler cette baisse du taux de croissance à l’exérèse d’un foyer de haut grade, que l’on pourrait dépister sur les séquences d’IRM de spectroscopie ou de perfusion. À l’inverse, on a mis en évidence une accélération de la croissance tumorale chez deux patients.
Même si l’on pourrait invoquer un effet oncogénique des processus inflammatoires de cicatrisation post-chirurgicale, il est tout à fait probable que ces deux cas correspondent à des transformations anaplasiques inhérentes à l’évolution spontanée, et non provoquées par la chirurgie.
Lorsque la chirurgie n’est pas indiquée, ou bien devant la ré-évolution d’un résidu post-opératoire, la chimiothérapie apparaît aujourd’hui comme le traitement de choix [25]. L’évolution radiologique par IRM, ainsi que la fréquence des crises d’épilepsie, sont les deux éléments à suivre pour évaluer la réponse au traitement, chez des patients par ailleurs le plus souvent asymptomatiques. Les taux de réponse radiologique sont compris entre 31 et 61 % selon les différentes études [8, 15, 22].
Cependant, le critère de réponse radiologique habituellement employé n’est peutêtre pas adapté à la problématique posée par les gliomes de bas grade [30]. En effet, selon les critères de MacDonald — initialement décrits dans le cas des gliomes de hauts grade — on parle de réponse complète, partielle (diminution de plus de 50 % de la surface tumorale) et mineure (diminution entre 25 et 50 % de la surface tumorale). Ainsi, un patient ayant un changement de surface tumorale inférieur à 25 % (que ce soit en augmentation ou en diminution) est considéré comme stable. Il paraît donc plus précis de suivre l’ensemble de la courbe d’évolution du diamètre tumoral moyen, si possible avant et après l’instauration du traitement. Deux études récentes rétrospectives [19, 23] ont tracé ces courbes, pour deux séries de patients, dans un cas traités par Témozolomide et dans l’autre cas par PCV. Il est très intéressant de noter que les conclusions de ces travaux sont concordantes et mettent en évidence des effets inattendus de la chimiothérapie :
— presque tous les patients répondent initialement, mais la durée de la réponse varie entre patients et semble être corrélée au statut moléculaire des tumeurs (présence de la co-délétion 1p19q versus surexpression de la p53), — le taux moyen de décroissance initiale est proche de 10 mm/an, — il existe un effet de rémanence : après l’arrêt de la chimiothérapie, le diamètre tumoral continue le plus souvent de décroître, avant de reprendre à nouveau une croissance linéaire, proche des 4 mm/an.
La recherche d’une explication pour ces résultats a permis de faire naître des hypothèses nouvelles. L’idée la plus séduisante serait celle de l’existence d’une double population cellulaire, l’une proliférante, et l’autre quiescente. La population quiescente diminuerait spontanément par apoptose. La chimiothérapie agirait initialement par un effet cytotoxique sur les cellules proliférantes. La prolongation de l’effet viendrait ensuite de l’observation du taux d’apoptose spontané des cellules quiescentes, jusqu’à ce que les cellules proliférantes réapparaissent et masquent à nouveau l’effet d’apoptose. Des travaux sont en cours pour améliorer le modèle mathématique de prolifération-diffusion, afin de prendre en compte ces deux populations de cellules et d’introduire l’effet de l’apoptose sur les cellules quiescentes.
CONCLUSION
Compte tenu des spécificités des gliomes de grade II rappelées dans l’introduction, il apparaît très difficile d’organiser des essais randomisés pour cette pathologie : il est donc probable que la stratégie thérapeutique ne sera jamais standardisée, comme elle peut l’être pour des traitements avec preuve de classe I. Elle restera personnalisée, adaptée à la tumeur de chaque patient et à la réaction de chaque patient à sa propre tumeur. Dans ce cadre, les modèles mathématiques peuvent s’avérer indispensables, pour mieux caractériser la dynamique tumorale propre à chaque patient et mieux évaluer l’effet des traitements.
Une validation plus poussée du modèle prolifération-diffusion est nécessaire, en particulier en comparant les prédictions sur l’étendue spatiale de la partie invisible avec des données histologiques quantitatives (ce qui demande un gros travail de numérisation et de comptage automatisé des cellules tumorales sur plusieurs dizaines de lames). Le défi consistera alors à personnaliser les modèles actuels, en sorte de disposer pour chaque patient de sa tumeur virtuelle, sur laquelle diverses attitudes thérapeutiques pourront être simulées [10, 31].
BIBLIOGRAPHIE [1] Baumert B.G., Stupp R. — Is there a place for radiotherapy in low-grade gliomas?
Adv. Tech .
Stand Neurosurg ., 2010, 35 , p. 159-82.
[2] Blankenberg F.G., Teplitz R.L., Ellis W., Salamat M.S., Min B.H., Hall L., Boothroyd D.B., Johnstone I.M., Enzmann D.R. — The influence of volumetric tumor doubling time, DNA ploidy, and histologic grade on the survival of patients with intracranial astrocytomas.
AJNR Am. J. Neuroradiol. , 1995, 16(5) , p. 1001-12.
[3] Brasil Caseiras G., Ciccarelli O., Altmann D.R., Benton C.E., Tozer D.J., Tofts P.S., Yousry T.A., Rees J., Waldman A.D., Jager H.R. — Low-grade gliomas: six-month tumor growth predicts patient outcome better than admission tumor volume, relative cerebral blood volume, and apparent diffusion coefficient. Radiology , 2009, 253(2), p. 505-12.
[4] Burgess P.K., Kulesa P.M., Murray J.D., Alvord E.C. JR. — The interaction of growth rates and diffusion coefficients in a three-dimensional mathematical model of gliomas. J.
Neuropathol. Exp. Neurol ., 1997, 56(6) , p. 704-13.
[5] Duffau H., Peggy Gatignol S.T., Mandonnet E., Capelle L., Taillandier L. — Intraoperative subcortical stimulation mapping of language pathways in a consecutive series of 115 patients with Grade II glioma in the left dominant hemisphere. J. Neurosurg ., 2008, 109(3) , p. 461-71.
[6] Duffau H. — Introduction. Surgery of gliomas in eloquent areas: from brain hodotopy and plasticity to functional neurooncology. Neurosurg. Focus , 2010, 28(2) , p. Intro.
[7] Hlaihel C., Guilloton J., Guyotat J., Streichenberger, Honnorat J., Cotton F. — Predictive value of multimodality MRI using conventional, perfusion, and spectroscopy MR in anaplastic transformation of low-grade oligodendrogliomas. J. Neurooncol ., 2010, 97(1) , p. 73-80.
[8] Hoang-Xuan K., Capelle L., Kujas M., Taillibert S., Duffau H., Lejeune J., Polivka M., Crinière E., Marie Y., Mokhtari K., Carpentier A.F., Laigle F., Simon J.M., Cornu P.,
Broet P., Sanson M., Delattre J.Y. — Temozolomide as initial treatment for adults with low-grade oligodendrogliomas or oligoastrocytomas and correlation with chromosome 1p deletions. J. Clin. Oncol. , 2004, 22(15) , p. 313 3-8.
[9] Jbabdi S., Mandonnet E., Duffau H., Capelle L., Swanson K.R., Pelegrini-Issac M., Guillevin R., Benali H. — Simulation of anisotropic growth of low-grade gliomas using diffusion tensor imaging. Magn. Reson. Med. , 2005, 54(3), p. 616-624.
[10] Konukoglu E., Clatz O., Menze B.H., Stieltjes B., Weber M.A., Mandonnet E., Delingette H., Ayache N. — Image guided personalization of reaction-diffusion type tumor growth models using modified anisotropic eikonal equations. IEEE Trans. Med. Imaging , 2010, 29(1) , p. 77-95.
[11] Mandonnet E., Delattre J.Y., Tanguy M.L., Swanson K.R., Carpentier A.F., Duffau H., Cornu P., Van Effenterre R., Alvord E.C. JR., Capelle L. — Continuous growth of mean tumor diameter in a subset of grade II gliomas. Ann. Neurol ., 2003, 53(4) , p. 524-8.
[12] Mandonnet E., Pallud J., Clatz O., Taillandier L., KonukoGLU E., Duffau H., Capelle L. — Computational modeling of the WHO grade II glioma dynamics: principles and applications to management paradigm. Neurosurg. Rev ., 2008, 31(3) , p. 263-9.
[13] Mandonnet E., Pallud J., Fontaine D., Taillandier D., Bauchet L., Peruzzi P., Guyotat J., Bernie V., Baron M.H., Duffau H., Capelle L. — Inter- and intrapatients comparison of WHO grade II glioma kinetics before and after surgical resection. Neurosurg. Rev. , 2010, 33(1) , p. 91-6.
[14] McGirt M.J., Chaichana K.L., Attenello F.J., Weingart J.D., Than K., Burger P.C., Olivi A., Brem H., Quinones-Hinojosa A. — Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery , 2008, 63(4), p. 700-7, author. reply, 707-8.
[15] Pace A., Vidiri A., Galie E., Carosi M., Telera S., Cianciulli A.M., Canalini P., Giannarelli D., Jandolo B., Caparella C.M. — Temozolomide chemotherapy for progressive lowgrade glioma: clinical benefits and radiological response. Ann. Oncol. , 2003, 14(12) , p. 1722-6.
[16] Pallud J., Mandonnet E., Duffau H., Kujas M., Guillevin R., Galanaud D., Taillandier L., Capelle L. — Prognostic value of initial magnetic resonance imaging growth rates for World Health Organization grade II gliomas. Ann. Neurol ., 2006, 60(3) , p. 380-3.
[17] Pallud J., Fontaine D., Duffau H., Mandonnet E., Sanai N., Taillandier L., Peruzzi P., Guillevin R., Bauchet L., Bernier V., Baron M.H., Guyotat J., Capelle L. — Natural history of incidental World Health Organization grade II gliomas. Ann. Neurol., 2010, 68(5), p. 727-33.
[18] Pallus J., Mandonnet E., Deroulers D., Fontaine M., Badoual L., Capelle F., GuilletMay P., Page P., Peruzzi E., Jouanneau M., Frenay S., Cartalat-Carel H., Duffau, Taillandier L. — Pregnancy increases the growth rates of World Health Organization grade II gliomas. Ann. Neurol. , 2010, 67(3) , p. 398-404.
[19] Peyre M., Cartalat-Carel S., Meyronet D., Ricard D., Jouvet A., Pallud J., Mokhtaro K., Guyotat J., Jouanneau E., Sunyach M.P., Frappaz D., Honnorat J., Ducray F. — Prolonged response without prolonged chemotherapy: a lesson from PCV chemotherapy in low-grade gliomas. Neuro. Oncol. , 2010, 12(10) , p. 1078-82.
[20] Pignatti F., Van den Bent M., Curran D., Debruyne C., Sylvester R., Therasse P., Afra D., Cornu P., Bolla M., Vecht C., Karim A.B. — Prognostic factors for survival in adult patients with cerebral low-grade glioma. J. Clin. Oncol ., 2002, 20(8) , p. 2076-84.
[21] Price S.J. — Advances in imaging low-grade gliomas. Adv. Tech.
Stand Neurosurg ., 2010, 35 , p. 1-34.
[22] Quinn J.A., Reardon D.A., Friedman A.H., Rich J.N., Sampson J.H., Provenzale J.M., McLendon R.E., Gururangan S., Bigner D.D., Herndon, Abgeropoulos2nd, N., Finlay
J., Tourt-Uhlig S., M.L. Affronti, B. Evans, V. Stafford-Fox, S. Zaknoen, And H.S.
Friedman, Phase II trial of temozolomide in patients with progressive low-grade glioma. J.
Clin. Oncol. , 2003, 21(4) , p. 646-51.
[23] Ricard D., Kaloshi G., Amiel-Benouaich A., Lejeune J., Marie Y., Mandonnet E., Kujas M., Mokhtari K., Taillibert S., Laigle-Donadey F., Carpentier A.F., Omuro A., Capelle L., Duffau H., Cornu P., Guillevin R., Sanson M., Hoang-Xuan K., Delattre J.Y. — Dynamic history of low-grade gliomas before and after temozolomide treatment. Ann. Neurol. , 2007, 61(5) , p. 484-90.
[24] Smith J.S., Chang E.F., Lamborn K.R., Chang S.M., Prados M.D., Cha S., Tihan T., Vandenberg S., McDermott M.W., Berger M.S. — Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J. Clin. Oncol ., 2008, 26(8) , p. 1338-45.
[25] Soffietti R., Baumert B.G., Bello L., Von Deimling A., Duffau H., Frenay M., Grisold W., Grant R., Graus F., Hoang-Xuan K., Klein M., Melin B., Rees J., Siegal T., Smits A., Stupp R., Wicik W. — Guidelines on management of low-grade gliomas: report of an EFNS-EANO* Task Force. Eur. J. Neurol ., 2010, 17(9) , p. 1124-33.
[26] Swanson K.R., Alvord E.C., Murray J.D. JR. — A quantitative model for differential motility of gliomas in grey and white matter. Cell Prolif. , 2000, 33(5) , p. 317-29.
[27] Swanson K.R., Alvord E.C., Murray J.D. J.R. — Virtual brain tumours (gliomas) enhance the reality of medical imaging and highlight inadequacies of current therapy. Br. J. Cancer, 2002, 86(1) , p. 14-8.
[28] Swanson K.R., Bridge C., Murray J.D., Alvord E.C. JR. — Virtual and real brain tumors:
using mathematical modeling to quantify glioma growth and invasion. J. Neurol. Sci. , 2003, 216(1) , p. 1-10.
[29] Tracqui P., Cruywagen G.C., Woodward D.E., Bartoo G.T., Murray J.D., Alvord E.C.
JR. — A mathematical model of glioma growth: the effect of chemotherapy on spatio-temporal growth. Cell Prolif ., 1995, 28(1) , p. 17-31.
[30] Van den Bent M.J., Vogelbaum M.A., Wen P.Y., MacDonald D.R., Chang S.M. — End point assessment in gliomas: novel treatments limit usefulness of classical Macdonald’s Criteria. J. Clin. Oncol. , 2009, 27(18) , p. 2905-8.
[31] Wang C.H., Rockhill J.K., Mrugala M., Peacock D.L., Lai A., Jusenius K., Wardlaw J.M., Cloughesy T., Spence A.M., Rockne R., Alvord E.C. JR., Swanson K.R. — Prognostic significance of growth kinetics in newly diagnosed glioblastomas revealed by combining serial imaging with a novel biomathematical model. Cancer Res. , 2009, 69(23) , p. 9133-40.
[32] Woodward D.E., Cook J., Tracqui P., Cruywagen G.C., Murray J.D., Alvord E.C. JR.
— A mathematical model of glioma growth: the effect of extent of surgical resection. Cell Prolif. , 1996, 29(6) , p. 269-88.
DISCUSSION
M. Pierre RONDOT
En cas de glioblastome multiple peut-on dire qu’il s’agit des métastases d’une seule tumeur et la vitesse de diffusion de chacune des tumeurs est-elle identique ?
Par résolution du problème inverse, on pourrait en effet déterminer si un glioblastome multifocal est compatible avec une origine spatiale unique, ou bien s’il est nécessaire de faire naître la tumeur à partir de plusieurs points distincts. Nous avons pu mesuré les vitesses de croissance radiologique de chaque nodule sur quelques patients. Elles étaient approximativement identiques dans la majorité des cas, mais on a trouvé chez certains patients des différences importantes d’un nodule à l’autre. Ces deux questions mériteraient donc une étude plus approfondie, afin d’apporter une réponse plus complète.
Mme Monique ADOLPHE
Pourriez-vous préciser si votre modèle mathématique peut aider au suivi de la thérapeutique par chimiothérapie ?
Deux études ont rapporté l’évolution du diamètre tumoral chez des patients traités par chimiothérapie [2, 3]. Elles ont mis en évidence une réponse triphasique : décroissance rapide sous chimiothérapie (environ 10 mm/an), poursuite d’une décroissance plus lente à l’arrêt de la chimiothérapie (effet de rémanence), et reprise évolutive, après un délai très variable d’un patient à l’autre. Si l’on veut rendre compte de ces effets, il faut inclure de nouveaux paramètres dans le modèle, tels que le taux de cytotoxicité de l’agent anti-tumoral ainsi que le taux d’apoptose spontanée intra-tumorale. Des travaux sont en cours pour confronter les prédictions d’un tel modèle aux courbes expérimentales.
M. Pierre GODEAU
Y-a-t-il une explication du caractère asymétrique de la croissance tumorale ? Existe-t-il un parallèlisme entre la rapidité de la croissance tumorale et la chimiosensibilité ? Quel est le rapport entre la diffusion et un mécanisme d’angiogenèse ?
A l’échelle macroscopique, le caractère asymétrique de la croissance tumorale s’explique par la forme des faisceaux de la substance blanche, dont les axones constituent des axes de migration cellulaire privilégiée. Cependant, les mécanismes cellulaires et moléculaires, mis en jeu lors de la motilité le long d’un axone, restent largement inconnus à ce jour. Il est généralement admis que la vitesse de décroissance sous chimiothérapie serait d’autant plus grande que la tumeur présenterait une vitesse de croissance spontanée élevée. Les deux études sus-citées [2, 3] retrouvent cette tendance, sans pour autant atteindre la significativité. On peut faire l’hypothèse que l’hétérogénéité de la tumeur, qui comprend sans doute des clones chimiosensibles et d’autres chimiorésistants, vient limiter la validité de cette règle générale. Des simulations pourraient donc apporter une réponse plus précise à cette question très importante cliniquement. Nous n’avons pas inclus l’angiogenèse dans notre modèle, puisque nous nous sommes centrés sur des tumeurs de bas grades, c’est à dire n’ayant pas encore acquis la capacité de créer des néo-vaisseaux. En fait, il serait très intéressant de coupler notre modèle à un modèle du métabolisme tumoral, afin de prédire où et quand vont apparaître des zones d’hypoxie, elles-mêmes génératrices des signaux cellulaires à l’origine de l’angiogenèse. En revanche, on sait que cette transformation anaplasique s’accompagne systé- matiquement de vitesses de croissance radiologique beaucoup plus élevées (croissance du diamètre > 8 mm/an).
M. Alain PRIVAT
Peut-on anticiper de ce qu’une analyse IRM de diffusion, non plus multidimensionnelle mais orientée suivant des vecteurs spécifiques, ait une valeur prédictive accrue par comparaison avec T1 et T2 ?
L’IRM de diffusion permet d’aboutir à des simulations plus réalistes [1], puisque prenant un compte la migration cellulaire préférentielle le long des vecteurs de plus grande diffusion, c’est-à-dire le long des axones. Par ailleurs, l’IRM de diffusion devrait également permettre de mieux estimer la relation entre cellules tumorales et faisceaux de substance blanche (destruction ? refoulement ? infiltration ?) [4].
Bull. Acad. Natle Méd., 2011, 195, no 1, 23-36, séance du 18 janvier 2011


