Résumé
Les cancers inflammatoires du sein sont des phénotypes tumoraux rares mais très agressifs de la femme jeune le plus souvent. Selon les données de la littérature, le développement des métastases dans les cancers les plus fréquents, notamment du sein, est lié à la surexpression de la protéine de c-Met. Plusieurs études ont montré que c-Met constitue une cible pour les thérapeutiques spécifiques qui potentiellement pourraient améliorer significativement le pronostic des tumeurs dans lesquelles la surexpression de la protéine peut être mise en évidence au moment du diagnostic. Dans l’étude présente, nous avons comparé l’expression de c-Met dans une série de cancers inflammatoires (n = 41) et dans les cancers non inflammatoires (n = 480) du sein répartis sur deux jeux de micro-biopsies. Les immunodé- tections sur coupes séquentielles de chacune des micro-biopsies rassemblées en 2 blocs tissulaires inclus en paraffine, ont été réalisées avec des anticorps anti c-Met, anti PI3K et anti E-cadhérine. Les immunomarquages ont fait l’objet d’une quantification par analyse d’images automatisée et densitométrie sur images microscopiques virtuelles (SAMBA Technologie). Nos résultats montrent : — que la protéine c-Met est significativement surexprimée dans les cancers inflammatoires par rapport aux cancers non inflammatoires (p<0.001), — que la protéine PI3K est parallèlement surexprimée (p<0.001) dans ces mêmes carcinomes inflammatoires témoignant du caractère fonctionnel de la protéine c-Met. Nous en avons conclu que dans les cancers inflammatoires, c-Met pourrait de ce fait constituer une cible thérapeutique potentielle utilisable pour la prise en charge des patientes porteuses de cancers du sein inflammatoires. De plus, l’utilisation d’un système d’analyse d’images automatisée innovant, dédié à l’évaluation de la densitométrie d’un nombre important de micro-biopsies de 0,6 mm rassemblées sur un seul bloc de paraffine, constitue un outil particulièrement performant pour les quantifications à haut débit des immunomarquages intratumoraux.
Summary
Inflammatory breast carcinoma (IBC) is a rare but very aggressive tumour phenotype. Increased c-Met protein expression correlates with reduced survival and a higher metastatic risk in many human malignancies, including breast cancer. Several studies have shown that c-Met protein is targetable by specific drugs. Here we compared c-Met expression in IBC (n = 41) and non IBC (n = 480). Two microarrays of IBC and non IBC tissues were constructed and standardized. C-Met, PI3K and E-cadherin were immunodetected (Ventana Benchmark Autostainer) on serial sections. The results were quantified with an automated image analysis device (SAMBA Technologies) by immunoprecipitate densitometry of each core section (0.6 microns thick). We found that (i) c-Met is significantly overexpressed in IBC compared to non IBC (p < 0.001), (ii) PI3K is also overexpressed (p < 0.001) in IBC, suggesting that overexpressed c-Met is functionally active, at least through the PI3K signal transduction pathway ; and (iii) E-cadherin is paradoxically overexpressed in IBC. We conclude that c-Met may constitute a target for specific therapy in patients with poor-prognosis malignancies like IBC. Automated image analysis of TMA is a valuable tool for high-throughput quantification of the immunohistochemical expression of the tumor proteome.
INTRODUCTION
Les carcinomes inflammatoires correspondent à un phénotype rare (3 %) mais très agressif des cancers du sein, rencontrés souvent chez la femme jeune. Leur pronostic est mauvais, avec des survies à 5 ans de 30 à 50 % [1]. La réponse à la chimiothérapie est bonne malgré le mauvais pronostic [2].
La caractéristique des cancers inflammatoires est de développer des métastases très précoces aussi bien dans le site ganglionnaire qu’à distance par voie vasculaire. Les tumeurs sont souvent de haut grade et s’associent à de multiples embols vasculaires notamment dans les lymphatiques dermiques qui constituent la caractéristique histopathologique de ces tumeurs [3] associées à des signes cliniques d’inflammation cutanée, avec érythème et œdème.
Le développement métastatique dépend de la masse tumorale, elle-même liée à la croissance cellulaire mais aussi au développement de la néoangiogénèse et à la facilité avec laquelle les cellules tumorales peuvent envahir et pénétrer les tissus.
L’infiltration néoplasique est fortement liée à la mobilité cellulaire, et à l’adhésion à la matrice extracellulaire modulée par plusieurs facteurs parmi lesquels le c-Met, une tyrosine kinase membranaire spécifique dont le ligand est l’HGF « Hépatocyte Growth Factor ». L’agressivité des carcinomes inflammatoires laisse supposer que les cellules tumorales sont hyperstimulées par les facteurs régulants la mobilité cellulaire, la néoangiogénèse et l’adhésion à la matrice extracellulaire [4-6].
C-Met et la dérégulation en aval des voies de signalisation peuvent être responsables du développement précoce des métastases d’autant que le c-Met stimule les cellules endothéliales favorisant leur multiplication, leur mobilité et leur agencement tridimensionnel ainsi que leur production de molécules stimulant aussi l’angiogénèse comme le VGFR 2 et son ligant le VEGF [6-9]. La régulation des phénomènes concernés par le processus métastatique est complexe puisque l’hypoxie, facteur majeur de la stimulation de la néoangiogénèse tumorale, induit aussi une activation du c-Met et de ces fonctions en aval [7].
C-Met est en effet surexprimé dans beaucoup de cancers notamment les cancers du sein. Nous avons émis l’hypothèse que les cancers inflammatoires du sein particulièrement agressifs expriment plus encore que la moyenne des cancers du sein c-Met et que par conséquent, l’utilisation de molécules inhibitrices de c-Met associées aux inhibiteurs de l’angiogénèse pourrait être particulièrement utile dans le cas des cancers inflammatoires, si toutefois le c-Met se montrait surexprimé et actif comme certaines équipes l’ont montré in vitro [6-9] et dans les cancers humains [10-15].
Dans la présente étude, nous avons voulu évaluer si les cancers inflammatoires du sein surexprimaient c-Met sous forme active (ce que reflète l’activation de la voie de signalisation PI3K et la surexpression simultanée de PI3K), ce qui permettrait de cibler cette protéine en thérapeutique [16-18].
Pour ce faire, nous avons développé des micro-biopsies (souvent appelées « puces tissulaires » ou « tissue micro-arrays / TMA » dans la littérature) pour comparer l’expression immunohistochimique de ces molécules dans les cancers inflammatoires du sein du tout venant.
Les données de la littérature montrant par ailleurs que la E-cadhérine, molécule d’adhésion cellule-cellule, étant paradoxalement surexprimée dans les cancers inflammatoires [5], nous avons voulu étudier aussi les modulations de la surexpression de la E-cadhérine en fonction de l’expression du c-Met et du PI3K.
Afin de valider nos résultats, nous avons standardisé notre méthodologie — En utilisant les mêmes substrats pour chaque immunodétection (coupes séquentielles des micro-biopsies de 4 microns d’épaisseur (contrôlées par microtome automatique) par marqueur, chaque jeu de micro-biopsies contenant 41 cas de cancers inflammatoires, pour l’un, et 480 cas de carcinomes canalaires de taille et statut
ganglionnaire variables, pour l’autre ; — Nous avons ensuite effectué des immunodétections standardisées pour automate Ventana Benchmark ;
— Les résultats des immunodétections ont été quantifiés par densitométrie sur analyseur d’images microscopiques virtuelles après numérisation automatisée sur système SAMBA 2050.
Nos résultats montrent qu’effectivement —la protéine c-Met est surexprimée dans les carcinomes inflammatoires (b) sous forme active avec surexpression concomitante du PI3K ; et que, (c) de plus cette surexpression s’associe au développement métastatique malgré une surexpression de la E-cadherine dans ces carcinomes particulièrement agressifs.
MATÉRIELS ET MÉTHODES
Matériel tissulaire
Les cancers inflammatoires ont été prélevés chez 41 patientes pour lesquelles une biopsie chirurgicale a été effectuée initialement à l’Hôpital de la Conception (PB) avant tout traitement, chimiothérapeutique notamment. Les fragments ont été traités de façon conventionnelle dans le Service de Pathologie de l’hôpital Nord du CHU de Marseille (SG, CTC, LA, SCM) selon les recommandations de l’HAS/AFAQAP (Association Française pour l’Assurance Qualité en Anatomie Pathologique). Des carcinomes inflammatoires inclus dans la série étaient des carcinomes de grade 3, N+ (avec métastases ganglionnaires axillaires) et RE(récepteurs négatifs évalués par immunohistochimie). Les carcinomes inflammatoires de la série ont été comparés à 480 carcinomes non inflammatoires canalaires du sein sélectionnés dans les archives tissulaires du Service prélevés dans les mêmes conditions (chirurgie première). Tous les fragments tissulaires utilisés pour la construction des jeux de micro-biopsies ont été fixés au formol tamponné, inclus en paraffine, les blocs de paraffine étant stockés à une température contrôlée de 18 à 22° C.
Construction des blocs de micro-biopsies
Les micro-biopsies ont été préparées comme décrit précédemment [19-21]. Pour chaque tumeur, deux zones représentatives ont été déterminées par cerclage sur les lames de verre des zones d’intérêt afin de guider les techniciens dans le prélèvement à l’aiguille de la carotte biopsique dans le bloc donneur. L’appareillage utilisé (Alphelys Arraying Device) (78-370 plaisir France) pour la construction des micro-biopsies permet de standardiser le prélèvement. Des « carottes » microbiopsiques cylindriques de 0.6 mm de diamètre ont été prélevées du bloc donneur puis déposées dans le bloc de paraffine receveur. Les coupes de micro-biopsies utilisées pour les immunodétections ont été faites 24 heures avant la technique
automatisée d’immunodétection sur coupes de 4 microns effectuées sur microtome automatisé (Leica).
Technique immunohistochimique
La technique d’immunohistochimie a été effectuée sur automate Ventana Benchmark selon les techniques précédemment rapportées [20, 22, 23]. Des anticorps spécifiques, monoclonal de souris anti c-Met (clone 8 F11, dilué à 1/20ème, Novocastra/TEBU, France) ; polyclonal de lapin anti PI3K clone P110 alpha (dilué au 10ème, cell signaling / Ozyme, France) ; monoclonal de souris anti E-cadhérine (clone 4A2 C7), dilué au 100ème, Cliniscience / France) ont été utilisés en premier lieu en association avec des kits Ventana sur l’automate, dans lequel les lames sont incubées 32 minutes à 37 ° avec les anticorps primaires.
La révélation de la réaction immuno-enzymatique a été effectuée avec la Diaminobenzidine ou l’AEC/3-ammino 9-ethyl-carbazol, puis les lames ont été contrecolorées avant montage.
Analyse d’image SAMBA 2050
Partant de notre expérience en analyse d’images microscopiques [24-29], nous avons appliqué un nouveau logiciel dédié aux coupes de micro-biopsies, permettant une analyse quantitative automatisée sur système SAMBA 2050 (SAMBA Technologie Meylan/ Grenoble France).
La quantification des immuno-précipités effectuée par densitométrie a suivi plusieurs étapes. Tout d’abord, la totalité de la lame a fait l’objet de la construction d’une image virtuelle à faible grossissement (x 2 ; un pixel = 3,7 microns). L’image virtuelle a été secondairement numérisée. Ensuite, la zone de la lame contenant les différents « spots » de micro-biopsies a été automatiquement délimitée et scannée à fort grossissement (x 10, dimension de pixel = 0,74 micron). Puis, après focalisation automatique, les images ont été précisément repérées par algorithme spécifique déterminant une position relative de chaque image par rapport à ces voisines. Une procédure spécifique a été ensuite appliquée pour superposer la grille des microbiopsies à l’image numérisée, permettant des alignements précis sans perte de spots ou superposition d’image. (figures 1-3).
L’étape finale consiste en une analyse automatique de la densitométrie par logiciel spécifique des immuno-précipités, permettant une quantification sur une échelle de valeurs continue bien qu’arbitraire, de niveau de gris de 0 à 255 (0 ≅ noir, 255 ≅ blanc) permettant le calcul de paramètres (% de surface marquée, et indice de marquage ou « quick score ») utilisables dans les études statistiques (avec tests paramétriques ou non en fonction de la normalité de la distribution).
Les tests de statistiques standards ont été effectués avec le logiciel NCSS 2005.
RÉSULTATS
Expression immunohistochimique de c-Met dans les micro-biopsies.
Expression immunohistochimique de c-Met dans les tissus apparaît sous forme d’un immunomarquage cytoplasmique de distribution variable d’une cellule à l’autre dans une même tumeur, avec des renforcements membranaires (figure 1).
L’étude statistique montre que l’expression de c-Met est significativement plus élevée dans les carcinomes inflammatoires pour chacun des deux paramètres évalués (tableau 1) montrant des indices de marquage plus importants (p<0,001) tests de Man Whitney et de Kolmorov.
Pour le « quick score » (surface marquée × la densité optique moyenne / DOM), les valeurs sont significativement aussi très différentes. L’inversion des valeurs (tableau 1) pour ce score s’expliquant par le fait que les intensités les plus fortes possèdent des valeurs numériques de DOM, plus faibles sur l’échelle de valeur arbitraire utilisée (0 pour le noir et 255 pour le blanc). De plus, aucun des carcinomes inflammatoires testés s’est révélé être c-Met négatif, alors que près d’un tiers des tumeurs du groupe contrôle se sont révélées c-Met négatives (n = 174 /480, p< 0,01) .
Expression de PI 3K dans les micro-biopsies
L’immunomarquage avec l’anti PI 3K est de type cytoplasmique, de densité très variable, souvent faible (fig 2). L’expression intracellulaire du PI 3K s’est révélée être significativement plus forte (tableau 1) dans les carcinomes inflammatoires par rapport au groupe contrôle (p<0,001) avec des « quick scores » significativement différents (p = 0,0019).
La plupart des carcinomes inflammatoires ont été PI 3K positive (N=35/41) tandis que le rapport cas positifs / cas négatifs dans le groupe contrôle s’est révélé nettement moins important (n=287/480, p<0,0001).
Expression de la E-cadhérine dans les micro-biopsies
La E-cadhérine est exclusivement observée le long de la membrane plasmique (fig 3, 4).
Les indices E-cadhérine positives se sont révélées être significativement plus fortes dans les carcinomes inflammatoires (p<0,001) (tableau 1). Néanmoins, du fait d’une intensité forte et homogène dans les deux séries à des valeurs relativement proches, les « quick scores » n’ont pas montré de différence significative. Dans toutes les tumeurs de la série inflammatoire comme dans la série contrôle, la E-cadhérine s’est révélée positive (bien que très variable, si bien que le calcul du chi 2 n’a pu être effectué pour ce marqueur).

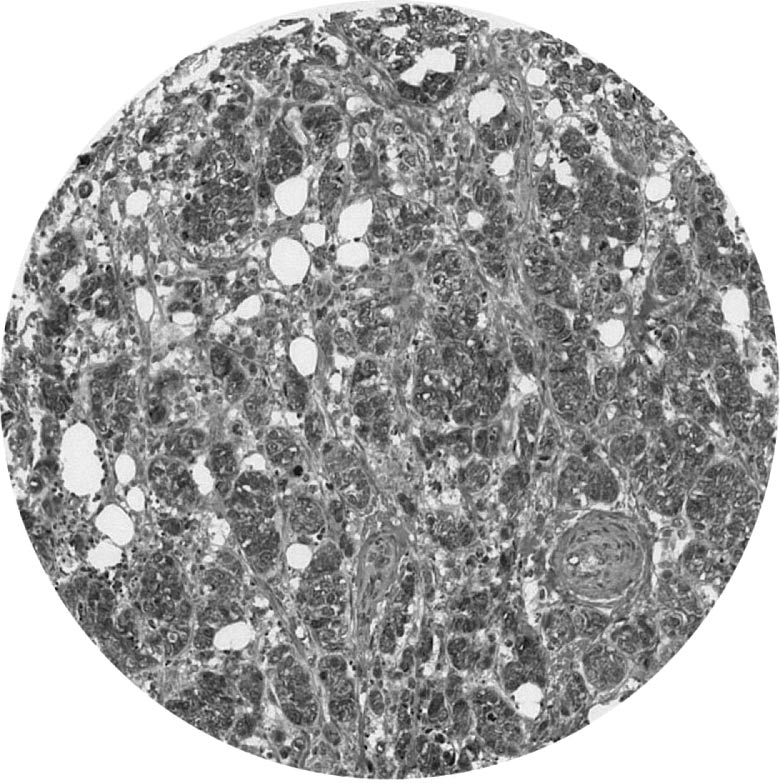
FIG. 1. — c-Met immunomarquage dans TMA de carcinomes inflammatoires (1 spot = 1 cas).
FIG. 2. — PI3K immunomarquage dans TMA de carcinomes inflammatoires (1 spot = 1 cas).
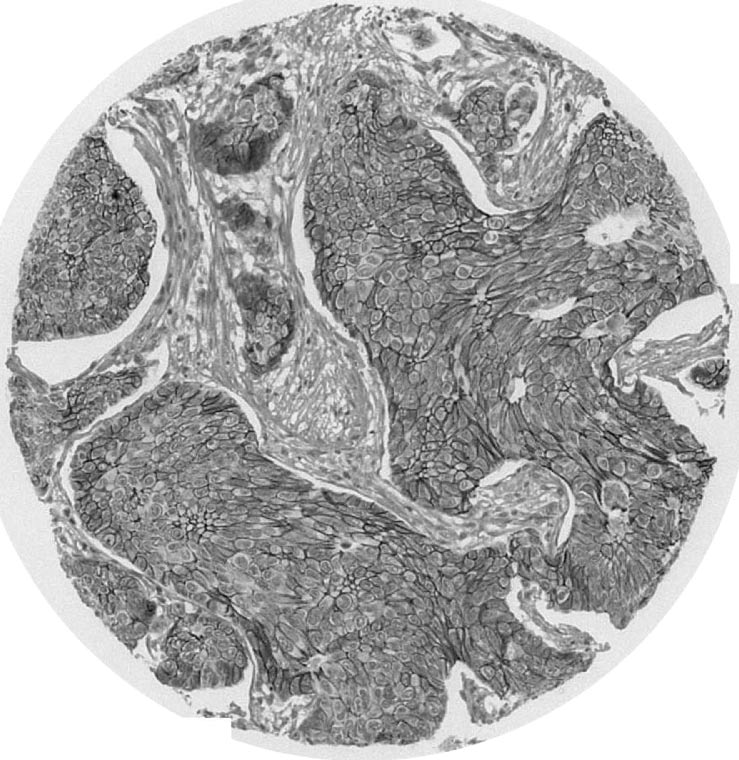

FIG. 3. — E Cadherine immunomarquage dans TMA de carcinomes inflammatoires (1 spot = 1 cas).
FIG. . — Lame de TMA à faible grossissement (480 spots de la série contrôle), testée avec l’anti E cadherine.
TABLEAU 1. — Expression immunohistochimique de c-Met, PI3K et E-Cadherine dans les cancers inflammatoires et non inflammatoires canalaires de la série contrôle, évaluée par densitométrie à haut débit par analyse d’images automatisée (SAMBA 2050) ; * test de Mann Whitney).
Indice de
Quick Score marquage
SAMBA c-Met
Cancers du sein inflammatoires 2,13 % 0,48 n = 41 (SD 2,6) (SD = 0,18) *p < 0,001 *p < 0,001
Cancers du sein non inflammatoires 0,27 % 5,5 n = 480 (SD = 0,81) (SD = 0,53) PI3.K
Cancers du sein inflammatoires 1,96 % 0,13 n = 41 (SD = 0,24) (SD = 0,02) *p = 0,0019 *p < 0,001
Cancers du sein non inflammatoires 0,44 % 5,7 n = 480 (SD = 0,38) (SD =2,4) E-Cadherin
Cancers du sein inflammatoires 35,4 % 5,2 n = 41 (SD = 2,5) (SD = 2,3) *p < 0,001 *p = NS
Cancers du sein non inflammatoires 10,3 % 6,7 n = 480 (SD = 3,4) (SD = 2,1) DISCUSSION
Le développement de la construction des blocs de paraffine incluant de nombreuses micro-biopsies rassemblées sur une même lame (encore appelées dans la littérature « puces tissulaires / TMA ») après coupe au microtome de 4 microns, a permis d’évaluer l’expression immunohistocytochimique de multiples marqueurs sur de grandes séries de tumeurs afin de valider les significations pronostiques de molécules utilisables aussi comme cibles thérapeutiques [5, 19-21].
Bien que c-Met ait été documenté dans la littérature sur le plan expérimental, notamment en culture cellulaire et dans un certain nombre de tumeurs solides, aucune étude permettant de valider le résultat sur de vraiment grandes séries sauf une [12], n’a été précédemment publiée sur micro-biopsies et surtout aucune avec quantification sur image microscopique numérisée n’a été rapportée.
Dans la présente étude, nous avons comparé l’expression immunohistochimique du c-Met sur micro-biopsies dans une série de carcinomes inflammatoires et de carcinomes canalaires non inflammatoires, ce qui n’avait jamais été montré auparavant bien que le c-Met ait rapporté comme associé à des phénotypes agressifs de cancer du sein et d’autres tumeurs malignes [10-15]. Les données de la littérature et l’expérience thérapeutique pratique ayant montré l’importance de l’intérêt d’inhibiteurs des tyrosines kinases comme la Trastuzumab, le Glivec, l’Iressa, le Tarceva montrent l’intérêt du développement d’inhibiteurs spécifiques du c-Met qui est aussi une tyrosine kinase (mais qui n’est pas altérée par ces inhibiteurs des tyrosine kinase) [6, 7, 9, 16, 17].
Dans cet ordre d’idées, diverses études ont déjà montré « in vitro » l’inhibition possible de l’HGF et du c-Met ou des voies de signalisation du c-Met par des anticorps monoclonaux bloquants ou par des petites molécules inhibitrices sélectives qui bloquent l’activité c-Met et ses effets régulateurs en aval sur les voies de signalisation PI3K, FAK et C-SRC [30-36].
Dans notre étude, le fait que le PI3K ait été surexprimé de façon concomitante dans les cancers inflammatoires témoigne d’une surexpression du c-Met dans sa forme active, confirmant le réel intérêt dans le ciblage direct du c-Met ou de ses voies de signalisation en aval par une thérapeutique spécifique combinée aux thérapeutiques cytotoxiques conventionnelles dans le but d’améliorer le pronostic des phénotypes agressifs de cancers du sein, dont les carcinomes inflammatoires.
La E-cadhérine est une protéine transmembranaire qui régule les mécanismes d’adhésion cellule-cellule dans les cellules épithéliales normales. La E-cadhérine permet l’adhésion des cellules épithéliales par sa connection aux caténines, au cytosquelette [6, 8-9-24]. L’HGF/SF réduit la fixation de la béta-caténine sur la portion intra-cellulaire de la E-cadhérine résultant dans un démantèlement de l’adhésion cellule-cellule [8, 16-18]. L’augmentation du couple HGF / c-Met, par conséquent, joue un rôle important dans l’altération de l’adhésion cellulaire. Dans les carcinomes lobulaires du sein, la mutation de la E-cadhérine est connue comme responsable du mode de dissémination des cellules tumorales sous forme de cellules isolées et la réduction globale de l’expression de la E-cadhérine dans les cancers du sein est associée à de forts risques de métastase [cf revue dans 24].
De façon surprenante et paradoxale, la E-cadhérine est surexprimée dans les cancers inflammatoires [5], ce que nous avons retrouvé aussi dans notre série. Il est néanmoins probable que le rôle joué par le c-Met sur la béta-caténine rend la E-cadhérine, surexprimée dans les cancers inflammatoires, non fonctionnelle, et donc sans renforcement potentiel de l’adhésion cellule — cellule.
Les travaux de recherche en Pathologie et le développement de techniques nouvelles dans ce domaine ont étroitement suivi celui de la biologie moléculaire. Parallèlement, en effet aux études génomiques à haut débit, le développement des microbiopsies a permis aussi l’évaluation du protéome in situ à haut débit. Néanmoins, la construction des micro-biopsies est délicate, nécessitant d’importantes collections
tissulaires fixées et stockées dans des conditions appropriées et sans altération antigénique.
Si la construction des micro-biopsies est laborieuse, l’évaluation des résultats par étude semi-quantitative par un observateur est aussi très difficile, posant un sérieux problème pratique de reproductibilité et de contrôle de qualité. L’utilisation d’analyseurs d’images permettant lecture par ordinateur mesurant les densitométries des immuno-précipités résultant des réactions immuno-enzymatiques sur coupes de tissus, après numérisation des images microscopiques, constitue un outil très performant autant par sa qualité que par sa rapidité, permettant de plus des contrôles de qualité de multiples étapes. Jusqu’à présent, les appareils d’analyse d’ images ont été utilisés largement par certains auteurs (en microscopie optique), dont notre équipe, sur les coupes de tissu standard « larges » [24-29]. En ce qui concerne les microbiopsies, néanmoins, très peu de développements pratiques en pathologie ont été jusqu’à ce jour rapportés [37, 38] car les logiciels sont très difficiles à adapter à la lecture des densitométries sur des centaines de coupes de « carottes biopsiques » par lame. Notre étude est la première en la matière à utiliser un système entièrement automatisé et original, permettant une étude statistique sur des variables quantitatives continues autorisant des calculs et tests statistiques paramétriques (ou non paramétriques). L’automatisation de la numérisation est en effet un progrès considérable permettant de numériser en quelques heures 50 lames contenant des centaines (jusqu’à 6 000 en théorie, 500 à 800 en pratique) de « carottes biopsiques » issues de tumeurs différentes. Par ailleurs, l’échelle de niveaux de gris sur laquelle est mesurée la densitométrie de 0 à 255, permet une analyse fine de variations minimes impossible à quantifier par étude semi-quantitative d’un observateur à l’examen microscopique, de façon reproductible.
CONCLUSION
Dans notre étude, nous avons évalué, dans les carcinomes inflammatoires, l’expression immunohistochimique du c-Met, associée à celle du PI3K et de la E-cadherine, utilisant une méthode de quantification protéomique sur coupes de tissus, originale, automatisée et standardisée, pouvant faire l’objet de contrôles de qualité, très appréciable pour l’évaluation à haut débit de marqueurs tumoraux sur blocs reconstitués de microbiopsies, constituant de potentielles cibles thérapeutiques. Dans les cancers du sein, notamment de phénotypes très agressifs, comme les carcinomes inflammatoires, cette approche permet d’envisager à terme une modification de la prise en charge des malades et une amélioration de l’évolution clinique grâce au développement de nouvelles thérapeutiques ciblant les molécules mises ainsi en évidence dans les tumeurs, au moment du diagnostic (comme le Trastuzumab ciblant la surexpression du HER-2 neu dans les thérapies (néo) adjuvantes des cancers du sein : recommandations de l’Institut National du Cancer 2005).
REMERCIEMENTS
Ce travail a été subventionné par la dotation Cancéropole PACA 2004-2005 ACI Cancer du sein, D. Birnbaum UMR 599 INSERM, Institut Paoli Calmettes, Marseille.
BIBLIOGRAPHIE [1] JAIYESIMI I.A., BULZDAR A.U., HORTOBAGYI G. — Inflammatory breast cancer : A review.
J.
Clin. Oncol., 1992, 10 , 1014-1024.
[2] BUZDAR A.U., SINGLETARY S.E., BOOSER D.J. et al. — Combined modality treatment of stage
III and inflammatory breast cancer. M.D. Anderson Cancer Center experience.
Surg. Oncol.
Clin. N. Am. , 1995, 4 , 715-734.
[3] TAVASSOLI F. and DEVILEE P. — WHO classification of Tumours. Tumours of breast and female genital organs. IARC Press , Lyon, 2001, 47-49.
[4] BERTUCCI F., FINETTI P., ROUGEMONT J., CHARAFE-JAUFFRET E., NASSER V., LORIOD B., CAMERLO J., TAGETT R., TARPIIN C., HOUVENAEGHEL G., NGUYEN C., MARANINCHI D., JACQUEMIER J., HOULGATTE R., BIRNBAUM D., VIENS P. — Gene expression profiling for molecular characterization of inflammatory breast cancer and prediction of response to chemotherapy. Cancer Res. , 2004, 64 , 8558-8565.
[5] CHARAFE-JAUFFRET E., TARPIN C., BARDOU V.J., BERTUCCI F., GINESTIER C., BRAUD A.C., PUIG B., GENEIX J., HASSOUN J., BIRNBAUM D., JACQUEMIER J. et D. VIENS P. — Immunophenotypic analysis of inflammatory breast cancers : Identification of an ‘‘ inflammatory signature ’’. J.
Path. , 2004, 202 , 265-273.
[6] GASPARINI G., LONGO R., FANELLI M., TEICHER B.A. — Combination of antiangiogenic therapy with other anticancer therapies : Results, challenges and open questions. J. Clin. Oncol ., 2005, 23 , 1295-1311.
[7] PENNACCHIETTI S., MICHIELI P., GALLUZZO M., MAZZONE M., GIORDANO S., COMOGLIO P.M. — Hypoxia promotes invasive growth by transcriptional activation of the met protooncogene. Cancer Cell. , 2003, 3 , 347-361.
[8] BIRCHMEIER C., BIRCHMEIER W., GHERARDI E., VANDE WOUDE G.F. — Met, metastasis, motility and more. Nat. Rev. Mol. Cell. Biol., 2003, 4 , 915-925.
[9] CHRISTENSEN J.G., BURROWS J., SALGIA R. — C-met as a target for human cancer and characterization of inhibitors for therapeutic intervention. Cancer Letters , 2005, 225 , 1-26.
[10] BEVIGLIA L., MATSUMOTO K., LIN C.S., ZIOBER B.L., KRAMER R.H. — Expression of the c-met/HGF receptor in human breast carcinoma : Correlation with tumour progression. Int. J.
Cancer , 1997, 74 , 301-309.
[11] GHOUSSOUB R.A., DILLON D.A., D’AQUILA T.G., RIMM E.B., FEARON E.R., RIMM D.L. — Expression of c-met is a strong independent prognostic factor in breast carcinoma. Cancer , 1998, 82 , 1513-1520.
[12] TOLGAY OCAL I., DOLLED-FILHART M., D’AQUILA T.G., CAMP R.L., RIMM D.L. — Tissue microarray-based studies of patients with lymph node negative breast carcinoma show that met expression is associated with worse outcome but is not correlated with epidermal growth factor family receptors. Cancer , 2003, 97 , 1841-1848.
[13] CAMP R.L., RIMM E.B., RIMM D.L. — Met expression is associated with poor outcome in patients with axillary lymph node negative breast carcinoma. Cancer , 1999, 86 , 2259-2265.
[14] NAKIPOULOU L., GAKIOPOULOU H., KERAMOPOULOS A., GIANNOPOULOU I., ATHANASSIADOU P., MAVROMMATIS J., DAVARIS P.S. — C-met tyrosine kinase receptor expression is associated with abnormal beta-catenin expression and unfavourable prognostic factors in invasive breast carcinoma. Histopathol. , 2000, 36 , 313-325.
[15] LEE W.Y., CHEN H.H., CHOW N.H., SU W.C., LIN P.W., GUO H.R. — Prognostic significance of co-expression of Ron and Met receptors in node-negative breast cancer patients. Clin.
Cancer Res ., 2005, 11 , 2222-2228.
[16] MAULIK G., SHRIKHANDE A., KIJIMA T., MA P.C., MORRISON P.T., SALGIA R. — Role of the hepatocyte growth factor receptor, c-met, in oncogenesis and potential for therapeutic inhibition. Cytokine Growth Factor Rev ., 2002, 13 , 41-59.
[17] MA P.C., MAULIK G., CHRISTENSEN J., SALGIA R. — C-met : Structure, functions and potential for therapeutic inhibition. Cancer Meta. Rev ., 2003, 22 , 309-325.
[18] TRUSOLINO L., COMOGLIO P.M. — Scatter-Factor and Semaphorin receptors : Cell signaling for invasive growth. Nature , 2002, 2 , 289-300.
[19] KALLIONIEMI O.P., WAGNER U., KONONEN J., SAUTER G. — Tissue microarray technology for high-throughput molecular profiling of cancer. Hum. Mol. Genet ., 2001, 10 , 657-662.
[20] CHARPIN C., DALÈS J.P., GARCIA S., CARPENTIER S., DJEMLI A., ANDRAC L., LAVAUT M.N., ALLASIA C., BONNIER P. — Tumour neoangiogenesis by CD31 and CD105 expression evaluation in breast carcinoma tissue microarrays. Clin. Cancer Res ., 2004, 10 , 5815-5819.
[21] GINESTIER C., CHARAFE-JAUFFRET E., BERTUCCI F., EISINGER F., GENEIX J., BECHLIAN D., CONTE N., ADELAÏDE J., TOIRON Y., NGUYEN C., VIENS P., MOZZICONACCI M.J., HOULGATTE R., BIRNBAUM D., JACQUEMIER J. — Distinct and complentary information provided by use of tissue and DNA microarrays in the study of breast tumour markers. Am. J. Pathol ., 2002, 161 , 1223-1233.
[22] DALÈS J.P., GARCIA S., MEUNIER-CARPENTIER S., ANDRAC-MEYER L., HADDAD O., LAVAUT M.N., ALLASIA C., BONNIER P., CHARPIN C. — Overexpression of hypoxia-inducible factor HIF-1α predicts early relapse in breast cancer : Retrospective study in a series of 745 patients.
Int. J. Cancer , 2005, 116 , 734-739.
[23] DALÈS J.P., GARCIA S., CARPENTIER S., ANDRAC L., RAMUZ O., LAVAUT M.N., ALLASIA C., BONNIER P., CHARPIN C. — Long-term prognostic significance of neoangiogenesis in breast carcinomas : Comparison of Tie-2/Tek, CD105 and CD31 immunocytochemical expression.
Human Path. , 2004, 35, 176-183.
[24] CHARPIN C., GARCIA S., BONNIER P., MARTINI F., ANDRAC L., CHOUX R., LAVAUT M.N., ALLASIA C. — Reduced E-cadherin immunohistochemical expression in node-negative breast carcinomas correlates with 10-year survival. Am. J. Clin. Pathol ., 1998, 109 , 431-438.
[25] CHARPIN C., GARCIA S., BONNIER P., MARTINI F., ANDRAC L., HORSCHOWSKI N., LAVAUT M.N., ALLASIA C. — Prognostic significance (ten year follow up) of Nm23/NDPK automated and quantitative immunocytochemical assays in breast carcinomas. J. Pathol ., 1998, 184 , 401-407.
[26] CHARPIN C., GARCIA S., BOUVIER C., BONNIER P., MARTINI F., ANDRAC L., HORSCHOWSKI N., LAVAUT M.N., ALLASIA C. — Bcl-2 automated and quantitative immunocytochemical assays in breast carcinoma : correlation with 10 year follow-up. J. Clin. Oncol. , 1998, 16 , 2025-2031.
[27] CHARPIN C., GARCIA S., BOUVIER C., MARTINI F., ANDRAC L., BONNIER P., LAVAUT M.N., ALLASIA C. — CD31/PECAM automated and quantitative immunocytochemical assays in breast carcinomas. Correlation with patient follow-up. Am. J. Clin. Pathol ., 1997, 107 , 534-541.
[28] CHARPIN C., VIELH P., DUFFAUD F., DEVICTOR B., ANDRAC L., LAVAUT M.N., ALLASIA C., HORSCHOWSKI N., PIANA L. — Quantitative immunocytochemical assays of P-glycoprotein in breast carcinomas : Correlation to mRNA expression and to immunohistochemical prognostic indicators. J Nat Canc Inst , 1994, 20, 1539-1545.
[29] CHARPIN C., GARCIA S., BOUVIER C., DEVICTOR B., ANDRAC L., CHOUX R., LAVAUT M.N., ALLASIA C. — Automated and quantitative immunocytochemical assays of CD44v6 in breast carcinomas. Hum. Pathol ., 1997, 28 , 289-296.
[30] LAID A.D., CHERRINGTON J.M. — Small molecule tyrosine kinase inhibitors : Clinical development of anticancer agents. Expert Opin. Investig. Drugs , 2003, 12 , 51-64.
[31] MATSUMOTO K., NAKAMURA T. — NK4 (HGF-antagonist/angiogenesis inhibitor) in cancer biology and therapeutics. Cancer Sci. , 2003, 94 , 321-327.
[32] ZHENG Z., ADAMS C., MOFFAT B., SCHWALL R.A. CHIMERIC — Fab. Antibody serves as an antagonist to the HGF/SF receptor c-met. Proc. Am. Assoc. Cancer Res ., 2003, 43 , 5717.
[33] MORTON P.A., JOY W.D., BONO C.P., ARBUCKLE A., EVANS M.L., HUYNH M.S. — In vitro and in vivo activity of fully-human monoclonal antibody antagonists to c-met protein tyrosine kinase.
Proc. Am. Assoc. Cancer Res ., 2003, 43 , 5604.
[34] SCHWALL R., ADAMS W.D., ZHENG Z., ROMERO M., MAI E., MOFFAT B. — Inhibition of c-met activation by a one-armed antibody. Proc. Am. Assoc. Cancer Res ., 2004, 44 , 1424.
[35] CHRISTENSEN J.G., SCHRECK R., BURROWS J., KURUGANTI P., CHAN E. — Le P. A selective small molecule inhibitor of c-met kinase inhibits c-met-dependent phenotypes in vitro and exhibits cytoreductive antitumour activity in vivo . Cancer Res. , 2003, 63 , 7345-7355.
[36] WANG X., LE P., LIANG C., CHAN J., KIENLICH D., MILLER T. — Potent and selective inhibitors of the Met [hepatocyte growth factor/scatter factor (HGF/SF) receptor] tyrosine kinase block HGF/SF-induced tumour cell growth and invasion. Mol. Cancer Ther. , 2003, 2 , 1085-1092.
[37] CAMP R.L., CHUNG G.C., RIMM D.L. — Automated subcellular localization and quantification of protein expression in tissue microarrays. Nature Med. , 2002, 8 , 1323-1327.
[38] PAGES F., BERGER A., CAMUS M., SANCHEZ-CABO F., COSTES A., MOLIDOR R., MLECNIK B., KIRILOSKY A., NILSSON M., DAMOTTE D., MEATCGI T., BRUNEVAL P., CUGNENC P.H., TRAJANOSKI Z., FRIDMAN W.H., GALON J. — Effector Memory T Cells, early metastasis and survival in colorectal cancer. N. Engl. J. Med ., 2006, 25 , 2654-2666.
DISCUSSION
M. Jean-Jacques HAUW
Vous avez, à juste titre, souligné l’économie de moyens apportée par la technique de lecture automatisée à haut débit des puces tissulaires en anatomie pathologique. Des études de coût évaluant le gain de temps médical et technique sont-elles disponibles ?
Les gains de coût en temps médical et technique sont difficiles à quantifier en valeur absolue car ils doivent tenir compte de l’amortissement des appareillages, des temps de personnel et de consommables, ainsi que le coût de fonctionnement des structures qui, à un niveau hospitalier, doivent faire l’objet d’une étude spécifique. Par contre, il est intéressant de savoir que le principe général de la technique (des puces tissulaires) est de rassembler sur une seule lame des centaines voire quelques milliers de prélèvements tissulaires. Ce qui se traduit par une réduction par un facteur 100 à 1 000 du temps technique, du temps d’utilisation et d’amortissement des appareils et de la quantité des
consommables, après constitution des échantillons élaborés en milieu de recherche. La réduction des coûts est donc majeure.
M. André-Laurent PARODI
Une standardisation rigoureuse de la méthodologie, en particulier de la confection des coupes et des puces tissulaires, est évidement indispensable. Davantage en amont, qu’en est-il de la fixation, en particulier pour les études rétrospectives ?
L’utilisation de matériel archivé, fixé et formolé et inclus en paraffine est un problème qui a été très largement contourné et évalué pour les études protéomiques intratissulaires.
L’étude du protéome intracellulaire par technique immunohistochimique se fait aisé- ment dans ce type de matériel après une évaluation comparative sur tissu congelé éventuellement. Les techniques de démasquage sont multiples et couramment utilisées, avant les tests immunohistochimiques, par différents appareillages, permettant à 90 % des anticorps d’être utilisés sur matériel archivé. Bien entendu, l’utilisation en pratique diagnostique et l’évaluation de l’intérêt clinique de marqueurs doit être déterminée au préalable dans des conditions techniques standardisées. De même, les prélèvements doivent être archivés à température contrôlée et la fixation doit être faite selon les temps habituels avec du formol tamponné contrôlé aussi.
M. Michel BOUREL
Cancers infiltrants ou/et cancers inflammatoires. Quelle est la situation par rapport aux cancers avec marqueurs génétiques (BRCA1, BRCA2…) ?
Les cancers inflammatoires constituent un type particulier de cancer infiltrant grave évoluant chez la femme jeune. Initialement, ces cancers ont été mis en évidence chez la femme enceinte, du fait de la stimulation des cellules tumorales par l’imprégnation hormonale de la grossesse. Le seul point commun avec les cancers dits familiaux avec mutation de BRCA, est qu’ils surviennent chez la femme jeune. Les cancers familiaux auraient plutôt morphologiquement des apparentés avec les carcinomes de type médullaire du sein.
M. Henri ROCHEFORT
Cellules basales ou liminales ? Où classer les cancers inflammatoires ? Quelles relations entre C-Met exprimé par cellules tumorales et lymphocytes inflammatoires : secrètent-ils des ligands de ce récepteur ou des facteurs stimulant l’expression de c-met ?
Les cancers inflammatoires ont un comportement proche au carcinome à cellules basales du fait de leur évolutivité et de leur résistance aux thérapeutiques conventionnelles. Par ailleurs, les carcinomes inflammatoires ont une signature moléculaire très proche des carcinomes à cellules basales.
M. Jacques-Louis BINET
Combien de coupes histologiques pouvez-vous analyser pour chaque prélèvement ? Comment les choisissez-vous ? Existe-t-il des différences de résultat entre chacune de ces
coupes ? Ne pouvez-vous pas étudier, sur le même prélèvement, une quantification en biologie moléculaire qui servirait de référence ?
Le nombre de micro biopsies effectuées dans chaque bloc donneur d’une tumeur doit être déterminé très simplement en se référant aux données de la littérature qui ont montré que le nombre est fonction de la qualification de celui qui cible les zones à microbiopsier.
Celles-ci ne peuvent être déterminées que par un pathologiste compétent qui détermine les zones tumorales pertinentes et les plus représentatives d’une tumeur. Dans ces conditions, les données de la littérature montrent que deux « carottes » sont suffisantes.
Dans notre étude, nous avons utilisé deux carottes par cas après avoir effectué des tests préliminaires nous permettant de montrer que les mesures effectuées dans quatre ou deux carottes étaient statistiquement très bien corrélées. Comme je l’ai indiqué, les zones à microbiopsier sont déterminées sur coupes de paraffine colorées à l’Hématoxyline Phloxyne Safran à partir du bloc donneur. Le pathologiste cercle ensuite sur la lame la zone pertinente qui est ainsi repérée sur le bloc ensuite par la technicienne. Si les microbiopsies sont localisées par un pathologiste, les différences sont minimes. Ce qui est bien sûr très différent si les prélèvements sont faits au hasard, notamment en dehors des zones tumorales carcinomateuses, dans le stroma par exemple. Les études en protéomique dérivent des études en biologie moléculaire permettant d’orienter les choix des marqueurs testés. Ceux que nous évaluons sont, au préalable, identifiés par signature moléculaire d’un type de tumeur donnée. De récents travaux ont montré qu’il pouvait y avoir des dissociations entre la protéomique et la génomique pour plusieurs raisons. Les études en biologie moléculaire peuvent en effet porter à côté des zones pertinentes puisqu’elles ne permettent pas de cibler les cellules tumorales carcinomateuses contrairement à l’approche morphologique. Ensuite, l’expérience a montré que les tests immunohistochimiques, effectués sur les mêmes prélèvements de tissu fixé à visée diagnostique, ne requièrant que très peu de tissu, (soit une coupe de 5 mm de côté × 5 µ d’épaisseur) sont largement suffisants et beaucoup plus gérables en pratique courante. Enfin, les coûts du test immunohistochimique sont de 10 à 100 fois moindres que ceux en biologie moléculaire qui se font en quelques heures, et que ces tests sont standardisables par automate à immunohistochimie d’une part et leurs résultats quantifiables par densitométrie des immunoprécipités visualisés par numérisation d’images microscopiques. La biologie moléculaire en la matière s’adresse plus à la recherche alors que l’anatomie pathologique, à l’interface de la clinique et de la biologie, permet un transfert en pratique diagnostique courante dans des délais, une qualité et un coût beaucoup plus compétitifs que les études en biologie moléculaire trop sophistiquées pour se substituer à l’immunohistochimie dans les études de protéome intracellulaire en pratique clinique.
* Membre de l’Académie nationale de médecine ** Service de Pathologie (Anatomie et Cytologie Pathologiques) CHU Nord, chemin des Bourreley, 13915 Marseille cedex 20 *** Commun de Microscopie Electronique et d’Analyse d’Images, Faculté de Médecine Timone, Marseille. **** Service d’Oncologie Gynécologique, Hôpital de la Conception / Centre Hospitalier libéral Beauregard, Marseille. Tirés à part : Professeur Colette TARANGER-CHARPIN, même adresse Article reçu le 29 septembre 2006, accepté le 20 novembre 2006
Bull. Acad. Natle Méd., 2007, 191, no 2, 361-376, séance du 27 février 2007


