Résumé
L’hyperinsulinisme est une maladie rare qui touche un enfant sur cinquante mille naissances. Initialement supposée être la conséquence d’une hyperplasie diffuse des îlots de Langerhans, appelée nesidioblastose, les techniques de radiologie interventionnelle ont permis de montrer l’existence de formes focales et de formes diffuses de la maladie. Ces techniques invasives ont été remplacées par l’étude en Tomographie par émission de positons (TEP) à la 18F Fluoro L Dopa. Les formes focales sont guéries par exérèse de la lésion tandis que les formes diffuses sont traitées par un traitement médical ou par une exérèse sub-totale du pancréas. Les études biochimiques et génétiques ont montré que les formes focales et diffuses sont la conséquence de plusieurs mutations différentes sur le chromosome 11.
Summary
Hyperinsulinism is a rare disorder, affecting one in more than 50 000 births. It was initially thought to be due to a diffuse anomaly called nesidioblastosis, but interventional radiologybased studies demonstrated the existence of two separate forms, one diffuse and the other focal. These invasive techniques have now been replaced by PET studies with 18F fluorodopa. Focal forms can be cured by surgical removal of the lesion, while the diffuse form can be treated medically or by subtotal resection of the pancreas. Biochemical and genetic studies show that focal and diffuse forms are due to various mutations of chromosome 11.
INTRODUCTION
Clinique
L’hyperinsulinisme de l’enfant est une maladie rare touchant un enfant pour cinquante mille naissances.
Elle se manifeste dès les premières heures de vie par une hypoglycémie profonde pouvant se révéler par des convulsions mettant en jeu le pronostic neurologique.
En effet, ces convulsions parce qu’elles surviennent dans un contexte d’hypoglycé- mie, sont à l’origine de destructions cérébrales importantes dans près de 20 % des cas. Il est donc absolument essentiel de prévenir cette encéphalopathie convulsivante hypoglycémique.
Devant toute suspicion d’hypoglycémie, le diagnostic est obtenu très rapidement par un dosage en urgence de la glycémie au lit du malade et par l’administration de glucagon par voie sous-cutanée qui sert, non seulement, de test diagnostic mais aussi de traitement immédiat. Ces hypoglycémies répondent en effet, très favorablement au glucagon. L’augmentation des besoins horaires en insuline au-dessus de 10 mg/Kg/min est un bon indicateur d’hyperinsulinisme.
Le diagnostic est ensuite effectué par le dosage de l’insuline périphérique et montre le contraste entre une hypoglycémie et une insuline non effondrée.
Données anatomo-pathologiques
Jusque dans les années 1990, on pensait que l’hyperinsulinisme de l’enfant était la conséquence d’une hyperplasie diffuse des îlots de Langerhans dans l’ensemble de la glande pancréatique. Le terme de nésioblastose a été proposé [1]. Cette nésioblastose était, pensait-on le résultat d’une persistance de l’organisation embryonnaire du pancréas. Les études récentes ont permis de montrer qu’en dehors des hyperinsulinismes d’origine métabolique, quatre formes anatomopathologiques peuvent être distinguées.
Dans les formes diffuses (36 % des cas), la totalité des îlots de Langerhans sont hyperplasiques, en hyperfonctionnement. Cette hyperplasie diffuse est identifiée par les méthodes immuno-histochimiques habituelles.
Dans les formes focales (44 % des cas), il existe non seulement une lésion focale le plus souvent millimétrique mesurant entre 2,5 et 7 mm, mais le reste du pancréas est éteint, au repos comme si l’hypersécrétion d’un îlot de Langerhans entraînait un hypofonctionnement du reste du pancréas.
Les formes atypiques (12 %) correspondent à une hyperactivité d’une région plus étendue du pancréas que les formes focales, sans atteindre l’ensemble du pancréas.
Enfin les adénomes sont l’apanage du grand enfant et ont été observés dans 7 % des enfants explorés aux Enfants Malades.
Génétique et mécanismes biochimiques [2]
La sécrétion normale d’insuline est sous la dépendance de multiples facteurs. Le canal potassique membranaire constitué de deux sous unités SUR1 et Kir 6,2 joue un rôle central. L’entrée de glucose se fait grâce à l’intervention d’un transporteur du glucose (GLUT 2). Cette augmentation intracellulaire de glucose permet l’accumulation d’ATP qui à son tour induit la fermeture du canal potassique. Cette fuite de potassium entraîne la dépolarisation de la membrane cellulaire et l’entrée de calcium dans la cellule. Cette entrée calcique entraîne la libération d’insuline. Il a été montré que les sous unités SUR1 et Kir 6,2 sont assemblées au niveau de la membrane des granules d’insuline et recyclées au niveau de la membrane cellulaire.
Ces canaux potassiques sont aussi retrouvés au niveau du plexus myentérique et du système nerveux central.
La synthèse de ces sous unités est régulée au niveau du chromosome 11 (intervalle 11p15,1) Une anomalie de ces sous unités (40 mutations décrites à ce jour) entraîne une fermeture permanente du canal potassique et une hypersécrétion d’insuline. A l’inverse certaines formes de diabète congénital sont la conséquence d’une mutation qui empêche la fermeture du canal potassique et donc la libération d’insuline [3].
Les études génétiques et en biologie moléculaire du matériel anatomo-pathologique obtenu lors du traitement chirurgical des formes diffuses et des formes focales a permis la mise en évidence des différentes mutations responsables.
Pour les formes diffuses, il s’agit de mutations récessives autosomiques sur le chromosome 11. Pour les formes focales deux événements sont nécessaires. Une mutation somatique sur le chromosome 11 paternel et une perte de l’allèle maternel correspondant dans la région focale.
Ainsi les formes focales et diffuses sont sous-tendues par des mécanismes génétiques proches mais différents.
Traitement [4]
La découverte de l’existence de deux formes d’hyperinsulinisme, focale et diffuse, a modifié considérablement la prise en charge thérapeutique de ces patients.
La prise en charge initiale est cependant identique quelque soit la forme. En effet il s’agit d’adapter les apports glucidiques pour éviter la survenue d’épisodes d’hypoglycémie. Des apports supérieurs à 20mg/kg/min sont souvent nécessaires.
Le traitement initial consiste en l’administration de diazoxide(10-15mg/kg/jour).
En cas d’inefficacité ou d’efficacité incomplète du diazoxide, l’administration continue de glucagon (1mg/jour) par voie intraveineuse est mise en place. D’autres composés peuvent être utilisés comme les analogues de la somatostatine, l’octreotide. L’utilisation de la Sandostatine (10 à 50 γ /Kg/ j) a, depuis cinq ans, considé- rablement fait diminuer le nombre de patients résistants au traitement médical et donc les indications chirurgicales de pancréatectomie totale.
Le traitement médical permet dans la plupart des cas de contrôler la phase aiguë. Ce traitement est cependant contraignant et n’est pas dépourvu d’effet secondaire. Une hypertrichose généralisée parfois esthétiquement gênante lors de l’utilisation du diazoxide peut être observée.
Deux situations sont alors rencontrées. Soit le traitement médical permet de stabiliser ces patients, soit les besoins en glucose restent tels qu’ils empêchent tout retour à domicile.
Il est alors indispensable de savoir s’il s’agit d’une forme diffuse ou d’une forme focale.
Les patients résistants au traitement médical — Dans le cas des formes diffuses le traitement consiste en une pancréatectomie sub-totale (95 %) permettant de guérir ces enfants au prix d’un diabète insulinodépendant et d’une insuffisance pancréatique externe.
— Par contre, la quasi totalité des enfants présentant une forme focale ou un adénome sont opérés. En effet, l’exérèse chirurgicale de la lésion responsable permet d’obtenir la guérison [5].
Toutes les interventions chirurgicales, à l’exception des adénomes lorsque la lésion a été identifiée en pre-opératoire, se font avec l’aide d’une étude anatomopathologique extemporanée. Plusieurs biopsies ont réalisées au niveau du pancréas et au niveau de la zone focale suspectée lorsque c’est le cas.
Cette étude extemporanée permet de confirmer la forme focale et d’assurer une résection en zone saine ou au contraire de poser le diagnostic de forme diffuse.
Cependant cette technique nécessite la présence d’un anatomopathologiste expé- rimenté pendant l’intervention. Le repérage anatomique précis est difficile. La glande pancréatique chez le nouveau né est une structure de petite taille (4 cm3) et profonde.
— Les formes atypiques Les formes atypiques ne sont pas diagnostiquées en pré-opératoire et sont une découverte au moment de l’intervention, à la lecture des biopsies extemporanées.
Elles sont traitées par pancréatectomie partielle réglée en fonction de l’étendue des anomalies anatomo-pathologiques.
Les patients sensibles au traitement médical — Lorsque l’imagerie pose le diagnostic de forme focale, le traitement est poursuivi. Dans quelques rares cas, il a été observé des améliorations spontanées de l’hyperinsulinisme.
— Dans le cas d’une suspicion de forme focale, la discussion entre la poursuite du traitement médical et l’intervention chirurgicale se fait au cas par cas. Une chirurgie limitée permet la guérison définitive du patient.
Ce travail rétrospectif précise le rôle des différentes techniques d’imagerie dans le diagnostic différentiel des formes focales et diffuses des hyper-insulinismes de l’enfant explorés de 1985 à 2008.
MATÉRIEL ET MÉTHODES
Quatre cent-dix patients (190 garçons, 220 filles) ont été étudiés à l’hôpital Necker de 1985 à 2008.
Tous les patients ont été vus initialement dans le service des maladies métaboliques.
Le diagnostic d’hyperinsulinisme a été établi selon les méthode décrites dans l’introduction.
L’âge moyen des enfants au moment du diagnostic, initialement élevé, s’est considérablement raccourci au cours du temps, l’information de la nécessité d’un diagnostic précoce étant passé dans la communauté médicale.
Dix-huit grands enfants ont été vus, cette cohorte correspond à 90 % à des enfants vus avant 1995.
Cent vingt-huit sont des nourrissons, deux cent soixante-quatre des nouveaux nés.
Sur cette cohorte 190 patients ont été opérés : 84 sont des formes focales (44 %), 70 des formes diffuses (36 %), 22 des formes atypiques (12 %), 14 des adénomes (7 %), 220 patients n’ont pas été opérés.
Trois groupes de patients ont été identifiés en fonction de l’évolution des techniques d’imagerie.
Le groupe I (158 patients) a été exploré grâce aux prélèvements étagés d’insuline (PEI).
Le groupe II (12 patients) a été exploré simultanément avec la technique des PEI et en TEP.
Le groupe III (37 patients) a été exploré uniquement en TEP. Dans ce groupe 31 ont eu une étude IRM abdominale couplée à la TE.
Groupe 1 cent cinquante-huit enfants on été explorés grâce à la technique des prélèvements étagés d’insuline (PEI)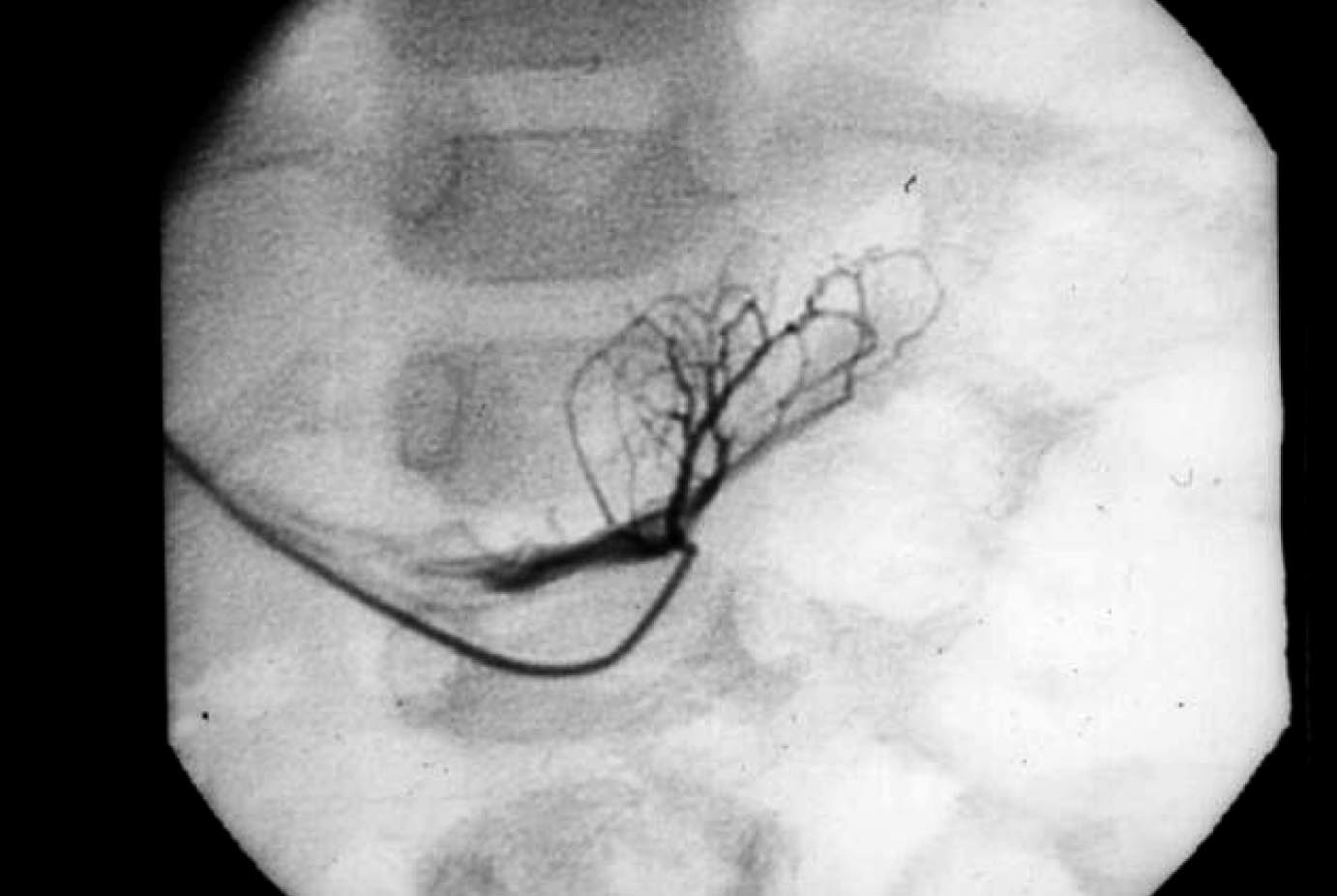
FIG. 1. — Cathétérisme de la veine principale du corps du pancréas. La veine pancréatique est opacifiée puis prélevée. L’échantillon est repéré sur la carte grâce à un numéro anatomique.
La technique de prélèvements étagés d’insuline (PEI) dans le système pancréatique permet, grâce à une cartographie de vérifier si l’hypersécrétion d’insuline est diffuse ou localisée à une seule région du tissu pancréatique. Cette technique a été mise au point par notre équipe. L’examen est réalisé sous anesthésie générale [6]. Le niveau de la glycémie est contrôlé régulièrement pour éviter toute hyperglycémie qui inhiberait la sécrétion d’insuline.
Le système porte est ponctionné par voie percutanée intercostale droite. Les veines du pancréas dépendant des territoires splénique, gastro-duodénal et mésentérique supérieur sont cathétérisées et prélevées grâce à des cathéters spécifiques pour chaque territoire (Figure 1). Chaque prélèvement est repéré par un numéro d’ordre et un numéro anatomique correspondant au territoire prélevé. L’insuline, le peptide C et la glycémie sont mesurés et rapportés sur une carte anatomique. Les résultats sont obtenus dans les six heures grâce à l’utilisation d’analyseurs automatiques.
L’analyse des cartes obtenues permet d’identifier deux types de malades, le type 1 qui correspond à une sécrétion diffuse de la glande pancréatique et le type 2 qui correspond à une lésion focale responsable de l’hypersécrétion d’insuline. Dans les formes focales, l’hypersécrétion d’insuline est cantonnée à un seul territoire, drainé par une seule veine (Figure 2). Au contraire dans les formes diffuses, tous les territoires pancréatiques sont le siège d’une hypersécrétion souvent très élevée. Les taux d’insuline sont comparés aux chiffres obtenus dans les territoires non pancréa-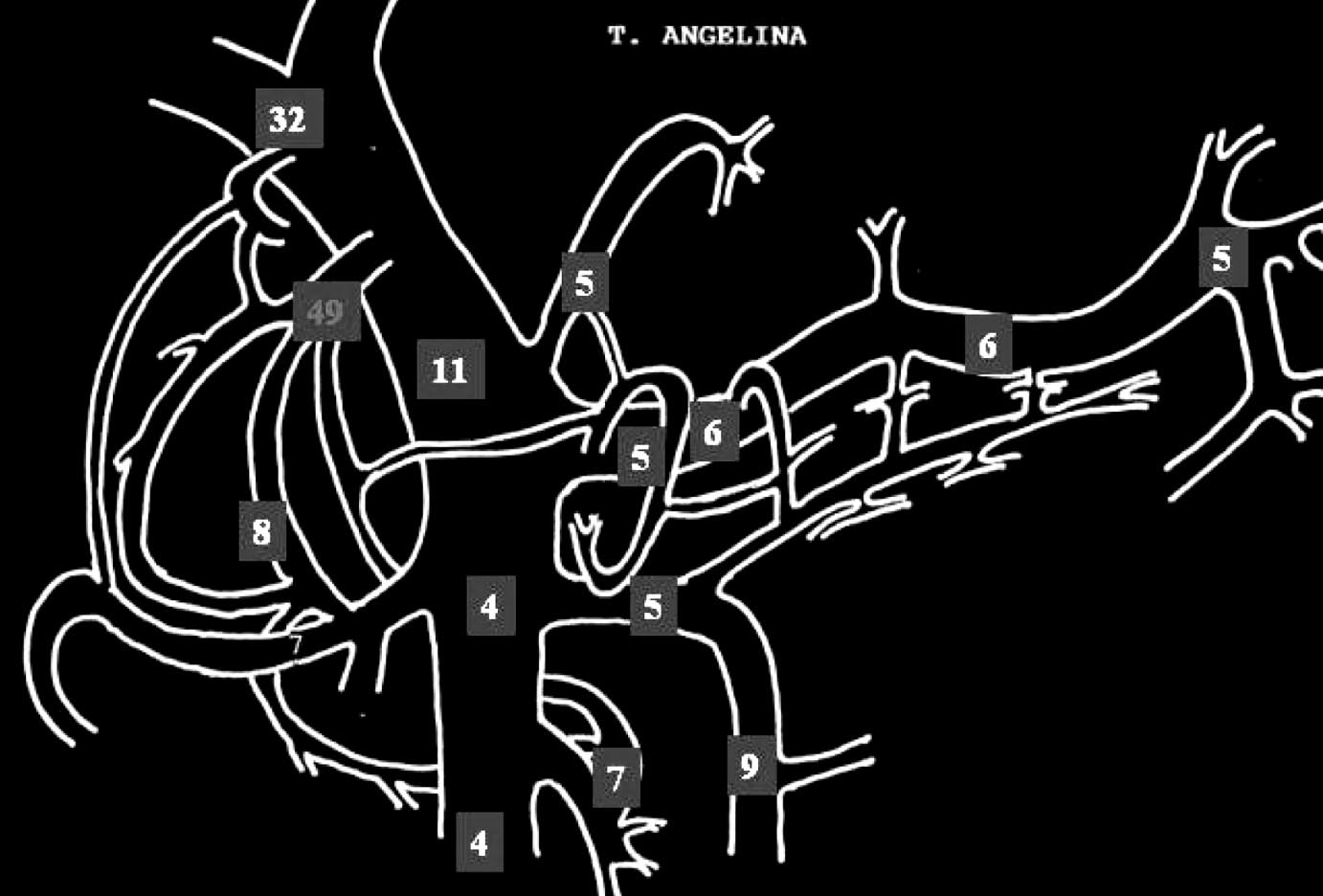
FIG. 2. — Cartographie fonctionnelle d’une forme focale.
Seul un point présente une valeur élevée d’insuline (49). Les valeurs d’insuline prélevées dans les autres veines sont normales (autour de 5 unités internationales par ml) La valeur élevée dans le tronc porte (32) correspond à la dilution de l’insuline provenant de la veine gastro-duodénale supérieure.
tiques comme la veine mésentérique supérieure. Dans un certain nombre de cas les prélèvements ne sont pas réalisés en raison de la persistance d’une glycémie normale pendant l’examen, ou ne sont pas interprétables (absence de gradient d’insuline au sein des territoires prélevés).
De plus cette technique a une valeur localisatrice et permet d’orienter le chirurgien en per-opératoire. En effet les lésions focales sont de très petite taille (entre 2 et 7 mm) et invisibles la plupart du temps à l’œil nu. Elles ne sont pas identifiées par les techniques d’imagerie traditionnelles, comme l’échographie ou le scanner. Des tentatives d’échographies per-opératoires ont été réalisées dans notre équipe et se sont soldées par des échecs.
La technique des PEI n’est cependant pas fiable à 100 % pour des raisons liées à la difficulté technique, à l’impossibilité de prélever l’ensemble des veines pancréatiques au caractère probablement aléatoire dans le temps de l’hypersécrétion de l’insuline et aux difficultés liées à l’anesthésie générale. De plus cette technique est irradiante car réalisée en radioscopie.
Quelques patients (n = 16) dont les résultats des PEI n’avaient pas été concluant ont bénéficié d’une technique complémentaire : la mesure du taux d’insuline en fonction
du temps dans la veine sus-hépatique après injection artérielle de gluconate de calcium au niveau des artères mésentériques supérieures, spléniques et gastroduodénales.
Cette technique est basée sur la capacité du gluconate de calcium injecté dans les artères du pancréas de stimuler la sécrétion d’insuline. Elle est anatomiquement moins précise que la précédente car elle ne permet d’identifier que trois grands territoires, le corps et la queue vascularisés par l’artère splénique, l’isthme par l’artère mésentérique supérieure et la tête par la gastro-duodénale [7].
Cette technique de stimulation calcique a permis dans un certain nombre de cas difficiles de mettre en évidence des formes focales non identifiées par les PEI.
Elle reste invasive, nécessite une anesthésie générale et un abord artériel toujours risqué chez le nouveau-né.
La tomographie en émission de positon, (TEP) [8]
La tomographie par émission de positons (TEP), en utilisant comme traceur la 18 Fluoro-L-Dopa a permis à une équipe finlandaise de dépister l’existence de métastases hépatiques dans le cadre des insulinomes malins de l’adulte [9]. Nous avons formulé l’hypothèse que les hyperinsulinismes de l’enfant pouvaient être étudiés grâce à cette technique.
Dans un premier temps, nous avons grâce à la collaboration avec cette équipe finlandaise, comparé les données des PEI et ceux de la TEP en utilisant la L-Dopa marquée au Fluor 18.
Cette étude a permis chez quatre malades de valider la TEP en confrontant ses résultats au PEI [10]. L’hypothèse sous tendant ce travail repose sur la capacité des cellules β du pancréas, qui font partie du système neuro-endocrine, de capter la dopamine. Pour vérifier cette hypothèse nous avons, sur des pièces de résection pancréatique de formes focales et de formes diffuses, recherché la présence de dopa décarboxylase et d’insuline. Nous avons démontré la présence de dopa décarboxylase dans les cellules β. La dopa décarboxylase permet la conversion de la 18FFluoro-L-Dopa en 18F-Fluoro-L-Dopamine dont l’accumulation pancréatique est visualisée sur les images TEP. Il existe une corrélation anatomique étroite entre la dopa décarboxylase et l’insuline, dans les formes diffuses, comme dans les formes focales [11].
Par ailleurs l’injection d’inhibiteur de la dopa décarboxylase immédiatement avant la réalisation de la TEP, a permis d’éteindre complètement le signal en TEP des enfants porteurs d’hyperinsulinisme diffus [12].
Quarante-neuf patients ont été étudiés en TEP. Les images TEP ont été fusionnées à une étude morphologique IRM permettant un repérage anatomique préopératoire plus précis, chez trente et un patients.

FIG. 3. — Coupe transversale de l’abdomen obtenue en TEP (tomographie à émission de positon) après injection de Fluoro 18 L Dopa. Ce traceur outre son élimination rénale et biliaire est spécifiquement capté par les cellules β du pancréas. Ici une forme focale visible grâce à une accumulation localisée du traceur radioactif (flèche). Une forme diffuse verrait l’ensemble du pancréas capter le traceur. Les deux reins et la vésicule biliaire sont visibles.
RÉSULTATS
Groupe 1
Sur les 158 malades explorés par PEI, 120 ont été opérés. La cartographie a été considérée comme interprétable dans 83 % des cas. Les 17 % restant correspondent à des explorations incomplètes dont les résultats étaient in-interprétables, ou au cours desquelles la glycémie n’a put être maintenue en dessous de 3mmole/L.
Parmi les PEI interprétables, la corrélation avec les données anatomo-pathologiques ont été cohérentes dans 80 % des cas (39 formes focales, 41 formes diffuses). Dans 20 % des cas les PEI n’ont pu correctement établir le diagnostic, la moitié de ces cas correspondent à des formes « atypiques ».
Groupe 2
Douze patients ont bénéficié successivement d’un PEI et d’une étude en TEP.
Dans 11 cas sur 12 les données du TEP et du PEI étaient concordants. 10 patients ont été opérés et le seul cas de divergence était une forme atypique.
Groupe 3
Quarante-neuf patients (incluant les 12 du groupe 2) ont été étudiés en TEP. 15 ont été considérés comme formes focales (Figure 3) et 34 comme forme diffuses.
Sur les 15 formes focales 14 ont été opérées et l’étude anatomo-pathologique a confirmé la forme focale et sa localisation prédite par le TEP dans 13 cas. Dans un cas la chirurgie a mis en évidence une hyperplasie adénomateuse dans la tête du pancréas, alors que le TEP avait mis en évidence une hyper fixation dans la région médiane du pancréas.
Sur les 34 formes diffuses, 9 enfants résistants au traitement médical ont été opérés.
Sept enfants ont subi une pancréatectomie sub-totale et 2 une pancréatectomie partielle pour forme atypique.
Ainsi la TEP a permis un diagnostic dans 84 % ces cas (21/24).
Par ailleurs il est à noter que contrairement au PEI, aucune TEP n’a été considérée comme non interprétable, ou comme un échec technique Sur les 31 enfants ayant bénéficié d’un examen IRM permettant un recalage des images TEP et IRM, pour une meilleure lecture anatomique préopératoire, il est a noté qu’aucune lésion focale ni a fortiori diffuse n’a pu être diagnostiquée par l’IRM seule.
DISCUSSION
L’imagerie joue un rôle décisif dans le diagnostic et la planification thérapeutique de l’hyper insulinisme de l’enfant. Initialement l’origine de cette pathologie était mise sur le compte de la persistance de l’état embryonnaire du pancréas et le terme de nésidioblastose avait été proposé.
La mise au point des PEI a permis :
— de montrer qui existe en fait deux formes distinctes, des formes focales et des formes diffuses — de localiser anatomiquement les formes focales — la mise au point d’un traitement chirurgical des formes focales et de guérir celles-ci.
— le développement des études génétiques et moléculaires.
Cependant cette technique présente de nombreux inconvénients. Elle est invasive.
Elle nécessite une anesthésie générale, une hypoglycémie contrôlée au cours de l’examen, un abord vasculaire, et une irradiation liée à l’utilisation de la radioscopie.
Techniquement difficile, elle a eu du mal a s’imposer en dehors de l’équipe qui l’a mise au point..
L’utilisation plus récente de la TEP a levé ces inconvénients.
Elle est aussi fiable que les PEI. Elle ne nécessite qu’une prémédication. Le couplage à une imagerie anatomique lui donne une valeur localisatrice aussi précise que les PEI dont la localisation ne repose que sur l’anatomie vasculaire veineuse. Cette technique d’imagerie a de plus l’avantage d’être disponible dans la plupart des pays développés.
Il faut mettre à part dans cette série, les adénomes pancréatiques qui surviennent chez l’enfant plus âgé. Il s’agit d’une pathologie se rapprochant de celle rencontrée chez l’adulte et leur diagnostic repose sur l’imagerie morphologique [13].
Les formes atypiques sont par définition un cadre intermédiaire entre les formes focales et les formes diffuses. Les techniques utilisées ne permettent pas aujourd’hui d’en faire le diagnostic pré-operatoire Cependant il est à noter que sur les seize formes atypiques explorées en PEI, onze sur douze examens interprétables avaient porté le diagnostic de forme focale et un seul de forme diffuse. Cette imprécision diagnostique n’a donc pas de conséquence sur la conduite opératoire car ces enfants ont été opérés.
PERSPECTIVES
Si le traitement chirurgical reste de mise chez les enfants porteurs d’une forme focale, puisque la chirurgie permet d’obtenir la guérison, chez les enfants porteurs d’une forme diffuse résistant au traitement médical, la pancréatectomie totale se fait aux dépends d’un diabète insulino-prive et d’une insuffisance pancréatique externe et donc d’un handicap sévère.
Le suivi des patients ayant subi une pancréatectomie sub-totale montre cependant que certains d’entre eux ne présentent pas de diabète post-operatoire et que certains voient leur diabète régresser.
Cette donnée clinique évoque la possibilité d’une régénération du tissu pancréatique. Une étude de la mesure du volume pancréatique en IRM en pre et en postopé- ratoire dans le suivi de ces patients est en cours. Cette étude devrait permettre de voir si le pancréas régénère après pancréatectomie. Si cette hypothèse est exacte, elle ouvre des possibilités thérapeutique importantes.
CONCLUSION
L’évolution des techniques d’imagerie, et de la thérapeutique ont profondément modifié la compréhension des mécanismes de l’hyperinsulinisme chez l’enfant. Les formes focales sont guéries par une chirurgie orientée et limitée. La prise en charge
des formes diffuses a été améliorée par l’utilisation du diazoxide et de la somatostatine. Une pancréatectomie sub-totale permet un contrôle de la glycémie chez les enfants résistants au traitement médical.
BIBLIOGRAPHIE [1] SHERMETA D.W., MENDELSOHN G., HALLER J.A., JR. — Hyperinsulinemic hypoglycemia of the neonate associated with persistent fetal histology and function of the pancreas. Ann. Surg., 1980 , 191 : 182-186.
[2] DELONLAY P., GIURGEA I., SEMPOUX C. et al. — Dominantly inherited hyperinsulinaemic hypoglycaemia.
J. Inherit. Metab. Dis., 2005 , 28 , 267-276.
[3] PEARSON E.R, FLECHTNER I., NJOLSTAD P.R et al. — Switching from insulin to oral sulfonylureas in patients with diabetes due to Kir6.2 mutations. N. Engl. J. Med., 2006 , 355 , 467-477.
[4] AYNSLEY-GREEN A., HUSSAIN K., HALL J. et al. — Practical management of hyperinsulinism in infancy.
Arch. Dis. Child. Fetal. Neonatal., 2000 , 82 , 98-107.
[5] CRETOLLE C., DE LONLAT P., SAUVAT F. et al. — Congenital hyperinsulinism of infancy :
surgical treatment in 60 cases of focal form.
Arch. Pediatr., 2005 , 12 , 258-263.
[6] DUBOIS J., BRUNELLE F., TOUATI G. et al. — Hyperinsulinism in children : diagnostic value of pancreatic venous sampling correlated with clinical, pathological and surgical outcome in 25 cases. Pediatr. Radiol., 1995, 25 , 512-516.
[7] CHIGOT V., DE LONLAY P., NASSOGNE M.C., et al. — Pancreatic arterial calcium stimulation in the diagnosis and localisation of persistent hyperinsulinemic hypoglycaemia of infancy.
Pediatr.
Radiol., 2001 , 31 , 650-655.
[8] RIBEIRO M.J., DE LONLAY P., DELZESCAUX T. et al. — Characterization of hyperinsulinism in infancy assessed with PET and 18F-fluoro-L-DOPA.
J. Nucl. Med., 2005 , 46 , 560-566.
[9] KAUHANEN S., SEPPANEN M., MINN H. et al. — Fluorine-18-L-dihydroxyphenylalanine (18F-
DOPA) positron emission tomography as a tool to localize an insulinoma or beta-cell hyperplasia in adult patients. J. Clin. Endocrinol. Metab., 2007 , 92 , 1237-1244.
[10] OTODONSKI T., NANTO-SALONEN K., SEPPANEN M. et al. — Noninvasive diagnosis of focal hyperinsulinism of infancy with [18F]-DOPA positron emission tomography.
Diabetes., 2006 , 55 , 13-18.
[11] DE LONLAY P., SIMON A., GALMICHE-ROLLAND L. et al. — Neonatal hyperinsulinism : clinicopathologic correlation.
Hum. Pathol., 2007 , 38 , 387-399.
[12] DE LONLAY P., SIMON-CARRE A., RIBEIRO M.J. et al. — Congenital hyperinsulinism : pancreatic [18F]fluoro-L-dihydroxyphenylalanine (DOPA) positron emission tomography and immunohistochemistry study of DOPA decarboxylase and insulin secretion. J. Clin. Endocrinol.
Metab., 2006 , 91 , 933-940.
[13] GUTELIUS B.J., KORYTKOWSKI M.T., CARTY S.E., HAMAD G.G. — Diagnosis and minimally invasive resection of an insulinoma : report of an unusual case and review of the literature. Am.
Surg., 2007 , 73 , 520-524.
DISCUSSION
M. Christian NEZELOF
A propos des formes dites atypiques d’hyperinsulinisme et qui représentent à peu près 15 % à 20 % des formes, l’enquête génétique peut-elle aider ?
En principe, il n’y a pas de mutation dans les gènes connus. Le mécanisme génétique n’est pas encore compris M. Jean-Louis CHAUSSAIN
Les formes diffuses et les adénomes correspondent-ils à une ou deux entités différentes, comme l’existence de formes intermédiaires peut le suggérer ? Avez-vous observé des rechutes après ablation sélective d’un adénome ?
Les adénomes ne s’observent que chez les grands enfants. Nous n’avons pas de données génétiques concernant les adénomes. Nous n’avons pas observé de rechute après cure chirurgicale d’adénomes.
M. Charles MENKÈS
Chez le nouveau-né, doit-on faire une anesthésie générale pour le Pet-Scan ?
Une simple prémédication suffit.
M. Jacques BATTIN
Dans votre grande expérience des hyperinsulinismes de l’enfant quelle est la place du syndrome de Beckwitt-Wiedeman qui correspond souvent à une disomie uniparentale du chromosome 11 ? Quelle est la raison de l’administration limitée dans le temps du diazoxide dans les formes sensibles à ce traitement ?
Dans notre expérience (ou recrutement), les hyperinsulinismes sont dans la grande majorité des d’hypoglycémies isolées. Les formes syndrome comme le syndrome de Beckwith-Wideman (SBW) sont rares. A l’inverse les hypoglycémies néonatales du SBW sont sous-diagnostiquées, probablement plus fréquentes qu’on ne le dit.
M. Michel HUGUIER
Avez-vous une expérience de l’échographie per-opératoire ? Chez l’adulte, cela nous a permis de localiser un adénome de quelques millimètres, non décelable macroscopiquement, mais dont l’échostructure était différente de celles des lobules pancréatiques. Un des risques de l’énucléation de ces adénomes, par ailleurs préférable à des résections pancréatiques, est celui de fistules pancréatiques par effraction de petits canalicules pancréatiques. Cette
complication est en général spontanément régressive. En avez-vous observé et dans quel pourcentage ?
L’échographie peropératoire n’est pas utilisable chez l’enfant. La taille des lésions est millimétrique et surtout la taille du pancréas chez un enfant de quatre kilos, ne permet pas une bonne exploration de la glande. De plus, si une image est retrouvée, rien ne prouve que cette image est la lésion qui secrète de l’insuline.
M. Jean-Daniel SRAER
Pourquoi les veines qui ne drainent pas les cellules hypersécretantes d’insuline contiennentelles de l’insuline en quantité certes faible mais qui devrait être nulle ? Le diazoxide chez l’enfant n’est-il pas un antihypertenseur majeur ?
Le taux d’insuline dans les veines non pancréatiques correspond au taux systémique d’insuline qui correspond à la dilution de l’insuline dans la masse sanguine. Le taux n’est donc pas nul. Le Diazoxide n’est pas un antihypertenseur. En revanche il peut donner une rétention hydrosodée.
M. Pierre GODEAU
Quel est le délai d’intervention pour un état de mal convulsif du nouveau-né ? Est-on certain d’éviter des séquelles neurologiques ?
Il s’agit d’une urgence pédiatrique classique. Un état de mal convulsif hypoglycémique doit être traité dans les minutes qui suivent son apparition, par apport de glucose et injection de glucagon.
* Radiologie pédiatrique, Hôpital Necker-Enfants Malades, 149, rue de Sèvres, 75743 Paris cedex 15 Tirés à part : Professeur Francis BRUNELLE, même adresse. Article reçu le 7 juin 2007, accepté le 15 octobre 2007
Bull. Acad. Natle Méd., 2008, 192, no 1, 59-72, séance du 15 janvier 2008


