Résumé
Des expériences sur culture de cellules endothéliales d’artères coronaires de porc ont été effectuées afin de déterminer si le vieillissement per se ou la densité cellulaire affecte l’activité de la NO-synthase endothéliale (eNOS), et explique la diminution de la relaxation endothélium-dépendante à la bradykinine observée au cours du processus de régénération après dénudation endothéliale. La présente étude démontre que des cellules endothé- liales mises en culture à partir d’endothélium régénéré prélevé huit jours après la dénudation possèdent une capacité basale de production de GMP cyclique (GMPc) intacte mais réagissent déjà plus faiblement à une stimulation réceptorielle (bradykinine) ou intracellulaire (ionophore calcique). En fonction de passages cellulaires multiples, employés pour mimer le phénomène de vieillissement, la production basale de GMPc reste stable pendant plusieurs passages (semaines), pour diminuer au bout d’un mois. En revanche, la réponse à la stimulation réceptorielle (bradykinine) faiblit déjà au bout de la seconde semaine pour rester stable au cours des passages suivants. Dans des cultures de cellules endothéliales aortiques, l’augmentation de la densité cellulaire s’accompagne d’une diminution de sites actifs de la eNOS, ainsi que d’une production de NO plus faible en réponse à la bradykinine et au A23187. Ces résultats suggèrent qu’aussi bien l’augmentation de la densité cellulaire que le vieillissement des cellules participent à la dysfonction endothéliale au cours du processus de régénération. Ils permettent de mieux comprendre l’évolution de la réactivité vasculaire après dénudation endothéliale et ses conséquences physiopathologiques.
Summary
Experiments were designed to determine whether or not aging per se or cellular density affects endothelial NO-synthase (eNOS) activity in cultured coronary endothelial cells of the pig. A diminished activity could explain the reduced endothelium-dependent relaxation to bradykinin previously observed during regeneration after endothelial injury. The results demonstrate that cell cultures derived from eight-day old regenerated endothelium exhibit a normal basal production of cyclic GMP, but a reduced response to bradykinin or the Ca2+ ionophore A23187. With multiple cellular passages, used to mimick aging, the basal production of cyclic GMP remained stable during the first passage, to decrease moderately after one month (4th passage). By contrast, the response to bradykinin was reduced as of the second passage, to remain stable thereafter. In cultured aortic endothelial cells, an increase in cellular density was accompanied by a reduced number of active eNOS-sites, as well as a reduction of NO production in the response to both bradykinin and A23187. These results suggest that both the increased cellular density and cell senescence explain the endothelial dysfunction during regeneration. They permit a better understanding of the changes in vascular reactivity in the course of endothelial regeneration, and of its pathological consequences.
INTRODUCTION
L’endothélium vasculaire synthétise et sécrète des substances vasodilatatrices telles que le monoxyde d’azote (NO), la prostacycline (PGI ) et un facteur hyperpolari2 sant endothélial ( endothelium-derived hyperpolarizing factor, EDHF) de nature inconnue, en réponse à des médiateurs neurohumoraux ou à des stimuli physiques.
Il libère également des substances vasoconstrictrices tels que les endoperoxydes et l’endothéline [1-7]. L’importance du NO, en particulier dans le contrôle local du tonus vasculaire in vivo , a été montrée à la fois dans des modèles animaux et humains [8, 9]. Le NO est produit en continu par les cellules endothéliales au cours de l’oxydation de l’arginine par le monoxyde d’azote synthase endothéliale (eNOS) avec production simultanée de citrulline. L’activité de cette isoforme constitutive des NOS est dépendante du complexe calcium-calmoduline [10, 11]. La synthèse de NO peut être induite, soit par des processus mécaniques tels que les forces de cisaillement, ou par de nombreux agonistes physiologiques tels que l’acétylcholine, la bradykinine, l’histamine, la thrombine, l’insuline, la sérotonine et l’ATP.
Après dénudation intimale, il s’installe une altération fonctionnelle progressive de l’endothélium cicatriciel [12 , 13]. En effet, huit jours après sa dénudation, l’endothélium régénéré qui recouvre la totalité du segment dénudé au préalable est capable d’induire une relaxation vasculaire normale. Trois semaines plus tard, une altération sélective des réponses fonctionnelles des vaisseaux avec un endothélium régénéré est observée [12-14]. Une stimulation par la sérotonine entraîne une relaxation infé-
rieure à celle observée sur des vaisseaux avec un endothélium natif [12-14]. En revanche, les relaxations induites par la bradykinine ne semblent pas ou peu affectées [13]. Mais le maintien d’une réponse inchangée à la bradykinine n’est qu’apparent. En effet, une diminution de la composante NO-dépendante de la relaxation endothélium-dépendante à la bradykinine est démasquée par l’inhibition de la participation de l’EDHF à la réponse [14] . Néanmoins, la diminution de la réponse à la bradykinine n’est pas comparable à l’effondrement de celle induite par la sérotonine. Si ce dernier peut s’expliquer par une inhibition sélective des protéines de couplage Gi [13, 14], ceci ne peut être le cas pour la diminution relative de la composante NO-dépendante de la relaxation induite par la bradykinine, puisque la stimulation des récepteurs B2-kininergiques provoque toujours une libération d’EDHF [14, 15]. Il semblerait donc qu’au bout d’un mois, une dysfonction relative plus fondamentale de la eNOS se soit installée, qui n’est pas apparente huit jours après l’agression intimale à l’origine de la régénération endothéliale.
Huit jours après la dénudation endothéliale, l’endothélium est totalement régénéré [12]. Les cellules n’ont pour cela utilisé qu’une faible partie de leur capacité de doublement, alors qu’au bout d’un mois (24 doublements au maximum) celle-ci s’est fortement amoindrie, ce qui conduit les cellules vers un état de sénescence. Les cellules d’endothélium régénéré de huit jours ont une morphologie comparable à celle d’endothélium natif. En revanche, trois semaines plus tard, le phénotype de ces cellules est modifié. L’endothélium est constitué de cellules de taille très hétérogène, souvent élargie, et des cellules géantes parfois multinucléées sont observées. Ces cellules présentent également une diminution de leur capacité à proliférer [16]. Ces modifications morphologiques ont déjà été décrites sur l’endothélium d’artères rénales, pulmonaires et aortiques humaines, en association avec l’âge et l’importance des lésions d’athérosclérose [17]. Par ailleurs, en dehors de l’évolution de la morphologie des cellules, la densité cellulaire au cours de la régénération augmente de 40 % en huit jours et de 95 % en un mois [12].
Les expériences rapportées dans cet article ont été effectuées afin de déterminer si les phénomènes de vieillissement per se et/ou l’augmentation de la densité cellulaire affectent l’activité de la eNOS et peuvent expliquer la diminution relative de la réponse à la bradykinine de l’endothélium régénéré. Un modèle de culture cellulaire a été utilisé, dans lequel une meilleure réponse à la bradykinine qu’à la sérotonine est observée [15-20], et qui permet la mesure de GMPc, de l’activité de la eNOS ainsi que la quantification des sites actifs de cette enzyme.
MATÉRIELS ET MÉTHODES
Dénudation endothéliale d’artère coronaire de porc
L’intervention a été réalisée sur des porcs Large White âgés de 2 à 3 mois et pesant de 18 à 25 kg, en respectant les recommandations définies par le ministère français
de l’Agriculture pour l’utilisation et les soins des animaux. Les animaux sont anesthésiés par une injection intramusculaire de tiletamine (15 mg/kg) et de zolazepam (15 mg/kg), intubés et ventilés avec un respirateur. Des injections intraveineuses d’héparine (30 µg/kg) et d’aspirine (10 mg/kg) sont réalisées avant l’intervention, de façon à éviter toute formation de thrombus. La procédure suivie est comparable à celle utilisée chez l’homme pour réaliser une angioplastie coronaire. Une sonde porteuse est introduite dans l’artère fémorale jusqu’à l’ostium de l’artère coronaire droite. Son positionnement est visualisé par l’injection de liquide de contraste sous amplificateur de brillance. Une sonde, présentant à son extrémité un ballonnet de 2 cm de longueur, est introduite par la sonde porteuse et permet de dénuder l’endothélium de l’artère coronaire droite. Le ballonnet est gonflé trois fois de suite, par séquence de 30 secondes au niveau de chaque segment coronaire. En fin d’intervention, et à titre de traitement prophylactique, 20 mg/kg de terramycine sont administrés par voie intramusculaire. Les animaux sont ensuite surveillés jusqu’à leur réveil.
Primoculture de cellules endothéliales d’artères de porc
Les animaux sont anesthésiés par une injection intramusculaire de tiletamine (15 mg/kg) et de zolazepam (15 mg/kg). Après exsanguination par section des carotides, le cœur et l’aorte sont prélevés et placés dans une solution saline de Earle (EBSS) additionnée de 5 % sérum de veau fœtal (SVF) et de pénicillinestreptomycine (100 U/ml). La dissection des vaisseaux (artère coronaire ou aorte thoracique) est réalisée le plus rapidement possible. Ils sont ensuite ouverts longitudinalement pour gratter l’endothélium à l’aide d’un scalpel. Les fragments d’endothélium ainsi obtenus sont mis en culture sur des supports collagénés dans du milieu de Eagle (MEM) additionné de 10 % de SVF, de glutamine et de pénicillinestreptomycine. Au bout de huit jours, le tapis de cellules endothéliales a atteint la confluence. Dans le cas des animaux ayant subi une dénudation endothéliale d’une artère coronaire, le prélèvement est réalisé huit jours après l’intervention.
Mesure du GMPc
Les cellules endothéliales sont ensemencées à une densité subconfluente dans des plaques à 96 puits recouverts de collagène. Le jour de l’étude, le tapis cellulaire est rincé avec un tampon physiologique à 37° C contenant 20 mM d’HEPES, 0.7 mM de MgSO , 2.4 mM de CaCl , 5.4 mM de KCl, 140 mM de NaCl ayant un pH de 7.4.
4 2 Les expériences sont réalisées en présence de 10 µM d’indométacine et de 100 µM d’isobutyl méthylxanthine (IBMX), sous agitation douce à 37° C, afin de bloquer respectivement les cyclooxygénases et les phosphodiestérases. Les agonistes de la voie du NO (bradykinine et ionophore calcique, A23187, à 1 µM) sont ensuite ajoutés au milieu réactionnel. La réaction est arrêtée en remplaçant le milieu extracellulaire par 30 µl d’éthanol contenant 100 µM d’IBMX afin de perméabiliser les cellules et de recueillir leur contenu intracellulaire. Le nombre de cellules présentes dans chaque puits est déterminé à l’aide d’une technique colorimétrique, l’héma-
color. Le GMPc est dosé à l’aide d’un test radioimmunologique (Amersham, RPA 525). Les valeurs de GMPc sont exprimées en fmoles par million de cellules.
Vieillissement in vitro des cellules endothéliales
Ce vieillissement est induit par la multiplication des passages de cellules endothé- liales natives de coronaires. Un passage (P) correspond à une étape de décollement du tapis cellulaire à l’aide de la trypsine, suivi d’un réensemencement de ces cellules à plus faible densité afin de les amplifier. Le temps de culture (huit jours) et la densité d’ensemencement sont identiques entre deux passages. La production de GMPc, basale et stimulée, est étudiée selon le protocole précédent, de P1 à P4, sur cinq primocultures différentes.
Activité de la eNOS
L’activité de la eNOS de cellules endothéliales d’aorte est déterminée en quantifiant la production de citrulline, plus stable que le NO, à partir d’arginine radiomarquée.
La formation de citrulline est parallèle à celle du NO lors de l’oxydation de l’arginine par la eNOS. Les cellules sont ensemencées sur des plaques à six puits recouverts de collagène. La citrulline peut être également formée par le cycle de l’urée. Afin d’éliminer cette voie, le tapis cellulaire est incubé avec 10 µM de nor-NOHA. La nor-NOHA, dérivé de la N-hydroxy-arginine (intermédiaire de synthèse au cours de la formation de NO), bloque l’activité de l’arginase. L’arginine tritiée est ajoutée à raison de 1.2 µM (L-[2,3,4,5-3H]-arginine (35-70 Ci/mmol, Amersham TRK 698).
L’activité de la eNOS est stimulée pendant 20 minutes par 1 µM de bradykinine ou de ionophore calcique. La réaction est arrêtée en retirant le milieu réactionnel. Les cellules sont lysées par 350 µl de NaOH (0,1 N). Après neutralisation, les échantillons sont analysés par chromatographie haute pression en phase inverse. La phase stationnaire est constituée d’une colonne BDS C18 150 × 4,6 mm (Hypersyl) et la phase mobile d’H O (1 000 ml), de CH CN (140 ml) et d’acide heptafluorobuty2 3 rique (4,4 ml). Le dénombrement cellulaire est effectué après trypsination des cellules par comptage à l’aide d’un compteur Coulter. La quantité de citrulline formée est exprimée en nmoles par million de cellules.
Marquage du site actif de la eNOS
Le site actif de la eNOS de cellules endothéliales d’aorte est marqué en utilisant l’un de ses inhibiteurs, la L-NG-Nitro-L-[2,3,4,5-3H]-arginine (LNA*, 66 mCi/mmole, Amersham TRK 927). Les cellules sont ensemencées en plaques à 48 puits recouverts de collagène. Le nombre de sites actifs est défini par la différence de fixation du LNA* en présence et en absence de 200 µM LNA non radioactif. Au bout de 45 minutes d’incubation à 37° C sous agitation 60 nM de LNA* sont ajoutés. La réaction est arrêtée 90 minutes plus tard en retirant le milieu réactionnel. L’ajout d’éthanol permet de perméabiliser les cellules et d’éliminer la LNA incorporée mais
non fixée aux membranes cellulaires. Les fragments membranaires sont récupérés dans de la NaOH 0,1 N et la radioactivité présente sur les membranes de cellules endothéliales est mesurée. En parallèle, le nombre de cellules est déterminé après trypsination des cellules par comptage cellulaire à l’aide d’un compteur Coulter. Le nombre de sites actifs présents sur le tapis cellulaire est exprimé en fmoles de LNA*
spécifiquement fixées par million de cellules.
Méthodes statistiques
Les valeurs moyennes sont comparées entre les différents groupes au moyen du test t de Student apparié en adoptant un seuil de significativité de 0,05.
RÉSULTATS
Teneur en GMPc intracellulaire
Sur chaque cœur de porc, les deux types de vaisseaux coexistent, avec un endothé- lium natif ou régénéré. Ainsi, les deux populations de cellules peuvent être étudiées en parallèle, dans les mêmes conditions de culture. Huit jours après l’intervention, le vaisseau ayant subi la dénudation endothéliale possède un endothélium régénéré.
Les cellules en culture dérivées de cet endothélium régénéré présentent un aspect normal, de forme pavimenteuse (Fig. 1). La voie du NO a été rapidement analysée puisque ces cellules n’ont pas été maintenues plus de quatre jours en culture afin de limiter au maximum l’influence des conditions de culture sur leur phénotype. Dans ces conditions, la teneur basale en GMPc intracellulaire est identique dans les cellules provenant d’endothélium natif ou régénéré (Fig. 2). En réponse à une stimulation par la bradykinine ou l’ionophore calcique, la teneur en GMPc est respectivement majorée d’environ trois ou quatre fois dans les cellules d’endothé- lium natif. La réponse aux mêmes agonistes est significativement plus faible dans les cellules provenant d’endothélium régénéré. Même si cette différence est importante, la teneur en GMPc en présence des deux agonistes n’en reste pas moins supérieure à celle mesurée en condition basale.
Voie du NO en fonction de l’âge
L’effet du vieillissement in vitro sur la production de GMPc, en conditions basales et après stimulation par 1 µM de bradykinine, a été étudié durant quatre semaines à raison d’un passage par semaine (P1 à P4). La production basale de GMPc est maintenue jusqu’au troisième passage puis diminue au-delà (Fig. 3). En revanche, la réponse à la bradykinine est altérée dès le deuxième passage (Fig. 3).
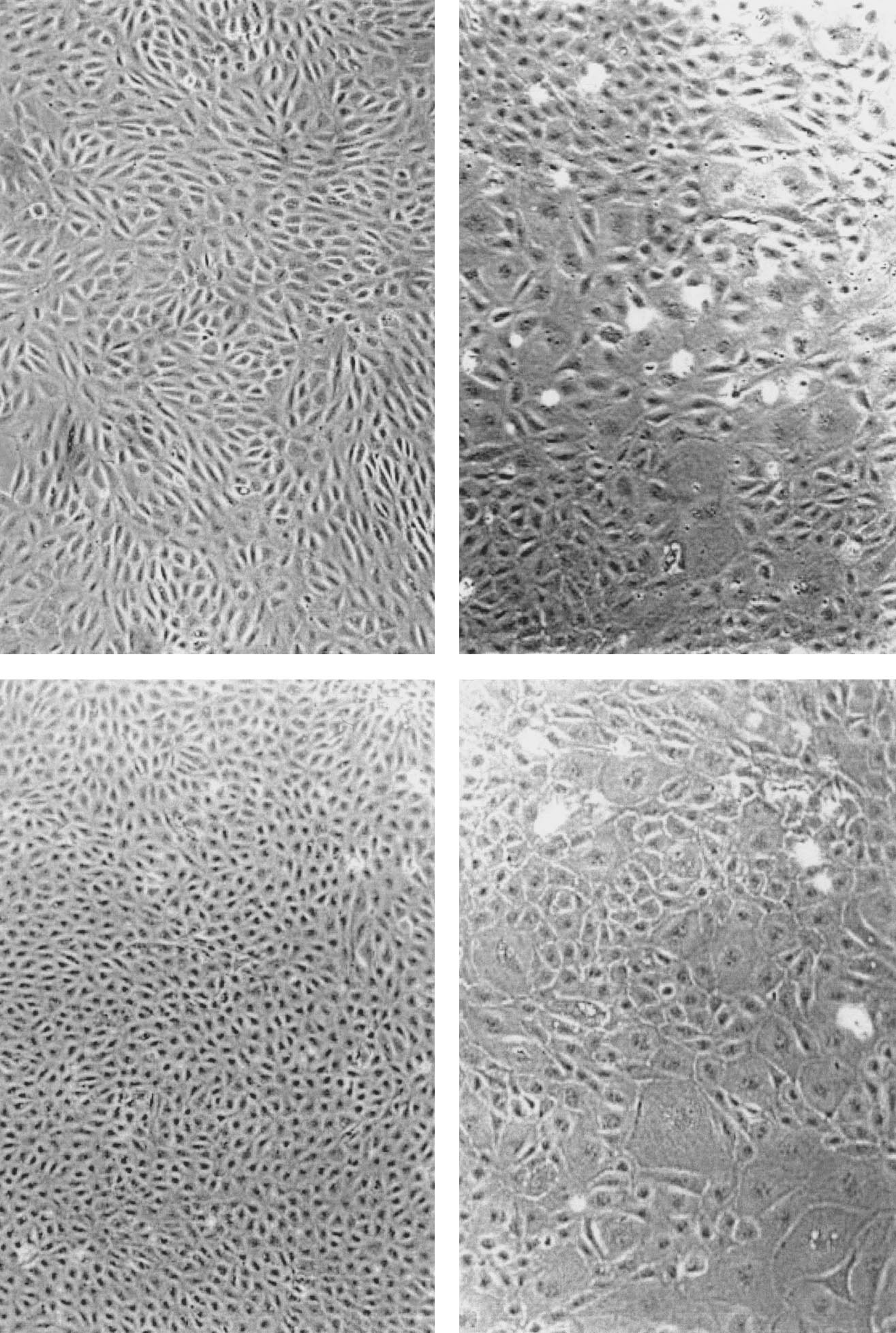 en ou (gauche) tif na é lium ’ endoth d é es v é ri d e cultur en é liales endoth (bas).
en ou (gauche) tif na é lium ’ endoth d é es v é ri d e cultur en é liales endoth (bas).
mois cellules un de ou (haut) monocouches semaine des une gique depuis oite) morpholo (dr tion Aspect é r a — é n 1.
r é g IG.
F
FIG. 2. — Production de GMPc intracellulaire de cellules provenant d’endothélium natif (CTL) ou d’endothélium régénéré (REG) d’artères coronaires de porc. La production de GMPc en conditions basale ou stimulée par 1 µM de bradykinine (BK) ou d’ionophore calcique, A23187, a été déterminée sur sept couples de cellules endothéliales provenant de sept porcs.
Données exprimées en valeurs moyennes fi ESM. *= différence significative (P<0.05).
Activité de la eNOS en fonction de la densité cellulaire
L’activité de la eNOS a été mesurée en suivant la quantité de citrulline formée à partir d’arginine tritiée, pour trois densités cellulaires représentatives de différents états de confluence du tapis cellulaire : subconfluente, confluente et très confluente (50 000, 100 000 et 170 000 cellules par cm2). Quelle que soit la densité cellulaire, l’activité basale de l’enzyme est comparable alors que l’activation induite par la bradykinine ou le A23187 est moindre lorsque la densité cellulaire augmente (Fig. 4).
Nombre de sites actifs de la eNOS en fonction de la densité cellulaire
La voie du NO a été étudiée dans des cellules endothéliales d’aorte de porc, cette technique nécessitant une grande quantité de cellules. Pour chaque primoculture, les cellules ont été ensemencées après le même nombre de doublement, au passage P1, à des densités cellulaires variant de 40 000 à 225 000 cellules/cm2. L’étude a été réalisée le lendemain de l’ensemencement de façon à éviter toute prolifération cellulaire. L’utilisation de la LNA tritiée pour marquer le site actif de la eNOS
FIG. 4. — Production de citrulline en fonction de la densité cellulaire en conditions basales (basal) ou après stimulation avec 1 µM de bradykinine (BK) ou d’ionophore calcique A23187 (iono).
Données exprimées en valeurs moyennes fi ESM (n=3). * = différence significative par rapport à la réponse obtenue en présence de 50 000 cellules/cm2.
permet de déterminer le nombre d’enzymes disponibles pour oxyder l’arginine et donc pour produire du NO. Le nombre de sites actifs de la eNOS diminue de façon significative en passant d’une densité cellulaire subconfluente (40 000 cellules/cm2) à très confluente (220 000 cellules/cm2) (Fig. 5).
DISCUSSION
Cette étude démontre que — des cellules endothéliales mises en culture à partir d’endothélium régénéré prélevé huit jours après la dénudation possèdent une capacité basale de production de GMPc intacte mais réagissent déjà plus faiblement à une stimulation réceptorielle (bradykinine) ou intracellulaire (ionophore calcique) ;
FIG. 5. — Évolution du nombre de sites actifs de la eNOS en fonction de la densité cellulaire.
Données exprimées en valeurs moyennes fi ESM (n=6).
— en fonction de passages cellulaires multiples, employés pour mimer le phénomène de vieillissement, la production basale de GMPc reste stable pendant plusieurs passages (semaines), pour diminuer au bout d’un mois. En revanche, la réponse à la stimulation réceptorielle (bradykinine) faiblit déjà au bout de la seconde semaine pour rester stable au cours des passages suivants ;
— l’augmentation de la densité cellulaire endothéliale s’accompagne d’une diminution de sites actifs de la eNOS, ainsi que d’une réponse plus faible à la stimulation réceptorielle ou intracellulaire directe. Ces résultats permettent de mieux comprendre l’évolution de la réactivité vasculaire après dénudation endothéliale et ses conséquences physiopathologiques.
Huit jours après une dénudation endothéliale in vivo les réponses endothéliumdépendantes à la bradykinine sont comparables dans des artères coronaires, étudiées ex vivo , recouvertes d’endothélium régénéré et natif [12]. Néanmoins, les résultats de l’étude in vitro rapportée ici démontrent que la réponse des cellules endothéliales à la stimulation kininergique est affaiblie dès la première semaine de régénération in vivo ou dès le second passage in vitro de cellules natives. La réponse à l’ionophore calcique A23187 est amoindrie d’une façon similaire à celle à la bradykinine. Comme l’ionophore active la production de NO par augmentation de la concentration en Ca2+ [4] , l’affaiblissement de la réponse à la bradykinine en
terme de production de NO et de GMPc peut être attribué à une diminution de l’activité enzymatique plutôt qu’à un dysfonctionnement des récepteurs B2-kininergiques ou de leur couplage à la eNOS. Le maintien d’une relaxation endothélium-dépendante normale à la bradykinine (ou à l’ionophore calcique), malgré la diminution de la production de NO, s’explique par l’effet freinateur de ce dernier sur la production d’EDHF et donc de l’importance accrue de l’hyperpolarisation endothélium-dépendante lorsque la eNOS est inhibée ou dysfonctionnelle [21, 22]. Ce n’est que si le processus de régénération continue durant quatre mois que la diminution de la réponse à la bradykinine devient évidente, malgré le maintien de la réponse liée à l’EDHF [13].
Malgré sa chute initiale, dès la première semaine de régénération in vivo ou dès le second passage in vitro , la réponse à la bradykinine reste remarquablement stable au cours des passages successifs imposés lors de l’étude présente, et ceci malgré une diminution modeste de la production basale de GMPc, qui confirme des observations antérieures (le degré d’inhibition de la production de GMPc observé au cours des expériences rapportées correspond au niveau d’inhibition de la relaxation endothélium-dépendante à la bradykinine en présence d’inhibiteurs de la production d’EDHF [14]). La persistance de la réponse à la stimulation kininergique observée in vitro au fil des passages est conforme aux observations ex vivo démontrant que les relaxations endothélium-dépendantes à la bradykinine ne diminuent pas jusqu’à quatre mois après l’initiation in vivo du processus de régénération [13].
La diminution non sélective des réponses à la bradykinine et à l’ionophore calcique pourrait être une conséquence du vieillissement endothélial induit par les multiplications forcées imposées aux cellules en culture. Cette interprétation est peu probable. En effet, la diminution s’installe d’emblée, dès le second passage in vitro ou après huit jours in vivo , et ne s’aggrave pas avec le temps et les passages répétés. D’autre part, après huit jours de régénération in vivo , les cultures cellulaires dérivées de l’endothélium régénéré ne donnent aucun signe morphologique de la sénescence qui caractérise les cultures provenant d’endothélium régénéré depuis un mois [14].
L’explication la plus plausible à la diminution de la réponse à la bradykinine (et à l’ionophore calcique) très tôt au cours du processus de régénération, ou dès le deuxième passage en culture, est une augmentation de la densité cellulaire. En effet, le nombre de cellules endothéliales par unité de surface intimale augmente au cours de la régénération [12]. Dans les expériences présentes, effectuées sur cellules endothéliales aortiques (afin de disposer d’une source suffisante de cellules natives), l’augmentation de la densité cellulaire cause une diminution progressive de la réponse à la bradykinine et à l’ionophore calcique, sans affecter l’activité basale de l’enzyme, une situation analogue à celle observée avec les cultures de cellules dérivées de l’endothélium coronarien régénéré depuis huit jours, ou avec des cellules coronariennes natives dès le second passage. La diminution de l’activité enzymatique s’explique par une réduction progressive, en fonction de la densité cellulaire, du nombre de sites actifs, et donc activables, de l’enzyme. Les expériences rapportées ici ne permettent pas de conclure quant à la cause de la diminution du nombre de sites
actifs de la eNOS. Une possibilité serait que l’engorgement cellulaire résultant des fortes densités diminue l’accès aux cavéoles membranaires, dont l’association proche avec la eNOS est bien établie [23].
Les maladies cardiovasculaires comme l’hypertension artérielle, le diabète et l’athé- rosclérose sont associées à une altération de la fonction endothéliale. Cette dysfonction se caractérise par un déséquilibre entre les facteurs vasodilatateurs et vasoconstricteurs qui contrôlent le tonus vasculaire, les événements thrombotiques ainsi que la migration et de la prolifération des cellules musculaires lisses de la tunique médiale. Les conséquences de la dysfonction de l’endothélium sont le vasospasme, l’adhérence et l’agrégation plaquettaire, l’adhérence et l’infiltration monocytaire, la migration et la prolifération des cellules musculaires lisses adjacentes et la synthèse de matrice extracellulaire, autant d’événements qui favorisent la formation de plaques d’athérome [4]. Le développement et les complications de ces lésions, comme leur rupture, sont à l’origine de nombreuses manifestations cliniques comme l’angine de poitrine, l’infarctus du myocarde, les accidents vasculaires cérébraux, rénaux et l’ischémie des membres inférieurs. Ainsi, la compréhension des mécanismes impliqués dans l’apparition de la dysfonction endothéliale revêt un caractère médical important dans la perspective de limiter ou de contrecarrer les complications qui lui sont associées.
CONCLUSION
Un endothélium régénéré de huit jours est constitué de cellules ayant utilisé une partie de leur capacité de doublement, sans pour autant l’avoir épuisé. En revanche, la densité cellulaire est plus importante dans cet endothélium cicatriciel [12]. Ainsi, il présente les caractéristiques associées à son état de confluence : l’activité de la eNOS est normale en condition basale mais est réduite en condition de stimulation.
Pour un endothélium régénéré d’un mois, la situation est plus complexe. En effet, les cellules ont fortement entamé leur potentiel de doublement. Cet effet est très variable d’une cellule à une autre, expliquant les hétérogénéités morphologiques observées. De plus, ce tapis cellulaire est encore plus confluent que celui d’un endothélium régénéré de huit jours [12]. Deux phénomènes se cumulent alors : le vieillissement et l’état de confluence du tapis cellulaire sont impliqués dans l’altération de la production de NO, aussi bien dans les conditions stimulées que dans les conditions basales. Ceci explique qu’un agoniste comme la sérotonine, qui stimule faiblement la production de NO dans des cellules natives, ne puisse induire une relaxation totale de vaisseaux avec un endothélium régénéré d’un mois [12]. La bradykinine, quant à elle, induit une large production de NO mais aussi d’EDHF dans les cellules endothéliales. Les mécanismes impliqués dans la relaxation sont, dans ce cas multifactoriels, ce qui peut expliquer le délai d’apparition de l’altération fonctionnelle. Car si le NO joue un rôle non négligeable dans la relaxation induite par ce peptide, le facteur majoritairement impliqué reste l’EDHF. Dans les vais-
seaux avec un endothélium régénéré d’un mois, cette production d’EDHF est normale [15, 22].
Une moindre production basale de NO n’affecte pas seulement la réponse vasodilatatrice. Elle joue aussi un rôle important dans le maintien du potentiel membranaire de repos des cellules musculaires lisses. Une dépolarisation de ces cellules est d’ailleurs observée sur des vaisseaux avec un endothélium régénéré d’un mois, état favorisant le vasospasme [15, 22]. Par ailleurs, le NO basal influence le vieillissement des cellules endothéliales. En effet, une limitation de sa production accélère la sénescence cellulaire alors qu’un donneur de NO la ralentit en activant les télomé- rases [24].
Au cours de la régénération de l’endothélium, la production de NO est donc progressivement altérée par un vieillissement accéléré des cellules endothéliales.
Comme le NO contrôle de nombreux processus impliqués dans l’athérogenèse, l’altération de cette voie rend l’endothélium régénéré plus susceptible au développement de la pathologie coronaire. Comme la dysfonction endothéliale est accélérée par l’âge, l’hypercholestérolémie, le tabagisme et l’hypertension artérielle [3, 5, 25, 26] les observations rapportées ici prennent une signification médicale particulière.
BIBLIOGRAPHIE [1] FURCHGOTT R.F., ZAWADZKI J.V. — The obligatory role of the endothelial cells in the relaxation of arterial smooth muscle by acetylcholine . Nature, 1980, 288 , 373-376.
[2] VANHOUTTE P.M . — The endothelium — modulator of vascular smooth-muscle tone. New
England J. Med ., 1988, 319, 512-513.
[3] FURCHGOTT R.F., VANHOUTTE P.M. — Endothelium-derived relaxing and contracting factors.
FASEB J ., 1989, 3 , 2007-2018.
[4] LUSCHER T.F., VANHOUTTE P.M. — The endothelium : modulator of cardiovascular function .
Boca Raton, CRC Press, 1990, 1-250.
[5] VANHOUTTE P.M . — Endothelial dysfunction and atherosclerosis. European Heart Journal, 1997 , 18, 19-29.
[6] IGNARRO L.J., BUGA G.M., WOOD K.S., BYRNS R.E., CHAUDHURI G. — Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide . Proc. Natl. Acad. Sci.
USA., 1987, 84 , 9265-9269.
[7] BUSSE R., EDWARDS G., FELETOU M., FLEMING I., VANHOUTTE P.M., WESTON A.H. — EDHF :
bringing the concepts together. Article sous presse T.I.P.S, août 2002.
[8] AISAKA K., GROSS S.S., GRIFFITH O.W., LEVY R. — N-G methylarginine, an inhibitor of endothelium-derived nitric oxide synthesis, is a potent pressor agent in the guinea pig : does nitric oxide regulate blood pressure in vivo ? Biochem. Biophysic. Res. Comm., 1989 , 160 , 881-886.
[9] VALLANCE P., COLLIER J., MONCADA S. — Effects of endothelium-derived nitric oxide on peripheral arteriolar tone in man . Lancet, 1989, 2 , 997-1000.
[10] PALMER R.M., ASHTON D.S., MONCADA S. — Vascular endothelial cells synthesize nitric oxide from L-arginine. Nature, 1988, 333 , 664-666.
[11] FORSTERMANN U., POLLOCK J.S., SCHMIDT H., HELLER M., MURAD F . — Calmodulindependent endothelium-derived relaxing factor/nitric oxide synthase activity is present in the particulate and cytosolic fractions of bovine aortic endothelial cells. Proc. Natl. Acad. Sci, 1991, 88 , 1788-1792.
[12] SHIMOKAWA H., AARHUS L., VANHOUTTE P.M. — Porcine coronary arteries with regenerated endothelium have a reduced endothelium-dependent responsiveness to aggregating platelets and serotonin. Circ. Res ., 1987, 61 , 256-270.
[13] SHIMOKAWA H., FLAVAHAN N.A., VANHOUTTE P.M. — Natural course of impairment of endothelium-dependent relaxation after balloon endothelial removal in porcine coronary arteries. Possible dysfunction of pertussis toxin-sensitive G protein . Circ Res., 1989, 65 , 740-753.
[14] BORG-CAPRA C., FOURNET-BOURGUIGNON M.P., JANIAK P., VILLENEUVE N., BIDOUARD J.P., VILAINE J.P., VANHOUTTE P.M. — Morphological heterogeneity with normal expression but altered function of G proteins in cultured regenerated porcine coronary endothelial cells. Br. J.
Pharmacol., 1997, 122 , 999-1008.
[15] THOLLON C., FOURNET-BOURGUIGNON M.P., LESAGE L., SABOUREAU D., CAMBARRAT C., REURE H., VANHOUTTE P.M., VILAINE J.P. — Endothelium-derived hyperpolarizing factor maintains a normal relaxation to bradykinin despite impairment of nitric oxide pathway in porcine coronary arteries with regenerated endothelium. EDHF, 2000, éditeur P.M. Vanhoutte. 2001, 332-340.
[16] FOURNET-BOURGUIGNON M.P., CASTEDO-DELRIEU M., BIDOUARD J.P., LEONCE S., SABOUREAU D., DELESCLUSE I., VILAINE J.P., VANHOUTTE P.M. — Phenotypic and functional changes in regenerated porcine coronary endothelial cells. Increased uptake of modified LDL and reduced production of NO. Circ. Res ., 2000, 86 , 854-861.
[17] COTTON M.B., WARTMAN W.B. — Endothelial patterns in human arteries.
Arch. Pathol ., 1961, 71 , 15-24.
[18] SIMON B.C., CUNNINGHAM L.D., COHEN R.A. — Oxidised low density lipoproteins cause contraction and inhibit endothelium-dependent relaxation in the pig coronary artery. J. Clin.
Invest ., 1990, 86 , 75-79.
[19] FLAVAHAN N.A., VANHOUTTE P.M. — Endothelial cell signaling and endothelial dysfunction..
Am. J. Hypertension, 1995, 8 (2), 28S-41S.
[20] BOULANGER C., SCHINI V.B., MONCADA S., VANHOUTTE P.M. — Stimulation of cyclic GMP production in cultured endothelial cells of pig by bradykinin, adenosine diphosphate, calcium ionophore A23187 and nitric oxide. Br. J. Pharmacol ., 1990, 101 , 152-156.
[21] OLMOS L., MOMBOULI J-V., ILLIANO S., VANHOUTTE P.M. — cGMP mediates the desensitization to bradykinin in isolated canine coronary arteries. Am. J. Physiol ., 1995, 268 , H865-H870.
[22] THOLLON C., BIDOUARD J.P., CAMBARRAT C., DELESCLUSE I., VILLENEUVE N., VANHOUTTE P.M., VILAINE J.P. — Alteration of endothelium-dependent hyperpolarizations in porcine coronary arteries with regenerated endothelium. Circ. Res , 1999, 84 , 371-377.
[23] GOVERS R., RABELINK T. — Cellular regulation of endothelial nitric oxide synthase.
Am. J.
Physiol. Renal. Physiol ., 2001, 280 , F193-F206.
[24] VASA M., BREITSCHOPF K., ZEIHER A.M., DIMMELER S. — Nitric oxide activates telomerase and delays endothelial cell senescence. Circ.Res ., 2000, 87 , 540-542.
[25] GERHARD M., RODDY M.A., CREAGER S.J., CREAGER M.A. — Aging progressively impairs endothelium-dependent vasodilatation in forearm resistance vessels of humans. Hypertension , 1996, 27 , 849-853.
[26] NABEL E.G., SELWYN A.P., GANZ P. — Large coronary arteries in humans are responsible to changing blood flow : an endothelium-dependent mechanism that fails in patients with atherosclerosis. J. Am. Coll. Cardiol ., 1990, 16 , 349-356.
DISCUSSION
M. Raymond ARDAILLOU
La diminution de la production de NO dans les cellules endothéliales régénérées s’expliquet‘elle par la diminution de la quantité de NO synthase endothéliale exprimée dans les cellules ?
Oui, par histochimie nous avons pu démontrer la présence moindre de NO synthase endothéliale dans les cellules régénérées.
M. Jacques CAEN
Y a-t-il des anomalies de la fibrinolyse ? Quid des récepteurs en dehors du NOS ? Et de la cadhérine ?
Dans le modèle que nous avons étudié, nous nous sommes limité à l’étude de libération de facteurs vasoactifs. Vu la perturbation majeure qui résulte du processus de régénération, par exemple pour l’adhésion cellulaire, il nous semblerait logique que tous les aspects de la fonction endothéliale soient touchés.
M. François-Bernard MICHEL
Vos recherches relatives aux effets de la dysfonction du monoxyde d’azote sur la cellule endothéliale s’acheminent-elles vers des applications thérapeutiques ? Quels sont les effets de l’aspirine ?
Nous espérons en effet trouver des substances qui restaureraient la fonction des cellules endothéliales perturbées, ce qui permettrait d’arrêter la progression du processus d’athé- rosclérose et, qui sait, peut-être sa réversion. L’aspirine, en inhibant les cyclooxygénases endothéliales empêchera la formation de facteurs vasoconstricteurs par les cellules dysfonctionnelles.
M. Alain LARCAN
Peut-on distinguer une perturbation de la vasomotricité intrinsèque et une autre touchant la vasomotricité extrinsèque ou ne s’agit-il que de l’altération de cette dernière ? Vous avez étudié la macrocirculation coronaire. Peut-on savoir ce qu’il en est de la microcirculation myocardique ? Quelles sont les conséquences sur l’adhésion endothélium-leucocytes, l’activation leucocytaire et l’hyperexpression des sélectines, intégrines… Ne s’agit-il pas d’une perturbation transitoire ou définitive et susceptible de complications (athérome, thrombose) de l’autorégulation (« up » et « down » régulation) ?
La diminution de production de monoxyde d’azote affectera tant les régulations intrinsèques qu’extrinsèques en diminuant un effet freinateur de base. Pour des raisons
purement techniques, notre modèle est exclusivement limité à l’étude des gros troncs coronariens. Mais nous avons, suite à nos études sur les effets maléfiques de l’hypercholestérolémie et l’impact bénéfique des acides gras insaturés ω toutes raisons de croire que 3 la réponse de l’endothélium des micro-vaisseaux est semblable. La diminution de l’inhibition de l’expression des molécules d’adhésion, et l’adhésion accrue qui en résulte constituent une source majeure de facteurs de croissance et donc une stimulation du processus de multiplication cellulaire à la base de la formation de l’athérome. Nous n’envisageons pas un rôle majeur de la libération du monoxyde d’azote dans les processus d’autorégulation. Il s’agit bien d’un phénomène local de régulation, mais en réponse à des stimulations externes. L’aspect « down regulation » se retrouve essentiellement pour la fonction des protéines de couplage.
M. Maurice TUBIANA
Est-ce que l’hyperdensité cellulaire observée dans le cancer est d’autant plus élevée que la tumeur est moins différenciée ? Certains pensent que les nitrates dans l’eau de boisson sont dangereux en raison du risque de formation de nitrites. D’autres pensent au contraire que les nitrites sont bénéfiques car ils favorisent la formation de NO ?
Les vaisseaux tumoraux ressemblent sous nombre d’aspects aux vaisseaux recouverts d’endothélium régénéré. Nous n’avons pas étudié ce problème nous-mêmes. Personnellement je suis convaincu que l’apport normal d’arginine est suffisant dans la plupart des cas, et qu’il ne faut pas trop penser à une formation de NO autre que par la NO synthase.
M. Jean-Luc DE GENNES
Le processus de cicatrisation est normalement relativement long et passe par un état transitionnel de réaction inflammatoire in situ. Aussi serait-il important de vérifier, à plus long délai, si les modifications de l’état fonctionnel de l’endothélium peuvent être seulement transitoires. Avez-vous eu l’occasion de faire ces vérifications supplémentaires ?
Nous avons en effet comparé le comportement des cellules endothéliales régénérées après un, deux, et six mois. Il n’y avait plus d’évolution après un mois, mais la dysfonction n’était pas réversible.
** Institut de Recherches Servier, 11 rue des Moulineaux — 92150 Suresnes. Tirés-à-part : Professeur Paul M. VANHOUTTE, à l’adresse ci-dessus. Article reçu le 3 avril 2002, accepté le 6 mai 2002.
Bull. Acad. Natle Méd., 2002, 186, n° 8, 1525-1541, séance du 19 novembre 2002


