Résumé
L’horloge interne est synchronisée par des facteurs de l’environnement dont les principaux chez l’homme sont l’alternance lumière-obscurité, l’alternance veille-sommeil et la vie sociale. Une horloge qui n’est plus en phase avec l’environnement entraîne une désynchronisation de l’organisme c’est-à-dire un déplacement (en avance ou en retard) de la phase des rythmes circadiens conduisant à des signes cliniques faits de fatigue, troubles du sommeil, troubles de l’humeur … Les causes de désynchronisation de l’horloge sont liées à une inadéquation des relations entre l’horloge et les synchroniseurs, à un défaut d’entraînement de l’horloge, ou à un dysfonctionnement propre de l’horloge. Ces causes, nombreuses et de nature variée, sont retrouvées dans des situations aussi différentes que le travail posté et le travail de nuit, importante question de santé publique, les vols transméridiens sur plus de trois fuseaux horaires, les états dépressifs et d’autres maladies psychiatriques, la cécité, certains médicaments ou des drogues comme l’alcool. La mélatonine et l’exposition à la lumière, deux agents fondamentaux du contrôle de l’horloge, sont utilisés pour remettre l’horloge à l’heure. Leur utilisation dans les désynchronisations est basée sur la notion de courbe de réponse de phase (PRC) qui montre qu’en fonction de l’heure d’utilisation de ces agents on est capable d’avancer ou de retarder l’horloge des patients traités et ainsi remettre l’horloge à l’heure. Selon les indications, mélatonine et lumière sont utilisées seule ou en association et représentent à elles deux une thérapeutique majeure pour ajuster le fonctionnement de l’horloge interne.
Summary
The internal clock is synchronized by environmental factors. In humans the main factors are the light-dark alternation, the sleep-wake cycle, and social life. Rhythm desynchronization occurs when the clock is no longer in phase (harmony) with the environment, resulting in a phase shift (phase advance or phase delay) which can produce fatigue, sleep disorders and mood disorders. Clock desynchronization is related to a a loss of adaptation between the clock and synchronizers, to an inability of the clock to be entrained, or to a dysfunction of the clock itself. Shiftwork and nightwork, transmeridian flights, depressive states and other psychiatric disorders, as well as blindness, aging and intake in some medications and psychoactive agents like alcohol are among the numerous causes of rhythm desynchronization. Melatonin and light exposure are able to control and resynchronize the clock. The phase response curve (PRC) clearly demonstrates that light exposure and/or melatonin administration are able to shift (advance or delay, depending on their timing) and thereby reset the clock.
La structure temporelle des mammifères est caractérisée par des rythmes de diffé- rentes périodes : rythmes ultradiens de période inférieure à 20 heures (pulses de LH et FSH par exemple), rythmes circadiens de période égale à 24 fi 4 heures (rythmes circadiens du cortisol par exemple), et rythmes infradiens de période supérieure à 28 heures (rythmes mensuels, circannuels ou saisonniers par exemple). Ces rythmes sont sous la dépendance d’une horloge interne et d’horloges périphériques. L’horloge biologique (encore appelée pacemaker ou oscillateur circadien) actuellement la mieux connue est représentée par les noyaux suprachiasmatiques (SCN) de l’hypothalamus antérieur auxquels parviennent diverses informations, en particulier de l’environnement, et duquel sont transmis un certain nombre de signaux aux organes et cellules de l’organisme [1-3]. Le SCN contrôle de nombreux rythmes circadiens mais pas tous ce qui sous-entend que d’autres horloges existent dans l’organisme.
Un certain nombre d’entre elles ont été caractérisées dans la peau, la rétine, les glandes surrénales, le foie, le cœur, les muscles et les reins par exemple [4]. La hiérarchie de ces horloges périphériques, leur interdépendance comme leurs relations avec le SCN sont encore mal connues [5].
Le concept de base du système circadien
Le concept de base du système circadien est un axe reliant l’œil à la glande pinéale qui sécrète la mélatonine, une hormone fondamentale dans la régulation du système circadien. Les messages apportés à l’œil par la lumière et l’obscurité sont relayés par le système rétino-hypothalamique dont le SCN fait partie [6-8] (figure 1). L’ensemble du système, c’est-à-dire le fonctionnement de l’horloge, est contrôlé par des stimuli provenant de l’environnement externe que l’on appelle synchroniseurs ou encore agents donneurs de temps. Toutes les alternances de l’environnement peuvent être considérées comme des synchroniseurs, certaines plus importantes cependant que d’autres) [9]. Chez l’homme les synchroniseurs prépondérants sont les alternances de la lumière et de l’obscurité c’est-à-dire du jour et de la nuit, les alternances d’activité et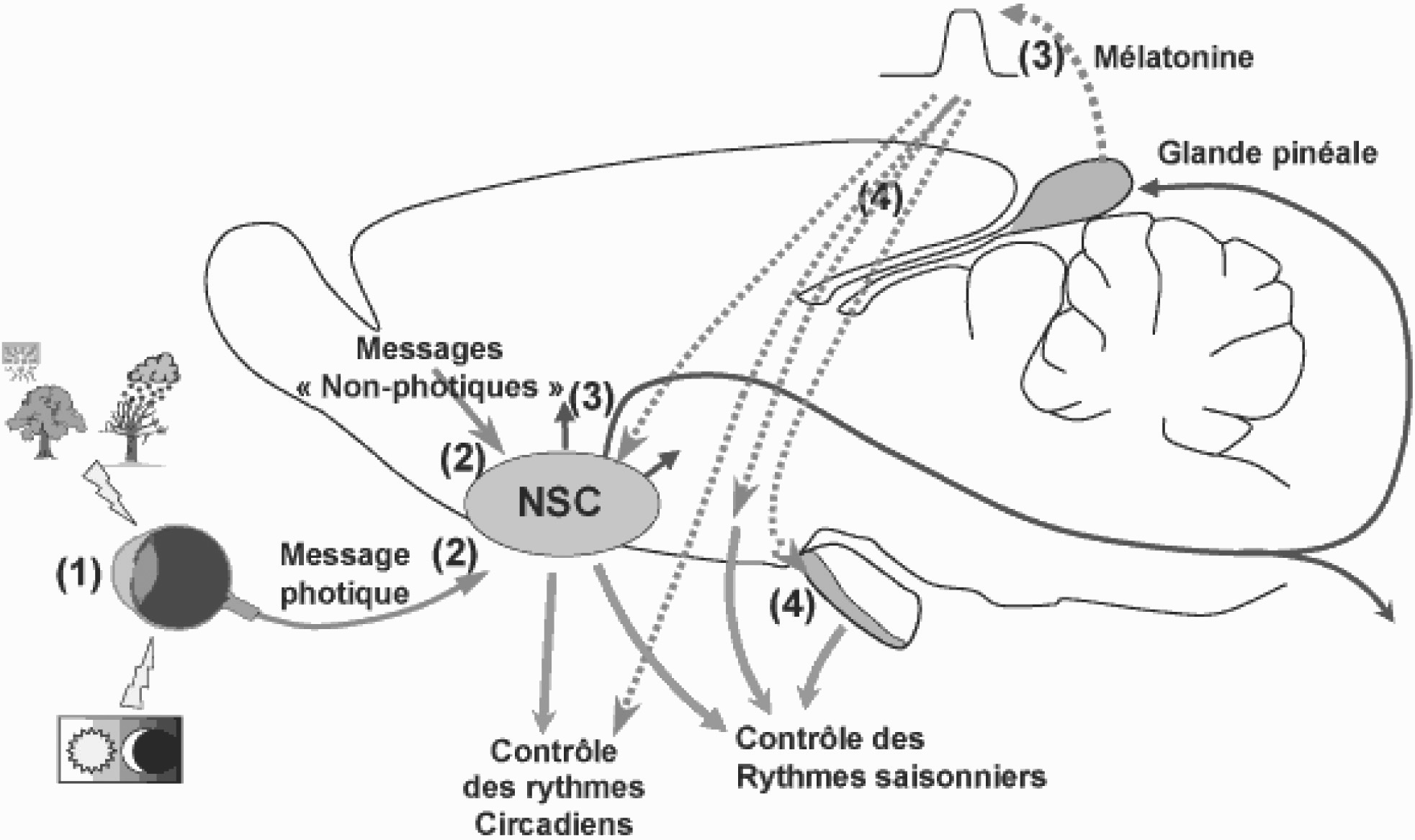
Fig. 1. — Schéma général du système circadian de repos correspondant aux périodes d’éveil et de sommeil, la vie sociale, auxquels s’ajoute l’heure des repas dans certaines conditions particulières [10]. Les facteurs saisonniers correspondant aux modifications de la température, de l’humidité et de la photopériode jouent également leur rôle dans la synchronisation des organismes [11, 12]. Certains rythmes circadiens sont plus sensibles aux facteurs exogènes que d’autres. Il en est ainsi de la pression sanguine, du diamètre bronchique, de l’hormone de croissance (GH), de la prolactine car, selon la variable, le niveau peut être modifié par les activités physiques et mentales (pression sanguine, diamètre bronchique) ou pendant le sommeil (GH, prolactine). En revanche le rythme circadien de la mélatonine (lorsque le niveau de lumière est contrôlé) et du cortisol plasmatiques dépendent peu des facteurs exogènes, ils ont une composante endogène forte ce qui en fait des marqueurs majeurs de la synchronisation circadienne d’un organisme.
Les synchroniseurs contrôlent les rythmes circadiens mais ne les créent pas. Ils entraînent (calibrent) sur 24 heures les rythmes circadiens dont la période naturelle est de 25 heures. Ces données ont pu être établies dans des expériences dites hors du temps dans lesquelles des spéléologues volontaires ont été abstraits des signaux de l’environnement dans des grottes dans lesquelles aucune des alternances décrites ci-dessus n’existe ou encore dans des laboratoires spécialement aménagés, véritables bunkers aménagés pour réaliser un total isolement de l’extérieur. L’ensemble des rythmes circadiens persistent dans ces conditions constantes des facteurs environnementaux, avec une modification de la période du rythme qui est dit alors en libre cours (free run des anglo-saxons) et que l’on retrouve également chez les personnes atteintes de cécité [13, 14]. Ces expériences d’isolement comme les travaux plus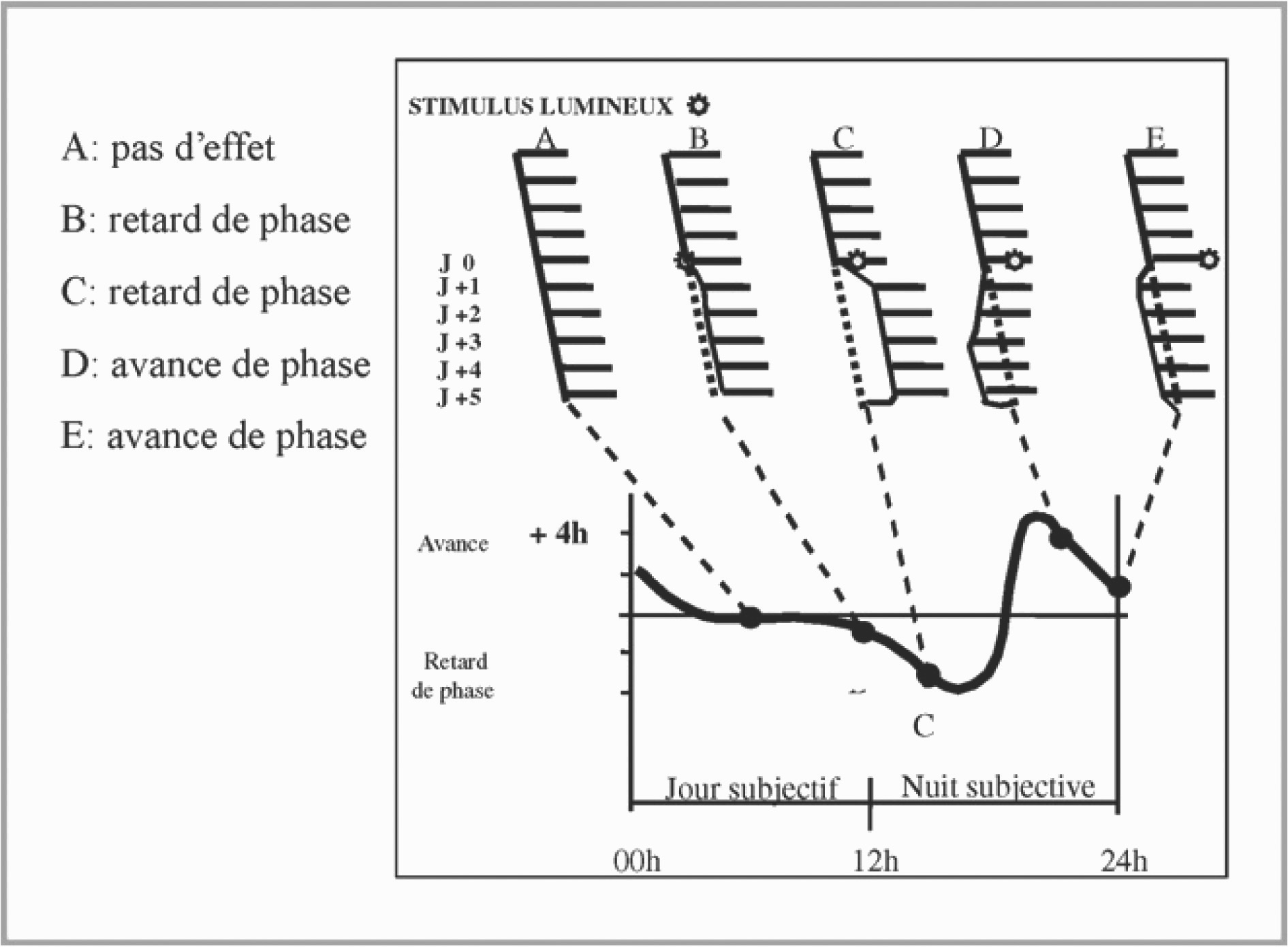 récents de génétique mettant en évidence les gènes d’horloge [15], soulignent que les rythmes circadiens sont de nature endogène et sont contrôlés par les facteurs de l’environnement. Schématiquement les facteurs de transcription Clock et bmal1 activent l’expression des gènes Period (Per1 et Per2) et Cryptochrome (Cry1 et
récents de génétique mettant en évidence les gènes d’horloge [15], soulignent que les rythmes circadiens sont de nature endogène et sont contrôlés par les facteurs de l’environnement. Schématiquement les facteurs de transcription Clock et bmal1 activent l’expression des gènes Period (Per1 et Per2) et Cryptochrome (Cry1 et
Cry2) [16]. Quelque heures plus tard dans le nycthémère le produit de ces gènes, les protéines clock et cry, ont un rétrocontrôle négatif sur leur propre expression en réprimant l’activité transcriptionnelle de clock/bmal1 [17].
La réponse de l’horloge aux synchroniseurs : la courbe de réponse de phase (PRC)
Les notions exposées ci-dessus sont fondamentales car elles ont permis de montrer expérimentalement que les rythmes circadiens endogènes sont eux-mêmes soumis à des rythmes de sensibilité et de réponse aux synchroniseurs dont la courbe de réponse de phase (PRC) est l’application immédiate [18]. En effet, selon l’heure à laquelle un stimulus (par exemple la lumière ou la mélatonine) est appliqué celui-ci peut entraîner une avance de phase correspondant à un déplacement du pic (ou acrophase) de la fonction étudiée en avance par rapport au rythme habituel, ou en retardant sa phase correspondant à un déplacement du pic à une heure plus tardive par rapport au rythme habituel, ou encore ne produire aucun effet (Figure 2).
Fig. 2. — Courbe de réponse de phase (PRC) de l’activité motrice de rongeurs exposés à la lumière, à différentes heures. La réponse est totalement différente selon l’heure d’exposition (2).
On comprend que l’intérêt immédiat de la notion de PRC est sa mise en application dans les troubles du système circadien comme les troubles du sommeil avec avance ou retard de phase. Il s’agira d’administrer dans ces cas le stimulus à l’heure adéquate afin de contrecarrer le déplacement de phase à traiter.
Les causes de désynchronisation du système circadien
Un organisme est dit synchronisé lorsque son horloge biologique fonctionne en harmonie (c’est-à-dire en résonance) avec les facteurs de l’environnement.
Lorsqu’au contraire l’horloge biologique n’est plus en phase avec les signaux extérieurs majeurs il en résulte un dysfonctionnement qui conduit à la désynchronisation du système circadien de l’organisme. Ce dysfonctionnement est lié au fait que les synchroniseurs qui normalement entraînent les rythmes circadiens sur 24 heures ne jouent plus leur rôle. Il y a alors dissociation temporelle du fonctionnement de l’horloge interne de celui de l’horloge astronomique (notre montre). Cette désynchronisation s’accompagne de signes atypiques tels que fatigue persistante, troubles de l’humeur pouvant conduire en cas de désynchronisation chronique à une dépression, troubles du sommeil pouvant amener à une insomnie chronique, troubles de l’appétit, diminution des performances et de la vigilance avec augmentation des risques d’accidents au travail ou lors de la conduite automobile [9].
Les causes de désynchronisation de l’horloge interne peuvent être en rapport soit avec une inadéquation des relations entre l’horloge et les synchroniseurs, soit avec un défaut d’entraînement de l’horloge, soit avec un dysfonctionnement propre de l’horloge (figure 3).
Ces causes sont donc nombreuses et de nature variée ; elles peuvent être liées :
— à des synchroniseurs en conflit avec l’horloge : décalages horaires liés à des vols transméridiens, travail posté, travail de nuit.
La désynchronisation lors des vols transméridiens (jet lag des Anglo-Saxons) s’observe lorsque au moins trois fuseaux horaires sont traversés. Le type de désynchronisation observée après un vol transméridien dépend du sens du vol. Les vols vers l’Est, qui sont plus difficiles à supporter, correspondent à une avance de phase de l’horloge interne par rapport à l’heure de destination. Les vols vers l’Ouest sont plus faciles car ils correspondent à un retard de phase pour lequel l’ajustement temporel est plus aisé. Le temps et la vitesse d’ajustement au nouvel horaire varient d’un sujet à l’autre, semblent plus rapide chez le sujet jeune, et sont différents d’une variable à l’autre (ainsi le rythme veille-sommeil est recalé en environ deux à trois jours alors que celui du cortisol l’est en trois semaines) [19, 20].
Le travail posté est une situation chronique, contrairement au jet lag, de conflit entre l’horloge et les synchroniseurs environnementaux et sociaux. Dans le travail posté l’inversion ou les modifications importante de la vie sociale entraîne des troubles de l’organisme connus sous le terme d’intolérance au travail posté. Il s’agit d’un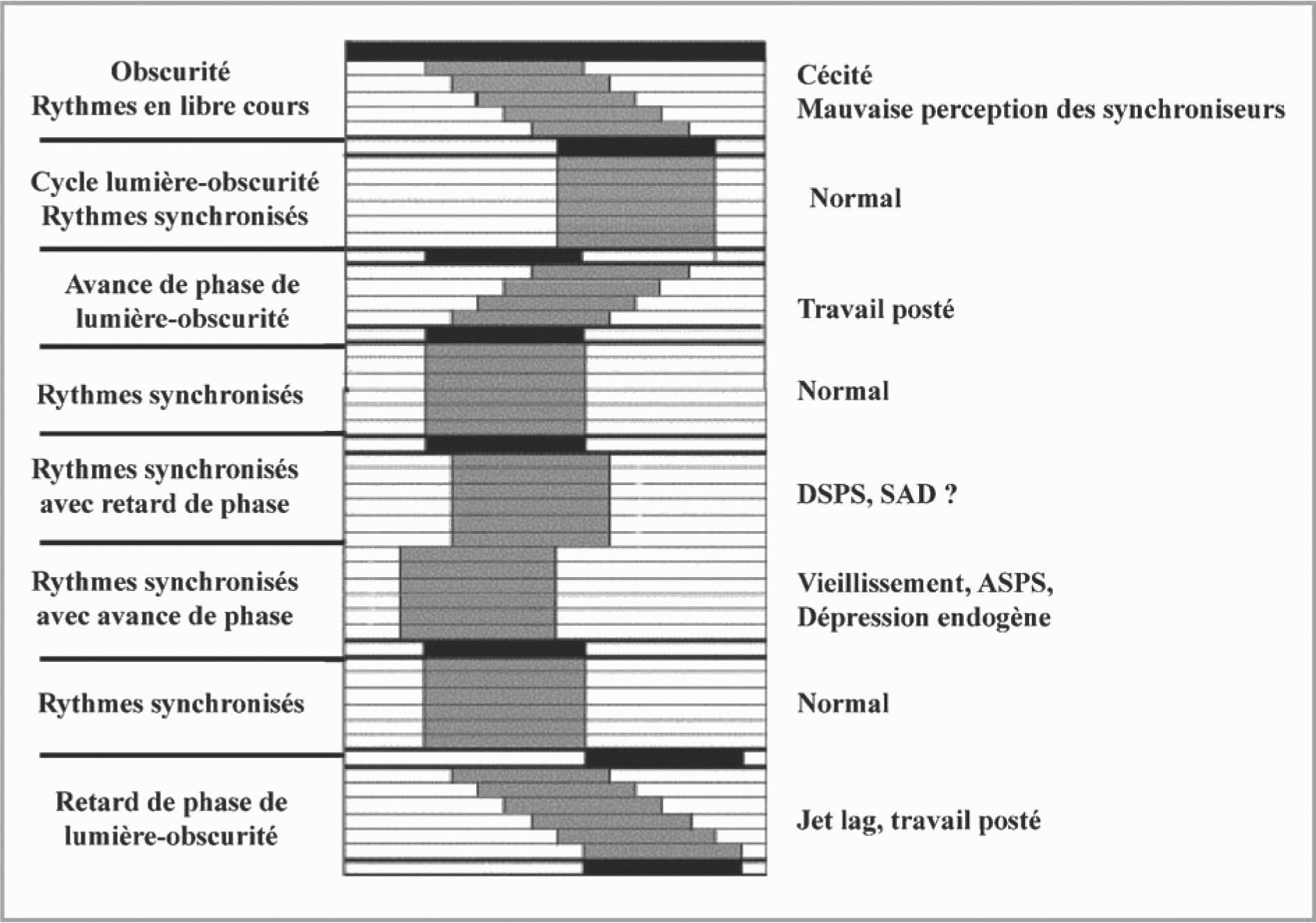
Fig. 3. — Avance ou retard de phase observées chez l’homme dans différentes situations de désynchronisation.
véritable problème de santé publique en raison de la dette de sommeil qui peut entraîner des risques d’accidents au travail et lors de la conduite automobile [21- 25].
Sur le long terme la question se pose des risques cardio-vasculaires et des risques de cancer dans les désynchronisations chroniques observées dans le travail posté ou le travail de nuit [26-32] — à des synchroniseurs inefficaces car non utilisés par l’organisme : absence de contacts sociaux, diminution de l’activité physique, faible exposition à la lumière, observée en particulier lors du vieillissement [33-39] ou dans les maladies psychiatriques [40-43].
— à des synchroniseurs qui ne sont pas ou qui sont mal perçus : cécité, cataracte, dégénération rétinienne [13, 14, 44].
— à un défaut d’entraînement de l’horloge interne retrouvé dans les désordres circadiens du sommeil dont la caractéristique est un décalage du cycle veille sommeil par rapport au système circadien de l’individu ou par rapport à l’environnement alors que les mécanismes du sommeil ne sont pas du tout altérés. C’est la raison pour laquelle ces troubles répondent mal aux hypnotiques qui interviennent sur le sommeil lui-même. Le traitement de ces désordres fait appel à des molécules capables de resynchroniser l’horloge interne en agissant sur la phase du cycle veille sommeil, appelées chronobiotiques pour cette raison [45].
Ce défaut d’entraînement de l’horloge se retrouve dans les troubles circadiens du sommeil.
• Le syndrome de retard de phase du sommeil est caractérisé par un cycle veillesommeil retardé de trois à six heures [46, 47]. La dette de sommeil qui en résulte est très handicapante pour la vie active et la vie sociale. Il débute à l’adolescence, sa prévalence est importante dans certaines maladies psychiatriques [48] et il faut souligner sa fréquence chez les adolescents dont la tendance est, pour des raisons diverses, de se coucher de plus en plus tard ce qu’atteste le nombre croissant de publications scientifiques récentes sur ce sujet [49-56] comme les recommandations du rapport de l’Académie nationale de médecine [57]. Le désordre est d’origine familiale chez environ 40 % des patients et une mutation du gène de l’horloge (P er, Clock, Tim ) a été décrite.
•
Le syndrome d’avance de phase du sommeil est caractérisée par un début du sommeil et un réveil précoces entraînant une somnolence diurne s’observe essentiellement chez les sujets âgés [33]. Des formes familiales ont été décrites avec une mutation dominante du gène Per2 sur le chromosome 2q .
•
Le syndrome hypernycthéméral ou syndrome en libre cours est un trouble rare, observé dans la cécité, caractérisé par l’inefficacité des synchroniseurs de l’environnement à recaler sur 24 heures l’horloge interne dont la période naturelle est de 25 heures ce qui entraîne un décalage des horaires du sommeil d’une à deux heures tous les jours [13, 14].
• Le rythme irrégulier veille-sommeil s’observe chez les patients présentant des lésions dégénératives (maladie d’Alzheimer…), traumatiques, vasculaires ou tumorales de la région suprachiasmatique. Il s’agit d’une désorganisation totale du rythme veille sommeil et le patient ne peut pas trouver des horaires fixes de sommeil [47, 58]. La resynchronisation de ces patients est particulièrement difficile.
• Le syndrome de Smith-Magenis , rapporté à une délétion du chromosome 17 p. 11.
2, correspond à un retard mental sévère associée à des troubles du comportement et à un sommeil très perturbé [59-61]. Sa caractéristique biologique est l’inversion du rythme circadien de la mélatonine avec un pic le matin favorisant la somnolence diurne des patients [62].
— à un dysfonctionnement propre du mécanisme de l’horloge tel qu’il est observé dans les états dépressifs. Ceux-ci sont caractérisés par une importante perturbation du sommeil et par la variabilité d’un jour à l’autre des rythmes circadiens avec une amplitude basse et une avance ou un retard de phase [41-43,45]. Les troubles des rythmes paraissent liés à une instabilité de la structure circadienne, variable d’un jour à l’autre, entraînant une désorganisation du système dans lequel chaque rythme circadien évolue avec sa propre période. Il y a ainsi rupture entre l’horloge et l’environnement, défaut qui pourrait être génétiquement déterminé, et qui est favorisé par l’âge, les médicaments et toxiques désynchronisants, la lumière artificielle, les changements des rythmes sociaux.
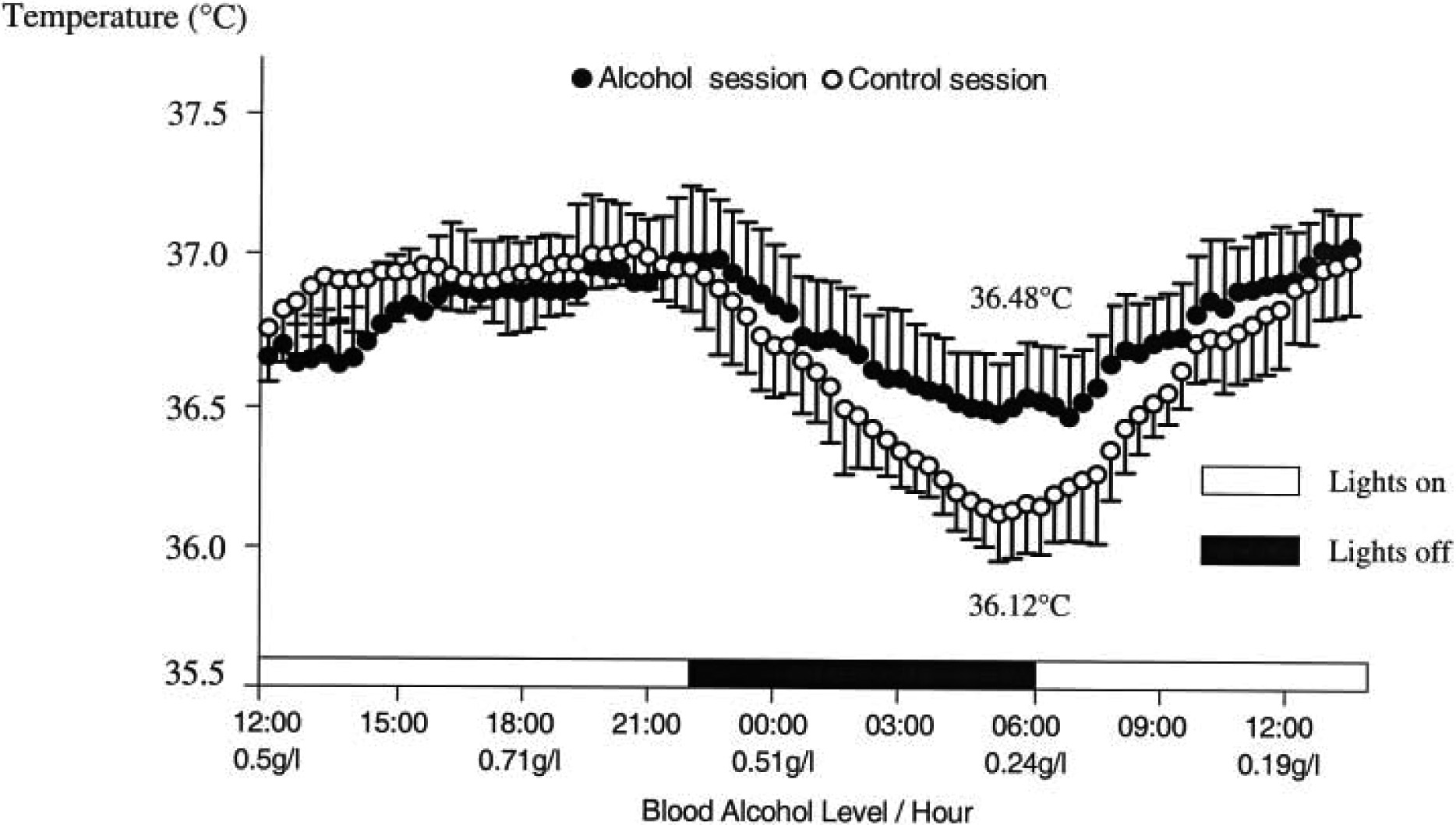 — à des drogues comme l’alcool (figure 4) pour lequel ont été retrouvés un effet hypothermique pendant le jour et un effet hyperthermique la nuit entraînant une diminution de moitié de l’amplitude du rythme circadien de la température pouvant expliquer, au moins en partie, les désordres de l’humeur et du sommeil observés chez les patients alcooliques [63]. L’alcool est un agent de désynchronisation qui entraîne également un retard de phase du rythme circadien de la mélatonine chez les patients alcoolo-dépendants [64], non retrouvé chez des volontaires sains dans un protocole d’alcoolisation [65]. L’altération circadienne des hormones stéroïdiennes et peptidiques a été également décrite lors de l’absorption d’alcool [66-68].
— à des drogues comme l’alcool (figure 4) pour lequel ont été retrouvés un effet hypothermique pendant le jour et un effet hyperthermique la nuit entraînant une diminution de moitié de l’amplitude du rythme circadien de la température pouvant expliquer, au moins en partie, les désordres de l’humeur et du sommeil observés chez les patients alcooliques [63]. L’alcool est un agent de désynchronisation qui entraîne également un retard de phase du rythme circadien de la mélatonine chez les patients alcoolo-dépendants [64], non retrouvé chez des volontaires sains dans un protocole d’alcoolisation [65]. L’altération circadienne des hormones stéroïdiennes et peptidiques a été également décrite lors de l’absorption d’alcool [66-68].
Fig. 4. — Profil circadian de la température corporelle chez des volontaires sains explorés avant et après prise d’alcool (63).
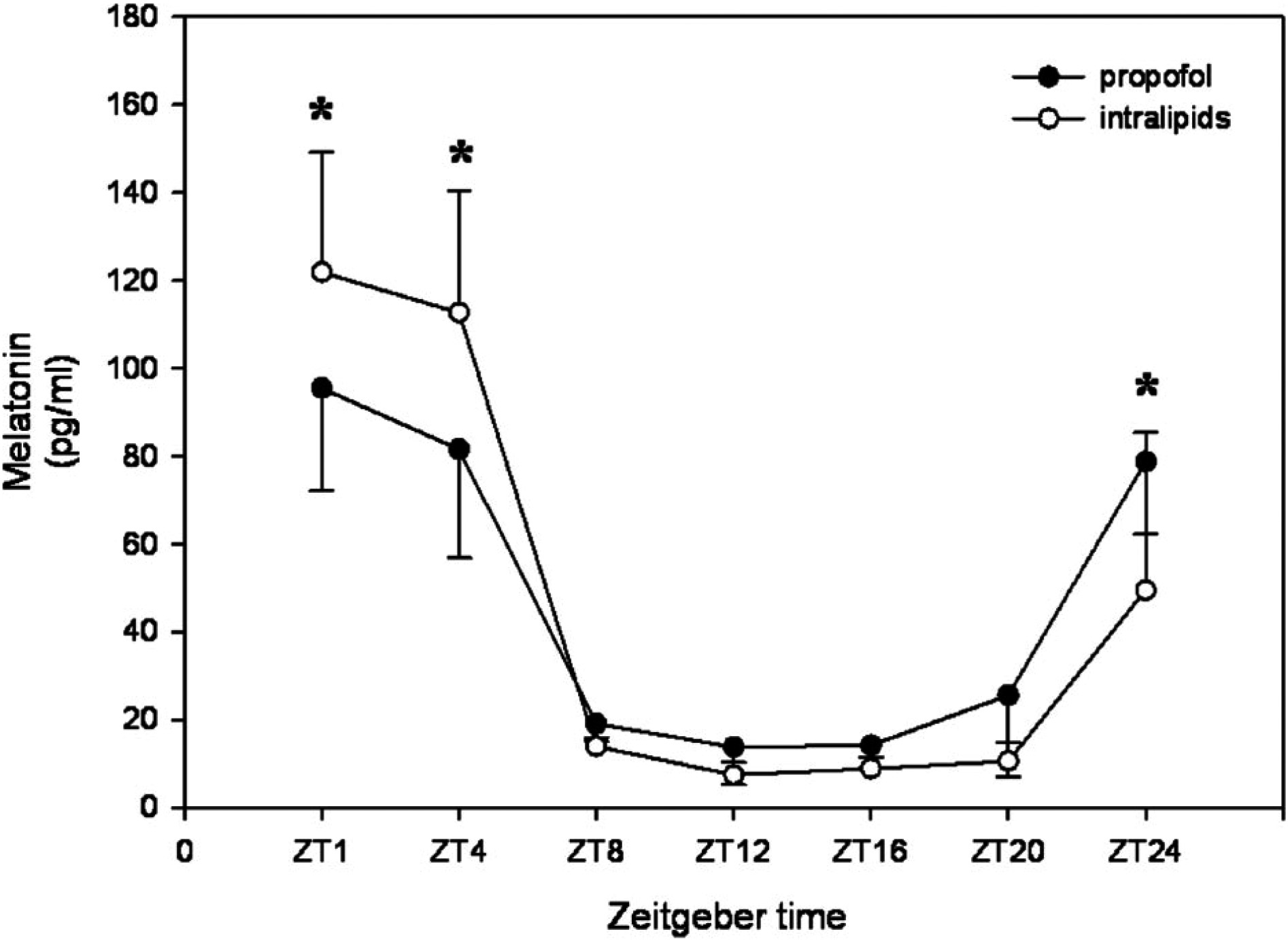
— à des médicaments comme le propofol (figure 5), un anesthésique général, pour lequel a été montré chez le rat et chez l’homme après colonoscopie, l’effet désynchronisant sur les rythmes circadiens de la température, du cycle veillesommeil et de la mélatonine [69-72], ces perturbations étant encore observées de 48 à 72 heures après l’anesthésie, entraînant un risque sous-estimé d’accidents au travail et d’accidents routiers en raison d’une vigilance amoindrie [73].
Les marqueurs du système circadien
La mise en évidence d’un trouble circadien nécessite l’utilisation de marqueurs de la structure circadienne dont le choix dépend du trouble recherché. Un rythme marqueur est le rythme d’une variable qui présente un rythme circadien d’amplitude importante, très reproductible et fiable, dont la modification signe une perturbation du fonctionnement de l’horloge interne [74].
Fig. 5. — Effets d’une anesthésie au propofol (contrôle=intralipids) sur la sécrétion de mélatonine chez le rat à différents stades circadiens (ZT) de l’animal. * Différences significatives (p<0,05) (71) Les marqueurs circadiens ont deux principales origines :
— soit « physiques » avec pour l’essentiel la mesure de l’activité motrice par actimètrie, ou l’établissement d’un agenda du sommeil, ou éventuellement la polysomnographie ;
— soit biologiques avec l’étude des rythmes circadiens de la mélatonine et du cortisol plasmatique ou salivaire, et du rythme circadien de la température corporelle.
Le choix d’un rythme marqueur dépend naturellement des buts de la recherche : par exemple et de façon non exhaustive, on utilise comme marqueurs circadiens le rythme des leucocytes, du cortisol et de l’activité motrice en cancérologie [75, 76], le rythme de la température corporelle, du rythme cardiaque ou de la pression arté- rielle, entre autres rythmes, dans les recherches sur les activités physiques et sportives [77-79], le rythme de la mélatonine et du cortisol dans les recherches sur le travail posté et le travail de nuit [80, 81].
Le traitement des désordres circadiens par chronothérapie
L’objectif du traitement des désordres circadiens est de remettre à l’heure une horloge interne qui est désynchronisée, en avance ou en retard de phase. La réalisa- tion de cette remise à l’heure se fait en entraînant l’horloge biologique grâce à des protocoles de chronothérapie ou par l’utilisation d’agents d’entraînement comme la lumière et la mélatonine [82].
La chronothérapie des désordres circadiens correspond à une remise à l’heure de l’horloge dans les trouble circadiens du sommeil avec avance ou retard de phase en déplaçant l’heure du coucher des patients. Dans les deux cas le traitement se fait exclusivement en milieu hospitalier et nécessite une compliance sans faille des patients. Bien qu’efficace, ce type de traitement est surtout intéressant pour son intérêt théorique et dogmatique car il reste très difficile à mettre en œuvre.
Dans le syndrome de retard de phase du sommeil l’heure du coucher est retard ée de trois heures tous les jours en conservant une durée de sommeil fixe avec l’interdiction des siestes, ce qui entraîne un allongement de la période du cycle veille sommeil. Le patient retrouve un cycle normal en sept jours (trois heures de moins que l’heure initiale du coucher). Les horaires doivent alors être maintenus strictement par la suite.
Dans le syndrome d’avance de phase du sommeil l’heure de coucher est avancée de trois heures tous les jours ce qui entraîne un raccourcissement de la période du cycle veille-sommeil. Le patient retrouve un cycle normal en sept jours. Le syndrome d’avance de phase est beaucoup plus difficile à traiter par chronothérapie que le syndrome de retard de phase.
Outre la chronothérapie, le traitement des troubles de l’horloge peut faire appel sous certaines conditions à la mélatonine et à la lumière, deux agents de synchronisation capables d’entraîner l’horloge lorsque l’heure d’exposition pour la lumière ou l’heure d’administration pour la mélatonine sont convenablement choisies en fonction de leurs courbes de réponse de phase (PRC). A ces deux agents majeurs de resynchronisation, d’autres synchroniseurs comme l’activité physique, les synchroniseurs sociaux, les horaires des repas peuvent aider à la remise à l’heure de l’horloge.
Le traitement des troubles de l’horloge par la mélatonine
La mélatonine (N-acétyl 5-méthoxytryptamine), principale hormone de la glande pinéale est synthétisée selon un rythme circadien très marqué, de forte amplitude, généré par les noyaux suprachiasmatiques de l’hypothalamus. Elle est également synthétisée dans d’autres tissus comme la rétine, le tractus gastro-intestinal, les lymphocytes… La caractéristique du rythme circadien de la mélatonine est son importante sécrétion nocturne tandis que les taux diurnes sont très bas. La sécrétion de mélatonine qui diminue de moitié avec le vieillissement, selon un ou des mécanismes encore mal compris [83-85], peut rendre compte, au moins en partie, des troubles du sommeil chez le sujet âgé.
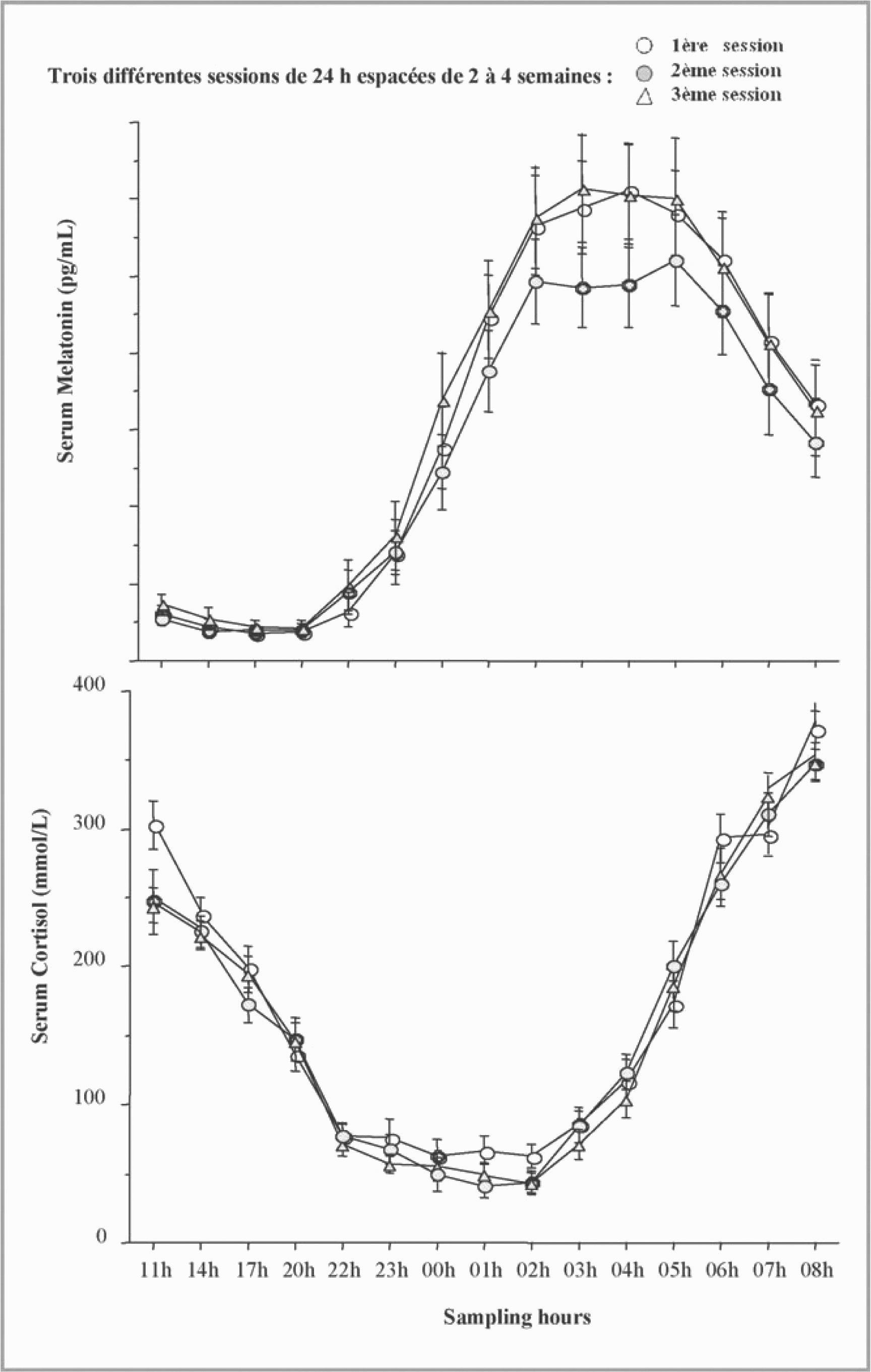
Sa sécrétion est altérée (déplacement de phase et/ou diminution de l’amplitude et/ou modification de sa concentration plasmatique) dans les dysfonctionnements de l’horloge biologique ce qui en fait, avec la température corporelle et le cortisol plasmatique ou salivaire, un rythme marqueur de la désynchronisation de l’horloge [74] (figure 6).
Fig. 6. — Reproductibilité du rythme circadian de la mélatonine et du cortisol plasmatiques chez 31 sujets étudiés à 3 reprises espacées de 2 à 4 semaines (74).
La mélatonine est l’agent donneur de temps de notre organisme auquel elle apporte la notion du jour et de la nuit. Le rythme circadien de la mélatonine est entraîné par l’alternance lumière obscurité. La lumière est le principal facteur de l’environnement agissant sur la sécrétion de mélatonine en la freinant, chez l’homme comme chez l’animal [86]. Une illumination nocturne aussi brève qu’un flash de quelques secondes abaisse le taux de mélatonine chez l’animal de laboratoire. La lumière freine la sécrétion de l’hormone par la glande pinéale en bloquant le tractus rétino-hypothalamique et ainsi la fonction, elle aussi bloquée, des récepteurs bêtaadrénergiques présents sur les pinéalocytes conduisant à la libération de norépinephrine à l’origine de la cascade de réactions permettant activation et synthèse des enzymes clés de l’hormone.
Comme la mélatonine intervient sur le sommeil en agissant sur l’horloge, ce qui n’est pas le cas des hypnotiques, elle est considérée comme un chronobiotique, terme attribué à toute molécule capable d’agir sur l’horloge biologique soit directement, soit indirectement sur d’autres systèmes susceptibles de modifier les signaux adressés à l’horloge comme les systèmes de couplage des rythmes, les horloges périphériques ou le contrôle des systèmes circadiens entre eux [45].
L’administration de mélatonine réduit le temps de latence à l’endormissement, augmente la qualité et la durée du sommeil sans altérer son architecture [87]. Elle agit sur le sommeil en diminuant la température corporelle, ce qui favorise l’endormissement, selon un processus thermorégulateur. L’effet de la mélatonine sur le sommeil semble être la conséquence d’un double mécanisme : l’augmentation de la propension au sommeil par augmentation de l’amplitude des oscillations de l’horloge via les récepteurs MT1 et la synchronisation de l’horloge via les récepteurs MT2 [88].
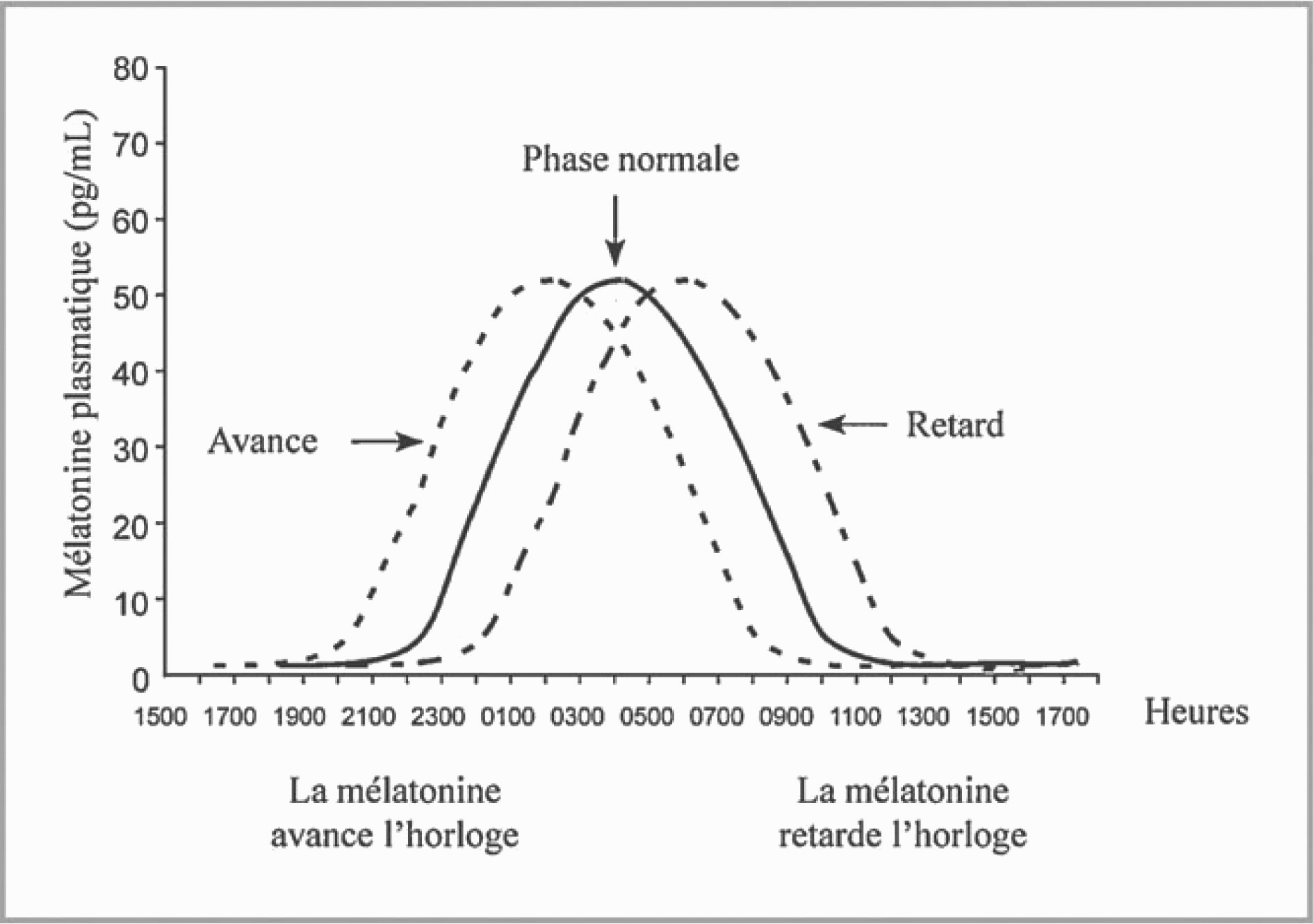
Sa courbe de réponse de phase est inverse de celle de la lumière : l’administration de mélatonine le matin retarde la phase des rythmes circadiens alors que son administration en fin d’après-midi avance leur phase [89] (figure 7). L’ensemble de ces études expérimentales ont conduit à des protocoles de traitement utilisant la mélatonine :
— dans les troubles du sommeil avec retard de phase [18, 46, 47] ;
— dans le syndrome hypernycthéméral observé dans la cécité qui correspond à un sommeil en libre cours retrouvé en particulier chez l’aveugle [13, 14, 44, 47, 58] ;
— dans le trouble bipolaire où ont été décrits une diminution de la sécrétion nocturne de mélatonine, un allongement de la période, une avance de phase des marqueurs circadiens, mélatonine, cortisol et température (90) ;
— dans la maladie d’Alzheimer avec comme but l’amélioration de la vigilance des patients [47, 58] ;
— dans les perturbations liées à un vol transméridien sur plus de trois fuseaux horaires avec une amélioration des troubles liés au décalage horaire chez 70 à 80 % des sujets comme cela ressort d’une étude Cochrane [91, 92].
Les doses administrées sont très différentes d’un protocole à l’autre allant de 0.5 à 10 mg, sans preuve expérimentale que les doses les plus élevées soient plus efficaces.
Fig. 7. — La mélatonine est un chronobiotique : selon l’heure de son administration elle avance ou retarde la phase circadienne, propriété mise en application dans le traitement des désordres circadiens.
La mélatonine est actuellement sur le marché pharmaceutique en France. Le Circadin®, qui contient 2 mg de mélatonine retard, a été agréé en 2011 par les autorités sanitaires avec des indications restreintes aux troubles veille-sommeil, chez l’enfant de plus de six ans, associés à une maladie neurogénétique, (syndrome de Smith-Magenis, syndrome d’Angelman…). Il est également proposé par les autorités de santé dans le traitement à court terme de l’insomnie primaire caractérisée par un sommeil de mauvaise qualité chez des patients de cinquante-cinq ans ou plus.
Le traitement des troubles de l’horloge par la lumière
La lumière est le synchroniseur majeur de l’organisme d’entraînement de l’horloge interne. Chez les mammifères, la synchronisation de l’horloge biologique par la photopériode commence très tôt, dès la vie fœtale, en relation avec la sécrétion de la mélatonine maternelle [93].
La lumière intervient sur les rythmes circadiens de deux manières : d’une part l’exposition à la lumière diminue considérablement la sécrétion de mélatonine, l’hormone qui participe au contrôle du système circadien, d’autre part et selon l’heure de cette exposition elle entraîne l’horloge interne ce qui en fait un élément fondamental du traitement des troubles du système circadien avec avance ou retard de phase. La luminothérapie fait appel, comme la mélatonine, à la notion de courbe de réponse de phase de la lumière qui permet de montrer que selon l’heure d’exposition des patients les effets obtenus sont fondamentalement différents. En effet, la lumière avance la phase des rythmes circadiens lorsque l’exposition a lieu le matin, elle la retarde lorsque l’exposition a lieu en soirée.
L’effet de la lumière dépend de ses caractéristiques (intensité, durée d’exposition, spectre). Il est maintenant formellement établi que l’horloge interne est plus sensible à la portion bleue du spectre lumineux c’est-à-dire aux courtes longueurs d’onde (entre 450 et 483 nm) qu’à toute autre longueur d’onde [94-99]. Ainsi, une lumière bleue de 8 lux est capable de produire une avance de phase similaire à celle obtenue avec une lumière blanche de 12 000 lux [96]. Le signal photique qui arrive au niveau du SCN est traité par des cellules ganglionnaires rétiniennes [100] possédant un photopigment, la mélanopsine, sensible aux courtes longueur d’ondes, ce qui explique l’efficacité du spectre bleu de la lumière aussi bien sur le déplacement de phase du rythme que sur la diminution de sécrétion de mélatonine chez les sujets exposés.
Outre la dépression saisonnière, le Comité Chronothérapeutique de la Société Internationale pour les Troubles Affectifs Saisonniers (ISAD) recommande le traitement des dépressions majeures par la lumière [40, 90]. Chez les patients unipolaires elle peut aussi être utilisée en complément des traitements conventionnels, l’exposition des patients à la lumière potentialisant les effets du traitement (in 40). L’exposition à la lumière blanche se fait le matin pendant 30 à 60 minutes, selon les possibilités du patient, grâce à un système pouvant délivrer 5 000 à 10 000 lux. Ce traitement doit être assorti d’une consultation préalable en ophtalmologie, surtout chez les personnes âgées, pour éviter tout dommage rétinien. Les traitements entraînant une photosensibilisation de la peau et du tissu rétinien comme l’amiodarone, les antimalariques, les psoralènes etc. contrindiquent l’usage de la lumière comme antidépresseur.
Une autre application chronobiologique est non pas l’utilisation de la lumière mais au contraire son blocage pour allonger la période d’obscurité car ce type de protocole avait donné des résultats favorables chez des patients dépressifs résistant au traitement conventionnel [101]. En partant du paradigme que le pic nocturne de la mélatonine, dont la sécrétion est bloquée par la lumière, est utile au sommeil car elle augmente la propension au sommeil et que la lumière bleue diminue la sécrétion de l’hormone, filtrer cette lumière bleue par des verres optiques appropriés, conduisant à une situation d’obscurité artificielle, devrait entraîner une amélioration des troubles du sommeil, de la vigilance et des performances chez les patients porteurs de ce type de lunettes. Des travaux préliminaires récents sont très prometteurs à cet égard dans le travail posté de nuit [102-104] et chez le sujet âgé [105, 106].
CONCLUSION
La désynchronisation d’un organisme est le reflet de la dissociation entre le temps astronomique (notre montre) et l’horloge interne. Elle est mise en évidence en établissant le profil circadien du patient grâce à l’utilisation de marqueurs du système circadien (température corporelle, profils circadiens du cortisol et de la mélatonine plasmatiques…) qui permettent de préciser le sens de la désynchronisation par avance ou retard et ainsi l’utilisation d’agents de resynchronisation de l’horloge dont les plus utilisés actuellement sont la lumière et la mélatonine.
BIBLIOGRAPHIE [1] Bartness T.J., Song C.K., Demas G.E. — SCN efferents to peripheral tissues : Implications for biological rhythms. J. Biol. Rhythms , 2001, 16 , 196-204.
[2] Mrosovsky N. — Beyond the suprachiasmatic nucleus.
Chronobiol.Int. , 2003, 20 , 1-8.
[3] Okamura H. — Suprachiasmatic nucleus clock time in the mammalian circadian system.
Cold
Spring Harb Symp Quant Biol . 2007, 72 , 551-556.
[4] Leibetseder V., Humpeler S., Svoboda M., Schmid D., Thalhammer T., Zuckermann A., Marktl W., Ekmekcioglu C. — Clock genes Display Rhythmic Expression in Human Hearts.
Chronobiol Int ., 2009, 26 , 621-636.
[5] Karakas A., Gündüz B. — Suprachiasmatic Nuclei May Regulate the Rhythm of Leptin Hormone Release in Syrian Hamsters ( Mesocricetus Auratus ). Chronobiol. Int ., 2006 , 23 , 225-236.
[6] Abrahamson E.E., Moore R.Y. — Lesions of suprachiasmatic nucleus efferents selectively affect rest-activity rhythm. Mol. Cell. Endocrinol. , 2006, 252 , 46-56.
[7] Moga M.M., Weis R.P., Moore R.Y. — Efferent projections of the paraventricular thalamic nucleus in the rat. J. Comp. Neurol. , 1995, 359 , 221-238.
[8] Leak R.K., Moore R.Y. — Topographic organization of suprachiasmatic nucleus projection neurons. J. Comp. Neurol., 2001, 433 , 12-34.
[9] Touitou Y., Haus E (Eds). — Biological rhythms in clinical and laboratory medicine.
Springer,
Berlin, 1992.
[10] Bogdan A., Bouchareb B., Touitou Y. — Ramadan fasting alters endocrine and neuroendocrine circadian patterns. Meal-time as a synchronizer in humans ? Life Sci., 2001, 68 , 1607-1615.
[11] Touitou Y., Sulon J., Bogdan A., Reinberg A., Sodoyez J.C., Demey-Ponsart E. — Adrenocortical hormones ageing and mental condition : seasonal and circadian rhythms of plasma 18-hydroxy-11-deoxycorticosterone, total and free cortisol and urinary corticosteroid.
J. Endocrinol ., 1983, 96 , 53-64.
[12] Touitou Y., Bogdan A., Haus E., Touitou C. — Modifications of circadian and circannual rhythms with aging. Exp. Gerontol ., 1997, 32, 603-614.
[13] Lewy A.J., Bauer V.K., Hasler B.P., Kendall A.R., Pires M.L., Sack R.L. — Capturing the circadian rhythms of free-running blind people with 0.5 mg melatonin. Brain Res., 2001, 918 , 96-100.
[14] Lockley S.W., Dijk D.J., Kosti O., Skene D.J., Arendt J. — Alertness, mood and performance rhythm disturbances associated with circadian sleep disorders in the blind. J. Sleep Res., 2008, 17 , 207-216.
[15] Ogı´nda Ka H., Podorski J., Ogin´ski A. — Gender, ageing, and shiftwork intolerance.
Ergonomics, 1993, 36 , 161-168.
[16] Gekakis N., Staknis D., Nguyen H.B., Davis F.C., Wilsbacher L.D., King D.P., Takahashi J.S., Weitz C.J. — Role of the CLOCK protein in the mammalian circadian mechanism.
Science, 1998, 280 , 1564-1569.
[17] Sato T.K., Yamada R.G., Ukai H., Baggs J.E., Miraglia L.J., Kobayashi T.J., Welsh D.K., Kay S.A., Ueda H.R., Hogenesch J.B. — Feedback repression is required for mammalian circadian clock function. Nat. Genet., 2006, 38 , 312-319.
[18] Touitou Y., Arendt J., Pevet P. — Melatonin and the Pineal Gland.
From Basic Science to
Clinical Application (Elsevier Science Publishers, Edit.), 1 volume, 1993.
[19] Arendt J. — Managing jet lag : Some of the problems and possible new solutions.
Sleep Med
Rev ., 2009, 1 , 249-56.
[20] Ashkenazi I.E., Reinberg A.E., Motohashi Y. — Interindividual differences in the flexibility of human temporal organization : pertinence to jet lag and shiftwork. Chronobiol. Int., 1997, 14 , 99-113.
[21] A Í kerstedt T., Nordin M., Alfredsson L., Westerholm P., Kecklund G. — Sleep and sle epiness : impact of entering or leaving shiftwork — a prospective study. Chronobiol. Int ., 2010, 27 , 987-996.
[22] Lombardi D.A., Folkard S., Willetts J.L., Smith G.S. — Daily sleep, weekly working hours, and risk of work-related injury : us national health interview survey (2004-2008). Chronobiol.
Int ., 2010, 27 , 1013-1030.
[23] Driesen K., Jansen N.W.H., Kant I., Mohren D.C.L., Van Amelsvoort L.G.P.M. — Depressed mood in the working population : associations with work schedules and working hours. Chronobiol. Int ., 2010, 27 , 1062-1079.
[24] Wirtz A., Nachreiner F. — The effects of extended working hours on health and social well being : a comparative analysis of four independent samples. Chronobiol. Int ., 2010, 27 , 1124- 1134.
[25] Ogin´ska H., Pokorski J., Ogin´ski A. — Gender, ageing, and shiftwork intolerance. Ergono- mics., 1993 , 36, 161-168.
[26] Schernhammer E.S., Laden F., Speizer F.E., Willett W.C., Hunter D.J., Kawachi I. et al.
— Rotating night shifts and risk of breast cancer in women participating in the Nurses Health Study. J. Natl. Cancer Inst ., 2001, 93 , 1563-1568.
[27] Erren T.C. — Light, Clocks, Mood, and Cancer : Consolidation and Novel Tests of Latitude and Instability Hypotheses. Chronobiol. Int., 2011, 28 , 471-473.
[28] Stevens R. — Testing the light-at-night (LAN) theory for breast cancer causation.
Chronobiol.
Int., 2011, 28, 653-656.
[29] Davis S., Mirick D.K., Stevens R.G. — Night-shift work, light at night, and risk of breast cancer. J.Natl.Cancer Inst., 2001, 93 , 1557-1562.
[30] Hansen J. — Increased breast cancer risk among women who work predominantly at night.
Epidemiology , 2001, 12 , 74-77.
[31] Schernhammer E.S. — Light pollution 7 light pollution ?
Chronobiol. Int., 2011, 28 , 378-379.
[32] Stevens R.G., Hansen J., Costa G., Haus E., Kauppinen T., Aronson K.J., Castan˜oVinyals G., Davis S., Frings-Dresen M.H., Fritschi L., Kogevinas M., Kogi K., Lie J.A., Lowden A., Peplonska B., Pesch B., Pukkala E., Schernhammer E., Travis R.C., Vermeulen R., Zheng T., Cogliano V., Straif K. — Considerations of circadian impact for defining ‘shift work’ in cancer studies : IARC Working Group Report. Occup. Environ Med ., 2011, 68 , 154-162.
[33] Cooke J.R., Ancoli-Israël S. — Normal and abnormal sleep in the elderly. Handb. Clin
Neurol., 2011 , 98 , 653-665.
[34] Touitou Y. — Effects of ageing on endocrine and neuroendocrine rhythms in humans.
Horm.
Res., 1995, 43 , 12-19.
[35] Touitou Y. — Human aging and melatonin. Clinical relevance.
Exp. Gerontol., 2001, 36 , 1083-1100.
[36] Scheuermaier K.D., Munch M., Guzik A., Silva E.J., Ronda J.M., Diffu J.F. — Phase delay shifts to blue-enriched vs. standard polychromatic white light in healthy older people in a semi-ambulatory setting. Sleep , 2008, 31 , A44.
[37] Wu Y.H., Swaab D.F. — Disturbance and strategies for reactivation of the circadian rhythm system in aging and Alzheimer’s disease. Sleep Med ., 2007, 8, 623-636.
[38] Benloucif S., Green K., L’Hermite-Balériaux M., Weintraub S., Wolfe L.F., Zee P.C. — Responsiveness of the aging circadian clock to light. Neurobiol . Aging , 2006, 27 , 1870-1879.
[39] Van Someren E.J., Riemersma R.F., Swaab D.F. — Functional plasticity of the circadian timing system in old age : light exposure. Prog. Brain Res., 2002, 138 , 205-231.
[40] Wirtz-Justice A., Benedetti F., Terman M. eds. — Chronotherapeutics for affective disorders, 115 p, Karger, 2009.
[41] Salgado-Delgado R., Tapia Osorio A., Saderi N., Escobar C. — Disruption of circadian rhythms : a crucial factor in the etiology of depression. Depress. Res. Treat., 2011 : doi. 839743.
(sous presse).
[42] Monteleone P., Maj M. — The circadian basis of mood disorders : recent developments and treatment implications. Eur. Neuropsychopharmacol., 2008, 18 , 701-711.
[43] Morris D.W., Trivedi M.H., Fava M., Wisniewski S.R., Balasubramani G.K., Khan A.Y., Jain S., Rush A.J. — Diurnal mood variation in outpatients with major depressive disorder.
Depress Anxiety , 2009 , 26 , 851-863.
[44] Sack R.L., Brandes R.W., Kendall A.R., Lewy A.J. — Entrainment of free-running circadian rhythms by melatonin in blind people. N. Eng. J. Med ., 2000, 343 , 1070-1077.
[45] Touitou Y., Bogdan A. — Promoting adjustment of the sleep-wake cycle by chronobiotics.
Physiol. Behav., 2007, 90 , 294-300.
[46] Nagtegaal J.E., Kerkhof G.A., Smits M.G., Swart A.C.W., Van der Meer Y.G. — Delayed sleep phase syndrome : a placebo-controlled cross-over study on the effects of melatonin administere five hours before the individual dim light melatonin onset . J. Sleep Res ., 1998 , 7 , 135-143.
[47] Sack R.L., Auckley D., Auger R.R., Carskadon M.A., Wright K.P. JR., Vitiello M.V., Zhdanova I.V. — American Academy of Sleep Medicine. Circadian rhythm sleep disorders :
part II, advanced sleep phase disorder, delayed sleep phase disorder, free-running disorder, and irregular sleep-wake rhythm. An American Academy of Sleep Medicine review. Sleep, 2007, 11, 1484-1501.
[48] Wulff K., Gatti S., Wettstein J.G., Foster R.G. — Sleep and circadian rhythm disruption in psychiatric and neurodegenerative disease. Nat. Rev. Neurosci ., 2010 , 11, 589-599.
[49] Urner M., Tornic J., Bloch K.E. — Sleep patterns in high school and university students : a longitudinal study. Chronobiol. Int ., 2009, 26 , 1222-1234.
[50] Urba´n R. — Morningness-Eveningness, Chronotypes and Health-Impairing Behaviors in Adolescents. Chronobiol. Int ., 2011 , 28 , 238-247.
[51] Figueiro M.G., Rea M.S. — Evening daylight may cause adolescents to sleep less in spring than in winter. Chronobiol. Int ., 2010, 27 , 1242-1258.
[52] Borisenkov M.F., Perminova E.V., Kosova A.L. — Chronotype, sleep length, and school achievement of 11 to 23 year old students in northern european Russia. Chronobiol. Int ., 2010, 27 , 1259-1270.
[53] Guerin N., Reinberg A., Testu F., Boulenguiez S., Mechkouri M., Touitou Y. — Role of school day schedule, age, and parents’ socioeconomic status on sleep duration and sleepiness of Parisian children. Chronobiol. Intern., 2001, 18 , 1005-1017.
[54] Digdon N.L. — Circadian preference and college students’ beliefs about sleep education.
Chronobiol . Int ., 2010, 27 , 297-317.
[55] Crowley S.J., Carsladpon M.A. — Modifications to weekend recovery sleep delay circadian phase in older adolescents. Chronobiol. Int ., 2010, 27 , 1469-1492.
[56] Taylor Daniel J. — Circadian phase preference in college students. relationships with psychological functioning and academics, Chronobiol. Int ., 2011, 28 , 541-547.
[57] Touitou Y., Begue P. — Aménagement du temps scolaire et santé de l’enfant.
Bull. Acad. Med., 2010, 194 , 107-122.
[58] Zee P.C., Vitiello M.V. — Circadian rhythm sleep disorder : irregular sleep wake rhythm type.
Sleep Med. Clin., 2009, 4 , 213-218.
[59] Boudreau E.A., Johnson K.P., Jackman A.R., Blancato J., Huizing M., Bendavid C., Jones M., Chandrasekharappa S.C., Lewy A.J., Smith A.C., Magenis R.E. — Review of disrupted sleep patterns in Smith-Magenis syndrome and normal melatonin secretion in a patient with an atypical interstitial 17p11.2 deletion. Am. J. Med. Genet. A ., 2009, 149A , 1382-1391.
[60] De Leersnyder H. — Inverted rhythm of melatonin secretion in Smith-Magenis syndrome :
from symptoms to treatment. Trends Endocrinol. Metab., 2006, 17, 291-298.
[61] Sloneem J., Oliver C., Udwin O., Woodcock K.A. — Prevalence, phenomenology, aetiology and predictors of challenging behaviour in Smith-Magenis syndrome. J. Intellect Disabil. Res ., 2011, 55 , 138-151.
[62] Tordjman S., Anderson G.M., Pichard N., Charbuy H., Touitou Y. — Nocturnal urinary excretion of 6-sulphatoxymelatonin in children and adolescents with autistic disorder. Biol.
Psychiatry , 2005, 57 , 134-138.
[63] Danel T., Libersa C., Touitou Y. — The effect of alcohol consumption on the circadian control of human core body temperature is time dependent. Amer. J. Physiol., 2001, 281 ,
R52-R55.
[64] Danel T., Cottencin O., Tisserand L., Touitou Y. — Inversion of melatonin circadian rhythm in chronic alcoholic patients, Preliminary study. Alcohol Alcohol. , 2009, 44 , 42-45.
[65] Danel T., Touitou Y. — Alcohol consumption does not affect melatonin circadian synchronization in healthy men. Alcohol Alcohol. , 2006, 41 , 386-390.
[66] Danel T., Touitou Y. — Alcohol decreases the nocturnal peak of TSH in healthy volunteers.
Psychopharmacology (Berl), 2003, 170 , 213-214.
[67] Danel T., Vanyghem M.-C., Touitou Y. — Responses of the steroid circadian system to alcohol in humans : importance of the time and duration intake. Chronobiol. Int., 2006, 23, 1025-1034.
[68] Danel T., Touitou Y. — Chronobiology of alcohol : from chronokinetics to alcohol-related alterations of the circadian system. Chronobiol. Int ., 2004, 21 , 923-935.
[69] Dispersyn G., Pain L., Touitou Y. — Circadian disruption of body core temperature and rest-activity rhythms after general (propofol) anesthesia in rats. Anesthesiology , 2009, 110 , 1305-1315.
[70] Dispersyn G., Touitou Y., Coste O., Jouffroy L., Lleu J.C., Challet E., Pain L. — Desynchronization of daily rest-activity rhythm in the days following light propofol anesthesia for colonoscopy. Clin. Pharmacol. Ther ., 2009, 85 , 51-55.
[71] Dispersyn G., Pain L., Touitou Y. — Propofol anesthesia alters significantly plasma blood levels of melatonin in rats. Anesthesiology , 2010, 112 , 333-337.
[72] Dispersyn G., Sage D., Challet E., Pain L., Touitou Y. — Plasma corticosterone in rats is specifically increased at recovery from propofol anesthesia without concomitant rise of plasma ACTH. Chronobiol. Int., 2009, 26, 697-708.
[73] Touitou Y., Coste O., Dispersyn G., Pain L. — Disruption of the circadian system by environmental factors : effects of hypoxia, magnetic fields and general anesthetics agents. Adv.
Drug. Deliv. Rev., 2011, 62 , 928-945.
[74] Selmaoui B., Touitou Y. — Reproducibility of the circadian rhythms of serum cortisol and melatonin in healthy subjects. a study of three different 24-h cycles over six weeks. Life Sci. , 2003, 73 , 3339-3349.
[75] Mormont M.C., Langouët A.-M., Claustrat B., Bogdan A., Marion S., Waterhouse J., Touitou Y., Levi F. — Marker rhythms of the circadian system function : study in patients with metastatic colorectal cancer and good performance status. Chronobiol. Int., 2002, 19, 141-155.
[76] Touitou Y., Bogdan A., Levi F., Benavides M., Auzeby A. — Disruption of the circadian patterns of serum cortisol in breast and ovarian cancer patients : relationships with tumor marker antigens. Brit. J. Cancer , 1996, 74 , 1248-1252.
[77] Morris C., Atkinson G., Drust B., Marrin K., Gregson W. — Human Core Temperature Responses during Exercise and Subsequent Recovery : An Important Interaction between Diurnal Variation and Measurement Site. Chronobiol. Int., 2009, 26 , 560-575.
[78] Bulckaert A., Exadaktylos V., Haex B., De Valck E., Verbraecken J., Berckmans D. — Elevated Variance in Heart Rate During Slow-Wave Sleep After Late-Night Physical Activity.
Chronobiol Int., 2011, 28 , 282-284.
[79] Armstrong R.G., Kenny G.P., Green G., Seely A.J.E. — Diurnal Variation in Heart Rate Variability before and after Maximal Exercise Testing. Chronobiol. Int ., 2011, 28 , 344-351.
[80] Arendt J. — Shift work : coping with the biological clock.
Occup Med (Lond ), 2010, 60 , 10-20.
[81] Touitou Y., Motonashi Y., Reinberg A., Touitou C., Bourdeleau P., Bogdan A., Motohashi Y. — Effect of shift work on the secretory nighttime patterns of melatonin, prolactin, cortisol and testosterone. Eur. J. Appl. Physiol., 1990, 60 , 288-292.
[82] Weyerbrock A., Timmer J., Honagen F., Berger M., Bauer J. — Effects of light and chronotherapy on human circadian rhythms in delayed sleep phase syndrome : cytokines, cortisol, growth hormone, and the sleep-wake cycle. Biol. Psychiatry , 1996, 4 , 794-797.
[83] Touitou Y., Fevre M., Lagoguey M., Carayon A., Bogdan A., Reinberg A., Cesselin F., Touitou C. — Age and mental health-related circadian rhythms of plasma levels of melatonin, prolactin, luteinizing hormone and follicle stimulating hormone in man. J. Endocrinol., 1981, 91 , 467-475.
[84] Zhao Z.Y., Xie Y., Fue Y.-R., Bogdan A., Touitou Y. — Aging and the circadian rhythm of melatonin: a cross-sectional study of Chinese subjects 30-110yr of age. Chronobiol. Int. , 2002, 19 , 1171-1182.
[85] Zhao Z.Y., Xie Y., Fue Y.-R., Li Y.-Y., Bogdan A., Touitou Y. — Circadian rhythm characteristics of serum cortisol and dehydroepiandrosterone sulfate in healthy Chinese men aged 30 to 60 years. A cross-sectional study. Steroids , 2003, 68 , 133-138.
[86] Lewy A.J., Wehr T.A., Goodwin F.K., Newsome D.A., Markey S.P. — Light suppresses melatonin secretion in humans. Science , 1980, 210 , 1267-1269.
[87] Hugues R.J., Badia P. — Sleep-promoting and hypothermic effects of daytime melatonin administration in humans. Sleep , 1997, 20 , 124-131.
[88] Mundey K., Benloucif S., Harsanyi K., Dubocovich M.L., Zee P.C. — Phase dependent treatment of delayed sleep phase syndrome with melatonin. Sleep , 2005, 28 , 1214-1216.
[89] Lewy A.J., Bauer V.K., Ahmed S., Thomas K.H., Cutter N.L., Singer C.M. — The human phase response curve (PRC) to melatonin is about 12 hours out of phase with the PRC to light.
Chronobiol. Int ., 1997, 15 , 71-83.
[90] Dallaspezia S., Benedetti F. — Chronobiological therapy for mood disorders.
Expert Rev.
Neurother., 2011, 11 , 961-970.
[91] Herxheimer A., Petrie K.J. — Melatonin for the prevention and treatment of jet lag.
Cochrane Database Syst. Rev ., 2002 , 2 , CD001520.
[92] Arendt J., Skene D.J., Middleton B., Lockley S.W., Deacon S. — Efficacy of melatonin treatment in jet-lag, shift work and blindness. J. Biol. Rhythms , 1997, 12 , 604-617.
[93] Reppert S.M., Duncan M.J., Goldman B.D. — Photic influences on the developing mammal. Photoperiodism, melatonin and the pineal (Ciba Foundation Symposium 117), London :
Pittman, 1985, 116-128.
[94] Wright H.R., Lack L.C. — Effect of light wavelength on suppression and phase delay of the melatonin rhythm. Chronobiol. Int., 2001, 18, 801-808.
[95] Lockley S.W., Brainard G.C., Czeisler C.A. — High sensitivity of the human circadian melatonin rhythm to resetting by short wavelength light. J. Clin. Endocrinol. Metab. 2003, 88 , 4502-4505.
[96] Warman V.L., Dijk D.J., Warman G.R., Arendt J., Skene D.J. — Phase advancing human circadian rhythms with short wavelength light. Neurosci. Lett., 2003, 342, 37-40.
[97] Wright H.R., Lack L.C., Kennaway D.J. — Differential effects of light wavelength in phase advancing the melatonin rhythm. J. Pineal Res., 2004, 36 , 140-144.
[98] Revell V.L., Arendt J., Terman M., Skene D.J. — Short-wavelength sensitivity of the human circadian system to phase-advancing light. J. Biol. Rhythms, 2005, 20 , 270-272.
[99] Revell V.L., Skene D.J. — Light-induced melatonin suppression in humans with polychromatic and monochromatic light. Chronobiol. Int., 2007, 24, 1125-1137.Berson D.M., Dunn
F.A., Takao M. — Phototransduction by retinal ganglion cells that set the circadian clock.
Science, 2002, 295 , 1070-1073.
[100] Barbini B., Benedetti F., Colombo C., Dotoli D., Bernasconi A., Cigala-Fulgosi M., Florita M., Smeraldi E. — Dark therapy for mania : a pilot study. Bipolar Disord ., 2005, 7 , 98-101.
[101] Sasseville A., Hébert M. — Using blue-green light at night and blue-blockers during the day to improves adaptation to night work : a pilot study. Prog. Neuropsychopharmacol. Biol.
Psychiatry , 2010 , 34, 1236-1242.
[102] Sasseville A., Benhaberou-Brun D., Fontaine C., Charon M.-C., Hebert M. — Wearing Blue-Blockers in the Morning Could Improve Sleep of Workers on a Permanent Night Schedule : A Pilot Study. Chronobiol. Int ., 2009, 26 , 913-925.
[103] Taylor S.R., Weiss J.S. — Review of insomnia pharmacotherapy options for the elderly :
implications for managed care . Popul. Health Manag., 2009, 12 , 317-323.
[104] Luthringer R., Muzet M., Zisapel N., Staner L. — The effect of prolonged-release melatonin on sleep measures and psychomotor performance in elderly patients with insomnia.
Int. Clin. Psychopharmacol ., 2009, 24 , 239-49.
[105] Garzo´n C., Guerrero J.M., Aramburu O., Guzma´n T. — Effect of melatonin administration on sleep, behavioral disorders and hypnotic drug discontinuation in the elderly : a randomized, double-blind, placebo-controlled study. Aging Clin. Exp. Res ., 2009, 21 , 38-42.
DISCUSSION
M. Claude JAFFIOL
Quelle est l’incidence des troubles métaboliques sur la sécrétion de mélatonine, en particulier les hypoglycémies ? Quel est le rôle potentiel de la leptine ?
Je n’ai pas la notion que la relation hypoglycémie-mélatonine ait été étudiée chez l’homme. Il existe des récepteurs de la mélatonine dans l’adipocyte mais leur relation au syndrome métabolique est imprécise.
M. Bernard LECHEVALIER
Qu’en est-il du rôle de la mélatonine dans le sommeil et l’état de veille chez les non-voyants dits « aveugle de naissance » ?
Les non-voyants se plaignent fréquemment de perturbations de leur sommeil. Les aveugles n’ayant plus du tout de cellules rétiniennes ne perçoivent pas le signal de la lumière, ils sont désynchronisés et leurs rythmes sont dits en libre cours, ce qui se manifeste par des troubles du sommeil. En revanche, la présence de quelques cellules rétiniennes résiduelles favorise la synchronisation des personnes malvoyantes. En effet, la mélanopsine, un photopigment localisé au niveau des cellules ganglionnaires rétiniennes présentes, prend alors en charge le signal lumineux au niveau de la rétine ce qui permet le fonctionnement du système circadien. Les troubles du sommeil de l’aveugle, lorsqu’ils existent, peuvent être améliorés par l’administration de mélatonine aux doses de 0,3 à 0,5 mg le soir, environ une heure avant le coucher.
M. Paul VERT
L’adaptation du nouveau-né au rythme circadien pose souvent problème aux parents. Que sait-on de la synchronisation à cette période ? Dans les unités de réanimation on est confronté à la nécessité d’un éclairement permanent, plus ou moins intense, pour la surveillance clinique.
Quelle en est la conséquence sur l’adaptation du rythme veille-sommeil ?
Le nouveau-né n’a pas encore de structure circadienne mais fonctionne sur une période ultradienne. L’établissement de la structure circadienne est progressive dans le temps et demande quelques mois pour être complète. La nécessité d’un éclairement continu dans les unités de réanimation entraîne une diminution de la sécrétion de mélatonine et donc des altérations probables du cycle veille-sommeil Mme Monique ADOLPHE
Quelle est l’influence de la température sur la mélatonine ? Que pensez-vous des lumières infligées, en pleine nuit, dans les hôpitaux et dans les prisons ?
Les processus thermorégulateurs sont impliqués dans l’initiation du sommeil humain. La mélatonine est un médiateur entre le système de thermorégulation et le système d’éveil. Il existe un lien fort entre sécrétion de mélatonine et température corporelle : la mélatonine diminue de façon dose dépendante la température d’où résulte une diminution du temps de latence au sommeil. L’exposition à la lumière la nuit, que ce soit dans les hôpitaux ou dans les prisons, est un élément défavorable pour la santé, lorsque l’exposition est chronique, entraînant en particulier, mais pas uniquement, des troubles du sommeil bien étudiés chez les infirmières de nuit.
M. Jean CAMBIER
Qu’en est-il des Inuits ?
Il existe une forte prévalence des suicides chez les Inuits en hiver liée à l’absence de lumière pendant la longue période hivernale (environ quatre mois) entraînant des dépressions allant jusqu’au suicide. Ces dépressions peuvent être traitées par exposition à la lumière forte le matin. Lors de la transition entre l’hiver et le printemps les Inuits sont euphoriques en raison de l’installation d’une longue photopériode.
M. Jacques BATTIN
Le syndrome de Smith-Magenis comporte un phénotype comportemental très particulier :
colères, auto et hétéro agressivité et troubles du sommeil liés à une inversion de la sécrétion circadienne de la mélatonine. Le traitement associant bêtabloquant le jour et mélatonine le soir a transformé le pronostic de cette affection, due à la microdélétion du bras court du chromosome 17. À ce niveau, a-t-on isolé un gène régulateur de la sécrétion de la mélatonine ? Chez les insomniaques a-t-on réalisé des cycles de sécrétion de la mélatonine ? Enfin la vente en pharmacie de cette hormone naturelle est-elle enfin autorisée aux dépens des hypnotiques non naturels ?
Il existe bien une expression circadienne des gènes d’horloge dans la glande pinéale (gènes Clock, Cry et Bmal1). La sécrétion de la mélatonine est abaissée chez les insomniaques en lien, au moins en partie, avec leur exposition à la lumière la nuit. Les agoniste de la mélatonine (Rameltéon) sont intéressants dans ce cas. Il est intéressant cependant de noter que récemment deux cas étiquetés Smith-Magenis ont été rapportés dans la littérature avec un profil circadien normal de la mélatonine. Une mélatonine retard (Circadin ; 2 mg) vient d’obtenir l’agrément des autorités sanitaires pour des indications très précises : traitement à court terme de l’insomnie du sujet âgé de plus de 55 ans et pathologies d’origine neurogénétique (autisme, syndrome d’Angelman, syndrome de Rett, syndrome de Smith-Magenis).
M. Jean-Paul BOUNHOURE
Nous avons étudié les enregistrements pendant 24 heures de la tension artérielle et de la fréquence cardiaque chez des sujets normaux et chez des hypertendus. Nous avons remarqué des variations saisonnières, l’effet de l’éveil sur la TA étant plus prononcé, les mois d’été.
L’hiver, les pics de TA et de FC du matin, sont moins prononcés. A votre avis la luminosité peut-elle jouer un rôle ? Les évènements coronariens et les accidents cérébraux sont plus fréquents l’été que l’hiver, ces variations étant tout de même minimes.
Un certain nombre de rythmes circadiens subissent avec les saisons des modifications des paramètres qui les caractérisent (phase, amplitude…). Nous avons ainsi montré dans mon laboratoire les modifications saisonnières des rythmes circadiens hormonaux en fonction de l’âge. Par ailleurs, de nombreux travaux épidémiologiques montrent l’importance des saisons, par exemple en psychiatrie. En revanche, je n’ai pas connaissance de résultats décisifs sur la relation des saisons avec la pression artérielle, les rares travaux publiés sur de petits échantillons étant contradictoires.
M. Henry LACCOURREYE
Le bruit intervient-il dans la désynchronisation ?
Toutes les alternances de l’environnement sont des synchroniseurs et l’alternance bruitsilence en fait probablement partie. Malheureusement il n’existe pas à ma connaissance de travaux sur le rôle précis de ce type d’alternances sur la structure circadienne. Le bruit étant un agent de stress important, on peut faire l’hypothèse qu’il devrait affecter la régulation du système circadien. La mise en évidence de ses effets nécessite des travaux sur le terrain (grands magasins, aéroports, gares par exemple) difficiles à mettre en œuvre sur le plan pratique.
Bull. Acad. Natle Méd., 2011, 195, no 7, 1527-1549, séance du 11 octobre 2011