Résumé
Depuis plus de 40 ans, le traitement des pathologies cancéreuses s’appuie sur quatre modalités, la chirurgie, la radiothérapie, la chimiothérapie et l’hormonothérapie. Le mécanisme d’action supposé de la plupart de ces traitements résulte d’une action cytotoxique directe sur les cellules tumorales. Récemment, la mise en évidence de mécanismes d’immunosuppression liés au développement des tumeurs, et du rôle du système immunitaire dans l’immunosurveillance anti-tumorale amène à reconsidérer l’idée que le cancer n’est qu’une maladie de tissu pour le concevoir également comme une maladie de l’hôte. Cette théorie a été largement renforcée par nos travaux montrant que certaines chimiothérapies génèrent une réponse immunitaire liée à l’induction d’une mort cellulaire immunogène. Ainsi, la réponse thérapeutique à la chimiothérapie correspond à l’association d’une synergie entre des effets directs cytotoxiques, et des effets indirects retardés médiés par le système immunitaire. Notre travail a mis en lumière certains mécanismes moléculaires de l’immuno génicité de la mort cellulaire induite par les agents thérapeutiques classiques. La cellule tumorale mourante expose la calréticuline favorisant sa phagocytose par les cellules dendritiques (CD) puis relargue le facteur nucléaire HMGB1, cytokine inflammatoire responsable de l’apprêtement antigénique par les CD exprimant le récepteur TLR4. Ainsi, les signaux échangés entre la tumeur et le système immunitaire conduiraient-ils à l’activation * Institut Gustave Roussy, F-94805 Villejuif, 39, rue Camille Desmoulins, France ** Faculté Paris Sud-Université Paris XI, France *** Institut National de la Santé et de la Recherche Médicale, U848 ‘‘ Apoptosis, Cancer and Immunity ’’, F-94805 Villejuif, France **** Institut National de la Santé et de la Recherche Médicale, U805 ‘‘ Immunologie et immunothérapie des tumeurs ’’, F-94805 Villejuif, France ***** Centre d’Investigations Clinique BT507 CIC BT507, F-94805 Villejuif, France Tirés à part : Professeur Laurence Zitvogel, même adresse Article reçu le 7 février 2008, accepté le 13 octobre 2008 des lymphocytes T par les CD. L’analyse d’un polymorphisme du récepteur TLR4 ayant des conséquences fonctionnelles sur la liaison à HMGB1 nous a permis de montrer que la présence de ce polymorphisme était associé à l’apparition plus fréquente de métastases, chez des patientes traitées par anthracyclines pour un cancer du sein. Ces résultats permettront d’établir des stratégies thérapeutiques optimales combinant chimiothérapie et immunothérapie.
Summary
For over 40 years, four therapeutic modalities, namely surgery, radiotherapy, chemotherapy and hormone therapy have formed the core of anticancer treatments. Their mode of action is thought to involve a direct cytotoxic action on tumor cells. Recently, the discovery of tumor-associated immunosuppression and tumor immunosurveillance has led to cancer being reconsidered not only as an organ disease but also as a host disease. This new concept is supported by the recent discovery of the immunogenic effects of tumor cell death induced by a variety of cytotoxic drugs. This work describes a new pathway of tumor-derived antigen presentation mediated by the alarmin HMGB1 (released by dying tumor cells in response to chemo/radiotherapy) and by TLR4 on dendritic cells. In this model, TLR4 recognizes ? tumor-derived antigens, leading to T cell activation and to the induction of an antitumor immune response. Accordingly, we show that breast cancer patients bearing a loss-offunction mutation of the TLR4 receptor have shorter disease-free survival, confirming the major role of the immune system in the response to cytotoxic treatments. The response to chemotherapy and/or radiotherapy may thus combine both direct cytotoxic effects and the development of long-term antitumor immunity. We anticipate that these new results will have major impact on cancer management.
INTRODUCTION
L’immunosurveillance antitumorale
Malgré les progrès récents dans le diagnostic précoce et la prise en charge des pathologies cancéreuses, le cancer est devenu la première cause de mortalité en France en 2004. Il est donc capital de proposer de nouvelles stratégies adaptées permettant d’en diminuer la mortalité. Les pathologies tumorales sont actuellement traitées par une association de protocoles comprenant le plus fréquemment la chirurgie, la radiothérapie et/ou la chimiothérapie. La combinaison de ces traitements permet dans certains cas d’obtenir une éradication clinique des tumeurs, mais l’existence de micrométastases de cellules tumorales (ou cellules souches cancéreuses) conduit fréquemment à la rechute tumorale locale ou à distance et à l’échec thérapeutique. Pour obtenir une guérison complète, il serait nécessaire de développer une réponse immunitaire antitumorale capable de contrôler la maladie résiduelle.
Le cancer est communément conçu comme une maladie d’origine génétique résultant d’altérations d’oncogènes, de gènes suppresseurs de tumeurs, ou de gènes garantissant la stabilité du génome. Cependant, le cancer est également une patho- logie dans laquelle le microenvironnement tumoral, le stroma, et le système immunitaire jouent un rôle majeur [1, 2]. En effet, afin d’acquérir son autonomie d’expansion, une tumeur doit s’affranchir de différentes barrières, à la fois intrinsèques, et extrinsèques. Initialement, six caractéristiques principales des cellules tumorales ont été décrites [3]. Ces caractéristiques sont la résistance à l’apoptose, l’insensibilité aux signaux régulant la croissance, le potentiel réplicatif illimité, la capacité à envahir les tissus et à métastaser, la sécrétion dérégulée de facteurs de croissance, et la possibilité de générer des néovaisseaux. Récemment, et compte tenu de l’importance du rôle du système immunitaire dans le contrôle des cellules tumorales, la capacité à échapper au système immunitaire a été suggérée comme une septième caractéristique commune aux cellules tumorales [4]. Ainsi, seules les cellules tumorales ayant échappé à la destruction par le système immunitaire peuvent se développer et former une tumeur [5]. La fréquence accrue de tumeurs solides chez les patients immunodéprimés [6], les cas rapportés de régression tumorale spontanée, et le bon pronostic de la présence de lymphocytes T cytotoxiques infiltrant certaines tumeurs confortent l’idée que le système immunitaire contrôle la progression tumorale chez l’homme [7, 8]. Les programmes de développement de la grande majorité des médicaments anticancéreux ont jusqu’à récemment occulté la possibilité que le système immunitaire puisse jouer un rôle dans la réponse thérapeutique antitumorale. En effet, les premiers criblages de médicaments cytotoxiques effectués par le National Cancer Institute (NCI), ont été effectués sur des souris immunodéficientes ayant reçu une xénogreffe de tumeur humaine [9]. Cependant, même si la radiothé- rapie et la chimiothérapie sont encore considérées comme des stratégies ciblant uniquement les cellules tumorales, de nombreux éléments montrent que ces traitements ont un impact sur le système immunitaire permettant de contribuer à la réponse thérapeutique anti- tumorale.
Rappelons les composantes essentielles de notre système immunitaire actif contre le cancer. Si les anticorps peuvent directement atteindre une cellule tumorale et provoquer son apoptose (exemple du Rituximab dans le lymphome folliculaire), les réponses immunitaires humorales ne peuvent cependant pas contrôler la croissance des tumeurs. Au contraire, l’immunité retardée lymphocytaire T CD4+ et CD8+ est indispensable à la mémoire antitumorale chez les animaux guéris et peut être adoptivement transférée. Pour éduquer les lymphocytes T naifs, les ganglions sont équipés de cellules possédant de nombreuses fonctionnalités, les cellules dendritiques (CD), seules dotées du pouvoir d’initiation des réponses immunitaires T naives.
Les CD capturent les antigènes dans les tissus puis migrent vers les ganglions dans la zone riche en lymphocytes T pour les différencier en cellules effectrices cytotoxiques et ayant une capacité de mémoire immunologique. Ce programme d’éducation des lymphocytes par les CD est complexe, faisant intervenir des étapes limitantes diverses au niveau des CD (phagocytose, activation, migration, maturation et mort).
Des animaux modifiés génétiquement pour la destruction conditionnelle des CD ont permis de démontrer le rôle majeur des CD dans la défense antivirale, antiinfectieuse au sens large et anti-tumorale.
La compréhension de l’importance du système immunitaire dans le processus d’élimination des tumeurs a incité les scientifiques a développer des approches destinées à renforcer son action antitumorale. Par exemple, l’administration de cytokines comme l’interleukine-2 en association avec l’interféron α reste très utilisée dans le traitement des adénocarcinomes du rein métastatiques ou des mélanomes malins [10]. Cependant, le développement de l’utilisation des cytokines en immunothérapie du cancer est limité du fait de leur manque de spécificité et de leur toxicité [11] Afin de stimuler spécifiquement le système immunitaire contre les tumeurs, de nouvelles stratégies d’immunothérapie active ou passive ont été mises en œuvre. La caractérisation précise d’antigènes tumoraux a permis de vacciner des patients contre ces antigènes[12]. Ainsi, le transfert adoptif passif de lymphocytes T CD4+ ou CD8+ activés expandus à partir de mélanomes a fait la preuve de son efficacité[13, 14]. Le conditionnement préalable du patient par lymphodéplétion (induite par cyclophosphamide et de fludarabine) suivi du transfert adoptif passif de lymphocytes T CD8+ spécifiques des antigènes du mélanome entraine des réponses antitumorales remarquables [15] associées à des phénomènes autoimmuns. Enfin, l’identification récente de la capacité des cellules dendritiques à activer les lymphocytes contre un antigène exogène (peptidique ou cellulaire) a permis le développement de protocoles d’immunothérapie active [16-18]. Même si les réponses cliniques observées restent encore malheureusement d’une ampleur modeste, ces différentes méthodes de vaccinations génèrent fréquemment de fortes réponses immunologiques [19]. L’absence de réponse clinique dans ces protocoles s’explique très certainement par la sélection de patients à des stades avancés de leur maladie où le système immunitaire n’est plus fonctionnel à cause de l’immunosuppression médiée par les cellules tumorales. Ainsi, l’administration de traitements cytotoxiques, en favorisant la libération d’antigènes tumoraux et en supprimant l’immunosuppression tumorale pourrait éventuellement restaurer l’activité cellules effectrices du système immunitaire et ainsi conduire à l’élimination des tumeurs.
Ce travail démontre les relations étroites entre le système immunitaire et les cellules tumorales, la synergie entre le système immunitaire et les traitements cytotoxiques, et démontre l’importance clinique du système immunitaire dans la réponse thérapeutique induite par la chimiothérapie par l’intermédiaire du récepteur Toll like 4 (TLR4). A la lumière de ces nouvelles données, il apparaît que le statut du système immunitaire de l’hôte constitue un paramètre majeur à prendre en compte dans les stratégies thérapeutiques chez les patients cancéreux.
Effets synergiques sur la tumeur des traitements cytotoxiques conventionnels et du système immunitaire
Un des mécanismes majeurs induisant une réponse immunitaire antitumorale est la capacité des cellules du système immunitaire à phagocyter les cellules tumorales, puis à apprêter et à présenter les antigènes tumoraux à des lymphocytes T naïfs. Les effets immunoadjuvants des chimiothérapies permettent de favoriser cette étape, en induisant au niveau des cellules tumorales stressées ou mourantes, des signaux qui régulent la phagocytose (« eat-me signal »), l’apprêtement et la présentation des antigènes tumoraux. Ces signaux vont également influencer la maturation des cellules dendritiques, les mécanismes de co-stimulation, et la polarisation de la réponse lymphocytaire.
On sait maintenant que la mort cellulaire tumorale est capable d’induire une réponse immunitaire uniquement si les cellules mourantes émettent des signaux de « danger », ou de phagocytose (« eat me signals ») [20], qui déclenchent leur phagocytose par les cellules dendritiques, puis, dans un second temps, la maturation des cellules dendritiques. En fonction des composés cytotoxiques utilisés, certains types de mort cellulaire peuvent induire une réponse immunitaire anti-tumorale, et ce phénomène peut être utilisé de façon bénéfique pour contrebalancer l’immunosuppression induite par la tumeur [21]. Ainsi, la mort de cellules tumorales induite par les anthracyclines ou la radiothérapie peut-elle générer une réponse immunitaire lymphocytaire T spécifique médiée par les cellules dendritiques, et permettant d’établir une immunité antitumorale spécifique et durable [21].
Notre équipe a contribué à mettre en évidence le premier signal indispensable à la reconnaissance des cellules tumorales mourrantes par les CD. Le signal de phagocytose généré par les cellules tumorales exposées aux anthracyclines, à l’oxaliplatine ou aux radiations ionisantes est l’exposition, à la surface de la membrane plasmique, d’une protéine du réticulum endoplasmique, la calréticuline [22, 23] La calréticuline est retrouvée à la surface de cellules mourantes dans les trente minutes suivant le stress chimiothérapeutique et est caractéristique de la mort cellulaire immunogène, constituant ainsi un des premiers régulateurs de l’effet immunoadjuvant de la mort cellulaire tumorale [24]. Un de nos résultats les plus surprenants est qu’une chimiothérapie non immunogène comme l’étoposide ou la mitomycine C (incapable de provoquer la translocation de la calréticuline à la membrane) devient soudainement agent antitumoral très efficace lorsqu’elle est combinée à un agent pharmacologique provoquant l’exposition de la calréticuline (comme la tautomycine) ou combinée à la calréticuline recombinante injectée en intratumoral. Ces effets synergiques (étoposide + calréticuline locale) disparaissent chez les souris immunodéficientes [23]. Cependant, l’exposition de la calréticuline à la membrane plasmique n’est pas un évènement suffisant pour induire une réponse immunitaire antitumorale. En effet, les cellules vivantes exprimant la calréticuline ne sont pas capables d’entrainer une maturation des cellules dendritiques, de favoriser la présentation antigénique, et donc ne sont pas capables d’induire une réponse immunitaire antitumorale [23].
Cela suggère donc qu’il existe d’autres signaux associés à la mort cellulaire, permettant l’induction d’une telle réponse immunitaire.
Les récepteurs Toll like (TLR) reconnaissent des motifs et des molécules agissant comme signaux de danger exogènes, (pathogènes) ou endogènes. Ils possèdent tous des structures chimiques similaires [24]. Au cours des infections microbiennes, les TLR présents à la surface des cellules dendritiques ou des macrophages sont activés par la reconnaissance de composants exogènes, et induisent l’activation des cellules présentatrices d’antigènes (APC[24, 25]. De plus, les TLR présents sur la membrane interne jouent un rôle régulateur en apprêtant et en présentant des antigènes provenant des débris phagocytés [26-28]. Nous avons cherché à déterminer si les récepteurs TLR étaient impliqués dans la reconnaissance des cellules tumorales mourantes, et dans le déclenchement d’une réponse immunitaire antitumorale 2[29].
Nous avons ainsi pu montrer, chez la souris, que l’expression de TLR4 sur les cellules dendritiques était indispensable à la présentation des antigènes tumoraux dérivés de cellules tumorales mourantes [30]. En effet, la présentation croisée par des cellules dendritiques murines à partir de cellules tumorales mourantes aboutissant à la stimulation lymphocytaire T n’est observée qu’en présence d’une voie de signalisation TLR4/MyD88 intacte, que ce soit in vitro ou in vivo (Figure 1A et 1C).
L’absence de TLR4 est responsable d’un défaut de présentation d’antigène en aval de la phagocytose des cellules tumorales mourantes. Ainsi, nous avons confirmé dans ce modèle, le rôle déjà décrit de TLR4 dans l’inhibition de la fusion phagosomes-lysosomes, permettant une présentation antigénique optimale[31]. En effet, l’absence de TLR4 dans les cellules dendritiques murines se traduit par une accélération de la fusion phagosomes-lysosomes, provoquant une diminution de l’exposition de surface des molécules de classe I et II du CMH[30]. Cette observation nous a également permis de montrer que le relargage de la protéine nucléaire « high mobility group box 1 » (HMGB1) dans le milieu extracellulaire, par les cellules tumorales mourantes, aux stades tardifs de l’apoptose constitue un signal de danger reconnu par TLR4 sur les cellules dendritiques. Ces deux éléments, relargage de HMGB1 et intégrité de la voie de transduction TLR4/MyD88 sont indispensables à l’établissement d’une réponse immunitaire antitumorale en réponse à la chimiothé- rapie et à la radiothérapie chez l’homme. Nous avons montré que les autres récepteurs TLR et les autres ligands potentiels de TLR4 n’intervenaient pas dans ces effets et décliné l’implication de TLR4/HMGB1 dans la réponse aux anthracyclines, oxaliplatine et rayons X, gamma et UVC.
Compte tenu de l’importance de ces résultats, et des conséquences majeures en termes de stratégie thérapeutique, nous avons cherché à savoir si ces phénomènes existaient également chez l’homme. Un polymorphisme nucléotidique du gène tlr4 (896A/G, Asp299Gly, rs4986790) affectant le domaine extracellulaire du récepteur est associé à une diminution de la réponse au LPS, et à une susceptibilité accrue au décès par choc septique ainsi qu’à une diminution des pathologies cardiovasculaires chez l’homme [32, 33]. Bien que soit débattu le rôle de l’allèle Asp299Gly dans la déficience de la signalisation TLR4 en réponse au lipopolysccharide (LPS) [33-35], nous avons cherché à savoir si le polymorphisme tlr4 Asp299Gly pouvait être associé à une modification de la réponse à HMGB1, ligand identifié comme étant relargué par les cellules tumorales mourantes, et responsable de l’activation de la voie TLR4/MyD88 chez la souris[30]. Nous avons d’abord étudié les interactions entre le récepteur TLR4 normal et variant et la protéine HMGB1, puis nous avons ensuite examiné la capacité de cellules dendritiques humaines possédant un récepteur TLR4 variant à reconnaître les antigènes tumoraux dérivés de cellules tumo- rales apoptotiques, à présenter ces antigènes et à stimuler des lymphocytes T naïfs afin de déclencher une réponse immunitaire antitumorale. Enfin, nous avons également étudié la pertinence clinique de ces questions en analysant le rôle de différents polymorphismes de TLR4, ayant des conséquences fonctionnelles sur le récepteur, dans une cohorte de patientes traitées par chimiothérapie pour un cancer du sein.
MATÉRIELS ET MÉTHODES
Immunoprécipitation
Des cellules Hela exprimant TLR4 ont été transfectées par des plasmides contenant tlr4 Asp299Gly, tlr4 Thr399Ile, la double mutation, ou un insert vide. Les cellules ont ensuite été lysées dans du tampon de lyse, associé à un cocktail d’inhibiteurs de protéase (Roche, Mannheim, Germany). Les extraits cellulaires totaux ont été centrifugés à 14 000 tours/min, pendant vingt minutes. Les réactions d’immunopré- cipitations ont été effectuées en incubant les extraits cellulaires totaux avec les anticorps appropriés couplés à l’agarose, a 4° C sur douze heures. Les produits d’immunoprécipitations ont ensuite été lavés, puis resuspendus dans du tampon de Laemmli, et analysés sur un gel Tris Hcl PAGE à gradient variable (4-15 %).
Immunoblots
Les échantillons ont été lysés dans du tampon de lyse, associé à un cocktail d’inhibiteurs de protéase (Roche, Mannheim, Germany). La concentration protéique de chaque échantillon a été déterminée par le test de Bradford avec le kit Bio-Rad Protein Assay (Bio-Rad Laboratories, Inc., Hercules, CA) selon les recommandations du fabricant. Apres migration, la détection immunochimique a été effectuée grâce à des anticorps secondaires appropriés. Les bandes spécifiques ont été visualisées grâce au kit enhanced chemiluminescence detection system (Southern Biotechnologies Associates, ECL kit, Pierce) selon les recommandations du fabricant, et révélés sur des films appropriés.
Présentation croisée des antigènes tumoraux
Des cellules de mélanome Mel96 HLA-A2 negative, Mart1 positive ont été traitées pendant 24 heures par oxaliplatine in vitro . Les cellules tumorales mourantes ont été cultivées en présence de cellules dendritiques HLA*A0201 humaines (MD-DC) générées à partir de monocytes de volontaires sains, ou de volontaires portant l’allèle tlr4 variant Asp299Gly, dans un milieu contenant du GMCSF et de l’IFNα.
Ces cellules dendritiques ont ensuite été cocultivées avec le clone LT12 restreint HLA*A0201, spécifique de Mart1 pendant 24h. L’identification des cellules produisant de l’IFNγ a été effectuée par ELISPOT. Les expériences ont été réalisées au moins trois fois, avec ou sans chloroquine, et avec ou sans anticorps anti-HMGB1.
Schéma de l’étude clinique
Nous avons réalisé une étude clinique rétrospective en construisant une base de données regroupant toutes les patientes traitées pour un cancer du sein à partir de trois centres (Institut Gustave Roussy, Centre René Huguenin, et cohorte nationale E3N). Le recueil du consentement éclairé écrit a été effectué pour chaque patiente.
Cette étude a été approuvée par le CCPPRB du Val de Marne.
Les patientes inclues étaient toutes porteuses d’un cancer du sein sporadique avec envahissement ganglionnaire confirmé par un examen histologique. Le traitement comportait une association de chirurgie et de chimiothérapie/radiothérapie, selon les protocoles locaux. Toutes les patientes incluses ont bénéficié d’un traitement par anthracyclines. Les traitements par taxanes n’étaient pas considérés comme un critère d’exclusion. Les patientes ayant un cancer d’emblée métastatique ont été exclues de cette étude. Le critère de jugement principal était la durée de survie sans métastases, définie, par le temps entre le diagnostic et l’apparition d’un ou plusieurs envahissements tumoraux à distance.
Deux cent quatre-vingts patientes ont été inclues dans cette étude. Les données suivantes ont été recueillies pour chaque patiente incluse : âge au diagnostic, taille histologique de la tumeur, grade tumoral, nombre de ganglions lymphatiques envahis, traitements reçus, positivité des récepteurs hormonaux, traitement par hormonothérapie associée, existence de récidive locale ou à distance, durée du suivi, date de dernières nouvelles.
Génotypage des allèles tlr4 Asp299Gly, Thr399Ile et polymorphismes associés
L’ADN a été isolé à partir de leucocytes de patients. Les amorces PCR (Applied Biosystems) ont été utilisées afin d’amplifier un fragment de cent et une paires de bases du gène de TLR4 contenant le site de la variation Asp299Gly (rs4986790) (forward 5′-CCATTGAAGAATTCCGATTAGCATA-3′ and reverse 5′-CACTCACCAGGGAAAATGAAGAA-3′). Après amplification PCR, chaque génotype a été déterminé en comparant les signaux FAM ™ et VIC ™ (calcul du ratio log(FAM/VIC)) pour chaque patient [21]. Les autres polymorphismes de TLR4 et de CD14 ont également été analysés en parallèle, en utilisant les amorces spécifiques correspondantes (Applied Biosystems). En pratique pour les réactions de PCR, 5ng d’ADN génomique dans 2 μl ont été amplifiés en ajoutant 5 μl de 2X Universal Taqman Master Mix (Applied Biosystems), 0.25 μl de 40X amorces PCR, sondes Taqman MGB et 2.75 μl H20. Les conditions PCR sont les suivantes :
dénaturation initiale à 95° C pendant 10 min, puis 45 cycles de dénaturation à 92° C de 15s, suivi d’hybridation à 60° C pendant 60 sec. La détection de fluorescence a été réalisée sur un ABI Prism7700 Sequence Detector (Applied Biosystems).
Analyse statistique
L’analyse des données expérimentales a été réalisée grâce au test de Mann-Whitney (comparaison de variables quantitatives) et au test de Chi2 (comparaison de variables qualitatives). L’analyse des courbes de survie sans métastases (Kaplan Meier) a été réalisée grâce au test du log rank. Toutes les analyses statistiques ont été réalisées à l’aide du logiciel JMP 5.1 (SAS Institute, Cary, NC). Une valeur de p. < 0.05 a été considérée comme statistiquement significative.
RÉSULTATS
Afin de déterminer si le polymorphisme tlr4 Asp299Gly pouvait être associé à une modification de la réponse à HMGB1, nous avons transfecté des cellules Hela avec un récepteur TLR4 d’origine humaine normal ou variant. Ces cellules ont ensuite été immunoprécipitées avec un anticorps anti-HMGB1, puis révélées avec un anticorps anti-TLR4, en présence d’HMGB1 recombinant. La liaison d’HMGB1 au récepteur variant Asp299Gly est réduite par rapport au récepteur normal Asp299Asp, alors que le contrôle de transfection montre que les cellules sont porteuses de la même quantité de récepteurs. Cette expérience a été répétée selon les mêmes paramètres, mais en effectuant une immunoprécipitation avec un anticorps anti-TLR4, puis en révélant avec un anticorps anti-HMGB1. Les résultats obtenus confirment le déficit de liaison de HMGB1 au variant humain de TLR4 Asp299Gly (Fig. 1A).
Ce déficit de liaison de HMGB1 sur le récepteur TLR4 variant Asp299Gly peut permettre d’expliquer l’incapacité des cellules dendritiques humaines (derivées de monocytes, MD-DC) à effectuer une présentation croisée des antigènes tumoraux aux clones lymphocytaire T que nous avons mis en évidence in vitro (Figure 1B). En effet, les MD-DC de volontaires sains ( tlr4 Asp299Asp), sont capables d’effectuer une présentation croisée des antigènes Mart1 obtenus à partir de cellules de mélanomes traitées par oxaliplatine vers les clones lymphocytaires T CD8+, de façon HMGB1 dépendante. Au contraire, les MD-DC obtenues à partir de volontaires sains porteurs de l’allèle tlr4 Asp299Gly ne sont pas capables d’effectuer une telle présentation croisée des antigènes tumoraux Mart1. De ce fait, l’allele tlr4 Asp299Gly inhibe la réponse à HMGB1.
Etant donné le rôle fondamental de TLR4 dans la dynamique des compartiments et la fusion phagosomes-endosomes entrainant l’acidification accélérée des débris cellulaires phagocytés, nous avons cherché à déterminer si la chloroquine ou un inhibiteur de la v-ATPase (agents lysosomotropes régulateurs de pH) pouvaient rétablir la présentation antigénique dans les CD murines TLR4 déficientes ou les MD-DC de patients porteurs de tlr4 Asp299Gly. Comme démontré, la chloroquine rétablit la présentation antigénique et permet, en association avec la chimiothérapie, de rétablir la réponse thérapeutique chez la souris porteuse de tumeur établie (Fig. 1C).
Les patientes porteuses de cancer du sein bénéficiant le plus de la chimiothérapie sont celles ayant un envahissement ganglionnaire, du fait de la masse tumorale résiduelle après exérèse chirurgicale. Nous avons donc analysé la survie sans récidive à distance de 280 patientes ayant un cancer du sein sporadique avec envahissement ganglionnaire, non métastatique, traité par chirurgie puis chimiothérapie par anthracyclines, en fonction de leur allèle tlr4 (normal ou variant). La fréquence des allèles Asp299Asp, Asp299Gly et Gly299Gly que nous avons observée dans cette population était de 82,2 %, 17,1 % et 0,7 % respectivement (par la suite, Asp299Gly et Gly299Gly sont appelés allèle tlr4 variant). Les caractéristiques épidémiologiques, pathologiques, thérapeutiques et histopronostiques des patientes inclues dans cette étude ne différaient pas dans les deux groupes tlr4 normaux et tlr4 variants. La fréquence observée de métastases sur la durée de suivi était significativement plus élevée dans le groupe de patientes porteuses de l’allèle tlr4 variant cinq ans après la chirurgie (40 % versus 26,5 % chez les patients ayant l’allèle normal, p<0,05, risque relatif 1,53, intervalle de confiance à 95 %, 1,1-3,58) [30]. De plus, l’analyse globale de survie sans métastases de la population de patientes a permis de montrer une proportion significativement plus basse de patientes sans métastases dans le groupe de patientes porteuses de l’allèle tlr4 variant (test Log rank, p. = 0,03). L’analyse du polymorphisme tlr4 Thr399Ile, en déséquilibre de liaison avec Asp299Gly, a retrouvé des résultats similaires. L’analyse statistique des autres polymorphismes étudiés, dans un des introns de Tlr4, ou dans la région 5′UTR ( Tlr4 mutation rs1927911 and rs10759932(26) respectivement) ou de CD14 (qui interagit avec TLR4 pour former le complexe protéique récepteur au LPS) n’a pas permis de mettre en évidence de différences en terme de durée de survie sans métastases sur cette même population démontrant le rôle clé de la variation spécifique de l’allèle variant Asp299Gly [30, 31]. Ainsi, nous avons montré qu’une variation spécifique du récepteur TLR4 humain, associée à un déficit fonctionnel de liaison à HMGB1, détermine la réponse thérapeutique à long terme de la chimiothérapie par anthracyclines chez l’homme.
DISCUSSION
L’effet principal lors de l’utilisation de la chimiothérapie dans le traitement des cancers est une cytotoxicité directe sur les cellules tumorales. Ce travail démontre pour la première fois que la chimiothérapie anti tumorale possède également des effets médiés par le système immunitaire qui améliorent la réponse thérapeutique, notamment dans le traitement du cancer du sein. Effectivement, les cellules tumorales mourant en réponse à la chimiothérapie sont capables d’induire une réponse immunitaire antitumorale favorisant l’efficacité thérapeutique des traitements cytotoxiques. Nous avons ainsi décrit deux des mécanismes moléculaires déterminant la réponse immunitaire antitumorale générée par la chimiothérapie, faisant intervenir l’interaction précoce entre la calréticuline (exposée immédiatement dès le stress médicamenteux) et son récepteur sur les CD et entre une protéine libérée par les cellules tumorales à la phase tardive de l’apoptose (HMGB1), et son récepteur TLR4 sur les CD [30]. Les tissus subissant des lésions peuvent générer une réponse immunitaire transitoire contre des antigènes du soi [36, 37], probablement en raison du relargage par les cellules mourantes de facteurs qui vont stimuler le système lymphocytaire T [22, 38-41]. Ce travail, pour la première fois, met en évidence le rôle des signaux de danger endogènes dans l’induction d’une réponse immunitaire antitumorale, en démontrant le rôle clé de la voie de signalisation TLR4 dans l’induction d’une réponse immunitaire dirigée contre les cellules tumorales apoptotiques. Bien que TLR4 ait été impliqué auparavant dans la tumorigénèse pulmonaire après inflammation chronique[42], son rôle dans l’induction d’une réponse immunitaire spécifique induite par la mort cellulaire liée à la chimiothérapie ou à la radiothérapie n’avait jusqu’à présent jamais été démontré. Le récepteur TLR4 est un complexe multiprotéique formé du récepteur lui-même, et de deux autres molé- cules, CD14 et MD2, récepteur au LPS [24, 43]. Afin de mieux comprendre le rôle de ces différentes protéines dans la reconnaissance de HMGB1, et dans l’induction de la réponse immunitaire antitumorale, il serait nécessaire de vérifier leurs rôles respectifs dans ce modèle. Ainsi, nous pourrions comprendre la voie d’activation complète en réponse à HMGB1, et notamment l’implication en aval du facteur de transcription NF-κB. En particulier, cette question serait particulièrement importante pour générer de nouvelles solutions thérapeutiques, et déterminer si des approches comme l’immunostimulation par des agonistes de TLR4 peuvent être bénéfiques dans ce contexte.
Ce travail montre également que le polymorphisme tlr4 Asp299Gly (et le polymorphisme associé tlr4 Thr399Ile), dont la fréquence dans la population caucasienne est de l’ordre de 10 % diminue l’efficacité de la chimiothérapie anticancéreuse dans le cancer du sein. L’existence de cette variation avait été associée à une diminution de réponse au LPS [32]. Pour la première fois, nous montrons que ce polymorphisme est associé une réduction des interactions entre TLR4 et HMGB1, et inhibe la capacité des MD-DC à effectuer une présentation croisée d’antigènes tumoraux dérivés de cellules de mélanome Mart 1 HLA-A2 à des clones lymphocytaires T spécifiques. Enfin, l’étude rétrospective d’une cohorte de patientes traitées par anthracyclines pour des cancers du sein sporadiques non métastatiques a montré pour la première fois le rôle important des facteurs immunogénétiques dans l’évolution clinique après traitement des pathologies cancéreuses. Il est intéressant de noter qu’il existe dans cette cohorte une surreprésentation de l’allèle tlr4 Asp299Gly par rapport aux populations caucasiennes décrites dans la littérature [32]. Cette constatation pouvait alors faire penser que l’allèle tlr4 Asp299Gly était un gène de prédisposition au cancer du sein. Nous avons cherché à la vérifier en comparant deux populations de patientes atteintes de cancers du sein sporadiques (806 patientes) et de cancers du sein et de l’ovaire familiaux (568 patientes), à des témoins appariés. L’analyse de ces ADN a montré que la fréquence de l’allèle Asp299Gly était similaire entre les cas sporadiques et les témoins (12,7 % et 13,8 % respectivement), mais inférieure chez les cas familiaux par rapport aux témoins (9,3 % et 13,8 % respectivement)44. Ce résultat préliminaire pose donc la question du rôle potentiel de l’inflammation chronique dans l’apparition des cancers [45]: une mutation du récepteur TLR4 pourrait-elle être associée à un blocage de certaines voies de l’inflammation, et à une moindre incidence de cancers ?
Par ailleurs, il serait nécessaire de progresser dans la compréhension du rôle précis de la variation tlr4 Asp299Gly dans la réponse thérapeutique à la chimiothérapie. En effet, 10 % environ de la population caucasienne est porteuse de cette variation spécifique. Il existe par ailleurs certains déficits acquis du récepteur TLR4. Chez tous ces patients, les interventions thérapeutiques visant à restituer une fonction normale du récepteur TLR4 permettront très probablement d’améliorer la réponse à la chimiothérapie. En effet, les médicaments agissant sur les lysosomes, comme la chloroquine, ont été testés dans de nombreuses indications, et notamment les tumeurs multi résistantes [46, 47]. De façon intéressante, la présentation croisée par des MD-DC portant un TLR4 variant peut être restituée par l’adjonction de chloroquine, dont l’efficacité a également été montrée chez la souris [30]. Des données préliminaires du laboratoire montrent également que les ligands de TLR3 et TLR9 (PolyA:U ou I:C et CpG respectivement) permettent de rétablir une réponse antitumorale chez des souris déficientes en TLR4 [31]. Il sera important de déterminer par la suite si ce mécanisme d’action permet de normaliser les fonctionnalités du récepteur TLR4 chez les patients porteurs de la variation Asp299Gly traités par chimiothérapie, et si l’association d’anthracyclines et de chloroquine permet d’améliorer le pronostic de ces mêmes patients.
De nombreuses études cliniques associant un traitement par chimiothérapie et un traitement par immunothérapie ont été réalisées, certaines suggérant effectivement qu’il existe des synergies entre ces deux stratégies thérapeutiques. Deux études cliniques ont permis de montrer l’intérêt de la vaccination antitumorale avant traitement par chimiothérapie [48] Dans un premier travail, 29 patients atteints de cancer du poumon à petites cellules en phase terminale, résistant à une première ligne de traitement par des dérivés de platine ont été vaccinés avec des cellules dendritiques transfectées par un vecteur adénoviral contenant p53. La progression tumorale chez 23 patients a entrainé la prescription d’une deuxième ligne de paclitaxel ou carboplatine. De façon intéressante, le taux de réponse à cette deuxième ligne a été de 61,5 %, et le taux de survie de 38 % à un an, plus élevés que les contrôles historiques. De façon similaire, une autre étude a permis de montrer le bénéfice de la vaccination antitumorale par des cellules dendritiques mises en présence de peptides ou lysats tumoraux (dirigés contre tyrosinase-related protein 2 (TRP-2)) dans le traitement des glioblastomes 4 [49]. Ce travail montre que l’immunothérapie agit en synergie avec la chimiothérapie, en rétablissant la sensibilité des cellules tumorales à la mort cellulaire, et que cette association permet de prolonger la survie des patients. Ces résultats suggèrent donc, comme notre travail, qu’il existe une réelle place pour les associations d’immuno/chimiothérapie dans le traitement des pathologies tumorales chez l’homme. Il sera important de pouvoir démontrer l’efficacité thérapeutique et l’intérêt de ces associations sur des études prospectives randomisées ultérieures.
Au delà des avancées conceptuelles, ces résultats posent également la question de la validité de certaines stratégies thérapeutiques anticancéreuses employées à l’heure actuelle. En effet, s’il existe une réponse immunitaire antitumorale lymphocytes T dépendante en réponse à la mort cellulaire générée par certaines chimiothérapies, et initiée dans les ganglions lymphatiques, il semble capital de préserver ces composants essentiels du système immunitaire. Ainsi, le rôle de la prescription de glucocorticoïdes, en prévention/traitement des nausées et vomissements induits par la chimiothérapie, devra être examiné en fonction des effets sur le sytème immunitaire.
Il nous appartiendra de répondre à ces questions au cours de futures études cliniques ayant pour but sera de déterminer les stratégies thérapeutiques optimales en tenant compte des effets synergiques de la chimiothérapie et de la réaction immunitaire anti tumorale.
Les réponses que nous tenterons d’obtenir à toutes ces questions devraient permettre de déterminer les pré-requis nécessaires au niveau de l’hôte, et au niveau de la tumeur, à l’obtention d’une réponse immunitaire anti tumorale optimale (figure 2), et de proposer des protocoles de traitement adaptés permettant d’augmenter l’efficacité thérapeutique dans les pathologies cancéreuses (figure 3).
CONCLUSION
Les résultats exposés dans ce travail soulignent le rôle majeur joué par le système immunitaire dans le traitement des pathologies tumorales par la chimiothérapie, et s’associent aux travaux récents [50] pour démontrer que l’efficacité des thérapeutiques conventionnelles anticancéreuses peut être améliorée par la participation du système immunitaire. Cette participation peut se faire sous deux formes. D’une part, certaines chimiothérapies peuvent stimuler le système immunitaire, par exemple par déplétion lymphocytaire transitoire, et inhibition de mécanismes immunosuppresseurs, ou par stimulation directe des effecteurs cytotoxiques. D’autre part, certaines chimiothérapies peuvent générer des réponses cellulaires spécifiques aboutissant à l’induction d’une mort cellulaire immunogène. Ces réponses peuvent être l’exposition de la calréticuline à la surface membranaire, l’induction de molécules du CMH de classe I, ou bien, le relargage de HMGB1 et de la voie de signalisation de TLR4 démontrés dans ce travail.
Compte tenu de ces éléments, il est certain que les futures stratégies thérapeutiques anticancéreuses, pour être optimales, devront prendre en compte non seulement les caractéristiques de la tumeur, mais également de l’hôte :
— La connaissance des caractéristiques immunogénétiques [51] des patients permettra de déterminer les polymorphismes et variations déterminantes pour la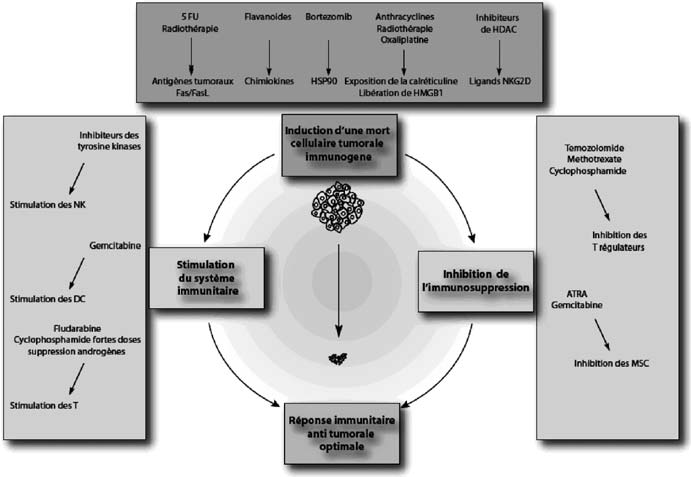
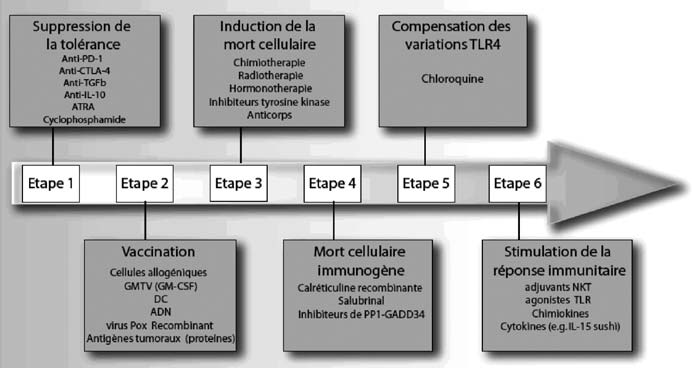
Fig. 2. — Facteurs de l’hote et de la tumeur à prendre en compte dans les nouvelles stratégies thérapeutiques afin d’augmenter la réponse immunitaire anti tumorale Fig. 3. — Moyens d’optimisation de la réponse immunitaire anti tumorale induite par les thérapeutiques anticancéreuses conventionnelles réponse thérapeutique et l’évolution, comme le polymorphisme de TLR4 dans le cancer du sein, de l’IL-10 [52] dans le lymphome, de l’IL-18 dans le cancer de l’ovaire [53] ou du FcγRIIIA dans la réponse aux anticorps monoclonaux [54].
— L’existence de mécanismes de tolérance ou d’immunosuppression liés à la tumeur (Lymphocytes T régulateurs, cellules dendritiques myéloïdes immunosuppressives ou tolérogènes, sécrétion de TGFb, d’arginase, d’IL-10, de CTLA4) devra être supprimée par l’utilisation d’anticorps neutralisants, par des immunostimulants, ou par des stratégies de déplétion lymphocytaire transitoire — Les effets délétères provoqués par la chimiothérapie et la radiothérapie sur le système immunitaire devraient être minimisés, afin de garantir une synergie optimale. Par exemple, l’emploi de médicaments immunosuppresseurs comme les glucocorticoïdes, ou l’exérèse systématique des ganglions lymphatiques devraient être repensés, en raison de leurs effets potentiellement délétères. De même, les protocoles de traitement néo-adjuvants (avant une éventuelle chirurgie), dont la pertinence immunologique est plus importante, devraient être examinés au cours d’essais cliniques. Ainsi, la chimiothérapie pourra permettre de générer une immunogénicité optimale des cellules tumorales mourantes.
— Enfin, il serait important de déterminer les caractéristiques immunologiques intrinsèques des cellules tumorales par des méthodes d’analyse à haut débit. Ces informations permettront de générer pour chaque tumeur une association thé- rapeutique optimale. Une connaissance précise de leur capacité à relarguer HMGB1, à exposer la calréticuline à la membrane plasmique, à exposer les HSPs, ou certains autres antigènes tumoraux, permettra de fournir des solutions d’immuno/chimiothérapies ciblées et adaptées.
REMERCIEMENTS
Nous tenons à remercier les soutiens financiers indispensables à la réalisation de ce travail : L’INSERM, La Ligue contre le Cancer, l’AIRC, la FRM, l’Inca et le Cancéropole Ile de France.
BIBLIOGRAPHIE [1] Finak G. et al. — Stromal gene expression predicts clinical outcome in breast cancer. Nat. Med., 14 , 518-527 (2008).
[2] Koebel C.M. et al. — Adaptive immunity maintains occult cancer in an equilibrium state.
Nature, 450, 903-907 (2007).
[3] Hanahan D., Weinberg R.A. — The hallmarks of cancer.
Cell, 100 , 57-70 (2000).
[4] Zitvogel L., Tesniere A., Kroemer G. — Cancer despite immunosurveillance: immunoselection and immunosubversion. Nat. Rev. Immunol., 6 , 715-727 (2006).
[5] Smyth M.J., Dunn G.P., Schreiber R.D. — Cancer immunosurveillance and immunoediting:
the roles of immunity in suppressing tumor development and shaping tumor immunogenicity.
Adv Immunol., 90 , 1-50 (2006).
[6] Penn I. — Tumors of the immunocompromised patient.
Annu. Rev. Med., 39 , 63-73 (1988).
[7] Galon J. et al. — Type, density, and location of immune cells within human colorectal tumors predict clinical outcome.
Science, 313 , 1960-1964 (2006).
[8] Clemente C.G. et al. — Prognostic value of tumor infiltrating lymphocytes in the vertical growth phase of primary cutaneous melanoma.
Cancer, 77 , 1303-1310 (1996).
[9] Kelland L.R. — Of mice and men: values and liabilities of the athymic nude mouse model in anticancer drug development. Eur. J. Cancer , 40 , 827-836 (2004).
[10] Stadler W.M., Vogelzang N.J. — Cytokine therapy in metastatic renal cancer.
N. Engl. J.
Med., 339 , 849, author reply 850-841 (1998).
[11] Dutcher J. et al. — Kidney cancer: the Cytokine Working Group experience (1986-2001) : part
II. Management of IL-2 toxicity and studies with other cytokines.
Med. Oncol., 18 , 209-219 (2001).
[12] Lucas S., Coulie P.G. — About human tumor antigens to be used in immunotherapy. Semin.
Immunol., (2008).
[13] Mackensen A. et al. — Phase I study of adoptive T-cell therapy using antigen-specific CD8+ T cells for the treatment of patients with metastatic melanoma.
J. Clin. Oncol., 24 , 5060-5069 (2006).
[14] Hunder N.N. et al. — Treatment of metastatic melanoma with autologous CD4+ T cells against NY-ESO-1.
N. Engl. J. Med., 358 , 2698-2703 (2008).
[15] Dudley M.E. et al. — Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes.
Science, 298 , 850-854 (2002).
[16] Banchereau J. et al. — Immune and clinical outcomes in patients with stage IV melanoma vaccinated with peptide-pulsed dendritic cells derived from CD34+ progenitors and activated with type I interferon. J. Immunother, 28 , 505-516 (2005).
[17] Steinman R.M., Banchereau J. — Taking dendritic cells into medicine.
Nature, 449 , 419-426 (2007).
[18] Palucka A.K. et al. — Immunotherapy via dendritic cells. Adv Exp. Med. Biol., 560 , 105-114 (2005).
[19] Banchereau J., Palucka A.K. — Dendritic cells as therapeutic vaccines against cancer. Nat.
Rev. Immunol., 5 , 296-306 (2005).
[20] Savill J., Fadok V. — Corpse clearance defines the meaning of cell death.
Nature, 407 , 784-788 (2000).
[21] Casares N. et al. — Caspase-dependent immunogenicity of doxorubicin-induced tumor cell death.
J. Exp. Med., 202 , 1691-1701 (2005).
[22] Gardai S.J. et al. — Cell-surface calreticulin initiates clearance of viable or apoptotic cells through trans-activation of LRP on the phagocyte.
Cell, 123 , 321-334 (2005).
[23] Obeid M. et al. — Calreticulin exposure dictates the immunogenicity of cancer cell death. Nat.
Med., 13 , 54-61 (2007).
[24] Medzhitov R., Preston-Hurlburt P., Janeway C.A. JR. — A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature, 388 , 394-397 (1997).
[25] Winau F. et al. — Apoptotic vesicles crossprime CD8 T cells and protect against tuberculosis.
Immunity, 24 , 105-117 (2006).
[26] Blander J.M., Medzhitov R. — On regulation of phagosome maturation and antigen presentation. Nat. Immunol., 7 , 1029-1035 (2006).
[27] West M.A. et al. — Enhanced dendritic cell antigen capture via toll-like receptor-induced actin remodeling.
Science, 305 , 1153-1157 (2004).
[28] Yarovinsky F., Kanzler H., Hieny S., Coffman R.L., Sher A. — Toll-like receptor recognition regulates immunodominance in an antimicrobial CD4+ T cell response. Immunity 25, 655-664 (2006).
[29] Beutler B. et al. — Genetic analysis of host resistance: Toll-like receptor signaling and immunity at large.
Annu. Rev. Immunol., 24 , 353-389 (2006).
[30] Apetoh L. et al. — Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy.
Nat. Med., 13 , 1050-1059 (2007).
[31] Apetho L. et al. — The interaction between HMGB1 and TLR4 dictates the outcome of anti-cancer chemotherapy and radiotherapy.
Immunological Reviews In press (2007).
[32] Arbour N.C. et al. — TLR4 mutations are associated with endotoxin hyporesponsiveness in humans.
Nat. Genet., 25 , 187-191 (2000).
[33] Van Rijn B.B., Roest M., Franx A., Bruinse H.W., Voorbij H.A. — Single step highthroughput determination of Toll-like receptor 4 polymorphisms. J. Immunol. Methods, 289 , 81-87 (2004).
[34] Kiechl S. et al. — Toll-like receptor 4 polymorphisms and atherogenesis. N. Engl. J. Med., 347 , 185-192 (2002).
[35] Erridge C., Stewart J., Poxton I.R. — Monocytes heterozygous for the Asp299Gly and Thr399Ile mutations in the Toll-like receptor 4 gene show no deficit in lipopolysaccharide signalling. J. Exp. Med., 197 , 1787-1791 (2003).
[36] Gallucci S., Lolkema M., Matzinger P. — Natural adjuvants: endogenous activators of dendritic cells. Nat. Med., 5 , 1249-1255 (1999).
[37] Kurts C., Miller J.F., Subramaniam R.M., Carbone F.R., Heath W.R. — Major histocompatibility complex class I-restricted cross-presentation is biased towards high dose antigens and those released during cellular destruction. J. Exp. Med., 188 , 409-414 (1998).
[38] Tanaka F. et al. — Intratumoral injection of dendritic cells after treatment of anticancer drugs induces tumor-specific antitumor effect in vivo . Int. J. Cancer, 101 , 265-269 (2002).
[39] Tabeta K. et al. — The Unc93b1 mutation 3d disrupts exogenous antigen presentation and signaling via Toll-like receptors 3, 7 and 9.
Nat. Immunol. 7, 156-164 (2006).
[40] Ishikawa T. et al. — Tumor-specific immunological recognition of frameshift-mutated peptides in colon cancer with microsatellite instability.
Cancer Res., 63 , 5564-5572 (2003).
[41] La Sala A. et al. — Extracellular ATP induces a distorted maturation of dendritic cells and inhibits their capacity to initiate Th1 responses.
J. Immunol., 166 , 1611-1617 (2001).
[42] Bauer A.K. et al. — Toll-like receptor 4 in butylated hydroxytoluene-induced mouse pulmonary inflammation and tumorigenesis.
J. Natl. Cancer Inst., 97 , 1778-1781 (2005).
[43] Shimazu R. et al. — MD-2, a molecule that confers lipopolysaccharide responsiveness on
Toll-like receptor 4.
J. Exp. Med., 189 , 1777-1782 (1999).
[44] Uhrhammer N. et al. — Genetic risk factors in non-BRCA breast/ovarian cancer families
Proceedings of the 99th Annual Meeting of the American Association for Cancer Research (2008).
[45] Lin W.W., Karin M. — A cytokine-mediated link between innate immunity, inflammation, and cancer. J. Clin. Invest., 117 , 1175-1183 (2007).
[46] Genne P. et al. — Cinchonine per os: efficient circumvention of P-glycoprotein-mediated multidrug resistance.
Anticancer Drug Des., 10 , 103-118 (1995).
[47] Wattel E. et al. — Quinine improves the results of intensive chemotherapy in myelodysplastic syndromes expressing P glycoprotein: results of a randomized study.
Br. J. Haematol., 102 , 1015-1024 (1998).
[48] Antonia S.J. et al. — Combination of p53 cancer vaccine with chemotherapy in patients with extensive stage small cell lung cancer.
Clin. Cancer Res., 12 , 878-887 (2006).
[49] Liu G. et al. — Cytotoxic T cell targeting of TRP-2 sensitizes human malignant glioma to chemotherapy.
Oncogene, 24 , 5226-5234 (2005).
[50] Zitvogel L., Apetoh L., Ghiringhelli F., Kroemer G. — Immunological aspects of cancer chemotherapy. Nat. Rev. Immunol., 8 , 59-73 (2008).
[51] Tsung A. et al. — The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion.
J. Exp. Med., 201 , 1135-1143 (2005).
[52] Lech-Maranda E. et al. — Interleukin-10 gene promoter polymorphisms influence the clinical outcome of diffuse large B-cell lymphoma.
Blood, 103 , 3529-3534 (2004).
[53] Bushley A.W. et al. — Polymorphisms of interleukin (IL)-1alpha, IL-1beta, IL-6, IL-10, and
IL-18 and the risk of ovarian cancer.
Gynecol. Oncol., 95 , 672-679 (2004).
[54] Nimmerjahn F., Ravetch J.V. — Antibodies, Fc receptors and cancer.
Curr. Opin. Immunol., 19 , 239-245 (2007).
DISCUSSION
M. Jacques ROUËSSÉ
Existe-t-il des essais de phase II d’association de chloroquine et d’oxoliplatine ?
Non, pas actuellement mais nous avons dans l’idée d’associer la Chloroquine avec les anthracyclines chez les patientes atteintes de cancer du sein, stables sous anthracyclines (mais pas de rémission partielle) et présentant un déficit TLR4 Asp299Gly.
Cette étude est déposée au CCPPRB de Bicêtre. Cependant, il semblerait que la chloroquine ne soit plus commercialisée. Un autre agent lysosomotropique devra être utilisé à sa place.
M. Jacques-Louis BINET
Dans votre travail, vous avez étudié surtout des cancers et travaillé sur des animaux. Qu’en est-il dans les leucémies en particulier résistant aux anthracyclines ? Qu’en est-il du TNF 4 dans les leucémies et les lymphomes ?
Nous avons étudié le rôle prédictif de l’exposition de la calréticuline dans la sensibilité à la combinaison AraC+daunorubicine dans les LAM sur une petite série de 15 patients.
Dans 3/15 cas, la CRT était uprégulée par le traitement et dans 6/15, la CRT était spontanément présente sur les blastes au diagnostic. Nos données préliminaires semblent indiquer que seuls les patients porteurs de blastes CRT+ ont une réponse immunitaire lymphocytaire T significative au diagnostic ou à distance, peut-être associée à une survie plus longue.
M. Pierre GODEAU
Etant donné la fréquence élevée d’une mutation du TLR-4, faut-il étudier systématiquement ce polymorphisme génétique avant tout traitement de cancer du sein ? Le prix de revient est-il élevé ? Nos données obtenues dans le cancer du sein et du colon sont issues d’études rétrospectives et nous devons effectivement confirmer ces découvertes dans des études prospectives pour valider le concept. Alors, nous pourrons instaurer la détection en routine de ce polymorphisme chez tout patient entrant en clinique pour la prise en charge d’un cancer. Les traitements anti-TNF α , largement utilisés, peuvent-ils intervenir dans ce contexte de façon défavorable ? Une publication récente laisse entendre effectivement la dangerosité de ce type d’immunomodulation dans la survenue accélérée d’un cancer.Cependant, un recul est nécessaire pour évaluer le bénéficie-risque de ces approches. L’IL 17 joue-t-elle un rôle dans le domaine carcinologique ?
Nous avons en effet testé directement le rôle de l’IL-17, cytokien inflammatoire, dans la réponse aux anthracyclines et oxaliplatine et radiothérapie chez l’animal. De fait, nous montrons le rôle clef de l’IL-17R dans ce succès thérapeutique et l’initiation de réponses T CD8+ IFNg+. La source d’IL-17 dans notre système semble être les NKT invariants des ganglions drainants la tumeur traitée, ce qui laisse des perspectives aux agents CD1d agonistes comme potentialisateurs des chimiothérapies. Cette réponse non publiée est confidentielle.
M. François-Bernard MICHEL
Cette sensibilité immuno-dépendante plus ou moins grande aux drogues, a-t-elle partie liée avec la résistance immunitaire naturelle aux cancers ou bien n’a-t-elle aucun rapport ?
C’est une question encore ouverte mais les premiers éléments de réponse sont que la mutation Asp299Gly TLR4 n’est pas plus fréquente dans la population de cancers du sein que dans la population générale sur une large série d’individus.
M. Jean-Jacques HAUW
La contribution du système immunitaire de l’hôte est-elle identique quelle que soit la topographie de la tumeur ? Intervient-elle, par exemple, pour ce qui concerne les tumeurs cérébrales ?
Les expériences murines se sont adressées à des localisations cutanées ou ganglionnaires.
Cependant, l’immunité, une fois suscitée ou élaborée à un endroit, doit protéger contre d’autres localisations à distance. Les tumeurs cérébrales sont des sites privilèges de la tolérance soit disant ignorées du système immunitaire mais les pathologies autoimmunes du SNC laissent entendre que ce dogme ne repose pas sur des études solides.
M. Jacques EUZÉBY
La synergie chimiothérapie-capacité réactionnelle du système immunitaire n’est-elle pas un fait d’ordre général ? En matière de thérapeutique anti-parasitaire, la chimiothérapie spé- cifique est peu efficace chez les individus immuno-déficients. Tel est notamment le cas pour la leishmaniose générale des chiens : les stibes. agissent mal chez les chiens, peu capables d’immunité à médiation cellulaire et le levamizole stimulant de cette forme d’immunité élève l’efficacité de la thérapeutique.
C’est un fait. Ceci mériterait d’être étudié plus largement dans des situations où le traitement entraîne la mort cellulaire de cellules infectées. D’ailleurs, une étude épidé- miologique très sérieuse faite dans la yersiniose a montré le rôle prédictif négatif de la mutation TLR4Asp299Gly dans la maladie.
M. Christian NEZELOF
Des déficits immunitaires héréditaires sont très nombreux. Parmi ceux-ci l’ataxie télangiectasie et le syndrome de Wiskott-Aldrich sont presque toujours compliqués d’un lymphome, d’une leucémie, d’un ostéosarcome. A-t-on observé des anomalies du polymorphisme TLR 4 et autres chez ces malades et leurs hétérozygotes ?
Je n’en ai pas eu connaissance. Cependant le système immunitaire de ces hôtes est altéré à de si nombreux niveaux qu’il me semble délicat d’arriver à dégager un facteur dominant d’immunosuppression, ce d’autant que les traitements sont toxiques car ces malades ont des troubles de la réparation tissulaire….
M. Jacques BAZEX
Le mécanisme de mort cellulaire immunogène que vous citez peut être évoqué lors du traitement des verrues : après une tentative de destruction de verrues par des moyens agressifs directs, des verrues non traitées mais situées à distance très souvent disparaissent spontanément. Nous savons qu’il existe des traitements des pathologies cancéreuses qui ne s’appuient sur aucune des quatre modalités que vous avez citées ; les modificateurs de la réponse immune pourraient jouer un rôle déterminant dans les situations suivantes : la maladie de Bowen et certains cancers cutanés épithéliaux sont éliminés par l’imiquimod qui a des propriétés immunomodulatrices ; on peut aussi citer les rétinoïdes qui ont une action très favorable dans les lymphomes cutanés. Ces deux médications constitueraient-elles un nouveau groupe de médications anticancéreuses qui n’aurait aucune action antimitotique directe ?
Non, je ne crois pas. Il faut une coopération étroite entre une cellule mourante (exprimant des ligands ou récepteurs clefs dans la rupture de la tolérance) et une cellule immune, dendritique (en général) pour voir s’opérer le nouveau dogme qui régirait la guérison, cad la contribution du système immunitaire à la guérison du patient traité par ces drogues. Sans action cytotoxique directe, le succès complet (« guérison » et non « rémission ») est improbable.
Bull. Acad. Natle Méd., 2008, 192, no 7, 1469-1489, séance du 14 octobre 2008


