Résumé
La neurochirurgie fonctionnelle lésionnelle, qui au cours de la première moitié du XX e siècle, a constitué le principal traitement des formes avancées de la maladie de Parkinson et en particulier du tremblement, associait l’efficacité spectaculaire du geste opératoire, surtout sur le tremblement, à des complications parfois non totalement régressives et d’autant plus sévères que l’intervention était bilatérale, pouvant conduire à des déficits neurocognitifs ou à des troubles de la parole. Ceci, associé à l’efficacité de la dopamine, avait été à l’origine de la disparition quasi complète de cette chirurgie à partir des années 60 à 80. Le retour à la neurochirurgie fonctionnelle, nécessité par les dyskinésies, a été en grande partie possible du fait de la mise au point de techniques à morbidité réduite, telle que la stimulation à haute fréquence (SHF). Celle-ci a été appliquée d’abord au noyau thalamique ventral intermé- diaire Vim et la faible morbidité de la méthode a été démontrée par la possibilité de faire, sur un grand nombre de malades, des interventions bilatérales sans complications. En 1990, la démonstration dans le cadre de la recherche fondamentale du rôle du noyau subthalamique (NST) comme élément clé de la régulation du mouvement, a suggéré son inscription sur la liste des cibles, malgré le risque d’hémiballisme que cette structure présente quand elle est lésée par une hémorragie, en raison même de la bonne tolérance de la SHF comme méthode chirurgicale. Celle-ci a rapidement montré sa remarquable efficacité sur l’ensemble des symptômes de la maladie de Parkinson, et du fait de la réduction des doses de traitements dopaminergiques ainsi permise, sa capacité à réduire, indirectement, l’intensité des dyskinésies. Si l’efficacité de la méthode est maintenant démontrée ainsi que la stabilité des résultats à long terme, le mécanisme de son action reste pour une part incompris. De surcroît les hypothèses physiopathologiques permettent d’évoquer la possibilité d’un effet neuropro* Membre correspondant de l’Académie nationale de médecine. Tirés-à-part : Professeur Alim Louis BENABID, Pavillon B, CHU Albert Michalon — 38043 Grenoble. Article reçu le 16 janvier 2003, accepté le 20 janvier 2003. tecteur de cette stimulation, ce qui reste néanmoins à établir clairement tant au plan expérimental que lors des applications cliniques.
Summary
Ablative functional neurosurgery constituted during the first half of the 20th century the main treatment of advanced forms of Parkinson’s disease. The surgical procedure was spectacularly efficient on tremor, but sometimes complications were not totally regressive and even more severe when surgery was bilateral, this leading to neurocognitive deficits or to speech problems. This, associated to the efficiency of levodopa, was at the origin of the almost total disappearance of this type of surgery during the ‘60s until the eighties. The rebirth of functional neurosurgery, necessitated by the appearance of dyskinesias, was possible in most part because of the development of techniques with a lower morbidity, such as high frequency stimulation (HFS). This was initially applied to the thalamic ventral intermedius nucleus VIM, and the low morbidity of the method has been demonstrated by the possibility to operate a large number of patients bilaterally without complication. The demonstration that the pallidal target, which had been abandoned during the ‘50s because of its low efficiency on the triad of symptoms of Parkinson’s disease, was selectively efficient on dyskinesias, led naturally to apply HFS to this target. In 1990, the demonstration in the field of fundamental research of the role of the subthalamic nucleus as a key element of regulation of movement, suggested to register this nucleus into the list of targets, despite the risk of hemiballism that this structure presents when it is lesioned by haemorrhage, because of the good tolerance of HFS as a surgical method. This target quickly showed its remarkable efficiency on all symptoms of Parkinson’s disease. Because of the reduction of the doses of dopaminergic treatments which were allowed, this target had also the capacity to reduce, indirectly, the intensity of dyskinesias. If the efficiency of the method is nowadays demonstrated as well as the stability on the long term of its results, the mechanism is still mostly not understood. Moreover the physiopathogenic hypothesis suggests the possibility of a neuroprotective effect of the stimulation, which still needs to be clearly established at the experimental level as well as at the level of clinical applications.
INTRODUCTION
Si la levodopa reste la principale thérapeutique de la maladie de Parkinson, l’évolution inéluctable de celle-ci aboutit à un traitement de longue durée avec des doses élevées, ce qui conduit en règle générale à des désordres iatrogènes constitués principalement par les dyskinésies et les fluctuations motrices entre les états on et off. Le recours à la neurochirurgie fonctionnelle est alors nécessaire et la stimulation à haute fréquence (SHF) ou stimulation cérébrale profonde (SCP) constitue actuellement l’alternative de choix. Mise au point en 1987 au niveau du noyau thalamique
Vim pour traiter essentiellement les formes tremblantes, cette méthode a été étendue au début des années 1990 à la cible pallidale, essentiellement efficace sur les dyskinésies, et à la cible subthalamique, suggérée par les avancées de la neurophysiologie fondamentale. Cette dernière cible s’est avérée d’une extrême efficacité, capable de diminuer très significativement les trois symptômes de la triade (tremblement, akinésie, rigidité) et de permettre la réduction du traitement dopaminergique, et par là de réduire les dyskinésies qui en sont la conséquence. Si la méthode n’a pas la prétention de remplacer le traitement médical, elle s’inscrit dans l’éventail thérapeutique mis à disposition des neurologues pour traiter les formes avancées de la maladie de Parkinson. Au cours des dix dernières années, l’efficacité de la méthode, la stabilité de ses résultats dans le temps, sa faible morbidité, les prédicteurs de son efficacité, comme l’éventail de ses complications ont été inventoriés et la méthode est actuellement bien codifiée. Son adoption par de nombreux centres et son application à une large population de malades dans le monde occidental se sont faites régulièrement. Elle a obtenu dans ces pays les agréments réglementaires nécessaires à son inscription sur la liste des traitements reconnus et pris en charge par les systèmes d’assurance maladie.
INDICATIONS ET MÉTHODES
Indications
Si au début de l’application de la méthode les malades proposés à ce type d’intervention étaient ceux arrivant, au terme de leur évolution, au stade où le traitement médical a cessé de leur permettre de mener une vie, si ce n’est normale, tout au moins autonome, la constatation au cours des dernières années de la faible morbidité de la technique ainsi que de son efficacité considérable, a fait étendre les indications à des stades plus précoces. On s’accorde à penser qu’un malade parkinsonien doit être opéré quand il apparaît que dans les mois ou les années à venir il va devoir quitter son travail, voir son milieu familial et social perturbé en raison de l’effet insuffisant, en particulier dans le temps, du traitement médical. Le candidat idéal à cette chirurgie est donc un malade parkinsonien après 5 à 6 ans d’évolution, répondant correctement à la levodopa, et présentant des fluctuations motrices avec dyskinésies, commençant ainsi à entamer son autonomie et à menacer sa vie professionnelle et familiale. Ces malades doivent être exempts des contre-indications classiques de la chirurgie, et ne pas présenter de signe d’extension de la dégénérescence à d’autres systèmes, ni de symptômes permettant de suspecter qu’il ne s’agit pas d’une maladie de Parkinson idiopathique mais d’un « syndrome parkinsonien plus », tel que, par exemple, l’atrophie multisystémique ou la paralysie supranucléaire progressive. Les malades, au cours de la phase de présélection chirurgicale, subissent un bilan préopératoire comportant un examen neurologique approfondi, une évaluation clinique quantitative aussi précise que possible des différents symptômes en état off (sans traitement) et en état on (en période d’efficacité dans les heures qui suivent
l’administration thérapeutique), une évaluation vidéographique de leurs symptô- mes, documents dont la qualité et l’importance dans le suivi postopératoire est tout à fait considérable.
Méthode
Sur le plan chirurgical, l’intervention peut être réalisée, selon les habitudes et les structures des équipes, en un temps ou en plusieurs étapes.
C’est cette solution qui est choisie dans notre groupe où les malades, une fois sélectionnés, vont subir successivement : une ventriculographie sous anesthésie générale avec mise en place de vis de fixation trans-osseuse. Cette ventriculographie, réalisée par injection d’un produit de contraste iodé dans le ventricule par ponction de la corne frontale de l’hémisphère mineur, va fournir des informations capitales sur la situation des commissures blanches antérieure (CA), et postérieure (CP), du plancher du ventricule latéral où le thalamus affleure, ainsi que sur la taille du IIIe ventricule et son éventuelle inclinaison par rapport au plan de ligne médiane et sa largeur qui témoigne d’un degré d’atrophie cérébrale.
À partir du système de référence que constituent la ligne médiane et la ligne CA-CP, on utilise comme coordonnées de la cible initiale les valeurs moyennes suivantes, respectivement normalisées par rapport à la distance CA-CP et à la hauteur du thalamus (HT), ce qui permet de réduire les variations interindividuelles. Il n’existe pas de normalisation satisfaisante pour la latéralité qui reste exprimée en mm :
Noyau subthalamique (NST) : antéro-postérieur : 5,22 fi 0,92 1/12° de CA-CP, vertical : —1,18 fi 0,67 1/8° de HT, latéral : 1164 fi 1,15 mm, Noyau thalamique (Vim) : antéro-postérieur : 3,53 fi 0,91 1/12° de CA-CP, vertical : 1,15 fi 1,18 1/8° de HT, latéral : 15,36 fi 1,61 mm. Noyau pallidal interne GPi : antéro-postérieur :
8,4 fi 1,2 1/12° de CA-CP, vertical : —0,7 fi 0,8 1/8° de HT, latéral 19,1 fi 2,9 mm.
À partir de ces coordonnées, le système stéréotaxique utilisé associé au système de neuronavigation permet de positionner le goniomètre et les tubes qui vont guider l’introduction des électrodes. Ces coordonnées numériques sont associées aux données de l’IRM et de la tomodensitométrie (TDM).
Des microélectrodes sont descendues à l’aide d’un micromanipulateur en direction de la cible (Fig. 1). À chaque étape de cette trajectoire d’exploration, des études électrophysiologiques sont éffectuées (détection des activités neuronales unitaires, réponse aux stimulations périphériques, effets cliniques de la stimulation, notamment en utilisant les paramètres de la stimulation chronique (60 microsecondes de largeur d’impulsion, 130 Hz, 0 à 10 mA). Les activités neuronales sont la signature des structures traversées. La caractéristique unique de cette méthode est de permettre d’observer à l’avance les effets obtenus par la stimulation sur les symptômes de la maladie. Au terme de cette exploration, on choisit parmi les trajectoires explorées celle qui correspond aux meilleurs résultats cliniques observés en cours d’intervention, dans le cadre d’une coopération étroite entre neurochirurgien, physiologiste et neurologue. On remplace la microélectrode par l’électrode chronique de stimulation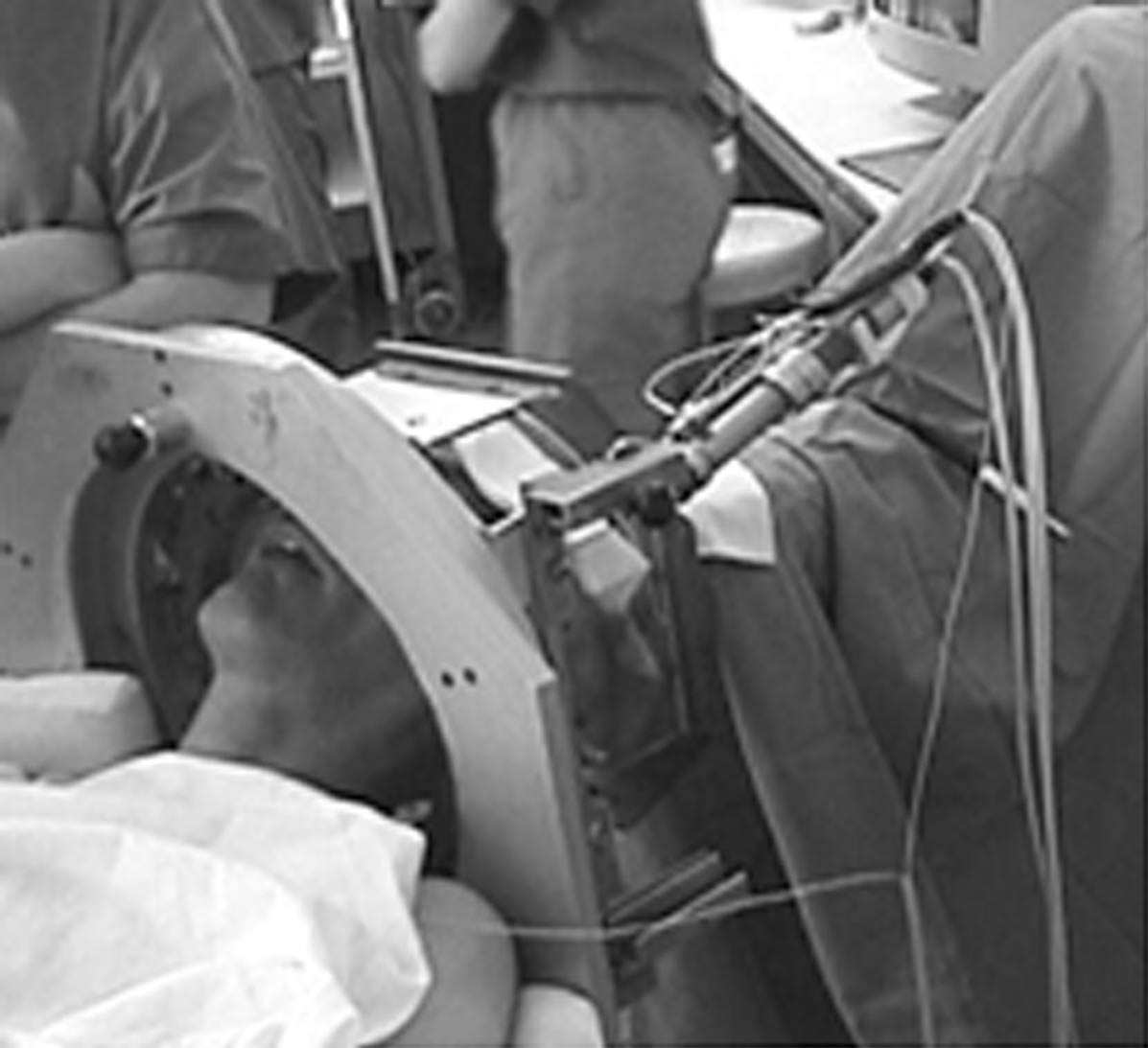
FIG. 1. — Intervention stéréotaxique chez un malade éveillé.
fixée à la voûte par un point transosseux et une micro-prothèse acrylique. L’intervention est pratiquée des deux côtés en une seule session, le deuxième temps bénéficiant des informations obtenues lors de la première phase, ce qui permet de réduire la durée de l’intervention. Dans les jours qui suivent on pratique une IRM de contrôle en condition stéréotaxique. Ultérieurement, sous anesthésie générale, lors de la troisième phase opératoire, les électrodes sont connectées à un stimulateur programmable implanté dans la région sous-claviculaire (Fig. 2). Au cours des jours qui suivent, les quatre contacts de chaque électrode sont successivement activés afin de déterminer au mieux les bénéfices et les effets secondaires indésirables, qui conduiront au choix final d’un contact et du voltage optimal de stimulation, les paramètres de largeur d’impulsion et de fréquence étant en général inchangés.
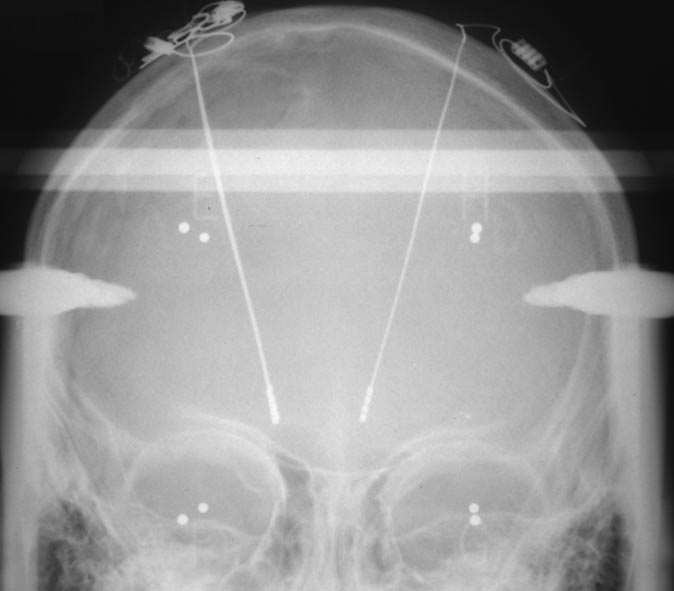
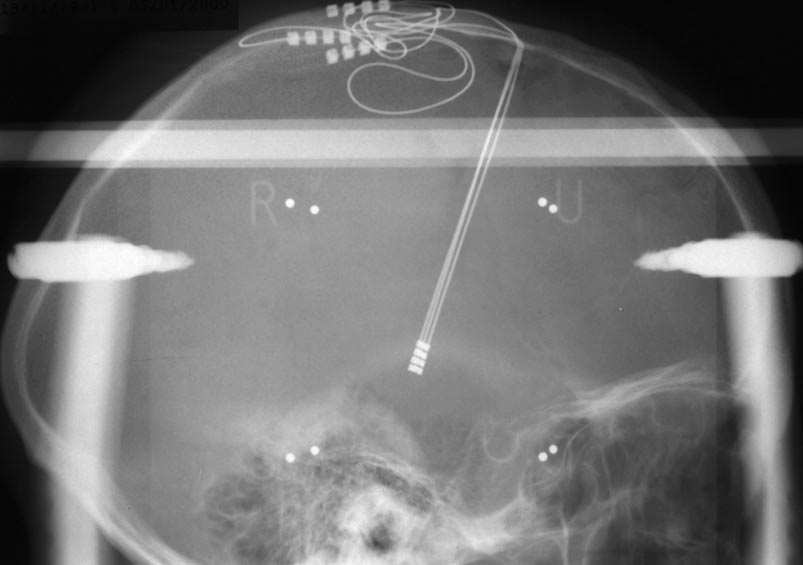
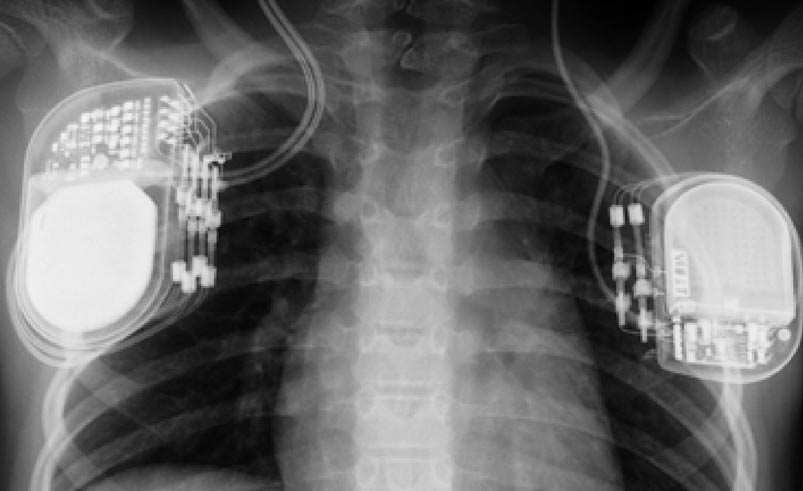 a. — de face.
a. — de face.
b. — de profil.
c. — stimulateur.
FIG. 2. — Radios de contrôle finales montrant les électrodes (crâne de face et de profil) et le stimulateur (en position sub-claviculaire droite).
RÉSULTATS
Complications
Dans l’ensemble, la morbidité est très restreinte. La ventriculographie détermine 0,5 % de complications infectieuses au site de ponction et dans 0,5 % des cas on note la présence au scanner d’une hyperdensité hématique dans le ventricule. A la suite de l’implantation des électrodes on a compté trois hémorragies intracérébrales sur 210 malades opérés bilatéralement (plus de 400 trajectoires). Deux ont été importantes, l’une entraînant un déficit hémiplégique grave et permanent. Dans les suites opératoires immédiates on compte environ 20 % de confusion, qui peut durer de quelques heures à trois semaines, toujours résolutive sans séquelles. Leur cause est multifactorielle : les malades qui sont des indications de stimulation du NST sont en général sévèrement atteints, leur état général est altéré par la maladie notamment la dénutrition, les perturbations du traitement pharmacologique liées à l’intervention et aux tests préopératoires sont souvent difficiles à supporter. La longueur de l’intervention (8 à 12 heures) est moins bien tolérée par les malades âgés ayant une longue durée d’évolution. La trajectoire d’approche peut avoir une part de responsabilité, selon qu’elle traverse le ventricule ou le noyau caudé de façon bilatérale, ou qu’elle soit encore plus latérale transfixiant dans son grand axe la capsule interne. En ce qui concerne le matériel implanté, il est certain que la présence sous la peau de ses composants peut entraîner à la longue des érosions cutanées, source d’infections secondaires. Les effets indésirables liés à la stimulation sont très modérés, liés à l’amplitude de la stimulation et à la position de l’électrode au sein du NST, de dimensions réduites (6 à 10 mm de grand axe, 4 à 6 mm de diamètre transversal). La diffusion du courant peut concerner des structures de voisinage et entraîner des effets secondaires de type moteur (contraction de certains muscles de la face ou de la main) au voisinage du faisceau pyramidal, paresthésies par diffusion au faisceau lemniscal, contraction des muscles du larynx pouvant entraîner une dysarthrie. La stimulation bilatérale chez les malades présentant une hypophonie préopératoire améliore la parole sur des tests instrumentaux, mais la marge de sécurité est extrêmement restreinte et l’augmentation de la stimulation, par le biais de la diffusion aux faisceaux cortico-nucléaires commandant les muscles de la face et de la région oro-faciale, entraîne rapidement une dysarthrie qui paradoxalement majore l’hypophonie. C’est un des inconvénients les plus regrettables de la méthode dans la mesure où les malades, tout en étant considérablement améliorés pour la motricité des membres, sont très gênés par l’hypophonie et le bredouillement, probablement d’ordre akinétique, ce qui interfère fortement sur leurs contacts sociaux et familiaux. Enfin, les malades présentant dans la phase préopératoire un blépharospasme ou apraxie d’ouverture des paupières, voient dans 20 % des cas ce symptôme aggravé ou au moins non amélioré lors de la stimulation.
Effets bénéfiques
À court terme
Il est fréquent d’observer dans les suites opératoires immédiates une amélioration spontanée des symptômes notamment de la rigidité et des fluctuations motrices, en dehors même de la stimulation. Elle est probablement liée à un effet lésionnel secondaire à la mise en place des électrodes. Ces effets sont en général transitoires mais témoignent d’emblée d’un certain degré de réussite de la procédure chirurgicale. Ils sont en général retrouvés lors de l’établissement des paramètres définitifs de la stimulation.
À moyen et long terme
La SHF de Vim n’est efficace que sur le tremblement [2-4]. La stimulation pallidale est efficace sur l’ensemble des symptômes parkinsoniens mais sélectivement sur les dyskinésies dopa-induites. Néanmoins le traitement médical ne peut pas être significativement diminué et les effets peuvent être opposés selon le site de la stimulation [11]. C’est essentiellement le NST qui constitue à ce jour la cible de choix [14]. Les résultats définitifs ne sont obtenus qu’après plusieurs séances d’ajustement des paramètres. L’établissement trop rapide ou d’un niveau élevé de stimulation induit rapidement des dyskinésies, malgré la diminution partielle du traitement dopaminergique qui a été en général instaurée dans les suites immédiates de l’intervention.
Il est apparu qu’il fallait augmenter progressivement l’amplitude de la stimulation, tout en diminuant progressivement les doses du traitement dopaminergique [7].
On arrive ainsi à éviter l’apparition de ces dyskinésies, et l’on observe au cours de l’évolution postopératoire une diminution de la tendance à répondre par des dyskinésies lors des tests de stimulation dopaminergique forte. L’amélioration durable des malades porte principalement sur les symptômes moteurs : le tremblement est très correctement contrôlé, la qualité de ce contrôle est au moins égale à celle obtenue lors de la stimulation thalamique, ce qui nous a amenés à ne plus proposer cette cible chez les parkinsoniens même porteurs d’un tremblement isolé, étant donné que l’évolution de la maladie provoquera une akinésie et une rigidité, symptômes peu sensibles à la stimulation thalamique. L’amélioration de l’akinésie et de la rigidité permettent la reprise de la marche, une autonomie domestique retrouvée, le confort nocturne du fait que les malades peuvent à nouveau se tourner dans leur lit, et parfois la reprise du travail si celui-ci n’a pas été arrêté depuis trop longtemps [13]. Cette éventualité plaide en faveur d’une intervention plus précoce, l’idéal étant d’opérer les malades avant qu’ils aient perdu leur autonomie. Les symptômes autres que la triade, comme les troubles de la marche et de la stabilité, sont également améliorés. En règle l’amélioration suit le profil de l’action dopaminergique et il est clair que le meilleur prédicteur du résultat de l’intervention est le degré d’amélioration obtenue dans la phase préopératoire par les doses supra liminaires de levodopa. La parole, comme nous l’avons dit, est le symptôme le moins amélioré, ce qui pose un réel problème chez les malades présentant en préopératoire
une hypophonie [8]. La faiblesse de cette amélioration peut être due à plusieurs facteurs : il est possible que le NST ne soit pas un des éléments majeurs des circuits de contrôle de la parole. Il est possible qu’il existe au sein de ce noyau une somatotopie des symptômes, en quelque sorte une symptomatotopie. Il est possible également que nous ne puissions pas trouver la représentation spécifique de la motricité orofaciale, difficile à tester en situation peropératoire, puisque le test clinique essentiellement utilisé lors de l’intervention est l’amélioration de la rigidité, testée au niveau du poignet. Les tests pratiqués sur des cohortes suivies plusieurs années, ne mettent pas en évidence d’altération des échelles cognitives [1,10].
L’évaluation des malades selon des échelles d’addiction, fondées sur le profil pharmacologique, tendrait à prouver que l’effet de la stimulation du NST reproduit également dans le domaine cognitif les effets de la stimulation dopaminergique, soit en créant des états d’euphorie, voire quelques cas rapportés de fou rire [12], encore que la localisation des électrodes ayant induit ce symptôme demande à être mieux précisée dans l’avenir. On observe dans un pourcentage d’environ 20 % dans les mois suivant l’intervention une tendance à la dépression, dont les causes sont probablement multiples : diminution importante des doses de médication, réinsertion brutale du malade dans un contexte socio-familial différent de celui dans lequel il s’était installé au cours des dix ans précédant l’intervention. L’implication de la partie limbique du NST dans ces manifestations neuropsychologiques est théoriquement possible mais n’a pas reçu à ce jour de preuve. Il est certain qu’il y a là un domaine qui nécessite d’être profondément exploré [12].
Il n’y a à ce jour pas de preuve que la stimulation au long cours du NST influence significativement l’évolution spontanée de la maladie dont on sait qu’elle échappe à toute forme de traitement. Néanmoins l’observation du score de base, notamment des scores moteurs de ces malades au cours des années, tendrait à suggérer que 25 % d’entre eux continuent à s’aggraver selon le schéma classique de l’évolution spontanée de la maladie de Parkinson, que 36 % d’entre eux verraient leur score de base se stabiliser, que dans 38 % des cas les scores moteurs montreraient une amélioration significative au cours du temps et que pour la moitié d’entre eux, c’est-à-dire environ 20 % de la population totale, il existe sur une durée d’environ cinq ans une amélioration significative de ces score moteurs. Il est difficile d’inférer de ses résultats un possible effet neuroprotecteur de la stimulation subthalamique, que des études expérimentales chez le rongeur intoxiqué à la 6 hydroxydopamine tendraient à suggérer [18].
Cette amélioration pourrait être un artefact d’observation étant donné qu’il est très difficile d’imposer aux malades de rester en situation off pendant une période trop prolongée en raison du caractère éminemment inconfortable de la déprivation thérapeutique. Ceci pourrait empêcher le retour à l’état de base réel et réintroduirait un biais dans l’évaluation des résultats.
Des études contrôlées, mettant en jeu en particulier l’imagerie isotopique de la pharmacologie du striatum , sont à mettre en œuvre pour essayer d’apporter à ce point capital une réponse définitive.
DISCUSSION
Mécanisme d’action
Le mécanisme par lequel la SHF mime les effets de la chirurgie lésionnelle est actuellement inconnu [19]. Dans toutes les cibles explorées à ce jour (Vim, centre médian parafasciculaire, NST, GPi) chez l’homme, ou chez l’animal (noyau ventro médian de l’hypothalamus), les effets de la SHF miment de façon très fidèle ceux de la destruction électrolytique, par exemple de ces cibles. Il paraît difficile de concilier les effets habituellement considérés comme excitateurs de la stimulation électrique, positifs, et ceux que l’on peut considérer comme négatifs de la destruction de structures neuronales. Une première hypothèse est que cette SHF induit un brouillage (en anglais jamming ) qui perturberait le message neuronal circulant dans un circuit et lui enlèverait tout son contenu sémantique. Constance Hammond, par des enregistrements intracellulaires sur des tranches de cerveau de rat, a montré l’apparition dans les cellules subthalamiques d’une activité en bouffées, très diffé- rente de l’activité neuronale habituelle et qui pourrait correspondre à un message devenu ininterprétable. Une autre hypothèse, plus facile à concilier avec la neurophysiologie classique, considère que la stimulation des fibres inhibitrices, notamment gabaergiques, venant se projeter sur les cellules du NST, les inhibe par l’intermédiaire de leurs récepteurs gabaergiques. Ceci est cohérent avec l’injection locale d’agonistes gabaergiques, tels que la bicuculine, mais la similitude des effets ne signifie pas l’identité des causes. La stimulation du NST chez le rat induit une activation, peut-être par voie rétrograde, du pallidum (équivalent du pallidum externe chez l’homme), lequel est un noyau gabaergique fortement inhibiteur se projetant à son tour sur le NST [6]. Néanmoins les expérimentations faites chez le rat montrent que la destruction du pallidum externe n’entraîne pas de disparition de l’effet inhibiteur de la SHF. Cette hypothèse enfin n’est pas cohérente avec l’existence de nombreuses afférences glutamatergiques, se projetant sur les mêmes neurones que les afférences gabaergiques, qui peuvent être également excitées par la stimulation et qui sont, elles, fortement excitatrices. Une troisième hypothèse postule que les effets membranaires induits par la stimulation, au-dessus d’une certaine fréquence, entraînent l’arrêt de l’électrogénèse locale, ce qui conduit in fine à un silence neuronal. Cette hypothèse n’a pas encore reçu de preuve, pour les ganglions de la base, mais des données expérimentales en particulier au niveau de l’hippocampe font état de résultats similaires. Il est enfin possible que l’effet mimétique de la destruction de structures neuronales par la stimulation soit le résultat d’une combinaison de ces différentes causes.
Néanmoins, quel que soit le mécanisme qui sera mis en évidence, unique ou multifactoriel, il devra être compatible avec le postulat fondamental qui est qu’au plan phénoménologique, symptomatique clinique et finalement fonctionnel, l’effet de la stimulation ressemble à une destruction, quoique réversible, des neurones concernés.
Quand on considère le nombre de travaux initiés dans un grand nombre de laboratoires sur ce sujet on peut s’attendre à ce que la question soit résolue dans un avenir inférieur à deux ans.
Perspectives dans le cadre de la maladie de Parkinson .
Quinze ans après le début de l’application de la stimulation cérébrale profonde au traitement des symptômes de certaines maladies neurodégénératives, les perspectives restent nombreuses. Des progrès sont à faire concernant la forme d’onde utilisée pour ces stimulations. Actuellement ce sont essentiellement des impulsions carrées, ou plus exactement biphasiques asymétriques une phase positive de faible amplitude de longue durée venant en théorie compenser, en termes de surfaces sous la courbe, la phase négative excitatrice. Cette forme d’onde, appelée impulsions de Lilly, a pour objectif d’équilibrer les transferts de charges afin d’éviter l’accumulation au site de la stimulation d’un trop grand nombre d’ions négatifs.
Rien ne prouve que ce pattern soit idéal et que l’on ne puisse pas obtenir un effet meilleur en utilisant des impulsions en dents de scie, ou sinusoïdales, réparties sur un mode aléatoire, avec une fréquence moyenne égale à la fréquence utilisée habituellement, par exemple 130 Hz. De la même façon en ce qui concerne la géométrie des électrodes de stimulation, on peut penser que la combinaison de plusieurs plots contigus, voire de plots situés sur des électrodes voisines, permettant d’engendrer un volume de stimulation plus complexe que le volume sphérique actuellement inté- ressé, et qui puisse se modeler sur la forme de la structure neuronale que l’on veut impliquer. Ceci constituerait une sorte de dosimétrie spatiale, dont on peut attendre qu’elle permette d’optimiser les effets désirés tout en minimisant les effets indésirables. De la même façon il apparaît que la stimulation dite monopolaire soit meilleure qu’une configuration bipolaire de contacts voisins sur l’un négatif, l’autre positif.
Lors de l’optimisation de la stimulation chez les malades, en cas d’effets secondaires, un montage de type bipolaire permet de minimiser ces effets indésirables, ce qui signifie néanmoins que les contacts responsables de la stimulation sont trop proches de structures induisant les effets secondaires, notamment les fibres du faisceau pyramidal. On peut imaginer, pour le matériel, des systèmes de connexion permettant de choisir par programmation transcutanée des combinaisons complexes de plusieurs contacts portés éventuellement par plusieurs électrodes.
L’alimentation électrique nécessaire à l’exécution de la stimulation est de faible amplitude, quand on considère que les stimulateurs actuels ont des durées de vie de sept ans. On peut penser que l’énergie nécessaire puisse être trouvée localement, à l’aide de biopiles par exemple, ou de piles à combustible. Enfin le principe de déclencher la stimulation en réponse à la détection de patterns spécifiques détectés au sein du tissu que l’on stimule, pourrait être envisagé. On peut imaginer également de pratiquer les réglages de ces stimulateurs à distance, ce qui aurait pour avantage d’éviter le déplacement des malades, notamment dans les contrées où les distances parcourues sont très importantes.
Applications de la stimulation cérébrale profonde à d’autres affections
En plus de l’application principale de la stimulation cérébrale profonde à la maladie de Parkinson, l’extension du principe selon lequel la SHF mime les effets des techniques lésionnelles, a conduit à tenter de les appliquer à d’autres indications et à leurs cibles spécifiques.
Dystonies
Il existait des preuves que la destruction stéréotaxique du pallidum interne pouvait améliorer de façon progressive et durable les symptômes moteurs des dystonies généralisées. Cette méthode mise au point par les Suédois, abandonnée en raison de son peu d’effets sur les symptômes de la maladie de Parkinson, a été remise à l’ordre du jour en raison de l’efficacité de la pallidotomie sur les dyskinésies induites par la levodopa. Il s’est avéré en effet que la SHF de la partie postéro latéro ventrale du thalamus et du pallidum était susceptible d’améliorer notablement les symptômes moteurs de la maladie dystonique. Cette thérapeutique est toujours en cours d’évaluation mais il apparaît de plus en plus que les dystonies généralisées, et en particulier celles d’origine génétique par mutation du gène DYT1, sont les meilleures indications de cette nouvelle chirurgie. À la différence de la maladie de Parkinson, l’amélioration est progressive, elle continue à se faire pendant de nombreux mois pour atteindre un niveau remarquable.
Épilepsie
Dans le champ des épilepsies pharmacorésistantes, certaines formes restent néanmoins exclues de la thérapeutique chirurgicale, soit parce que les foyers sont bilatéraux, soit parce que les foyers qu’il faudrait réséquer se trouvent en zone dite « éloquente ». Sur la base de données expérimentales, mettant en évidence l’existence d’un contrôle nigro strié de l’excitabilité corticale, il est apparu légitime d’envisager de traiter par SHF du NST des cas d’épilepsie rebelle au traitement médical et ne se prêtant pas à la chirurgie d’exérèse. Quatre malades porteurs de ce type d’épilepsie ont été ainsi implantés et sont stimulés avec un suivi de plus de quatre ans pour le premier. Ces données préliminaires confirment le bien-fondé de l’approche thérapeutique de ces formes doublement rebelles de l’épilepsie par la stimulation profonde du NST et/ou de son voisin sous-jacent, la substance noire réticulée [5].
Troubles Obsessionnels Compulsifs
Dans la logique qui consiste à considérer que la SHF mime les effets des lésions, des équipes belge et scandinave ont appliqué la SHF à la cible capsulaire antéro interne jusque-là utilisée pour traiter certaines formes de troubles obsessifs compulsifs [17].
Les résultats ont été encourageants mais ont fait suspecter que le site véritable d’efficacité se trouvait plus bas que le site chirurgicalement implanté, désignant comme cible potentiellement intéressante le noyau accumbens . Entre-temps,
l’observation presque fortuite que deux malades parkinsoniens stimulés dans le NST avaient vu leurs symptômes obsessionnels compulsifs simultanément améliorés par la stimulation [16], a fait envisager que cette cible puisse être utilisée également, en se basant par ailleurs sur la notion que le NST comporte une portion limbique. Des études multicentriques contrôlées, actuellement entreprises, permettront de tester l’efficacité de cette approche.
Troubles de l’alimentation
Certains désordres endocriniens notamment d’origine génétique, tels que le syndrome de Prader Willie, peuvent conduire à des obésités malignes dont le retentissement sur l’état général peut entraîner la mort du malade. Sur la base de données expérimentales chez le rat, on peut tenter de stimuler de façon chronique le noyau ventro médian de l’hypothalamus afin de corriger ces états d’hyperphagie et de désordres métaboliques conduisant à une obésité.
CONCLUSION
La simulation cérébrale profonde ouvre un nouvel avenir à la neurochirurgie fonctionnelle. À côté des importantes applications humaines à de nombreuses maladies neurologiques, ceci déclenche un effort de recherche ouvrant de nouvelles avenues. En ce qui concerne la maladie de Parkinson, le NST est la meilleure des cibles, sa stimulation améliore tous les symptômes moteurs, elle a remplacé la cible thalamique pour le traitement du tremblement et la cible pallidale pour le traitement des dyskinésies puisqu’elle permet de diminuer notablement les doses de médicaments. La simulation de STN a démontré la stabilité du bénéfice et n’a pas mis en évidence d’effets secondaires à long terme. Des indications plus précoces devraient être envisagées sur cette base, car il n’y a pas de raison d’obliger le malade à attendre qu’il perde son autonomie, son métier, son conjoint, ses amis, sa dignité, pour être finalement grabataire. La stimulation à long terme pourrait être neuroprotective mais ceci reste à démontrer dans les années à venir. En ce qui concerne le coût de la méthode, des études récentes ont montré qu’en fait elle permet de faire des économies. Des développements technologiques futurs peuvent être espérés ou sont attendus qui vont améliorer l’usage de la méthode : stimulateurs plus petits, plus plats, câbles plus courts. Des électrodes multiples pourraient être utilisées pour mieux couvrir les cibles. Des batteries bioénergétiques pourraient être conçues, la télémédecine et le télécontrôle permettront de prendre en charge des patients vivant à grande distance des centres médicaux. De nouvelles approches moléculaires et des techniques de transfert de gènes par électroperméation [15] pourraient introduire des perspectives révolutionnaires pour de futures améliorations thérapeutiques.
BIBLIOGRAPHIE [1] ARDOUIN C., PILLON B., PEIFFER E., BEJJANI P., LIMOUSIN-DOWSEY P., DAMIER P. et al. —
Bilateral subthalamic or pallidal stimulation for Parkinson’s disease affects neither memory nor executive functions, a consecutive series of 62 patients. Ann Neurol , 1999, 46 , 217-223.
[2] BENABID A.L., POLLAK P., LOUVEAU A., HENRY S., DE ROUGEMONT J. — Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease. Appl Neurophysiol , 1987, 50 , 344-346.
[3] BENABID A.L., POLLAK P., GERVASON C., HOFFMANN D., GAO D.M., HOMMEL M., PERRET J.E., DE ROUGEMONT J. — Long-term suppression of tremor by chronic stimulation of the ventral intermediate thalamic nucleus . Lancet , 1991, 337 , 403-406.
[4] BENABIB A.L., POLLAK P., GAO D., HOFFMANN D., LIMOUSIN P., GAY E., PAYEN I., BENAZZOUZ A. — Chronic electrical stimulation of the ventralis intermedius nucleus of the thalamus as a treatment of movement disorders. J Neurosurg , 1996, 84 , 203-214.
[5] BENABIB A.L., et al . — Antiepileptic effect of high-frequency stimulation of the subthalamic nucleus corpus luysi in a case of medically intractable epilepsy caused by focal dysplasia, a 30-month follow-up, technical case report. Neurosurgery , 2002, 50 , 1385-91.
[6] BENAZZOUZ A., PIALLAT B., POLLAK P., BENABID A.L. — Responses of substantia nigra pars reticulata and globus pallidus complex to high frequency stimulation of the subthalamic nucleus in rats, electrophysiological data. Neurosci Lett , 1995, 189 , 77-80.
[7] FRAIX V., POLLAK P., VAN BLERCOM N., XIE J., KRACK P., KOUDSIE A., BENABID A.L. — Effect of subthalamic nucleus stimulation on levodopa-induced dyskinesia in Parkinson’s disease.
Neurology, 2000, 55 , 1921-1923.
[8] GENTIL M., GARCIA-RUIZ P., POLLAK P., BENABID A.L. — Effect of stimulation of the subthalamic nucleus on oral control of patients with parkinsonism. J Neurol Neurosurg Psychiatry , 1999, 67 , 329-333.
[9] HOUETO J.L., et al . — Behavioural disorders, Parkinson’s disease and subthalamic stimulation.
J Neurol Neurosurg Psychiatry, 2002, 72 , 701-7.
[10] JAHANSHAHI M., ARDOUIN C.M., BROWN R.G., ROTHWELL J.C., OBESO J., ALBANESE A., RODRIGUEZ-OROZ M.C., MORO E., BENABID A.L., POLLAK P. — LIMOUSIN-DOWSEY P. — The impact of deep brain stimulation on executive function in Parkinson’s disease. Brain, 2000, 123 , 1142-1154.
[11] KRACK P., POLLAK P., LIMOUSIN P., BENABID A.L. — Levodopa-inhibiting effect of pallidal surgery. Ann Neurol , 1997, 42 , 129-130.
[12] KRACK P., KUMAR R., ARDOUIN C., DOWSEY P., MCVICKER J.M., BENABID A.L., POLLAK P. — Mirthful laughter induced by subthalamic nucleus stimulation. Mov Disord , 2001, 16 , 867-875.
[13] LIMOUSIN P., POLLAK P., BENAZZOUZ A. et al . — Effect on parkinsonian signs and symptoms of bilateral subthalamic nucleus stimulation.
Lancet , 1995, 345 , 91-95.
[14] LIMOUSIN P., KRACK P., POLLAK P., BENAZZOUZ A., ARDOUIN C., HOFFMANN D., BENABID A.L.
— Electrical stimulation of the subthalamic nucleus in advanced Parkinson’s disease. N Engl J Med , 1998, 339 , 1105-1111.
[15] LUO J., KAPLITT M.G., FITZSIMONS H.L., ZUZGA D.S., LIU Y., OSHINSKY M.L., DURING M.J.
— Subthalamic GAD gene therapy in a Parkinson’s disease rat model. Science, 2002, 298 , 425-9.
[16] MALLET L., MESNAGE V., HOUETO J.L., PELISSOLO A., YELNIK J., BEHAR C., GARGIULO M., WELTER M.L., BONNET A.M., PILLON B., CORNU P., DORMONT D., PIDOUX B., ALLILAIRE J.F., AGID Y. — Compulsions, Parkinson’s disease, and stimulation. Lancet, 2002, 360 , 1302-4.
[17] NUTTIN B., COSYNS P., DEMEULEMEESTER H., GYBELS J., MEYERSON B. — Electrical stimulation in anterior limbs of internal capsules in patients with obsessive-compulsive disorder. Lancet , 1999, 354 , 1526.
[18] PIALLAT B., BENAZZOUZ A., BENABID A.L. — Subthalamic nucleus lesion in rats prevents dopaminergic nigral neuron degeneration after striatal 6-OHDA injection, behavioural and immuno-histochemical studies. Eur J Neurosci ., 1996, 8 , 1408-1414.
[19] VITEK J.L. — Mechanisms of deep brain stimulation, excitation or inhibition.
Mov Disord , 2002, 17, Suppl 3 , S69-72.
DISCUSSION
M. Michel ARTHUIS
Chez les parkinsoniens stimulés, quelle est la durée d’action sur le tremblement ? Pour les dystoniques, faut-il les opérer précocement, même dans les formes héréditaires ?
Nous avons opéré des patients depuis janvier 1987. Pour la plupart, ceux-ci ont été régulièrement suivis par l’équipe du professeur Pollak. La stabilité de l’effet antitrémorique est maintenue pratiquement inchangée tout au long de l’évolution, c’est-à-dire, pour certains malades, jusqu’à 15 ans après l’intervention. En ce qui concerne les dystonies, bien que nous n’ayons pas le même recul que pour la maladie de Parkinson, il semble exister un consensus sur les interventions aussi précoces que possible. Par ailleurs, il semble que la stimulation fasse rétrocéder progressivement la symptomatologie et il devient alors évident que moins la symptomatologie a évolué, plus le chemin de retour est court. Ceci paraît d’autant plus vrai dans les formes héréditaires qu’il semble aussi, sous réserve d’études plus approfondies — que l’effet de la stimulation du pallidum dans les dystonies soit plus spectaculaire dans les dystonies généralisées primaires, notamment celles qui sont liées à l’altération du gène DYT1.
M. Jacques-Louis BINET
Combien de temps dure l’intervention ? Quand prenez-vous en charge la maladie ? Quelle est la durée de la liste d’attente ?
La durée de l’intervention dépend des équipes et du nombre de méthodes qu’elles utilisent pour déterminer la position finale des électrodes. En ce qui nous concerne, nous utilisons tous les moyens à notre disposition, notamment électrophysiologiques d’enregistrement et de stimulation. L’intervention dure environ 12 heures pour les deux côtés.
Ceci ne concerne que la phase d’implantation des électrodes, la ventriculographie sur laquelle la première détermination anatomique de la cible est réalisée a lieu quelques jours avant et nous attendons la semaine après l’implantation pour internaliser sous anesthésie générale le stimulateur. Nous prenons en charge la maladie quand le traitement médical, qui reste dans 85 à 90 % le traitement de choix pour toute la durée de la vie des malades, cesse de leur apporter un bénéfice suffisant en termes de qualité de vie. Nous pensons actuellement que l’idéal serait d’opérer les malades dans l’année qui précède leur éventuel arrêt de travail en raison des inconvénients liés la maladie. La durée de la liste
d’attente a fortement diminué depuis que le ministère a attribué à un certain nombre de services des crédits dans le cadre des innovations thérapeutiques coûteuses. Ceci permet actuellement d’opérer environ 50 malades par an, ce qui compte tenu de la liste d’environ une centaine de malades qui ont été sélectionnés constitue une liste d’attente d’environ deux ans. Nous sommes loin des huit ans d’attente que nous avons connus dans le passé où les centres pratiquant cette intervention étaient peu nombreux, et où les crédits alloués étaient nettement insuffisants.
M. Pierre PICHOT
Les résultats obtenus dans les troubles obsessionnels compulsifs l’ont été chez des sujets atteints de maladie de Parkinson. Le fait que, par conséquent, la stimulation a eu une cible identique suggère-t-elle des rapports en ce qui concerne les substrats neuro-physiologiques du trouble obsessionnel compulsif ?
Les résultats obtenus dans les troubles obsessionnels compulsifs ont été obtenus dans diverses cibles, que ce soit dans la capsule interne par les équipes belges et suédoises, mais également par les équipes de la côte Est des Etats-Unis. Les résultats auxquels vous faites référence sont ceux publiés récemment dans le Lancet par l’équipe de Luc Mallet et Yves
Agid, effectivement chez des malades opérés pour leur sémiologie parkinsonienne dans le noyau subthalamique. Il s’est avéré que ces malades avaient concomitamment des symptômes de la série obsessionnelle compulsive et que ces symptômes ont été améliorés.
Néanmoins, l’intensité de ces troubles n’était pas celle qui était envisagée dans les indications que l’on discute actuellement. Ces résultats, bien sûr, ne permettent pas de conclure mais constituent des données expérimentales qui suggéreraient que le noyau subthalamique puisse être impliqué, peut-être par sa composante limbique puisqu’on sait que chez le singe elle existe.
M. Claude-Henri CHOUARD
Le stimulateur fonctionne-t-il la nuit ? Quelle est sa durée de vie ? Avez-vous des problèmes avec les indications ultérieures d’IRM ?
Oui, la stimulation fonctionne également la nuit, puisque dès l’arrêt de la stimulation l’amélioration des symptômes disparaît, et que ces malades graves ont un handicap qui existe également la nuit. Ils ne peuvent pas se tourner seuls et doivent être aidés en cela par leur conjoint. Ils éprouvent des douleurs à type de crampes ou dues à des appuis prolongés du fait de leur immobilité. L’impact de la stimulation cérébrale sur la pratique ultérieure d’IRM constitue également un problème important, surtout si on opère des malades de plus en plus jeunes qui ont la probabilité d’avoir besoin de ces examens pour le restant de leur vie. En théorie, et selon les normes du constructeur, la pratique de l’IRM est proscrite chez les malades porteurs de stimulateurs, en particulier cérébraux. Néanmoins, dans toutes les équipes, nous avons été contraints de pratiquer des IRM alors que les malades portaient des stimulateurs. Dans ces cas-là, nous avons arrêté le stimulateur, mis ses paramètres, notamment l’amplitude, à zéro, et à ce jour, il n’y a pas de complication rapportée, ce qui ne permet pas d’avoir la certitude qu’il n’y en aura pas. La seule complication rapportée est liée à la pratique de cardio-version chez un malade qui portait un stimulateur dont l’électrode était dans le thalamus. À la suite de cette cardio-version, le malade a présenté une lésion intrathalamique, ultérieurement responsable d’un syn-
drome de Déjerine Roussy. Cependant, les circonstances étaient différentes puisque le stimulateur n’était pas du type de ceux utilisés mais qu’il s’agissait d’un stimulateur inductif, c’est-à-dire que l’énergie lui était délivrée à travers la peau par une antenne solénoïde. On peut comprendre alors que le récepteur du stimulateur, placé sous la peau à proximité de la région cardiaque, ait capté, puisque c’est sa fonction, une partie de l’énergie et du choc électrique et l’ait délivrée au niveau cérébral.
M. Georges DAVID
Le tableau de grande dystonie que vous avez présenté m’a évoqué celui réalisé par les séquelles d’une maladie néonatale, l’ictère nucléaire par encéphalopathie hyperbilirubinique, résultant de retards à la prise en charge des immunisations fœto-maternelles, retards qui étaient observés il y a quelques décennies, mais qui ont fort heureusement pratiquement disparu.
Effectivement, les ictères nucléaires dus aux incompatibilités rhésus constituent des tableaux que l’on peut considérer comme des syndromes dystoniques secondaires. Ces dystonies secondaires peuvent être dues à des lésions très variables des noyaux gris centraux et on connaît les nécroses de la partie postérieure du putamen dans les accidents anaphylactiques ou dans les accidents d’anesthésie. En général, ces dystonies secondaires répondent moins bien à la stimulation pallidale. Je n’ai pas connaissance, en ce qui me concerne, de malades porteurs d’encéphalopathies hyperbilirubinémiques qui aient été opérés par stimulation des noyaux gris centraux.
Mme Monique ADOLPHE
Je voudrais savoir si vous tenez compte de l’âge du patient. Mettez-vous une limite ?
En effet, comme dans tout geste chirurgical, l’âge finit par être un critère, si ce n’est d’exclusion, au moins limitant. Ce qui compte en fait est l’âge « physiologique » et il n’a vraiment d’importance qu’à travers la déficience de l’état général ou d’autres fonctions organiques, cardio-respiratoire ou rénale par exemple. Sur un autre plan, on peut discuter dans une perspective économique, l’intérêt qu’il y a à stimuler des malades dont l’espérance de vie est brève. Ceci touche à des points d’éthique que nous n’avons pas, jusqu’à présent, abordés.
M. André VACHERON
L’implantation de l’appareillage et des électrodes de stimulation se fait-elle sous anesthésie locale et comporte-t-elle des risques ?
En effet, l’implantation de l’appareillage et des électrodes de stimulation se fait sous anesthésie locale, dans la plupart des centres et en particulier dans le nôtre, pour bénéficier de la coopération du malade au moment de la phase dite électrophysiologique et en particulier lors des stimulations intra-opératoires, afin d’observer d’une part l’amélioration des symptômes parkinsoniens et, d’autre part, des effets secondaires qui sont aussi importants quand il s’agit de décider où une électrode doit être mise. L’implantation de l’appareillage et des électrodes comme toute intervention, comporte bien sûr
des risques et en particulier des risques hémorragiques. Ceci impose l’abstention de tout médicament qui faciliterait le saignement et en particulier l’aspirine. Néanmoins, la pratique correcte de la stéréotaxie tend à minimiser fortement ces risques, d’autant plus que l’on utilise l’IRM pour choisir le point d’entrée au niveau cortical, ce qui permet d’éviter les vaisseaux.
M. Louis HOLLENDER
Quelle est la durée de formation d’un jeune collègue à cette technique ?
La durée de formation dépend beaucoup du niveau à partir duquel on débute cette formation. Quand il s’agit d’un neurochirurgien qui a une pratique courante de la stéréotaxie, ne serait-ce que pour les biopsies tumorales, il s’agit alors simplement d’acquérir des compléments tels que l’anatomie fonctionnelle des noyaux gris centraux, le catalogue des coordonnées, et surtout la pratique de l’électrophysiologie intraopératoire. Quand il s’agit de former un jeune neurochirurgien qui ne possède que des notions de neurochirurgie générale, ceci peut prendre plusieurs années, de l’ordre de deux à trois ans par exemple.
Bull. Acad. Natle Méd., 2003, 187, n° 2, 305-322, séance du 18 février 2003


