Résumé
L’émergence des infections fongiques invasives (IFI) dans les pays industrialisés est une conséquence des techniques de soins modernes, qui permettent la prise en charge de patients très fragilisés. Les candidoses sont les plus fréquentes des IFI. Elles sont en majorité endogènes, à partir de la flore commensale du patient. Candida albicans est responsable de la moitié de ces infections, le plus souvent à partir de la muqueuse digestive. Les approches de biologie moléculaire et cellulaire permettent une compréhension fine des mécanismes en jeu lors de la transition commensal-pathogène. En clinique, nous avons ainsi montré qu’un patient neutropénique est généralement colonisé par un unique génotype de Candida albicans, et que toutes les sous-populations peuvent provoquer une infection invasive. Expérimentalement, dans des modèles d’interaction in vitro avec des cellules épithéliales, nous avons démontré le rôle des alpha 1,2 et bêta 1,2 mannosides de paroi dans l’adhérence aux entérocytes, et avons observé que Candida albicans pouvait développer des stratégies d’invasion différentes selon le type de cellule épithéliale rencontré.
Summary
Invasive fungal infections (IFI) have become a major public health problem in industrialized countries, notably due to the increasing number of immunocompromized individuals. Endogenous candidiasis, arising from the patient’s commensal flora, accounts for the majority of IFI. C. albicans, generally originating from the colonized gastrointestinal tract, is the causative agent in about 50 % of cases. Molecular and cellular investigations are helping to decipher the mechanisms underlying the commensal-pathogen transition. We have found that neutropenic patients are generally colonized by a single genotype, and that all C. albicans genotypes can cause invasive infection. By using epithelial cell-based models, we have shown that alpha 1,2 and beta 1,2 mannosides present in the outermost layer of the fungal cell wall mediate adherence to enterocytes. In addition, C. albicans uses different strategies for epithelial cell invasion, depending on the precise cell type with which it interacts.
INTRODUCTION
L’émergence des infections fongiques invasives (IFI) dans les pays industrialisés est un fait marquant des trois dernières décennies [1]. Elle résulte de l’amélioration des stratégies de soins a qui permettent la prise en charge de patients de plus en plus fragilisés, avec en contrepartie le développement d’IFI fréquentes, sévères, et pré- sentant une diversité microbiologique croissante [1]. Aux Etats-Unis la fréquence des IFI a ainsi augmenté de 207 % entre 1979 et 2000 [2].
Les candidoses sont les plus fréquentes des IFI [3]. Elles sont dues à des levures commensales des muqueuses et/ou de la peau, dont la persistance chez les sujets bien portants résulte de l’équilibre qu’elles établissent avec la flore bactérienne et les mécanismes de défense de l’hôte. La rupture de cet équilibre chez des patients fragilisés conduit à la translocation à travers la muqueuse, à la dissémination hématogène, et à l’invasion tissulaire. Les principaux facteurs de risque de ces formes hématogènes et invasives sont la colonisation préalable par Candida spp., l’hémodialyse, les antibiotiques antibactériens à large spectre, la neutropénie, la nutrition parentérale, les cathéters veineux centraux [1]. Outre ces candidoses d’origine endogène, une transmission manuportée ou liée à l’environnement est possible en milieu hospitalier [4].
Aux Etats-Unis, les candidoses invasives représentent la quatrième cause d’infection hématogène nosocomiale [5]. En Europe des études sur base de population ont montré une augmentation de l’incidence des candidémies au cours des années 1980-1990 en Islande et en Finlande [6, 7] et au début des années 2000 au Danemark [8]. En France où on ne dispose pas d’étude sur base de population, des taux de 0.17 à 2 /1000 admissions sont rapportés en milieu hospitalier depuis les années a Transplantation d’organes, greffe de moelle, chimiothérapie des cancers et des hémopathies, traitements immunosuppresseurs, réanimation et chirurgie lourdes, prise en charge des brûlés, infection par le virus de l’immunodéficience humaine, notamment.
1990 [9]. L’incidence des candidoses invasives est globalement stabilisée depuis le début des années 2000 ]9], mais on note leur émergence en milieu communautaire, probablement en rapport avec l’évolution des circuits de soins et le suivi extrahospitalier de patients fragilisés [10]. La mortalité attribuée à l’épisode candidémique est estimée à 24-49 %. Elle reste stable depuis vingt ans malgré l’apparition de nouveaux antifongiques [4].
Parmi les espèces du genre Candida , C. albicans est responsable de 50 à 60 % des candidoses invasives. La colonisation du tractus digestif par
C. albicans et l’altération des barrières anatomiques et / ou de la flore bactérienne résidente sont d’importants facteurs favorisants [11]. L’interaction avec la muqueuse intestinale est donc souvent la première étape dans l’histoire naturelle des candidoses invasives à C. albicans . Les mécanismes fondamentaux impliqués à ce niveau dans la transition commensal-pathogène sont peu connus. Notre laboratoire explore cette problématique en associant des approches biocliniques et des approches expérimentales.
Nous présentons ici les principaux acquis de ces recherches à travers les questions scientifiques abordées au cours des dix dernières années.
ETUDES BIOCLINIQUES
Certaines sous-populations génotypiques de
C. albicans présentent elles un pouvoir pathogène déterminé ?
Les études de génétique des populations ont montré que
C. albicans présente une reproduction « essentiellement clonale » [12]. Dans un modèle clonal de reproduction, le génome est transmis de façon inchangée d’une génération à l’autre, et les éventuels clones existant au sein d’une espèce peuvent présenter des propriétés biologiques distinctes qui sont stables au cours des générations. Un tel modèle est également caractérisé par un « déséquilibre de liaison », c’est à dire le fait qu’en l’absence de recombinaison génétique, les différentes combinaisons alléliques sont reliées entre elles à travers le génome [13]. Un unique marqueur peut ainsi être prédictif de combinaisons génotypiques multilocus. Cette reproduction clonale se distingue de la reproduction sexuée, qui génère de nouvelles combinaisons génotypiques, et donc potentiellement de nouvelles propriétés biologiques, à chaque génération. Ainsi, si C. albicans se reproduit sur un mode « quasi-clonal », il importe de déterminer si certaines sous-populations génotypiques présentent une capacité accentuée à coloniser les muqueuses ou envahir les tissus chez les sujets fragilisés.
Pour aborder cette question, nous avons comparé 48 isolats de C. albicans isolés d’hémocultures avec 48 isolats contrôles obtenus de prélèvements périphériques chez des patients distincts, appariés par la date d’hospitalisation, ne présentant pas d’hémocultures positives, et traités dans des unités de soins différentes pour éviter tout biais lié à une transmission manuportée. Les isolats ont été comparés par leur génotype au locus microsatellite polymorphe CEF3 [14]. Ce travail a révélé une répartition sensiblement identique des principaux génotypes entre isolats septicé- miques et isolats non-septicémiques [15]. Dans un second temps, nous avons étudié la flore commensale de la cavité buccale chez des sujets sains consultant en cabinet dentaire ou en médecine du travail. Afin d’éviter tout risque d’isolement de souches non commensales, des critères d’exclusion ont été appliqués : âge supérieur à 65 ans, grossesse, contraception orale, traitement antifongique ou antibiotique, hospitalisation dans les trois mois précédents, travail en milieu hospitalier, déficit immunitaire, traitement immunosuppresseur, maladie chronique, traitement au long cours, prothèse dentaire, maladie de la sphère buccale. Le prélèvement de sept cents personnes a permis l’isolement de 85 isolats de C. albicans chez 85 sujets distincts. La comparaison des fréquences alléliques dans ce groupe avec celles des deux populations précédemment isolées de sujets malades n’a pas révélé de différence significative [16]. Cette première série de travaux indique que les différentes souspopulations génotypiques de C. albicans définies au locus CEF3 ont la même capacité à coloniser et disséminer par voie hématogène chez des malades.
Il a été montré plus récemment que de rares échanges génétiques surviennent chez C. albicans [17]. Cette possibilité de recombinaisons explique que la structure populationnelle de
C. albicans n’est pas strictement clonale. Le « déséquilibre de liaison » de
C. albicans n’est donc pas absolu, et la capacité à prédire un génotype multilocus à partir d’un marqueur unique peut être prise en défaut. Nous avons donc complété l’étude du lien génotype-pouvoir pathogène en caractérisant les trois séries de souches au niveau de dix autres loci microsatellites polymorphes (Multi-Locus Microsatellite Typing, MLMT). La combinaison des onze marqueurs couvrant 7 des 8 chromosomes de C. albicans a permis d’augmenter le pouvoir discriminant à 0,999. Un total de 174 souches a été typé au niveau des 11 loci, générant 168 combinaisons génotypiques. L’analyse par la méthode UPGMA b a révélé 4 clades identifiés de I à IV, dont 3 sont organisés en sous clades (IIa, IIb et IIc ; IIIa et IIIb ; IVa et IVb ; Figure 1). Le clade I est apparu largement dominant avec 37 % des isolats. Aucune relation statistique entre le caractère invasif, colonisant ou commensal des souches, et leur répartition au sein des clades et sous clades, n’a été mise en évidence. Ces résultats obtenus dans notre laboratoire par MLMT sont à rapprocher de ceux obtenus par Multi-Locus Sequence Typing (MLST), une méthode basée sur le séquençage de régions d’ADN polymorphes. Chez C. albicans , la caractérisation par MLST de sept régions variables permet une discrimination fine et un classement des souches c. Comme le MLMT, le MLST identifie un clade dominant avec 34 % des isolats [18]. Bien que certains caractères phénotypiques (résistance à la flucytosine et à la terbinafine ; séquences de gènes codant pour des protéines de surface) prédominent dans certains clades, la méthode MLST ne montre pas d’association entre la structure génotypique et la virulence ou la nature de l’infection [19]. Les deux méthodes, MLMT et MLST, convergent donc pour indib Unweighted Pair Group Method with Arithmetic mean.
Fig. 1. — Regroupement de 174 souches de
C. albicans par la méthode UPGMA en 8 clades et sous-clades après caractérisation génotypique par Multilocus Microsatellite Typing.
quer qu’aucune population génotypique de C. albicans ne présente de capacité déterminée à disséminer par voie hématogène.
Les patients immunodéprimés colonisés par C. albicans hébergent ils une ou plusieurs sous-populations génotypiques ?
Plusieurs études ont montré une hétérogénéité de la flore oropharyngée à
C. albicans chez des patients infectés par le VIH [20]. Dans un tel modèle d’une flore muqueuse hétérogène, des sous-populations quantitativement mineures peuvent ne pas être identifiées. En effet, dans le flux d’analyse d’un laboratoire de mycologie médicale, une seule colonie fait en règle l’objet d’une identification en cas de culture positive, présupposant qu’elle est représentative de l’ensemble de la flore. Une souspopulation minoritaire mais présentant des caractères biologiques spécifiques pourrait n’être pas identifiée.
Afin de préciser ce risque, nous avons suivi pendant deux ans les patients admis pour leucémie aiguë dans notre CHU. La colonisation du nez, de la gorge, des urines et des matières fécales a été étudiée deux fois par semaine pendant les phases d’aplasie thérapeutique. Durant les six premiers mois, en cas de prélèvement positif à C. albicans , jusqu’à dix colonies étaient isolées pour génotypage à l’aide d’une combinaison de 4 microsatellites présentant un pouvoir discriminant de 0.998. Sur 66 patients, 19 présentaient une colonisation multi-site répétée par C. albicans , et 8 ont été sélectionnés de façon aléatoire pour analyse génotypique. Un total de 429 isolats a été génotypé. Chez 7 patients correspondant à un total de 377 isolats, la flore colonisante était constituée d’un génotype multilocus unique au cours du temps et sur tous les sites anatomiques, sans influence de la prescription d’antifongiques. Chez un patient, 2 isolats sur 52 ont présenté une variation d’1 marqueur sur 4. Cette étude montre une forte homogénéité dans le temps et sur différents sites anatomiques de la flore colonisante à
C. albicans chez des patients atteints de leucémie aigüe de novo [21]
ETUDES EXPERIMENTALES
IN VITRO
La paroi de
C. albicans est elle impliquée dans l’interaction avec les entérocytes ?
L’interaction avec la muqueuse digestive est la première étape de la colonisation par C. albicans . La paroi qui entoure la cellule fongique est l’interface avec les cellules de l’hôte. Sa couche la plus externe est constituée de phosphopeptidomannane, un polymère de protéines et de mannose qui présente notamment des résidus mannose en liaisons α-1,2 et β-1,2 [22]. Il a été montré que les β-1,2 mannosides sont impliqués dans l’adhérence de C. albicans au macrophage via la reconnaissance de la galectine 3 [23].
Afin d’explorer les mécanismes cellulaires de l’interaction entre C. albicans et la muqueuse digestive, nous avons développé un modèle in vitro d’adhérence de blastospores de
C. albicans avec des cellules Caco-2. Cette lignée cellulaire qui dérive d’un adénocarcinome colorectal présente à confluence les caractères d’entérocytes différentiés. Ce modèle a été utilisé pour préciser la contribution des résidus mannose de paroi dans l’adhérence aux entérocytes. La combinaison d’une approche directe (effet inhibiteur d’anticorps monoclonaux anti-α-1,2 et β-1,2 mannosides) et d’une approche indirecte (effet compétiteur de différents sucres dont des mannoté- traoses de synthèse) a montré le rôle des α-1,2 et des β-1,2 mannosides dans l’adhérence de C. albicans aux cellules Caco-2. L’étude en microscopie confocale de co-cultures
C. albicans — Caco-2 a d’autre part objectivé la présence d’oligomannosides dans la région apicale des cellules digestives, autours de levures, suggé- rant que C. albicans libère des fractions mannosidiques au contact de la cellule épithéliale de l’hôte (Figure 2). Ces observations convergent pour suggérer un rôle de la composante mannosidique de paroi dans l’interaction de C. albicans avec la muqueuse digestive [24]. Elles sont en accord avec l’expression de la galectine 3 par les cellules épithéliales intestinales [25], et avec des observations in vivo dans un modèle de colonisation intestinale chez le souriceau, qui montrent le rôle compétiteur de β-1,2 mannosides sur la colonisation par C. albicans [26].
L’interaction
C. albicans — cellules épithéliales est elle dépendante du type cellulaire ?
C. albicans peut coloniser différents sites anatomiques au niveau du tube digestif, provoquant des formes cliniques invasives ou non invasives. Des travaux antérieurs ont montré deux mécanismes d’invasion de cellules épithéliales buccales par C.
albicans — un mécanisme impliquant des forces physiques liées à la filamentation, et la sécrétion par
C. albicans d’enzymes (aspartyl protéases) [27] — un mécanisme d’internalisation par la cellule impliquant la voie de la E-cadhérine [28]. Nous avons ici comparé l’interaction de C. albicans avec des cellules épithéliales intestinales et
Fig. 2. — Immunolocalisation en microscopie confocale d’épitopes beta-mannosidiques lors de co-cultures C. albicans -Caco2. Il s’agit d’un double marquage — par la phalloidine révélant l’actine au niveau de la bordure en brosse en rouge — par 5B2, un anticorps monoclonal révélant les béta-mannosides en vert. A, 30 minutes d’interaction : des ilots de matériel réagissant avec 5B2 sont présents à la surface de la cellule autours des levures (flèches).
B, 12 heures d’interaction : en coupe verticale des épitopes béta-mannosidiques sont détectés à la surface apicale des cellules. La barre d’échelle correspond à 5 micromètres ( extrait de réfé- rence 24 ).
buccales en utilisant le modèle entérocytaire Caco-2 préalablement optimisé, et le modèle TR-146 qui dérive d’un adénocarcinome buccal d.
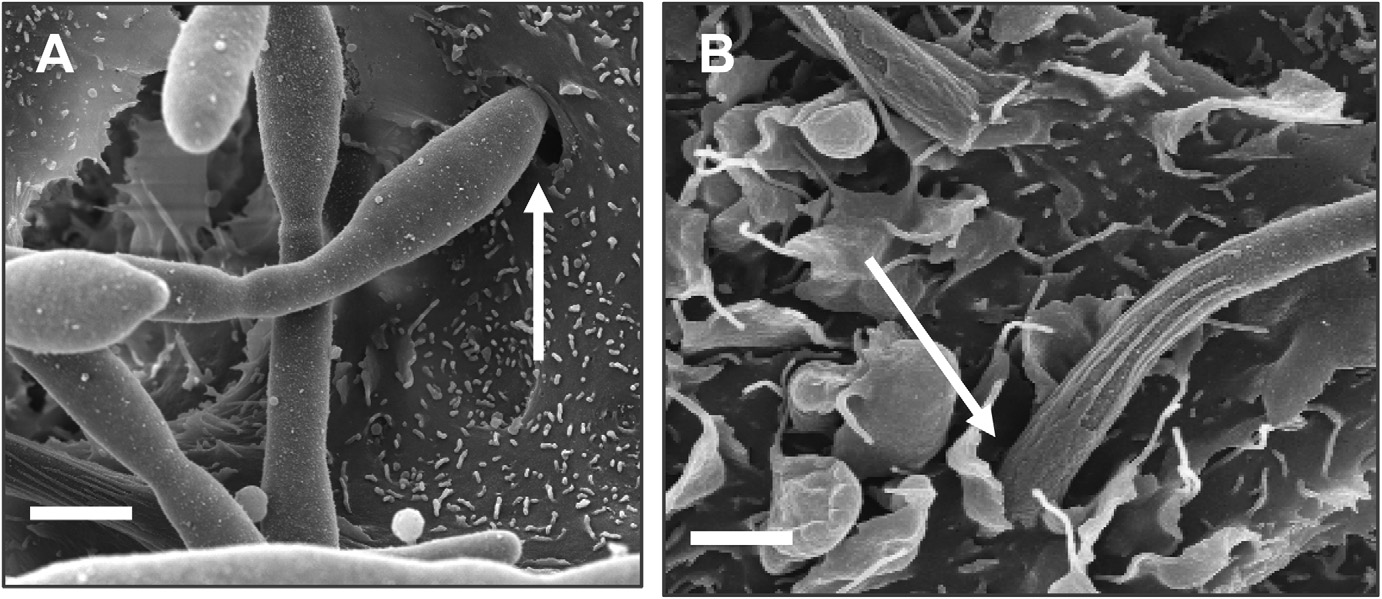
Pour tous les caractères étudiés : — adhérence des blastospores aux cellules épithé- liales — longueur des hyphes au contact des cellules — capacité d’invasion des cellules — capacité de migration trans-cellulaire — effet cytopathogène, C. albicans a révélé un comportement différent dans les deux modèles cellulaires [29]. Ainsi, l’adhérence est plus importante, l’invasion plus précoce et plus marquée (Tableau 1), la migration transcellulaire et l’effet cytopathogène significativement plus élevés avec les cellules épithéliales orales par rapport aux entérocytes. De plus, au niveau des entérocytes, les hyphes sont plus longues et regroupées en aggrégats à la surface cellulaire. Enfin, les mécanismes d’invasion diffèrent entre les deux types cellulaires.
Nos observations ont en effet confirmé que C. albicans envahit les cellules épithé- liales buccales par un processus de pénétration active du champignon et par un processus d’internalisation par la cellule. En revanche, seul le processus de péné- tration active a été observé au niveau des entérocytes [29] (Figure 3).
Ces résultats indiquent que différents types de cellules épithéliales présentent une susceptibilité variable à C. albicans , et que selon le type cellulaire avec lequel il interagit,
C. albicans peut développer des stratégies différentes, confirmant la complexité des échanges hôte-microorganisme à cette interface.
d Une partie de ces travaux a été réalisée pendant le stage post-doctoral de Frédéric Dalle dans le laboratoire du Pr. Hübbe au Robert Koch Institute de Berlin.
Tableau 1. — Internalisation de
C. albicans au niveau de cellules épithéliales buccales (TR-146) ou intestinales (Caco-2). Pour ces expériences, les tapis cellulaires sont infectés par les blastospores de C. albicans SC5314, et le pourcentage de levures internalisées à 1h, 2h et 3h de culture est mesuré. Les valeurs présentées correspondent à la moyenne et à l’écart type d’au moins 3 expériences réalisées en duplicat. * : p. = 0.024 par rapport à Caco-2 pour la même durée d’interaction ; ** p. = 0.004 par rapport à Caco-2 à 2h d’interaction ; nd : non déterminé ( d’après référence 29 ).
Type cellulaire Pourcentage d’internalisation 1 h 2 h 3 h Caco-2 15/21 jours de culture 1.3 +/- 0.52 10.8 +/- 4.19 38.6 +/- 11.59 TR-146 3 jours de culture 10.3* +/- 1.5 40.3* +/- 4.91 75.6* +/- 9.52 TR 146 23 jours de culture 2.6 +/- 1.14 25.6** +/- 3.28 nd Fig. 3. — Candida albicans présente 2 mécanismes d’invasion de cellules épithéliales présentés sur les photographies 3A et 3B. A : Pénétration active par
C. albicans SC5314 au niveau de la région apicale de la cellule. On observe une dépression de la surface cellulaire (flèche) au point de pénétration du micromycète. B : Endocytose par la cellule des hyphes de C. albicans SC5314 ;
noter les projections membranaires de la cellule en forme de pseudopodes (flèche) qui viennent entourer le filament. La barre d’échelle correspond à 3 micromètres. Les 2 mécanismes d’invasion (A et B) sont observés au niveau des cellules épithéliales orales. Seule la pénétration active par C. albicans (A) est observée au niveau des entérocytes ( d’après référence 29 ).
CONCLUSION
Commensal habituel du tractus digestif chez l’homme sain,
C. albicans est également le plus fréquent des agents responsables d’IFI chez les sujets malades. Ce micromycète est donc un remarquable organisme modèle pour étudier les bases fondamentales de l’adaptation et du pouvoir pathogène chez les microorganismes eucaryotes.
En nous appuyant sur trois séries de souches parfaitement caractérisés en terme de contexte clinique d’isolement (souches septicémiques ou non-septicémiques, isolées chez des malades ; souches commensales, isolées chez des sujets bien portants) nous avons montré qu’aucune des sous-populations génotypiques de C. albicans ne présente un pouvoir pathogène intrinsèque qui lui serait propre. Ce sont donc bien le terrain de l’hôte et la modulation des caractères phénotypiques de C. albicans par son microenvironnement (muqueuses, tissus) qui conditionnent la transition commensal-pathogène chez ce microorganisme.
Nous avons ainsi choisi d’étudier l’impact du microenvironnement sur les caractères phénotypiques de C. albicans en modélisant in vitro l’interaction C. albicans-cellules épithéliales, et en comparant deux lignées cellulaires distinctes du tractus digestif, les cellules épithéliales buccales et les cellules épithéliales intestinales. Ces deux types cellulaires sont en effet des interfaces habituelles avec C. albicans chez le sujet sain, mais au plan physiopathologique la muqueuse buccale est le siège d’infections superficielles alors que la muqueuse intestinale est la porte d’entrée la plus fréquente des formes invasives hématogènes. La mise en évidence chez Caco2 d’un unique mécanisme d’invasion, avec une réduction de l’adhérence, de l’invasion et de l’effet cytopathogène par rapport à des cellules buccales illustre la remarquable adaptabilité de C.albicans à son microenvironnement cellulaire.
Dans la continuité de ces résultats, nos travaux en cours ont pour objectif de comprendre les mécanismes mis en jeu par C .albicans pour transloquer à travers une muqueuse intestinale qui semble donc lui opposer une résistance plus importante que l’épithélium buccal. Différents aspects sont abordés, notamment la capacité d’adhérence et d’invasion cellulaire, la mort cellulaire par apoptose et nécrose, ainsi que le stress oxydatif induits dans les cellules épithéliales au cours de l’interaction avec C. albicans . Nous explorons également le rôle des jonctions serrées des entérocytes dans la protection de la muqueuse intestinale. Ces résultats seront interprétés dans le contexte global du transcriptome différentiel des cellules buccales et intestinales, que nous avons analysé à la phase précoce de leur interaction avec C. albicans . Pour ces travaux, la souche de référence SC 5314 est complétée par les souches cliniques de notre collection, et par une collection de mutants perte- et gain de fonction e. L’ensemble des données de ce programme permettra une première approche du dialogue complexe qui s’établit entre C. albicans et la muqueuse intestinale à la phase précoce des candidoses invasives d’origine endogène.
BIBLIOGRAPHIE [1] Pfaller M., Diekema D. — Epidemiology of invasive mycoses in North America.
Crit. Rev.
Microbiol ., 2010, 36 , 1-53.
e Etablie dans le laboratoire de Christophe d’Enfert à l’Institut Pasteur de Paris.
[2] Martin G., Mannino D., Eaton S., Moss M. — The epidemiology of sepsis in the United States from 1979 through 2000. New Engl. J. Med ., 2003, 348, 1546-54.
[3] Pfaller M., Diekema D. — Epidemiology of invasive candidiasis : a persistent public health problem. Clin. Microbiol. Rev ., 2007, 20 , 133-63.
[4] Diekema D.J., Pfaller M.A. — Nosocomial candidemia: an ounce of prevention is better than a pound of cure. Infect. Cont. Hosp. Ep. , 2004, 25 , 624-6.
[5] Wisplinghoff H., Bischoff T., Tallent S. et al. — Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study.
Clin.Infect.
Dis ., 2004, 39 , 309-17.
[6] Asmundsdottir L., Erlendsdottir H., Gottfredsson M. — Increasing incidence of candidemia: results from a 20-year nationwide study in Iceland. J. Clin. Microbiol ., 2002, 40, 3489-92.
[7] Poikonen E., Lyytikäinen O., Anttila V., Ruutu P. — Candidemia in Finland 1995-1999.
Emerg. Infect. Dis ., 2003, 9 , 985-90.
[8] Arendrup M.C., Fuursted K., Gahrn-Hansen B. et al . — Seminational surveillance of fungemia in Denmark: notably high rates of fungemia and numbers of isolates with reduced azole susceptibility. J. Clin. Microbiol ., 2005, 43 , 4434-40.
[9] Lass-Flörl C. — The changing face of epidemiology of invasive fungal disease in Europe.
Mycoses , 2009, 52, 197-205.
[10] Almirante B., Rodriguez D., Park B.J. et al . — Epidemiology and predictors of mortality in cases of Candida bloodstream infection: results from population-based surveillance, Barcelona, Spain, from 2002 to 2003. J. Clin. Microbiol ., 2005, 43 , 1829-35.
[11] Nucci M., Anaissie E. — Revisiting the source of candidemia: skin or gut ?
Clin. Infect. Dis ., 2001, 33 , 1959-67.
[12] Pujol C., Reynes J., Renaud F. et al . — The yeast Candida albicans has a clonal mode of reproduction in a population of infected human immunodeficiency virus-positive patients.
Proc. Natl. Acad. Sci. USA , 1993, 90 , 9456-9.
[13] Tibayrenc M., Kjellberg F., Arnaud J. et al . — Are eukaryotic microorganisms clonal or sexual ? A population genetics vantage.
Proc. Natl. Acad. Sci. U S A , 1991, 88 , 5129-33.
[14] Bretagne S., Costa J.M., Besmond C. et al . — Microsatellite polymorphism in the promoter sequence of the elongation factor 3 gene of Candida albicans as the basis for a typing system.
J.
Clin. Microbiol. , 1997, 35 , 1777-80.
[15] Dalle F., Franco N., Lopez J. e t al . — Comparative genotyping of Candida albicans bloodstream and nonbloodstream isolates at a polymorphic microsatellite locus.
J. Clin. Microbiol ., 2000, 38 , 4554-9.
[16] Dalle F., Dumont L., Franco N. et al . — Genotyping of Candida albicans oral strains from healthy individuals by polymorphic microsatellite locus analysis.
J. Clin. Microbiol ., 2003, 41 , 2203-5.
[17] Bennett R.J., Johnson A.D. — Completion of a parasexual cycle in Candida albicans by induced chromosome loss in tetraploid strains. Embo. J ., 2003, 22, 2505-15.
[18] Odds F.C., Bougnoux M.E., Shaw D.J. et al . — Molecular phylogenetics of Candida albicans.
Eukaryot. Cell ., 2007, 6, 1041-52.
[19] Odds F.C. — Molecular phylogenetics and epidemiology of Candida albicans.
Future Micro- biology , 2010, 5, 67-79.
[20] Reynes J., Pujol C., Moreau C. et al . — Simultaneous carriage of candida albicans strains from HIV-infected patients with oral candidiasis: multilocus enzyme electrophoresis analysis.
FEMS Microbiol. Lett. , 1996, 137 , 269-73.
[21] Dalle F., Lafon I., L’Ollivier C. et al . — Prospective analysis of the genotypic diversity and dynamics of the Candida albicans colonizing flora in neutropenic de novo acute leukemia patients. Haematologica , 2008, 93 , 425-31.
[22] Chauhan N., Li D., Singh P., Calderone R., Kruppa M. — The cell wall of Candida spp. In:
Calderone RA, editor. Candida and Candidiasis . Washington DC: ASM Press ; 2002.
[23] Fradin C., Poulain D., Jouault T. — Beta-1,2-linked oligomannosides from Candida albicans bind to a 32-kilodalton macrophage membrane protein homologous to the mammalian lectin galectin-3. Infect. Immun. , 2000, 68 , 4391-8.
[24] Dalle F., Jouault T., Trinel P.A. et al . — Beta-1,2- and alpha-1,2-linked oligomannosides mediate adherence of Candida albicans blastospores to human enterocytes in vitro . Infect.
Immun. , 2003, 71, 7061-8.
[25] Barondes S.H., Cooper D.N., Gitt M.A., Leffler H. — Galectins. Structure and function of a large family of animal lectins. J. Biol. Chem. , 1994, 269 , 20807-10.
[26] Dromer F., Chevalier R., Sendid B. et al . — Synthetic Analogues of beta-1,2 Oligomannosides Prevent Intestinal Colonization by the Pathogenic Yeast Candida albicans.
Antimicrob.
Agents Chemother ., 2002, 46 , 3869-76.
[27] Felk A., Kretschmar M., Albrecht A. et al . — Candida albicans hyphal formation and the expression of the Efg1-regulated proteinases Sap4 to Sap6 are required for the invasion of parenchymal organs. Infect. Immun. , 2002, 70 , 3689-700.
[28] Phan Q., Myers C., Fu Y. et al . — Als3 is a Candida albicans invasin that binds to Cadherins and induces endocytosis by host cells.
PLoS Biology , 2007, 5 , e64.
[29] Dalle F., Wächtler B., L’Ollivier C. et al . — Cellular interactions of Candida albicans with human oral epithelial cells and enterocytes.
Cell. Microbiol. , 2010, 12, 248-71.
Bull. Acad. Natle Méd., 2012, 196, no 1, 139-149, séance du 3 janvier 2012