Résumé
L’histoire de l’immunosuppression en transplantation d’organes est un exemple typique offrant un raccourci des changements dans l’évolution des concepts. On est, en effet, passé d’une médecine expérimentale source de découvertes biologiques à une biologie initiatrice de la pré-synthèse de médicaments. Par exemple, dans les années 1950-1980, l’azathioprine considérée d’abord comme un traitement de la prolifération leucémique été utilisée ensuite expérimentalement en transplantation pour ses effets immunosuppresseurs, et la ciclosporine développée comme un anti-protozoaire s’est révélée par hasard être un immunosuppresseur puissant. A chaque fois, l’approche expérimentale a permis la découverte de mécanismes moléculaires fondamentaux jusque-là inconnus. Aujourd’hui, c’est la compréhension de mécanismes moléculaires tels les synapses immunologiques, qui explique l’explosion de la synthèse de nouvelles molécules immunosuppressives (anticorps monoclonaux, petites protéines ubiquitaires, protéines de fusion) révolutionnant complètement le domaine par leur impact direct sur la survie des allogreffes, la survie des patients et les complications à court, moyen et long terme de ces traitements. On a, là, l’exemple d’un transfert direct et rapide de la recherche fondamentale d’amont vers la valorisation industrielle et l’utilisation clinique de produits, qui est à la base de la « biotechnologie ».
Summary
The history of immunosuppression in organ transplantation is an example of evolution from ‘‘ experimental ’’ medicine/biology to biological knowledge and drug development. For example, in the 1950-60s, azathioprine, a drug first noted for its anti-proliferative/antileukemic properties, started to be used as an immunosuppressant after organ transplantation. Cyclosporine A, first considered as an antiprotozoal agent, was subsequently discovered to be a powerful immunosuppressant. In each case, the experimental approach led to the discovery of previously unknown basic molecular mechanisms. Now, the dissection of basic phenomena such as the immunological synapse has generated a large array of new agents (monoclonal antibodies, small molecules, fusion molecules) that may revolutionize the field of organ transplantation by improving patient and allograft survival and by reducing shortand long-term adverse effects. This field also provides examples of direct transfer from basic research to industrial bioengineered immunosuppressants.
INTRODUCTION
La transplantation rénale est le meilleur traitement de l’insuffisance rénale chronique terminale, tant au point de vue de la qualité de vie que de la survie du patient à long terme. La transplantation nécessite la prise permanente au long cours de médicaments immunosuppresseurs, dont les cibles sont non-spécifiques, ubiquitaires et surtout induisent des effets secondaires très importants. Ces médicaments immunosuppresseurs qui étaient au nombre de trois dans les années 70 (corticosté- roïdes, azathioprine, sérums anti-lymphocytaires) entraînaient une survie d’allogreffe ne dépassant pas 60 % à 70 % à un an et s’accompagnaient d’une mortalité non négligeable. Par exemple l’introduction des anti-calcineurines (cyclosporine A, Tacrolimus) au début des années 1980 a permis une diminution importante de l’incidence du rejet aigu d’allogreffe, et une meilleure survie d’allogreffe et de façon surprenante une meilleure connaissance, grâce à ces drogues, des mécanismes de transmission du signal dans le lymphocyte T, auparavant inconnus. Mais ces médicaments n’ont eu aucune incidence sur la survie du greffon à long terme en raison de leur néphrotoxicité et sur la survie des patients.
Des progrès considérables dans la compréhension du rôle des lymphocytes T et B, des cellules présentatrices de l’antigène (CPA), de leurs interactions et de l’activation du lymphocyte T dans les laboratoires de recherche fondamentale ont permis le développement d’approches améliorant l’acceptation des allogreffes et induisant une meilleure tolérance. Ces nouvelles drogues immunosuppressives incluent de petites molécules, des anticorps monoclonaux et plus récemment des protéines de fusion [1]. Ces petites molécules thérapeutiques, qui sont dérivées de produits microbiologiques, ciblent des circuits immunologiques qui sont hautement conservés pendant l’évolution et sont un sujet de recherche de premier plan en immunologie des allogreffes. Une autre alternative est d’utiliser des anticorps monoclonaux (Abs) qui ciblent des molécules spécifiques de façon très précise et avec une haute affinité. La plupart de ces Abs détruisent les lymphocytes T ou B bien que certains Abs non-déplétants puissent modifier les réponses immunologiques sans compromettre les sous-populations lymphocytaires. Cependant, la cible de ces Abs est restreinte au compartiment extra-cellulaire (récepteurs et molécules d’adhésion) et leur bio-activité est limitée par la production d’anticorps humains anti-Abs de souris et d’anticorps anti-idiotypiques. Pour échapper à cette immunogénicité, des anticorps thérapeutiques chimériques ou humanisés ont été développés en utilisant des méthodes de bioingéniérie.
Ces nouvelles molécules demandent de nouvelles méthodes de production, des nouvelles voies d’administration et une nouvelle pratique de la part des médecins et des malades et sont résumées dans le tableau 1.
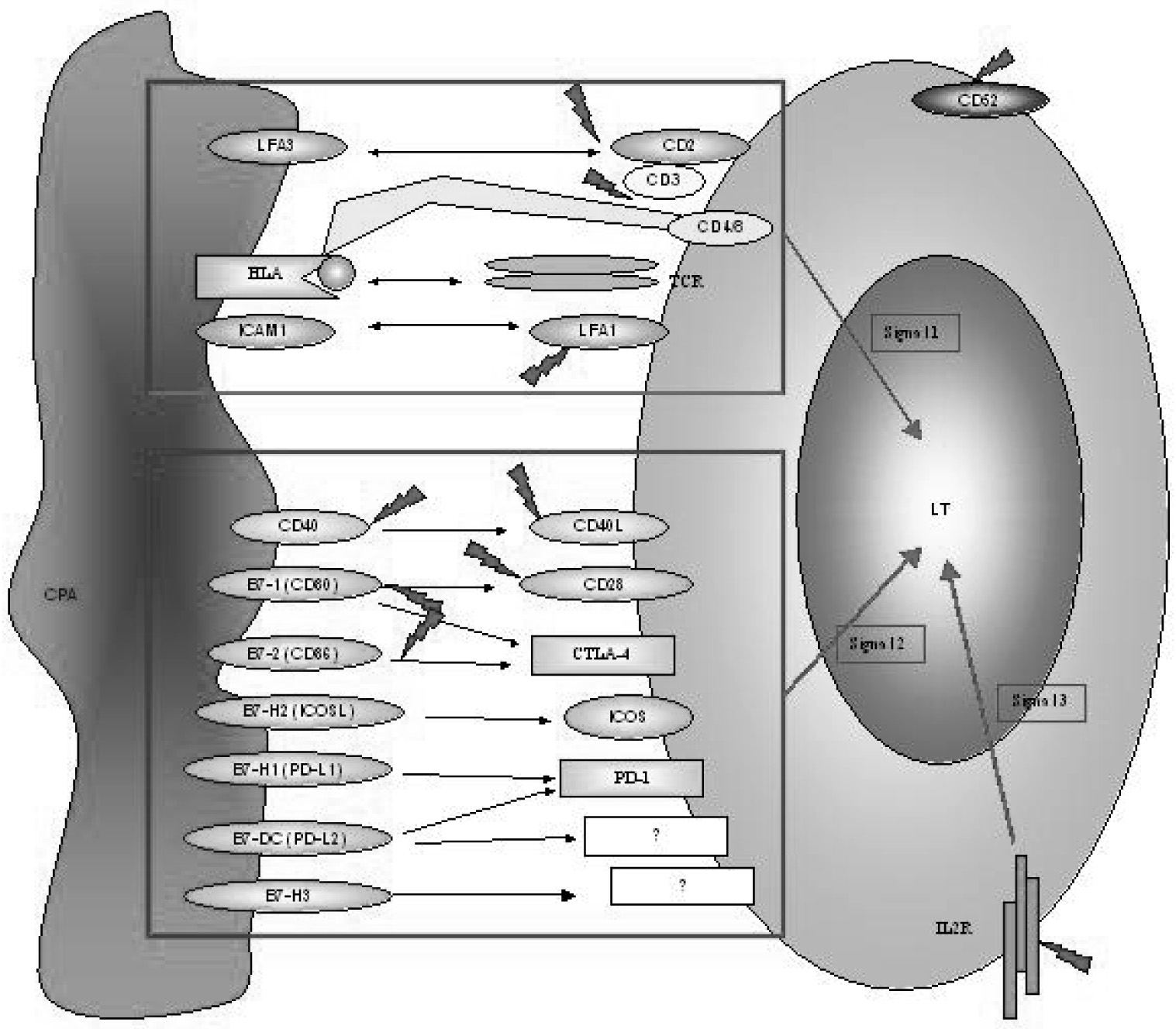
Le rejet d’allogreffe est médié par les lymphocytes T et leurs récepteurs à l’antigène (TCR), qui reconnaît spécifiquement les allo-antigènes présentés par les molécules du complexe majeur d’histocompatibilité (CMH), les lymphocytes T nécessitant trois signaux successifs pour être totalement matures. Les antigènes (Ags) sont présentés aux lymphocytes T par des cellules présentatrices de l’antigène (CPA) provenant soit du donneur (présentation directe) soit du receveur (présentation indirecte). La reconnaissance TCR-Ag/CMH est le premier signal qui conduit à l’activation T et qui inclut la voie de la calcineurine. Cette interaction est favorisée par des molécules accessoires (CD2, CD4, CD8, LFA-1) qui forment la synapse immunologique, stabilise l’interaction, et permettent le recrutement de molécules participant à la signalisation T, comme les tyrosine-kinases. D’autres facteurs de co-stimulation sont nécessaires à l’activation et à la prolifération des lymphocytes T.
Ils constituent le deuxième signal qui déclenche l’activation T. A la fois le premier et le deuxième signal aboutissent à la pleine activation et à la différenciation du lymphocyte T et à la sécrétion ultérieure de cytokines ou d’interleukines comme l’IL2 ou des chemokines.
L’interaction de l’IL2 avec son récepteur de haute affinité (chaine α/CD25) sur le lymphocyte T induit la transcription de l’ADN et la progression du cycle cellulaire de la phase G1 à S. Ces événements constituent le troisième signal de l’activation lymphocytaire. Par exemple, les Abs anti CD25 sont couramment utilisés en thérapeutique d’induction juste après la transplantation dans de nombreux protocoles immunosuppresseurs dont le but final est de réduire, voire d’éliminer le besoin d’une immunosuppression au long cours, comme celle utilisant les corticostéroïdes [2].
INHIBITION DU SIGNAL 1 DE L’ACTIVATION DU LYMPHOCYTE T
Anticorps anti CD3
La molécule CD3 étant indispensable pour la transmission du signal 1 dans le lymphocyte T, un anticorps monoclonal anti-CD3 de souris fut utilisé dans les années 1990 pour un traitement d’induction en transplantation, ainsi que le traitement du rejet aigu d’allogreffe cortico-résistant. Cet anticorps fut ensuite abandonné en raison de ses effets secondaires : intense immunosuppression, apparition d’un syndrome de libération de cytokines et inactivation de l’anticorps en raison de la synthèse d’anticorps anti-anticorps xénogéniques. Cependant, un anticorps monoclonal OKT3 humanisé, et non activant avec des mutations dans la région CH2 de la molécule et une affinité réduite pour le récepteur Fc a été développé et utilisé pour traiter l’apparition récente du diabète autoimmun [3].
En transplantation d’organes, un autre anticorps anti-CD3 (visilizumab) a été utilisé pour traiter les réactions du greffon contre l’hôte résistant aux corticoïdes [4], Il est caractérisé par un isotype IgG2 muté, une absence de liaison aux récepteurs Fc et la capacité d’induire une apoptose sélective des lymphocytes T grâce à sa liaison à la molécule CD3E (epsilon) [5, 7], sans libération de cytokines. Bien que des essais de phase I aient été entrepris [7], le développement de cet anticorps semble arrêté.
Anticorps anti-CD2
La synapse immunologique entre le lymphocyte T et la cellule présentatrice d’antigène est composée de plusieurs protéines transmembranaires (CD2, LFA-1, CD4, CD8) qui forment une sorte d’anneau autour du récepteur T, dans lequel chacune interagit avec son partenaire. Un anticorps monoclonal anti-CD2 de rat a été développé. Il reconnaît tous les lymphocytes T matures, 95 % des thymocytes, la majorité des cellules NK, mais aucun lymphocyte B. L’anticorps anti-CD2 (BTI-322) prévient et traite le rejet d’allogreffe dans des modèles expérimentaux [8]. Il a été utilisé en transplantation rénale humaine, dans le traitement de la réaction du greffon contre l’hôte après greffe de moelle, et en transplantation hépatique [9].
Anticorps anti-CD4
Les anticorps monoclonaux anti-CD4 (priliximab) ont montré un certain nombre de potentialités immunosuppressives dans des études pilotes [10]. Ils souvent associés à un taux élevé d’épisodes de rejet aigu (50 % dans les premiers mois posttransplantation) [11] expliqué par l’apparition d’anticorps anti-murin et nécessitant donc une humanisation de la molécule.
Anticorps anti-LFA1
La molécule LFA1 joue un rôle capital dans l’architecture de la synapse immunologique. C’est une molécule d’adhésion entre les lymphocytes et les cellules endothéliales par interaction avec la molécule d’adhésion (ICAM)-1. Des anticorps anti-ICAM1 (enlimomab) n’ont pas pu pourtant prévenir le rejet aigu après transplantation rénale chez les primates et l’homme [12, 13]. Un anticorps monoclonal anti-LFA1 (CD11a) a montré son efficacité dans des systèmes de transplantations expérimentales chez la souris (allogreffes de peau et de cœur) et les primates [14, 15] .
En revanche, il est peu efficace sur l’incidence du rejet aigu d’allogreffe rénale humaine et est associé à une incidence plus importante de développement de cancers [16].
INHIBITION DU SIGNAL 2 DE L’ACTIVATION DU LYMHPOCYTE T :
BLOCAGE DE LA COSTIMULATION
De nombreuses études in vitro et in vivo ont démontré que l’inhibition du second signal pouvait conduire à l’induction d’anergie et/ou de tolérance aux allogreffes chez le rongeur et qu’elle était donc potentiellement utilisable chez l’homme. Ce second signal vient de l’interaction entre des molécules situées sur la cellule présentatrice de l’antigène (CD40, CD80, CD86, ICOSL, PD-L1, PD-L2, B7-H3) et leurs ligands sur le lymphocyte T pouvant avoir un effet soit stimulateur (CD40L, CD28) soit inhibiteur (CD152) (figure 1) [17-18].
Le système CD40-CD154 (CD40L)
CD40 est une molécule membre de la famille du récepteur du TNF et constitutivement exprimée sur les CPA, les cellules endothéliales et les fibroblastes. CD40 joue un rôle majeur dans l’activation B, la production d’immunoglobulines et le développement des cellules B mémoires. Son ligand CD154, est exprimé à la membrane des lymphocytes T dès l’engagement de l’antigène au récepteur T sur les lymphocytes T CD4+ et certains lymphocytes T CD8+.
• Anticorps anti-CD154 Le ciblage thérapeutique de la voie de CD40 avait produit des résultats spectaculaires sur la survie d’allogreffe et l’induction de tolérance chez les rongeurs et chez les primates [19] ; cependant les résultats n’ont pas été confirmés en transplantation rénale humaine, avec des taux de rejet trop importants [20], mais aussi avec une très haute incidence de complications thrombo-emboliques, sans doute en relation avec l’existence de la molécule CD 154 sur les cellules endothéliales et les plaquettes [21].
• Anticorps anti CD40 Deux anticorps monoclonaux Ch5 D12 et CHI 220 anti CD40 ont été testés chez les primates. Ils ont montré une activité importante in vivo en prolongeant la survie d’allogreffe d’îlots pancréatiques et de reins chez les primates [22, 23], mais aucune tolérance immunitaire à long terme ne fut observée. Cependant, la voie CD40 reste une voie intéressante pour le futur.
Fig. 1. — Activation et prolifération des lymphocytes T : synapse immunologique et cibles des principaux anticorps Les cibles des anticorps sont soulignées. CPA : cellules présentatrices de l’antigène, CTLA :
cytotoxic-T lymphocyte — associated antigen, HLA : human leukocyte antigen, ICAM :
intercellular adhesion molecule, ICOS : inducible costimulator, IL-2R : interleulin 2 receptor, LFA : lymphocyte function — associated antigen, PD : programmed death, TCR : T-cell receptor, LT : lymphocyte T.
Le système CD28-B7
Les molécules CD80 et CD86, connues aussi sous le nom de B7-1 et B7-2 sont exprimées sur les CPA, les lymphocytes B et les cellules endothéliales activées. Elle interagissent avec leurs homologues CD28 et CD152 sur le lymphocyte T, soit pour induire une stimulation (CD80-CD28 ou CD86-CD28) ou une inhibition (CD80- CD152 et CD86-CD152), CD28 étant le récepteur de costimulation « central » dans l’activation T. En contraste avec CD28, son homologue CTL A4 (CD152) n’est exprimé que de façon transitoire après activation T et délivre un signal négatif qui diminue l’activation T et la prolifération. Deux stratégies différentes ont été utilisées pour cibler cette voie. La première utilise des protéines recombinantes qui entrent en compétition avec CD28 pour son interaction avec CD86/CD80 et induit une inactivation T. La seconde stratégie, à l’encontre de la première, aboutit à une activation de CD28 en utilisant un anticorps monoclonal humanisé super-agoniste de CD28(IgG 4 K). Cet anticorps entraîne la prolifération de la population de cellules T CD4+ CD25+ régulatrice en stimulant les lymphocytes T indépendamment de l’activation du récepteur T.
• CTLA4 Ig
La protéine recombinante de fusion soluble immunoglobulinique CTLA4-Ig abatacept a été développée pour inhiber compétitivement l’interaction de CD28 avec ses récepteurs CD80 et CD86. CTLA4 Ig combine l’ectodomaine de CTLA4 avec la portion Fc d’une IgG 1. Plusieurs études ont montré que CTLA4 Ig inhibait la réponse immunitaire à la fois in vivo et in vitro et prévenait le développement et la progression du rejet chronique dans des modèles animaux [24].
Cependant, CTLA4 Ig était moins efficace dans la prolongation des survies de greffes chez le primate que chez les rongeurs [25].
• LEA-29Y
Le LEA-29Y (Belatacept) est une forme de haute affinité et de deuxième génération de CTLA4 Ig. Cette molécule se fixe avec quatre fois plus d’affinité à CD86 et deux fois plus à CD80 que la première génération de CTLA4 Ig [26]. Les études chez le primate ont démontré la prévention du rejet aigu et la prolongation de survie d’allogreffe de rein. Une étude clinique de phase II, incluant deux cent vingt-six patients transplantés rénaux de novo sous traitement avec Belatacept, a montré une efficacité équivalente à celle du groupe contrôle traité par ciclosporine en matière de prévention du rejet aigu d’allogreffe prouvé histologiquement à douze mois. Les malades sous Belatacept présentaient également une incidence plus faible de néphropathie chronique d’allogreffe comparés à ceux sous ciclosporine [27]. Cet essai du LEA a introduit le concept de l’utilisation de longue durée d’une molécule immunosuppressive recombinante sans effets déplétifs pour réduire l’effet toxique de petites molécules immunosuppressives.
• Anti-CD28
TGN-1412 est un super agoniste humanisé qui stimule la prolifération des lymphocytes T, indépendamment de l’activation du récepteur du lymphocyte T. Le TGN-1412 stimule CD28, active et stimule préférentiellement les cellules T auxiliaires de type TH-2, en particulier la sous-population T CD4+ CD25+ régulatrice en induisant une légère lymphocytose sans effet toxique ni pro-inflammatoire. Cet anticorps a été testé en phase 1 chez les volontaires sains avec le but d’une éventuelle utilisation thérapeutique mais a entraîné une libération massive de cytokines aboutissant à une défaillance aiguë de nombreux organes. Le développement de cet anticorps a été arrêté [28].
INHIBITION DU SIGNAL 3 DE L’ACTIVATION DU LYMPHOCYTE T •
Anti CD25
Les anticorps monoclonaux anti-CD25 sont maintenant largement utilisés en transplantation chez des patients à risque immunologique faible ou modéré. La subunité α du récepteur de l’IL2, ou CD25, n’est rencontrée que sur les lymphocytes T activés. Le blocage de CD25 par des anticorps spécifiques prévient l’activation T dépendant de l’IL2. Il existe deux types d’anticorps anti-CD25 : le basiliximab chimérique (composé d’approximativement 75 % de protéine humaine et 25 % de protéine murine) et le daclizumab humanisé (composé approximativement à 90 % humain et à 10 % murin) [29]. Leur effet immunosuppresseur et leur peu d’effets secondaires ont entraîné leur large utilisation en clinique humaine en combinaison avec de faibles doses d’anti-calcineurines.
• Anti-CD52/CAMPATH-1H
Le récepteur CD52 est une glycoprotéine de membrane présente sur les lymphocytes T, B, les monocytes, les macrophages, les cellules NK et les granulocytes.
L’anticorps monoclonal CAMPATH-1H (alemtrizumab) est un anticorps humanisé qui a été utilisé d’abord pour le traitement des leucémies myéloïdes chroniques réfractaires [30] et ensuite en transplantation d’organes. La combinaison d’un anticorps anti-CD52 associé à la rapamycine a induit une tolérance chez treize receveurs d’allogreffe rénale sous faible dose d’anti-calcineurine et administration de CAMPATH-1H [31]. Cette étude a été suivie d’une autre avec résultat à trois ans toujours maintenu en monothérapie sous sirolimus ; cependant, en raison d’une incidence assez élevée de rejets aigus précoces, les auteurs ont recommandé une modification de la stratégie immunosuppressive, incluant un traitement bref par des anti-calcineurines [32].
DEPLETION DES LYMPHOCYTES B •
Anticorps anti-CD20
Les anticorps anti-CD20 ont montré leur intérêt en transplantation d’organes comme agent de déplétion des lymphocytes B depuis que les anticorps anti-HLA ont vu leur rôle mieux défini dans certains types de rejets aigus et chroniques. La molécule CD20 est exprimée de façon très large sur toute la lignée B, sauf sur les plasmocytes. L’anticorps monoclonal chimérique rituximab est utilisé dans certaines circonstances précises : — prévention du rejet humoral chez des patients lourdement immunisés ; — transplantations ABO incompatibles [33] ; — traitements de certains types de rejet aigu [31] ; — désensibilisation chez des patients immunisés contre le système HLA.
Le Rituximab est utilisé en combinaison avec des médicaments immunosuppresseurs, des plasmaphérèses et des immunoglobulines intra-veineuses, et agit donc sur la lignée pré-plasmocytaire car le taux de génération des plasmocytes est très rapide et que, de plus, les lymphocytes B peuvent servir de cellules présentant l’antigène de type « secondaire » et donc expliquer le rôle de cet anticorps sur la diminution de la réponse T.
CONCLUSION
Les traitements immunosuppresseurs actuels ont drastiquement réduit l’incidence du rejet aigu en transplantation d’organes, mais ont eu un faible impact sur la dysfonction chronique du greffon.
La recherche fondamentale en biologique cellulaire et en immunologie a permis le développement de nouvelles molécules ciblant les lignées T ou B qui ont un rôle capital dans les mécanismes du rejet et de la tolérance. Le meilleur exemple est celui du Belatacept qui allie une possibilité d’induction de tolérance et un rôle majeur dans le traitement d’entretien et est dépourvu d’effets secondaires majeurs. Les résultats de cette molécule en transplantation rénale apparaissent très encourageants.
BIBLIOGRAPHIE [1] Creput C., Durrbach A., Deroure B., Charpentier B. — New therapeutic targets for antibodies and recombinant proteins in organ transplantation. Curr. Opin. Mol. Ther., 2007, 9, 153-159.
[2] Ter Meulen C.G., Van Riemsdijk I., Hene R.J., Christiaans M.H., Borm G.F. et al. —
Steroid-withdrawal at 3 days after renal transplantation with anti-IL-2 receptor alpha therapy :
a prospective, randomized, multicenter study. Am. J. Transplant., 2004, 4, 803-810.
[3] Herold K.C., Hagopian W., Auger J.A., Poumian-Ruiz E., Taylor L. et al. — Anti-CD3 monoclonal antibody in new-onset type 1 diabetes mellitus.
N. Engl. J. Med. , 2002, 346, 1692-1698.
[4] Carpenter P.A., Lowder J., Johnston L., Frangoul H., Khoury H. et al. — A phase II multicenter study of visilizumab, humanized anti-CD3 antibody, to treat steroid-refractory acute graft-versus-host disease. Biol. Blood Marrow Transplant., 2005, 11, 465-471.
[5] Carpenter P.A., Pavlovic S., Tso J.Y., Press O.W., Golley T. et al. — Non-Fc receptorbinding humanized anti-CD3 antibodies induce apoptosis of activated human T cells.
J.
Immunol. , 2000, 165, 6205-6213.
[6] Li B., Wang H., Dai J., Ji J., Qian W. et al. – Construction and characterization of a humanized anti-human CD3 monoclonal antibody 12F6 with effective immunoregulation functions.
Immunology, 2005, 116, 487-498.
[7] Norman D.J., Vincenti F., de Mattos A.M., Barry J.M., Levitt D.J. et al. – Phase I trial of
HuM291, a humanized anti-CD3 antibody, in patients receiving renal allografts from living donors. Transplantation, 2000, 70, 1707-1712.
[8] Snanoudj R., Rouleau M., Bidere N., Carmona S., Baron C. et al. — A role for CD2 antibodies (BTI-322 and its humanized form) in the in vivo elimination of human T lymphocytes infiltrating an allogeneic human skin graft in SCID mice : an Fcgamma receptor-related mechanism involving co-injected human NK cells. Transplantation, 2004, 78, 50-58.
[9] Lerut J., Van Thuyne V., Mathijs J., Lemaire J., Talpe S. et al. — Anti-CD2 monoclonal antibody and tacrolimus in adult liver transplantation.
Transplantation, 2005, 80, 1186-1193.
[10] Moreland L.W., Pratt P.W., Bucy R.P., Jackson B.S., Feldman J.W. et al. — Treatment of refractory rheumatoid arthritis with a chimeric anti-CD4 monoclonal antibody. Long-term followup of CD4+ T cell counts. Arthritis Rheum., 1994, 37, 834-838.
[11] Dantal J., Ninin E., Hourmant M., Boeffard F., Cantarovich D. et al . — Anti-CD4 MoAb therapy in kidney transplantation-a pilot study in early prophylaxis of rejection.
Transplantation, 1996, 62, 1502-1506.
[12] Salmela K., Wramner L., Ekberg H., Hauser I., Bentdal O. et al. — A randomized multicenter trial of the anti-ICAM-1 monoclonal antibody (enlimomab) for the prevention of acute rejection and delayed onset of graft function in cadaveric renal transplantation : a report of the European Anti-ICAM-1 Renal Transplant Study Group. Transplantation, 1999, 67, 729-736.
[13] Cosimi A.B., Conti D., Delmonico F.L., Preffer F.I., Wee S.L. et al. — In vivo effects of monoclonal antibody to ICAM-1 (CD54) in nonhuman primates with renal allografts.
J Immunol., 1990, 144, 4604-4612.
[14] Kuypers D.R., Vanrenterghem Y.F. — Monoclonal antibodies in renal transplantation : old and new. Nephrol Dial Transplant., 2004, 19, 297-300.
[15] Nakakura E.K., Shorthouse R.A., Zheng B., McCabe S.M., Jardieu P.M. et al . — Longterm survival of solid organ allografts by brief anti-lymphocyte function-associated antigen-1 monoclonal antibody monotherapy. Transplantation, 1996, 62, 547-552.
[16] Vincenti F. — What’s in the pipeline ? New immunosuppressive drugs in transplantation.
Am
J Transplant., 2002, 2, 898-903.
[17] Snanoudj R., de Preneuf H., Creput C., Arzouk N., Deroure B. et al. — Costimulation blockade and its possible future use in clinical transplantation.
Transpl. Int., 2006, 19, 693-704.
[18] Greenwald R.J., Freeman G.J., Sharpe A.H. — The B7 family revisited.
Annu. Rev. Immu- nol. , 2005, 23, 515-548.
[19] Schuler W., Bigaud M., Brinkmann V., Di Padova F., Geisse S. et al. — Efficacy and safety of ABI793, a novel human anti-human CD154 monoclonal antibody, in cynomolgus monkey renal allotransplantation. Transplantation, 2004, 77, 717-726.
[20] Kirk A.D., Knechtle S.J., Sollinger H.W., Vincenti F., Stecher S. et al. — preliminary results of the use of humanized anti-CD154 in human renal allotransplantation.
Am. J.
Transplant., 2001, 1, S191.
[21] Koyama I., Kawai T., Andrews D., Boskovic S., Nadazdin O. et al. — Thrombophilia associated with anti-CD154 monoclonal antibody treatment and its prophylaxis in nonhuman primates. Transplantation, 2004, 77, 460-462.
[22] Asams A.B., Shirasugi N., Jones T.R., Durham M.M., Strobert E.A. et al. — Development of a chimeric anti-CD40 monoclonal antibody that synergizes with LEA29Y to prolong islet allograft survival. J. Immunol., 2005, 174, 542-550.
[23] Haanstra K.G., Sick E.A., Ringers J., Wubben J.A., Kuhn E.M. et al . — Costimulation blockade followed by a 12-week period of cyclosporine A facilitates prolonged drug-free survival of rhesus monkey kidney allografts. Transplantation, 2005, 79, 1623-1626.
[24] Chandraker A., Azuma H., Nadeau K., Carpenter C.B., Tilney N.L. et al. — Late blockade of T cell costimulation interrupts progression of experimental chronic allograft rejection.
J.
Clin. Invest., 1998, 101, 2309-2318.
[25] Levisetti M.G., Padrid P.A., Szot G.L., Mittal N., Meehan S.M. et al. — Immunosuppressive effects of human CTLA4Ig in a non-human primate model of allogeneic pancreatic islet transplantation. J. Immunol., 1997, 159, 5187-5191.
[26] Larsen C.P., Pearson T.C., Adams A.B., Tso P., Shirasugi N. et al. — Rational development of LEA29Y (belatacept), a high-affinity variant of CTLA4-Ig with potent immunosuppressive properties. Am. J. Transplant., 2005, 5, 443-453.
[27] Vincenti F., Larsen C., Durrbach A., Wekerle T., Nashan B. et al. — Costimulation blockade with belatacept in renal transplantation.
N. Engl. J. Med. , 2005, 353, 770-781.
[28] Suntharalingam G., Perry M.R., Ward S., Brett S.J., Castello-Cortes A. et al. —
Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412.
N. Engl. J.
Med., 2006, 355, 1018-1028.
[29] Lake K.D. — Immunosuppressive drugs and novel strategies to prevent acute and chronic allograft rejection. Semin. Respir. Crit. Care Med., 2001, 22, 559-580.
[30] Hale G., Dyer M.J., Clark M.R., Phillips J.M., Marcus R. et al . — Remission induction in non-Hodgkin lymphoma with reshaped human monoclonal antibody CAMPATH-1H.
Lancet, 1988, 2, 1394-1399.
[31] Becker Y.T., Becker B.N., Pirsch J.D., Sollinger H.W. — Rituximab as treatment for refractory kidney transplant rejection. Am. J. Transplant. , 2004, 4, 996-1001.
[32] Barth R.N., Janus C.A., Lillesand C.A., Radke N.A., Pirsch J.D. et al. — Outcomes at 3 years of a prospective pilot study of Campath-1H and sirolimus immunosuppression for renal transplantation. Transpl. Int., 2006, 19, 885-892.
[33] Boberg K.M., Foss A., Midtvedt K., Schrumpf E. — ABO-incompatible deceased donor liver transplantation with the use of antigen-specific immunoadsorption and anti-CD20 monoclonal antibody. Clin. Transplant., 2006, 20, 265-268.
DISCUSSION
M. Jacques-Louis BINET
Quels sont actuellement les résultats des greffes de rein avec la ciclosporine ? Quelle est la proportion des greffes acceptées après cinq ans ?
La survie des greffons rénaux s’est énormément améliorée au cours du temps : selon les cohortes 1985-1989, 1990-1994, 1995-1999, 2000-2005, elle a été respectivement de 82,9 %, 85,9 %, 90,1 %, 92,1 % à un an et de 66,5 %, 73,5 %, 79,8 % et de 80,1 % à cinq ans.
M. Jean-Daniel SRAER
Quel est l’avantage de ces nouveaux médicaments par rapport aux autres, administrés à faible dose (non néphrotoxiques) ? Combien de patients doivent être inclus pour montrer un effet très positif par rapport au traitement usuel ?
Même à faibles doses, les anti-calcineurines ont un effet vasoconstricteur et néphrotoxique bien démontré sur les biopsies du greffon et probablement tumorogène. L’avantage du Belatacept est d’être dénué de tous ces effets. Selon les résultats attendus, les cohortes actuelles sont souvent supérieures à 300 patients par étude…
M. Christian NEZELOF
Quelle est l’extension thérapeutique de cette nouvelle approche aux traitements des maladies auto-immunitaires ?
L’extension aux maladies auto-immunitaires est évidente, connaissant les effets secondaires des corticoïdes, des inhibiteurs métaboliques comme les antipurines ou les anticlacineurines. Il faudra donc attendre les phases II et III du Belatacept dans ces différentes indications pour connaître son efficacité.
Bull. Acad. Natle Méd., 2008, 192, no 5, 883-894, séance du 20 mai 2008