Résumé
Outre l’homéostasie phosphocalcique, plusieurs études, tant fondamentales qu’épidémiologiques, attribuent à la vitamine D un rôle dans le contrôle du système immunitaire, de la prolifération cellulaire et du métabolisme glucidique. Les fondements de ces actions multiples proviennent de la démonstration de la présence de la 25-hydroxyvitamine D 1 α -hydroxylase et de récepteurs spécifiques pour la 1,25-dihydroxyvitamine D, forme hormonale de la vitamine D, dans des tissus et organes aussi variés que le foie, l’épiderme, le thymus, l’intestin grêle et le pancréas. Le présent exposé fera une revue brève des études in vitro , animales et cliniques qui ont mené à l’association de la vitamine D au métabolisme glucidique. Bien que les études épidémiologiques et les méta-analyses montrent une association de faible amplitude entre le statut vitaminique D et le risque relatif de diabète, elles ne justifient pas les demandes excessives de sa mesure sérique. Elles ne devraient être restreintes qu’aux pathologies ayant un impact sur le métabolisme phosphocalcique.
Summary
Beyond its classical role in bone metabolism, fundamental and epidemiological studies suggest that vitamin D is also involved in immunity and cell proliferation. Indeed, 25-hydroxyvitamin D 1alpha-hydroxylase and specific receptors for 1,25-dihydroxyvitamin D, the hormonal form of vitamin D, have been found in a variety of organs and tissues, such as the liver, epidermis, thymus, small intestine and pancreas. This brief review examines the results of in vitro , animal and clinical studies suggesting a role of vitamin D in glucose
* Biochimie clinique et Centre de recherche, CHU Sainte-Justine. 3175 chemin de la Côte SainteCatherine, Montréal (Québec), Canada, H3T 1C5.
E-mail : edgard.delvin@recherche-ste-justine.qc.ca Tiré à part : Professeur Edgard Delvin, même adresse
Article reçu le 11 mai 2010, accepté le 13 décembre 2010 homeostasis. Epidemiological studies and meta-analyses have shown a weak association between vitamin D nutritional status and the risk of diabetes, but this does not justify the increasing demands for serum vitamin D assay. The latter should be restricted to disorders affecting the musculoskeletal system.
INTRODUCTION
La vitamine D revêt une importance capitale dans l’homéostasie phosphocalcique [1]. De plus, plusieurs études lui attribuent aussi un rôle au niveau du système immunitaire et de la prolifération cellulaire du diabète [2-5]. Le présent essai présente brièvement le métabolisme de la vitamine D, ses mécanismes d’action ainsi que les études in vitro , animales et cliniques qui ont mené à ces conclusions. Le statut vitaminique D d’un échantillon représentatif d’enfants et adolescents québécois est aussi présenté.
Métabolisme de la vitamine D
Le métabolisme et les modes d’action de la vitamine D ne seront abordés que brièvement, d’excellentes revues ayant déjà traité de ces sujets [6-8]. La vitamine D existe sous deux formes : la vitamine D ou ergocalciférol d’origine végétale, et la 2 vitamine D ou cholecalciférol d’origine animale. La structure de la vitamine D 3 2 diffère de celle de la vitamine D par la présence d’une double liaison en position 3 C -C sur la chaîne carbonée latérale et par l’addition d’un groupe méthyle en C .
22 23 24 La figure 1 schématise le métabolisme de la vitamine D . Un schéma identique peut 3 être appliqué pour la vitamine D . La pré-vitamine D , produite au niveau de 2 3 l’épiderme à partir du 7-déhydrocholestérol sous l’influence de rayons ultraviolets, subit une isomérisation thermo — dépendante en vitamine D . La vitamine D est 3 3 stockée dans le tissu adipeux ou transportée au foie par une protéine porteuse, la ‘‘ Vitamin D Binding Protein ou DBP ’’, afin d’y être hydroxylée en 25-hydroxyvitamine D (calcidiol ou 25OHD ) par un cytochrome P450 microsomal 3 3 (CYP2R1, 25-hydroxylase). La 25OHD est ensuite transportée au rein où, selon la 3 demande en calcium, phosphate et le contrôle de la parathormone (PTH) et du facteur de croissance fibroblastique-23 ‘‘ FGF23 ’’, est hydroxylée en 1,25 (OH) D 2 3 (calcitriol) ou en 24,25 (OH) D par les cytochromes CYP27B1 (1α-hydroxylase) et 2 3 CYP24A1 (24-hydroxylase) respectivement [9-11]. Il est important de souligner que ces cytochromes sont présents dans d’autres tissus que le rein tels les kératinocytes et les macrophages, et que les facteurs contrôlant l’hydroxylation de la 25OHD3 diffèrent. Ceci explique en partie les taux élevés de 1,25 (OH) D observés dans 2 3 certains cas de sarcoïdose et les hypercalcémies qui les accompagnent [12-14].
Mécanismes d’action de la vitamine D
La 1,25 (OH) D est une hormone stéroïdienne dans le sens où l’essentiel de son 2 3 action s’effectue par le biais d’un récepteur nucléaire (VDR), homologue à ceux des
Fig. 1 estrogènes (ER), de la triiodothyronine (TR) et de l’acide rétinoïque (RAR) [15]. Tel qu’illustré dans la figure 2, la 1,25 (OH) D , captée par les cellules cibles, se lie au 2 3 VDR qui s’hétérodimérise, en particulier avec le RXR, avant de s’ancrer sur un élément de réponse à la vitamine D (VDRE), présent dans le promoteur de gènes sensibles à la vitamine D. Des protéines co-activatrices, s’associent à ce complexe pour former le ‘‘ Vitamin D Receptor Interacting Protein Complex (DRIP) ’’, semblable à ceux des récepteurs stéroïdiens (SRC) [16]. Outre son action au niveau de la transcription génique, la 1,25 (OH) D a la capacité d’agir sur les voies de 2 3 signalisation qui impliquent les récepteurs de la membrane plasmique de plusieurs types de cellules [17, 18].
L’ubiquité du VDR nucléaire et de la 1α-hydroxylase sous-tend que la 1,25 (OH) D 2 3 peut avoir non seulement des effets endocriniens mais aussi paracrines et autocrines.
C’est précisément sur cette base qu’est fondée l’attribution des nombreux rôles de la vitamine D.
Évaluation du statut vitaminique D et définition de la déficience
La mesure sérique de la 25 (OH)D est le meilleur index du statut vitaminique D en l’absence de pathologie hépatique, de malabsorption intestinale ou de perturbation du cycle entérohépatique. Bien que les études épidémiologiques et cliniques, qui traitent de l’influence du statut vitaminique D dans différentes pathologies, soient
Fig. 2.
basées sur une définition de la déficience, aucun consensus n’a été établi pour la définir. Deux éléments contribuent à cette situation : le premier est d’ordre analytique et le deuxième d’ordre clinique.
Considérations analytiques
Les méthodes de mesure de la 25 (OH)D ont évolué au cours des quarante dernières années, passant de la protéine de liaison [19], aux immunoessais, à la chromatographie à haute performance et, plus récemment, à la spectrométrie de masse en tandem [20]. L’inexactitude et l’imprécision de chaque méthode et les variations interlaboratoires confondent l’interprétation clinique du statut vitaminique D. Le programme de contrôle de qualité externe DEQAS (http://www.deqas.org/), qui répertorie les résultats de plus de six cent laboratoires et douze méthodes de dosage, illustre la diversité des résultats.
Considérations cliniques
La définition de déficience en vitamine D est problématique en soi, étant donné qu’il varie selon le système biologique visé et la méthode pour l’évaluer. Si le rachitisme et l’ostéomalacie, expression d’une déficience chronique sévère en vitamine D, sont en cause, le seuil de 25 nmol/L est habituellement accepté [21]. Par contre si la parathormone sérique ou l’absorption intestinale du calcium sont utilisées comme index, une concentration de 25 (OH)D inférieure à 50 à 80 nmol/L est considérée comme insuffisante [21-23]. Toutefois ces seuils et le vocabulaire même qui les décrivent sont sujets de constantes discussions. Binkley et coll . [24] ainsi que
Cavalier et coll . [25] ont récemment bien résumé l’impact de l’incertitude des mesures de 25(OH)D sur les seuils cliniques acceptés.
Vitamine D et Métabolisme glucidique : études animales et in vitro
Entre 1980 et 1982, les groupes de Pike [26] et Norman [27] ont démontré, par méthode radio-isotopique, la présence de ce récepteur dans le noyau respectivement de pancréas de poulet et de rat. À la même époque, Clark et coll. [28] démontraient, par une analyse fonctionnelle in vivo , que l’administration de 1,25 (OH) D à des 2 3 rats déficients en vitamine D, stimulait la sécrétion de l’insuline. Le groupe de DeLuca [29] corroborait ultérieurement ces résultats en démontrant qu’un supplé- ment de 1,25 (OH) D administré à des rats déficients en vitamine D, corrigeait la 2 3 prise alimentaires et la sécrétion d’insuline par les ilots de Langherans perfusés.
Sergeev et Rothen [30] ont pour leur part démontré, en utilisant la lignée cellulaire monoclonale de cellule BRINr 1046-38, que la 1,25 (OH) D augmentait rapide2 3 ment la concentration intracellulaire de calcium qui stimule la sécrétion d’insuline.
Le développement de modèles animaux transgéniques, ou pour lesquels certains gènes ont été invalidés (knock-out), a permis d’étudier le rôle de la vitamine D dans le contrôle de l’homéostasie glucidique sans toutefois obtenir des conclusions unanimes. À titre d’exemple, Zeitz et coll . [31] ont rapporté que des souris transgé- niques, possédant un VDR dont le doigt de zinc requis pour la liaison au motif de reconnaissance de l’ADN est inactivé, démontraient une intolérance au glucose et une réduction de la sécrétion maximale d’insuline lors d’une épreuve de surcharge.
Par contre, Mathieu et coll. [32], et plus récemment Gysemans et coll. [33], n’ont pu démontrer chez des souris NOD démunies d’un récepteur fonctionnel de la vitamine D, de différence dans l’incidence de l’apparition du diabète de type 1 par rapport aux souris sauvages. Leurs observations les ont menés à proposer que le bagage génétique des souris modifiées génétiquement était un élément confondant important.
Vitamine D et Métabolisme glucidique : études cliniques et épidémiologiques
Les études cliniques et épidémiologiques étudiant la relation entre la vitamine D et le diabète qui se sont succédé au cours des derniers trente ans suscitent toujours le débat. En 1984, Nyomba et coll. [34], dans une étude comptant vingt-cinq sujets, déficients en vitamine D (dix patients épileptiques et quinze patients gériatriques non-épileptiques), ont montré que la glycémie et l’insulinémie à jeun étaient dans les limites de la normalité et qu’un supplément en vitamine D de quinze jours n’affectait pas ces variables. Fait intéressant, lors d’une hyperglycémie provoquée, la sécrétion d’insuline semblait paradoxalement exacerbée chez les sujets épileptiques et retardée chez les sujets en institution déficients en vitamine D, malgré un profil hyperglycémique normal. La réplétion en vitamine D, n’ayant pas affecté ces effets glucidique et hormonal de façon significative dans l’ensemble des sujets, mène à suggérer que la vitamine D a un rôle moins déterminant que le laissaient entrevoir les études animales.
Quelques études cliniques ont associé une insuffisance en vitamine D au développement de la résistance à l’insuline et du diabète. À titre d’exemple, Scragg et coll.
[35] ont documenté une intolérance au glucose et le diabète chez des patients ayant une insuffisance en vitamine D et Boucher et coll . [36] ont montré une relation entre la déficience en vitamine D et une dégradation de la sécrétion en insuline. Isaia et coll. [37] ont rapporté une forte prévalence d’hypovitaminose D chez des patientes ayant un diabète de type 2. Soulignons qu’aucune de ces études n’a cependant démontré une relation de cause à effet.
Récemment, Pittas et coll. [38] ont démontré, par le biais d’une méta-analyse, que les concentrations circulantes de 25(OH)D élevées étaient associées à une prévalence plus faible de diabète de type 2 (0,36 [0,16-0,80]) et, dans une proportion moindre, de résistance à l’insuline (0,71 [0,57-0,89]). Ils n’ont cependant pu conclure quelle serait concentration sérique optimale de 25(OH)D, bien qu’ils suggèrent un apport quotidien de 1000 UI. Il est intéressant de noter que le même groupe, utilisant la même approche, n’a pu récemment démontrer une association franche entre le statut vitaminique D et le diabète ou d’autres éléments cardiométaboliques [39].
Vitamine D et Syndrome métabolique : Étude dans un groupe représentatif d’enfants et d’adolescents
Qu’en est-il de l’impact du statut vitaminique D sur le syndrome métabolique chez l’enfant et l’adolescent ? Ce sujet est peu documenté chez des enfants et adolescents apparemment sains. Dans un premier temps, nous avons évalué le statut vitaminique D d’un groupe d’enfants et d’adolescents, représentatif de la population Québécoise et démontré (Tableau 1) que plus de 95 % d’entre eux avaient des concentrations sériques de 25(OH)D suboptimales (I. 75 nmol/L), alors que respectivement 10.1 et 12.6 % des filles et garçons, âgés de 16 ans, étaient franchement déficients (I 27.5 nmol/L) [40]. Notons qu’afin de minimiser l’effet saisonnier, nous avions prélevé les participants entre janvier et mars, époque à laquelle les concentrations sanguines de 25(OH)D sont à leur nadir. Ces observations mettent en évidence l’insuffisance hivernale en vitamine D malgré les suppléments alimentaires et les recommandations de la Société Canadienne de Pédiatrie d’assurer un apport minimum de 200 UI de vitamine D dès la période périnatale [41]. Ces recommandations sont cependant
Tableau 1. — Pourcentage des sujets selon trois valeurs seuil de 25(OH)D Sérique en deçà de celles de l’American Academy of Pediatrics qui conseille un apport minimal de 400 UI dès la naissance [42]. Dans un cas comme dans l’autre, ces apports sont clairement insuffisants et devraient être de 1000 à 1200 UI comme l’ont démontré plusieurs études [24, 43-45]. Nous avons, par la suite, vérifié l’association entre le statut vitaminique D et l’insulinémie, la glycémie, la cholestérolémie (HDL, LDL) et la triglycéridémie à jeun [46].
Le tableau 2 démontre que la glycémie diminuait modestement [—0,5 % (p= 0,015) et —0.4 % (p=0,025)] pour chaque augmentation de 10 nmol/L de 25(OH)D, chez les garçons et les filles respectivement. Nous avons par contre observé une augmentation marginale, mais statistique, des paramètres lipidiques chez les filles seulement.
Ce dimorphisme sexuel peut, comme l’ont suggéré Mittendorfer et coll. [47], s’expliquer par une différence de sensibilité des tissus cibles tels les muscles et le tissu adipeux. Cette étude transversale reflète un état nutritionnel à un moment donné, nous limitant de statuer sur les effets à long terme de l’insuffisance vitaminique D.
CONCLUSIONS
Bien que les modèles cellulaires et animaux démontrent un effet probant sur la sécrétion d’insuline, les résultats émanant des études cliniques et épidémiologiques sont beaucoup plus modestes. De multiples explications peuvent être évoquées. Tout d’abord, nous ne pouvons exclure que le statut en vitamine D soit un marqueur de substitution d’autres éléments nutritionnels ou environnementaux. De ce fait, bien qu’il y ait une association entre les taux de 25(OH)D et les variables glucidiques et lipidiques, la relation de cause à effet reste à être clairement démontrée. Par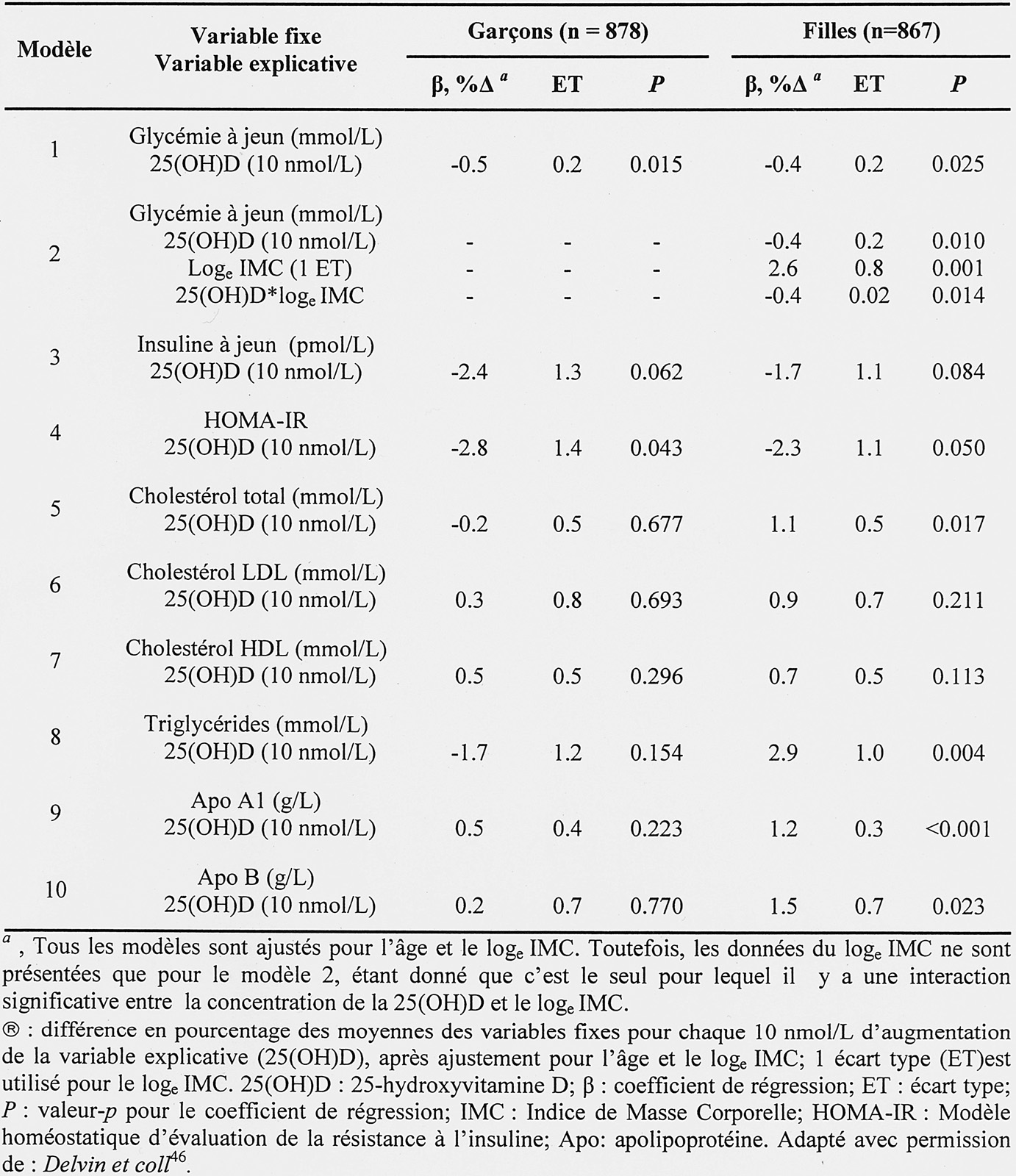
Tableau 2. — Association entre des variables sélectionnées et la concentration en 25(OH)D selon le sexe.
ailleurs, comme l’a énoncé Barker et coll . [48], il faut tenir compte de plusieurs éléments environnementaux et nutritionnels qui peuvent influencer in utero et ex utéro , par des mécanismes épigénétiques, l’expression de gènes, dont ceux impliqués dans le métabolisme glucidique et lipidique.
Finalement, la diversité du bagage génétique des humains fait en sorte que plusieurs polymorphismes de gènes candidats peuvent eux aussi moduler leur expression tant au niveau des ARN messagers que des protéines. Il est évident que des études multicentriques avec intervention au plan de la nutrition et des habitudes de vie sont nécessaires pour clairement confirmer l’hypothèse de l’impact de la vitamine D sur le métabolisme énergétique.
Notes pratiques
La définition du statut vitaminique D demeure un sujet non résolu et les évidences des effets de la vitamine D sur les maladies, autres que celles qui sont reliées au système musculosquelettique sont modestes.
Au plan analytique, la disponibilité de standards primaires internationaux et les méthodes basées sur la spectrométrie de masse permettront de mesurer les métabolites de la vitamine D avec exactitude et précision.
Les laboratoires cliniques devront donc à court terme se concerter et adopter les méthodes physicochimiques.
Au plan clinique, les demandes de dosage de 25(OH)D ne devraient être réservées aux patients avec ostéoporose, rachitisme, ostéomalacie, syndromes de malabsorption, atteintes hépatiques et rénales.
BIBLIOGRAPHIE [1] Holick M.F. — Resurrection of vitamin D deficiency and rickets.
J. Clin. Invest., 2006, 116 , 2062-2072.
[2] Reichel H., Koeffler H.P., Bishop J.E., Norman A.W. — 25 hydroxyvitamin D metabolism 3 by lipopolysaccharide-stimulated normal human macrophages. J. Clin. Endocrinol ., 1987, 64 , 1-9.
[3] Hewison M. — Vitamin D and the immune system. Endocrinol. Metab. Clin. North Am., 2010, 39 , 365-79.
[4] Krishnan A.V., Trump D.L., Johnson C.S., Feldman D. — The role of vitamin D in cancer prevention and treatment. Endocrinol. Metab. Clin. North Am., 2010, 39 , 410-18.
[5] Takiishi T., Gysemans C., Bouillon R., Mathieu C. — Vitamin D and diabetes.
Endocrinol.
Metab. Clin. North Am., 2010, 39 , 419-46.
[6] Richard C.L., Farach-Carson M.C., Rohe B., Nemere I., Meckline K.A. — Involvement of 1,25D -MARRS (membrane associated, rapid response steroid-binding), a novel vitamin D 3 receptor, in growth inhibition of breast cancer cells. Exp. Cell Res., 2010, 316 , 1675-1680.
[7] Norman A.W. — From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health. Am. J. Clin. Nutr., 2008, 88 , 491S-499S.
[8] Holick M.F. — Vitamin D: Photobiology, metabolism, mechanisms of action and clinical application. In primer of the metabolic bone diseases and disorders of mineral metabolism . (Favus
MJ, ed.) Lippincott-Raven, Philadelphia, USA. Chapter 13, pp 74-81.
[9] Inouye K., Sakaki T. — Enzymatic studies on the key enzymes of vitamin D metabolism : 1 alpha-hydroxylase (CYP27B1) and 24-hydroxylase (CYP24). Biotechnol. Ann. Rev., 2001, 7, 174-191.
[10] Hewison M., Zehnder D., Bland R., Stewart P.M. — 1α-hydroxylase and the action of vitamin D. J. Molec. Endocrinol , 2000, 25 , 141-148.
[11] Razzaque M.S, ST-Arnaud R, Tagushi T, Lanske B. — FGF-23, vitamin D and calcification : the unholy triad. Nephrol. Dial. Transplant., 2009, 20 , 2032-2035.
[12] Barbour G., Coburn J.W., Statopolski E., Norman A.W., Horst R.L. — Hypercalcemia in an anephric patient with sarcoidosis:
evidence for extra-renal production of 1, 25-dihydroxyvitamin D. New England J. Med ., 1981, 305 , 440-443.
[13] Adams J.S., Gacad M.A. — Characterization of 1-alpha-hydroxylation of vitamin D sterols 3 by cultured alveolar macrophages from patients with sarcoidosis. J. Exp. Med. , 1985, 161 , 755-765.
[14] Reichel H., Koeffler H.P., Bishop J.E., Norman A.W. — 25 hydroxyvitamin D metabolism 3 by lipopolysaccharide-stimulated normal human macrophages. J. Clin. Endocrinol ., 1987, 64 , 1-9.
[15] Margolis R.N, Christakos S. — The nuclear receptor superfamily of steroid hormones and vitamin D gene regulation. An update. Ann. N. Y. Acad. Sci., 2010, 1192 , 208-214.
[16] MacDonald P.N., Baudino T.A., Tokumaru H., Dowd D.R., Zhang C. — Vitamin D receptor and nuclear receptor co-activators: crucial interactions in vitamin D-mediated transcription. Steroids, 2001, 66 , 171-176.
[17] Ordo´n˜ez-Mora´n P., Mun˜oz A. — Nuclear receptors: genomic and non-genomic effects converge. Cell Cycle, 2009, 8 , 1675-1680.
[18] Christakos S., Norman A.W. — Studies on the mode of action of calciferol. XXIX. Biochemical characterization of 1,25-dihydroxyvitamin D3 receptors in chick pancreas and kidney cytosol. Endocrinology , 1981, 108 , 140-149.
[19] Haddad J.G., Chyu K.J.
— Competitive protein-binding radioassay for 25-hydroxycholecalciferol. J. Clin. Endocrinol. Metab., 1971, 33 , 992-995.
[20] Højskow C.S, Heickendorg L, MøËller H.J. — High-throughput liquid-liquid extraction and LCMSMS assay for determination of circulating 25(OH) vitamin D3 and D2 in the routine clinical laboratory. Clin. Chim. Acta, 2010, 411 , 114-116.
[21] Heaney R.P. — Functional indices of vitamin D status and ramifications of vitamin D status.
Am. J. Clin. Nutr. , 2004, 80(Suppl) , 1706S-1709S.
[22] Chapuy M.C., Preziozi P., Maamer M. et al. — Prevalence of vitamin D insufficiency in an adult normal population.
Osteoporos Int., 1997, 7 , 439-444.
[23] Lips P. Duong T., Oleksik A., Black D., Cummings S., Cox D., Nickelsen T. — A global study of vitamin D status and parathyroid function in postmenopausal women with osteoporosis: Baseline data from the multiple outcomes Raloxifene evaluation clinical trial. J. Clin.
Endocrinol. Metab. , 2001, 86 , 1212-1221.
[24] Binkley N., Ramamurthy R., Krueger D. — Low vitamin D status: Definition, prevalence, consequences, and correction. Endocrinol. Metab Clin. N. Am. , 2010, 39 , 287-301.
[25] Cavalier E., Rozet E., Gadisseur R., Carlisi A., Monge M., Chapelle J-P., Hubert P., Souberbielle J-C., Delanaye P. — Measurent uncertainty of 25-OH vitamin D determination with different commercially available kits : impact on clinical cut offs. Osteoporos. Int. , 2010, 21 , 1047-1051.
[26] Pike W.J. — Receptors for 1,25-dihydroxyvitamin D3 in chick pancreas : a partial physical and functional characterization. J. Steroid. Biochem. , 1982, 16 , 385-395.
[27] Norman A.W., Frankel J.B., Heldt A.M., Grodsky G.M. — Vitamin D deficiency inhibits pancreatic secretion of insulin. Science , 1980, 209 , 823-825.
[28] Clark S.A., Stumpf W.F., Sar M. — Effect of 1,25 dihydroxyvitamin D3 on insulin secretion.
Diabetes, 1981, 30 , 382-386.
[29] Chertow B.S., Sivitz W.I., Baranetski N.G., Clark S.A., Waite A., Deluca H.F. — Cellular mechanisms of insulin release: the effects of vitamin D deficiency and repletion on rat insulin secretion. Endocrinology, 1983, 113 , 1511-1518.
[30] Sergeev I.N., Rhoten W.B. — 1,25-Dihydroxyvitamin D3 evokes oscillations of intracellular calcium in pancreatic b-cell line. Endocrinology, 1995, 136 , 2852-2861.
[31] Zeitz U., Weber K., Soegiarto D.W., Wolf E., Balling R., Erben R.G. — Impaired insulin secretory capacity in mice lacking a functional vitamin D receptor. The FASEB J . 2003.
[32] Mathieu C., Van Etten E., Gysemans C., Decallonne B., Kato S., Laurys J., Depovere J., Valcks D., Verstuyf A., Bouillon R. — In vitro and in vivo analysis of the immune system of
Vitamin D receptor knockout mice.
J. Bone. Miner. Res., 2001, 16 , 2057-2065.
[33] Gysemans C., Van Etten E., Overbergh L., Giulietti A., Eelen G., Waer M., Verstuyf A., Bouillon R., Mathieu C. — Unaltered diabetes presentation in NOD mice lacking the vitamin D receptor. Diabetes, 2008, 57 , 269-275.
[34] Nyomba B.L., Auwerx J., Bormans V., Peeters T.L., Pelemans W., Reynart J., Bouillon R., Vantrappen G., De Moor P. — Pancretic secretion in man with subclinical vitamin D deficiency. Diabetologia, 1986, 29 , 34-38.
[35] Scragg R., Sowers M.F., Bell C. — Serum 25-hydroxyvitamin D, diabetes, and ethnicity in the third national health and nutrition examination survey. Diabetes Care , 2004, 27 , 2813-2818.
[36] Boucher B., Mannan N., Noonan K., Hales C.N., Evans S.J. — Glucose intolerance and impairement of insulin secretion in relation to vitamin D deficiency in East London. Diabetologia, 1995, 38 , 1239-1245.
[37] Isaia G., Giorgino R., Adami S. — High prevalence of hypovitaminosis D in female Type 2 diabetic population. Diabetes Care, 2001, 24 , 1496.
[38] Pittas A.G, Lau J., Hu F., Dawson-Hugues B. — The role of vitamin D and calcium in type 2 diabetes. A systematic review and meta-analysis. J. Clin. Endocrinol. Metab., 2007, 92 , 2017-2029.
[39] Pittas A.G., Chung M., Trikalinos T., Mitri J., Brendel M., Patel K., Lichtenstein A.H., Lau J., Balk E.M. — Systematic review : Vitamin D and cardiometabolic outcomes. Ann Intern Med., 2010, 152 , 307-314.
[40] Mark S., Gray-Donald K., Delvin E.E., O’Loughlin J., Paradis G., Levy E., Lambert M.
— Low vitamin D status in a representative sample of youth from Québec, Canada. Clin.
Chem., 2008, 54 , 1283-1289.
[41] Statement of the Joint Working Group, Canadian Paediatric Society, Dieticians of Canada, Health Canada. Nutrition for healthy term infants. Ottawa: Minister of Public Works and Government Services Canada, 1998. Available: www.hc-sc.gc.ca/fn-an/alt_formats/hpfbdgpsa/pdf/nutrtion/infant-nourisson_engl.pdf [42] Wagner C.L., Greer F.R., and the section on breastfeeding committee on nutrition. — Prevention of Rickets and Vitamin D Deficiency in Infants, Children, and Adolescents. Paediatrics, 2008, 122 , 1142-52.
[43] Agostini C., Buoncore G., CARNIELI V.P., DE CURTIS M., DARMAUN D., DECSI T.
et al. — Enteral nutrition for preterm infants : Commentary from the European Society for
Paediatric Gastroenterology, Hepatology, and Nutrition Committee on nutrition.
J. Pediatr.
Gastroenterol. Nutr. , 2010, 50 , 85-91.
[44] Delvin E.E., Salle B.L., Glorieux F.H., Adelainep, David L.S. — Vitamin D supplementation during pregnancy: Effect on neonatal calcium homeostasis. J. Pediatr., 1986, 09 , 328-334.
[45] Hollis B.W. — Vitamin D requirement during pregnancy and lactation.
J. Bone Miner. Res., 2007, 22 , V39-V44.
[46] Delvin E.E., Lambert M., LEVY E., O’Loughlin J., Mark S., Gray-Donald K., Paradis G.
— Vitamin D Status Is Modestly Associated with Glycemia and Indicators of Lipid Metabolism in French-Canadian Children and Adolescents. J. Nutr., 2010, 140 , 987-91.
[47] Mittendorfer B. — Sexual dimorphism and lipid metabolism.
J. Nutr, 2005, 135, 681-686.
[48] Barker D.J. — Fetal origins of coronary heart disease.
Brit. Med. J. , 1995, 311 , 171-174.
DISCUSSION
M. Roger NORDMAN
Alors qu’il est habituellement conseillé aux seniors d’avoir recours à une supplémentation en vitamine D, ceci n’est pas le cas pour les adolescents. Comme vous avez mis l’accent sur la fréquence d’une déficience chez ces derniers (surtout les filles), conseillez-vous également une telle supplémentation systématique à leur intention ?
Notre étude effectuée chez des enfants et adolescents québécois démontre une insuffisance en vitamine D chez la majorité. Il faut réaliser que les prélèvements ont été effectués de janvier à mars, période pendant laquelle la synthèse cutanée est à son nadir à la latitude à laquelle nous nous trouvons. Cette situation est susceptible de se retrouver ailleurs notamment en France, et particulièrement dans le nord. Je crois donc qu’une supplémentation est recommandée et notamment qu’elle doit être adaptée aux saisons ainsi qu’aux habitudes de vie.
M. Bernard SALLE
Comment expliquer que 11 à 12 % des adolescents au Canada soient déficients en vitamine D, alors que les produits laitiers sont supplémentés ?
Une des raisons est que les adolescents canadiens, et peut-être aussi, français, ne consomment pas de produits laitiers, mais plutôt du cola ou autres boissons gazéifiées.
M. Jean-Marie BOURRE
Pour ce qui est de la couverture en vitamine D, quelle est la proportion entre la synthèse par la peau et l’apport nutritionnel. Sachant que les recommandations devraient être très différentes selon les âges, les conditions physio-pathologiques, le lieu de vie, la pigmentation de la peau, etc. En effet, la synthèse dermatologique est divisée par plus que cinq entre vingt ans et soixante-dix ans, et la couleur de la peau exerce une influence considérable (division par cinq à sept entre une peau claire et une peau noire). De plus, selon la judicieuse recommandation des dermatologues, lors de toute exposition au soleil, il est indispensable d’utiliser une crème solaire, qui annihile de fait toute synthèse de vitamine D par la peau. En conséquence les recommandations nutritionnelles (Apports nutritionnels conseillés, ANC) sont certainement sous-estimées, car elles prennent en compte une synthèse dermatologique notable. Par ailleurs, les enquêtes de consommation montrent que plus des deux tiers de la population est déficitaire en cette vitamine. Ne faudrait-il pas augmenter considérablement les recommandations de consommation de poissons et de fruits de mer, ainsi que celle des œufs, pour augmenter l’apport nutritionnel ? Ou faudrait-il envisager une supplémentation massive des aliments, les seuls en France l’effectuant actuellement étant une marque de lait et une marque d’huile de table ?
La saine alimentation a toujours sa place. Il est vrai que certains poissons contiennent des concentrations appréciables de vitamine D. Toutefois il convient de mentionner qu’il y a une nette différence en contenu vitaminique D entre les poissons sauvages et les poissons d’élevage. Les taux de vitamine D peuvent varier en fonction de l’alimentation en ferme d’élevage. Une supplémentation en vitamine D accompagnée de calcium est certes la voie à privilégier autant chez les enfants que chez les adultes vieillissants. Il est important de s’assurer qu’il n’y a pas de carence calcique lors d’apport supplémentaire de vitamine D, car il y aurait alors un risque de résorption osseuse accrue suite à une hyperparathyroïdie secondaire.
M. Jean-Luc de GENNES
Quel est le rapport entre la déficience en vitamine D et la sécrétion de parathormone ?
Comme je l’ai montré dans une de mes diapositives, la parathormone a tendance à augmenter lorsque les taux circulants de 25-hydroxyvitamine D sont bas, indiquant un apport insuffisant en vitamine D. Le seuil critique se situe aux environs de 35-40 nmol/L.
Au-delà de ces concentrations, dans les conditions physiologiques, la concentration de la parathormone est stable.
Mme Monique ADOLPHE
Dans votre importante conférence sur la vitamine D et la résistance à l’insuline, j’aurais voulu savoir si vous aviez trouvé une différence entre les individus sveltes et les individus obèses ?
Oui tout à fait. Plusieurs études ont démontré qu’à apport identique en vitamine D, les sujets obèses avaient des valeurs de 25-hydroxyvitamine D sériques inférieures à celles des sujets sveltes. Par ailleurs nous avons démontré dans notre étude publiée récemment dans le Journal of Nutrition que la concentration sérique en 25-hydroxyvitamine D était inversement proportionnelle à l’indice de masse corporelle chez les filles.
Bull. Acad. Natle Méd., 2011, 195, nos 4 et 5, 1091-1103, séance du 10 mai 2011


