Résumé
Des études récentes ont mis à profit les progrès du scanner pour relancer le débat sur l’opportunité du dépistage du cancer bronchique. Même si ces premières études ont le mérite de montrer que la pratique du scanner hélicoïdal permet de dépister une proportion importante de stades précoces dont la survie à 5 ans peut être supérieure à 70 %, rien n’indique cependant qu’il en résulte une diminution de la mortalité spécifique. Des études sur des cohortes de plusieurs dizaines de milliers de sujets et d’une durée de 8 à 10 ans sont en projet et s’accompagnent d’une coordination internationale chargée d’harmoniser les protocoles afin de permettre l’analyse des données cumulées. Une étude pilote sur 1 000 sujets, financée par un PHRC, vient de démarrer en France.
Summary
Recent studies have benefited from the progress of the scanner in order to relaunch the debate on the opportunity of screening lung cancer. Even if these initial studies have succeeded in showing that the practise of helical scan allows the screening of a considerable proportion of cases at an early stage wich may have 5-year survivals of up to 70 %, there is no specific indication of the diminution of lung cancer-specific mortality. Studies of cohorts of several dozen millions subjects during a period of 8 to 10 years are to be realised and an international pool will be charged of the harmonization of the protocols in order to realize the analyse of the collected information. An experimental study of 1000 subjects financed by a grant have started recently in France.
Informationdépistage systématique, tabagisme, tomodensitomètre., tumeur broncheSpiral CT : is it time for lung cancer screening ?bronchial neoplasms, mass screening, smoking, tomography scanners, x-ray computed.G. Frija, A. Flahault, E. LemarieDes études récentes ont mis à profit les progrès du scanner pour relancer le débat sur l’opportunité du dépistage du cancer bronchique. Même si ces premières études ont le mérite de montrer que la pratique du scanner hélicoïdal permet de dépister une proportion importante de stades précoces dont la survie à 5 ans peut être supérieure à 70 %, rien n’indique cependant qu’il en résulte une diminution de la mortalité spécifique. Des études sur des cohortes de plusieurs dizaines de milliers de sujets et d’une durée de 8 à 10 ans sont en projet et s’accompagnent d’une coordination internationale chargée d’harmoniser les protocoles afin de permettre l’analyse des données cumulées. Une étude pilote sur 1 000 sujets, financée par un PHRC, vient de démarrer en France.
Recent studies have benefited from the progress of the scanner in order to relaunch the debate on the opportunity of screening lung cancer. Even if these initial studies have succeeded in showing that the practise of helical scan allows the screening of a considerable proportion of cases at an early stage wich may have 5-year survivals of up to 70 %, there is no specific indication of the diminution of lung cancer-specific mortality. Studies of cohorts of several dozen millions subjects during a period of 8 to 10 years are to be realised and an international pool will be charged of the harmonization of the protocols in order to realize the analyse of the collected information. An experimental study of 1000 subjects financed by a grant have started recently in France. INTRODUCTION
Le dépistage du cancer du poumon s’adresse aux cancers non à petites cellules, et redevient d’actualité grâce à l’amélioration des performances des scanners. En effet, dans une étude nord-américaine (ELCAP) publiée en 1999 [5], portant sur 1 000 sujets, il a été montré que le scanner hélicoïdal employant des faibles doses de rayons X permettait, par comparaison avec la radiographie pulmonaire, de détecter trois fois plus de nodules, quatre fois plus de cancers et surtout six fois plus de cancers de stade I, dont on sait que le taux de survie à cinq ans est de 85 % contre un taux global de 15 % tous stades confondus. Alors qu’il est généralement accepté sur la base des quatre principaux essais [2, 3, 7, 10] ayant testé la radiographie pulmonaire et/ou l’étude cytologique des crachats, que le dépistage du cancer basé sur l’une ou l’autre de ces procédures ne confère aucun bénéfice en terme de mortalité, les résultats de cette étude nord-américaine suscitent un large débat. Sont-ils suffisants pour envisager la généralisation du dépistage du cancer bronchique, ou alors quelles études complémentaires devrait-on réaliser dans une phase préalable ? Est-il fondé, en raison de leur durée et de leur coût, de les financer, surtout si l’on considère que la prévention primaire devrait prendre le pas sur la prévention secondaire ? L’objet de ce travail est de faire le point sur ces questions et notamment sur les initiatives françaises et internationales en la matière.
LES PROGRÈS DU SCANNER
Les progrès du scanner permettent une meilleure détection et une meilleure caractérisation des nodules pulmonaires grâce à la possibilité qu’ont les nouveaux appareils de réaliser un échantillonnage de l’ensemble du volume pulmonaire au cours d’une simple inspiration profonde [9]. Le balayage hélicoïdal introduit il y a quelques années, et plus récemment les scanners à multidétecteurs, représentent des avancées technologiques essentielles qui ont permis de progresser dans l’exploration du parenchyme pulmonaire à la fois en termes de rapidité mais aussi de qualité, en s’affranchissant notamment des artéfacts cinétiques d’origine respiratoire et cardiaque. Ces progrès dans la détection permettent en outre, et sans diminution des performances, d’abaisser notablement la dose de rayons X nécessaire : un examen de dépistage correspond à l’irradiation d’environ 10 clichés thoraciques (1 cliché thoracique correspond lui même à 25 % de l’irradiation naturelle annuelle). Il est ainsi possible de détecter dès aujourd’hui des nodules millimétriques au prix d’un risque radique très faible, alors que la radiographie thoracique n’est performante qu’à partir de 20 mm.
Cependant, si le scanner a aujourd’hui une sensibilité très élevée il a, en revanche, une spécificité faible. Hormis les cas, assez rares, où les nodules ont des aspects permettant d’affirmer leur bénignité (calcifications massives, association de graisse et de calcifications) ou leur malignité (contours spiculés), les 2 seules façons de juger de la nature d’un nodule sont sa taille et son évolution : un nodule ayant un diamètre supérieur à 20 mm, ou augmentant de taille à 2 examens successifs, est hautement suspect de malignité. Concernant l’évolutivité, son appréciation s’oriente vers l’utilisation de méthodes de calcul volumique en remplacement des méthodes de calcul surfacique, moins sensibles et plus sujettes à des causes d’erreurs. De ce point de vue, le développement de logiciels de détection et de calcul automatisés est du plus grand intérêt. En effet, la prévalence des anomalies visibles sur des scanners réalisés lors des premières études de dépistage est élevée, et peut varier de 25 à 50 % selon la prévalence des affections granulomateuses inflammatoires (histoplasmose essentiellement) ; ces logiciels automatiques, en permettant de juger de l’évolutivité d’une lésion de façon fiable, devraient éviter le recours à des examens plus invasifs pour obtenir la preuve histologique, et diminuer ainsi le taux de faux-positifs.
LES PREMIÈRES ÉTUDES
Au Japon [6], une étude a été réalisée en 1996, comparant le scanner hélicoïdal et la radiographie pulmonaire sur une période de deux ans. Sur 1 369 participants, 18 cancers ont été retrouvés dont 15 périphériques. Tous les cancers périphériques ont été vus par le scanner, alors que 4 sur 15 seulement étaient visibles sur la radiographie pulmonaire ; 14 des 15 cancers étaient de stade I avec un diamètre moyen de 16 mm fi 7 (radiographie thoracique : diamètre moyen de 30 mm fi 14).
L’étude ELCAP (Early Lung Cancer Action Project) portait sur 1 000 participants à haut risque de cancer bronchique qui ont été suivis avec un scanner hélicoïdal et une radiographie pulmonaire annuels [3]. Vingt-sept cancers ont été retrouvés (prévalence : 2,7 %) dont 81 % étaient de stade I ; 7 des 27 cancers étaient visibles sur la radiographie thoracique (prévalence : 0,7 %). Au terme de la première année de suivi, l’incidence des nodules était de 4 % dont 1,1 % de nodules malins. Le diamètre moyen des nodules dépistés était inférieur à 10 millimètres.
Les études japonaise et américaine ont pour principal mérite de montrer que le scanner, chez les patients à haut risque de cancer, détecte plus de lésions cancéreuses que la radiographie thoracique, et qu’une très forte proportion de ces lésions (80 %) est de stade I ; cependant ces scanners révèlent également environ 25 % d’anomalies pulmonaires, dont seulement 1 à 3 % correspondent à des cancers. Plus important, les études japonaise et américaine présentent des limites méthodologiques sérieuses.
En effet, elles ne comportaient qu’une cohorte de sujets dépistés, ce qui n’a pas permis d’évaluer l’impact du dépistage par comparaison avec un bras contrôle ; de plus, seule la survie a été analysée et non, comme il est d’usage en matière de dépistage, la mortalité spécifique par cancer. Ainsi, ces 2 études n’ont pas échappé aux biais inhérents à la méthodologie utilisée (biais de durée, biais d’avance et surdiagnostic) [1]. Il est donc généralement admis que ces 2 études ne peuvent suffire aujourd’hui pour développer un programme de dépistage du cancer bronchopulmonaire chez les sujets à haut risque. Malgré ces incertitudes, la pratique d’un scanner thoracique à faible dose chez les fumeurs de plus de 50 ans est devenue systématique au Japon, et tendrait à se développer, notamment aux États-Unis ; il n’est pas illogique de penser que l’Europe pourrait suivre la même évolution. C’est dans ce contexte qu’un éditorial publié en novembre 2000 dans le New England Journal of Medicine prend toute son importance en soulignant l’urgence que « des études biens conçues soient conduites à leur terme, analysées et validées avant qu’un programme de dépistage de masse ne soit mis en œuvre » [8].
LES ÉTUDES EN PROJET
Une démarche internationale
Les études à venir se situent dans un large contexte de mobilisation internationale :
un groupe s’est spontanément créé autour des promoteurs des principaux projets afin d’harmoniser les protocoles pour permettre une analyse des données cumulées.
Cet effort d’homogénéisation et de centralisation des données fait écho aux programmes de dépistage du cancer du sein au sujet desquels une vive polémique récente a contribué à jeter un doute sur la qualité des publications faisant état d’un bénéfice des campagnes de dépistage ; les principaux reproches portaient sur l’inhomogénéité des protocoles et sur les méthodes de dénombrement des décès imputables au cancer du sein [4]. On peut ainsi espérer que les études qui pourraient servir de bases à la généralisation du dépistage du cancer bronchique se seront affranchies des limites méthodologiques relevées dans les études sur le dépistage du cancer du sein par mammographie.
Les 3 principales recommandations d’ordre méthodologique qui émanent de ce groupe international auquel participent des équipes françaises sont les suivantes :
— le protocole doit être celui d’une étude randomisée à deux bras ; l’examen de dépistage doit être réalisé lors de l’inclusion et dans le cadre d’un suivi de telle sorte que les cancers prévalents et incidents puissent être dénombrés. L’objectif principal est la détermination de l’effet du dépistage sur la mortalité spécifique et globale par cancer en comparaison avec le groupe contrôle ;
— inclure des patients considérés comme à haut risque de cancer pulmonaire ;
— accepter le principe d’une analyse cumulée des données internationales en fournissant, selon des procédures de sécurité avérées, les données de l’étude à un centre de coordination internationale indépendant.
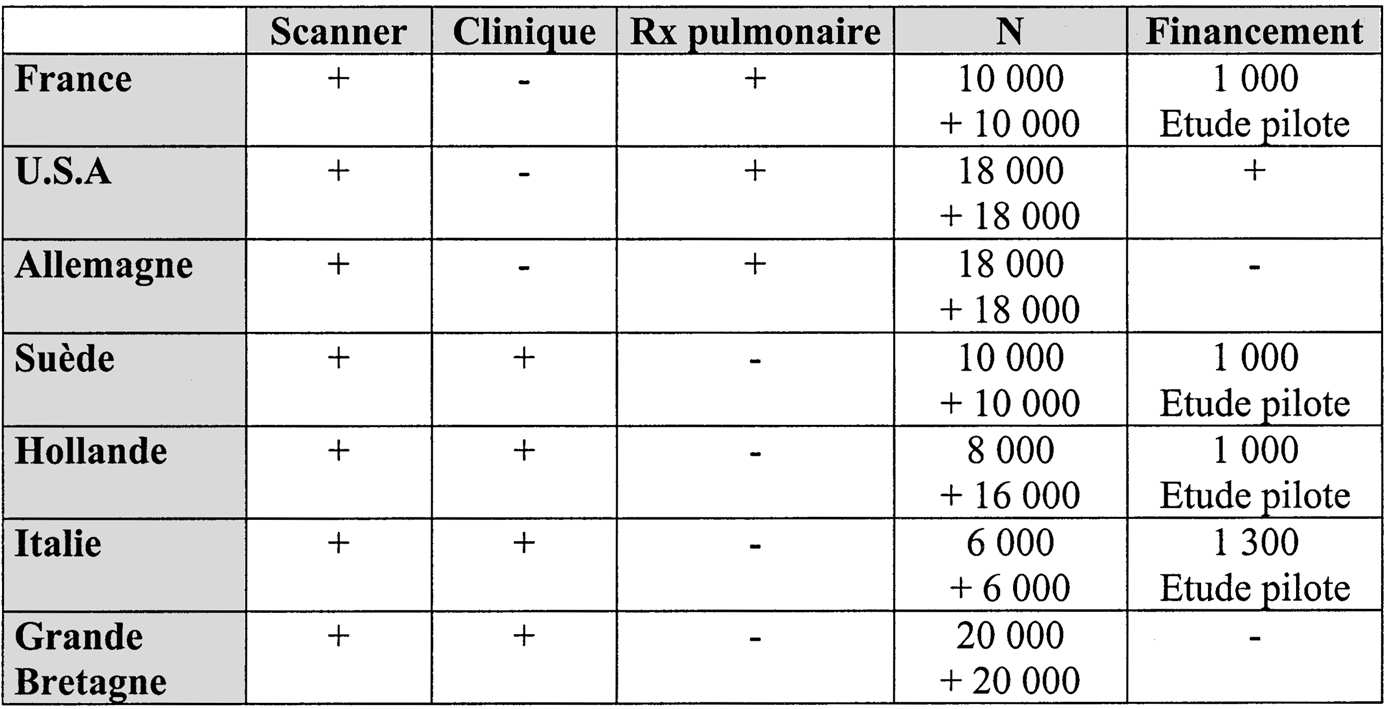
À l’heure actuelle, l’étude la plus vaste est financée par le NCI (National Cancer Institute) ; elle prévoit d’inclure une cohorte de 36 000 sujets avec un suivi de 8 ans et le démarrage est prévu fin 2002 ; l’effectif a été prévu pour mettre en évidence une différence de mortalité de 30 % entre le groupe dépisté et le groupe contrôle. En France, une étude pilote sur 1 000 sujets a été financée par un PHRC. Le tableau ci-dessous montre l’état d’avancement des différents protocoles internationaux, et les tests envisagés.
Le projet français
Le projet français, initié en commun par la Société Française de Radiologie et la Société de Pneumologie de Langue Française, serait réalisé sous l’égide de l’INSERM, promoteur de l’étude. Celui-ci a été présenté au conseil scientifique de la CNAMTS et aurait reçu des critiques, qui n’ont cependant pas été communiquées.
Il a également été présenté à la Direction Générale de la Santé, et son évaluation est en cours. Il prévoit d’étudier sur une période de 8 ans une cohorte de 40 000 sujets avec un bras témoin (n= 20 000) recevant une radiographie de thorax et un bras expérimental (n= 20 000) puis suivie par scanographie hélicoïdale à faible dose ; ce nombre sera ajusté au vu des résultats de l’étude pilote en tenant compte notamment du taux de détection de cancers, de la contamination du bras contrôle par la réalisation de scanners non prévus au départ, et naturellement par le taux d’observance des patients au protocole.
L’objectif principal est de démontrer une diminution du taux de mortalité spécifique et globale par cancer du poumon grâce à un programme annuel de dépistage par scanner hélicoïdal, sur une période de 5 ans.
Les objectifs secondaires seront :
— d’établir un arbre de décision pour la prise en charge des anomalies dépistées par le scanner et la radiologie thoracique, — de mesurer le ratio coût-bénéfice d’un programme de dépistage systématique, — de constituer une sérothèque en vue d’une évaluation de futurs biomarqueurs.
Les sujets seront recrutés par l’intermédiaire des médecins généralistes appartenant au réseau Sentinelles de l’Inserm et adressés à des centres hospitaliers accrédités ayant une compétence radio-pneumologique et chirurgicale. L’étude s’adressera à des sujets de 50 à 75 ans, gros fumeurs, actuels ou anciens (plus de 15 cigarettes par jour pendant plus de 20 ans). Les sujets remplissant les critères d’inclusions ayant signé une formule de consentement seront inclus dans l’un des 2 groupes parallèles de l’essai, selon une procédure de randomisation centralisée. Le système d’information utilisé permet un recueil électronique (sur un intranet sécurisé et anonymisé) de toutes les données patients, incluant l’imagerie ; il a été développé en collaboration avec l’équipe de Cornell University de New york (programme ELCAP) et permettra un partage international des données.
Le débat
De nombreuses interrogations ont été formulées à l’occasion du dépôt du projet français, mais également du projet américain. Les critiques portent principalement sur le nombre élevé de sujets à inclure (plusieurs dizaines de milliers), et sur la longueur de l’étude (entre 8 et 10 ans). Les principaux détracteurs estiment que les crédits alloués à ces recherches seraient mieux utilisés à d’autres fins (le coût du projet américain est évalué à deux cents millions de dollars et celui du projet français à un peu plus de neuf millions d’euros), que la faible spécificité du scanner induira des effets délétères significatifs, et enfin que la pression des fumeurs sera très forte pour accéder au dépistage par scanographie, même en l’absence de preuve scientifique ; l’exemple du Japon où la pratique du scanner chez les sujets à haut risque s’est généralisée est à cet égard instructif, et les méthodes de publicité utilisées aux États-Unis incitent au développement du dépistage individuel. En France, il n’y a pas de mécanisme financier qui pourrait freiner le développement de telles pratiques. Enfin, nombreux sont ceux qui estiment que le problème du cancer bronchique doit être avant tout résolu par une prévention primaire considérée comme plus efficace, et que l’avenir du dépistage passera par la mise au point de tests biologiques dans un futur proche.
A l’inverse, les promoteurs d’un projet d’évaluation de l’impact de la pratique d’un scanner thoracique sur la mortalité spécifique par cancer bronchique estiment que c’est un préalable nécessaire à une prise de décision rationnelle en matière de santé publique ; sensibles aux différentes critiques dont ils ont été l’objet, les différents projets dont celui développé en France, prévoient de standardiser la prise en charge des images anormales détectées en scanographie afin de diminuer les effets délétères dus à des faux-positifs ; le développement à court terme de logiciels puissants de diagnostic assisté par ordinateur contribuera très certainement à faciliter non seulement les études prévues mais un éventuel dépistage généralisé. La constitution d’une sérothèque est prévue pour des exploitations futures ainsi que l’évaluation de différentes stratégies de sevrage tabagique.
CONCLUSION
Le dépistage du cancer bronchique par scanographie à faible dose représente un sujet de réflexion intéressant. Un progrès technologique à lui seul, malgré une totale innocuité, ne justifie certainement pas son utilisation à des fins de santé publique sans précaution d’ordre scientifique. Les moyens à envisager pour obtenir une validation des premières études sont cependant extrêmement importants, et la pertinence d’une telle affectation doit être mise en balance avec des pratiques qui pourraient se généraliser malgré l’absence de support scientifique. Dans cette optique, une information du public sur les limites scientifiques des études actuelles paraît prioritaire. D’inévitables questions éthiques surgiront des affrontements entre les partisans d’une unique prévention primaire (arrêt ou diminution du tabagisme, en sachant que les progrès en la matière ont été très faibles) et ceux qui voudraient lui adjoindre aussi une prévention secondaire (dépistage précoce, s’il est efficace). La cohésion méthodologique qui s’organise au plan international et la centralisation des bases de données sont des éléments novateurs qui pourraient à l’avenir constituer un modèle de coopération internationale utile aux futures évaluations des programmes de dépistage du cancer.
BIBLIOGRAPHIE [1] BLACK W.C., WELCH H.G.— Screening for disease.
AJR , 1997, 168 , 3-11.
[2] FLEHINGER B.J., MELAMED M.R., ZAMAN M.B., et al. — Early lung cancer detection : results of the initial (prevalence) radiologic and cytologic screening in the Memorial Sloan-Kettering study. Am Rev Respir Dis., 1984, 130 , 555-560.
[3] FONTANA R., SANDERSON D.R., WOOLNER L.B., et al. — Lung cancer screening : The Mayo
Program.
J Occup Med ., 1986, 28 , 746-750.
[4] GOTZSCHE P.C., OLSEN O. — Is screening for breast cancer with mammography justifiable ?
Lancet, 2000, 355, 129-134.
[5] HENSCHKE C.I., MCCAULEY D.I., YANKELOVITZ D.F., et al. — Early lung cancer action project :
overall design and findings from baseline screening.
Lancet, 1999, 354 , 99-105.
[6] KANEKO M., EGUCHI K., OHMATSU H., et al . — Peripheral Lung Cancer : Screening and detection with low-dose spiral CT versus radiography.
Radiology , 1996, 201, 798-802.
[7] KUBIK A., POLAK J. — Lung cancer detection : results of a randomized prospective study in Czechoslovakia. Cancer, 1986, 57, 2427-2437.
[8] PATZ E.F., GOODMAN P.C., BEPLER G. — Screening for lung Cancer.
New England Journal of
Medicine , 2000, 343 , 1627-1633.
[9] REMY-JARDIN M., GIRAUD F., MARQUETTE C.H. — Pulmonary nodules : Detection with thick-section spiral CT versus conventional CT. Radiology , 1993, 187 , 513-520.
[10] TOCKMAN M. — Survival and mortality from lung cancer in a screened population : the Johns Hopkins study. Chest , 1986, 57 , 44-53.
* Professeur de Radiologie à l’Université René Descartes et Chef de service de Radiologie à l’Hôpital Européen G. Pompidou — 20 rue Leblanc — 75908 Paris cedex 15. ** Inserm (U 444). *** Professeur de Pneumologie et Chef de service à l’Hôpital Bretonneau de Tours. Tirés-à-part : Professeur Guy FRIJA, à l’adresse ci-dessus. Article reçu le 2 octobre 2002, accepté le 28 octobre 2002.
Bull. Acad. Natle Méd., 2003, 187, n° 1, 153-160, séance du 21 janvier 2003