Résumé
L’exérèse chirurgicale par une hépatectomie radicale, seul traitement curatif des métastases hépatiques colorectales n’est possible que dans 75 à 85 % des cas. L’originalité de notre travail a été de montrer dans les années 1990 que la chimiothérapie pouvait transformer les métastases irrésécables pour les rendre résécables. Notre expérience porte maintenant sur plus de deux cents cas d’hépatectomies pour des malades irrésécables avec une survie à cinq ans de 30 % et à dix ans de 18 %. Cette chirurgie est généralement lourde avec 55 % d’hépatectomies majeures, 36 % de réhépatectomies (jusqu’à quatre hépatectomies successives chez le même patient) et 20 % de résections pulmonaires associées. En même temps que l’objectif de la diminution des tumeurs pour les rendre résécables, nous avons développé le principe de l’augmentation du parenchyme hépatique sain pour permettre des hépatectomies larges évitant le risque de l’insuffisance hépatique due à un trop petit territoire de parenchyme restant. D’année en année les nouvelles chimiothérapies, les dernières étant les anticorps monoclonaux (Cetuximab) et les anti-angiogéniques (Bevacizumab) sont plus efficaces, offrant par une plus grande réduction tumorale à plus de malades la chance d’être opérés, but ultime de la stratégie associant chimiothérapie et chirurgie .
Summary
Radical hepatectomy — the only curative treatment for colorectal liver metastasis — is feasible in 75 to 85 % of cases. In 1990 we showed that chemotherapy rendered some otherwise unresectable colorectal liver metastases resectable. We have now treated more than 200 such patients, with respective 5-year and 10-year overall survival rates of 30 % and 18 %. This difficult surgery involves major hepatectomy in 55 % of patients, repeat hepatectomy (up to four procedures) in 36 % of patients, and associated pulmonary resection in 20 % of patients. We have also pioneered the use of presurgical liver parenchyma augmentation, in order to permit major hepatectomy without risking post-operative liver failure due to inadequate parenchymal tissue. New medical treatments, including monoclonal antibodies against tumoral growth factors (cetuximab) and vascular growth factors (bevacizumab), are also proving useful for tumor shrinkage prior to surgical resection.
INTRODUCTION
Le traitement des métastases hépatiques de cancer colo-rectal s’est profondément modifié au cours des dix dernières années.
— La chimiothérapie a connu une vraie ‘‘ révolution ’’ en terme d’efficacité. Reposant jusque dans les années 90 essentiellement sur le 5-Fluorouracile (5-FU) avec des taux de réponse objective de 20-25 %, elle a considérablement gagné en efficacité grace à de nouvelles molécules comme l’oxaliplatine ou l’irinotécan.
Ainsi les médianes de survie ont triplé atteignant vingt mois tandis que les taux de réponses ont plus que doublé… L’avènement récent des biothérapies antifacteurs de croissance (cétuximab) ou anti-angiogénèse (bévacizumab) promet d’amplifier encore l’efficacité des traitements.
— La chirurgie a elle aussi progressé en terme de moindre risque (mortalité opératoire < 2 %) et en terme de résultats (survie à cinq ans de 40-50 % voire plus…) et ce, malgré une extension des indications.
Histoire naturelle des métastases hépatiques de cancer colorectal
Le cancer colorectal (CCR) est le quatrième cancer le plus fréquent au monde et le troisième en France après le cancer du sein et de la prostate. En Europe, c’était en 2000, la seconde cause de mortalité par cancer. En France, la même année, 36 257 nouveaux cas et 16 000 décés lui ont été imputés. Ce chiffre est en hausse car entre 1980 et 2000, le nombre de nouveaux cas annuels de CCR a augmenté de 50 % [1].
Après la survenue d’un cancer colorectal, 40 à 50 % des malades vont développer des métastases hépatiques (MHCCR). Les MHCCR synchrones, présentes lors de la découverte du cancer colorectal, sont retrouvées dans 15 à 20 % des cas [1]. Le taux de MHCCR métachrones, découvertes à distance du traitement de la tumeur primitive, est de 15 à 20 % un à cinq ans [1]. Ces MHCCR métachrones sont isolées dans environ 80 à 90 % des cas.
La dernière série importante de malades non traités est extraite d’une cohorte de 1099 malades ayant des MHCCR affirmées histologiquement et analysés entre 1980
et 1990 [2]. Dans cette série, la médiane de survie des patients non traités (n = 484) était de 7,5 mois avec une survie à un an de 31,3 %, à trois ans de 2,6 % et à cinq ans de 0,9 % (trois malades).
Traitement des métastases hépatiques de cancer colorectal
L’exérèse chirurgicale des métastases hépatiques est le seul traitement susceptible d’offrir une survie à long terme. Actuellement, la survie à cinq ans après chirurgie varie entre 37 et 58 % [3, 4] avec une survie à dix ans de l’ordre de 20 à 25 % [5, 6]. La chimiothérapie prolonge indiscutablement la survie à court et moyen terme, mais la survie à cinq ans en l’absence de chirurgie associée, est exceptionnelle. Les traitements de destruction locale de type radiofréquence ou cryothérapie peuvent être efficaces sur des métastases isolées de petite taille et offrir une rémission prolongée [7]. Néanmoins, le consensus est de réserver ces traitements locaux aux situations où une éxèrese chirurgicale n’est pas réalisable [8].
La chirurgie d’exérèse constitue actuellement la seule perspective de survie à long terme et en tant que telle, doit toujours être envisagée en premier dans l’arsenal thérapeutique des métastases hépatiques de cancer colo-rectal. Le principe consiste à procéder à l’exérèse de toutes les lésions tumorales en laissant au moins 30 % de parenchyme hépatique non tumoral bien vascularisé. Cette proportion de foie restant est en effet la condition sine qua non pour éviter une insuffisance hépatique post-opératoire. La résection hépatique obéit en outre à la loi du « tout ou rien » :
seule l’ablation de toutes les lésions justifie la chirurgie. En effet, l’exérèse incomplète des métastases a un pronostic voisin de celui des malades non opérés [9]. La recommandation est donc de faire l’exérèse de toutes les metastases ou de ne pas faire d’hépatectomie. La seule exception à ce principe est représentée par les hépatectomies en deux temps dont le principe consiste, dans les tumeurs non résécables en un seul temps, à réséquer une partie de la tumeur par une première hépatectomie, d’attendre la régénération du foie restant et de procéder dans un deuxième temps à l’exérèse « radicale » du tissu tumoral résiduel [10].
La mortalité et la morbidité post-opératoire La mortalité post-opératoire de la chirurgie des métastases est actuellement comprise entre 0 % et 3,7 % dans la plupart des séries récentes [11]. Quant aux complications post-opératoires leur fréquence varie entre 15 % et 46 % [11]. Ce risque rend compte des indications de plus en plus poussées de ce type de chirurgie, seul traitement en mesure d’apporter un bénéfice de survie prolongée.
Facteurs pronostiques :
— Facteurs généraux L’âge ne doit pas être considéré en soi comme une contre-indication à la chirurgie hépatique. Nombre de malades agés de plus de 75 voire 80 ans sont actuellemnt
opérés sous réserve de l’absence de contre-indication liée aux co-morbidités, plus fréquentes à cet age. Les résultats de survie sont peu différents de ceux des malades plus jeunes [12].
— Facteurs lies à la tumeur primitive La présence de ganglions envahis et un intervalle libre de moins de un an entre la resection du primitif et les métastases hépatiques sont tous deux associés à un moins bon pronostic [6, 13] ainsi que le siège sur le colon droit ou le rectum. Le haut grade et le stade du primitif sont également corrélés à une moins bonne survie [13].
— Facteurs liés aux métastases hépatiques Nombre et taille des métastases Jusque dans les années 90, il était classique de considerer que seuls les malades ayant trois métastases au plus étaient susceptibles de bénéficier à long terme de la résection. Cette recommandation n’a plus cours actuellement. Dans notre experience, la survie à cinq ans des malades réséqués d’au moins quatre métastases est de 30 % et meme si elle est inférieure à celle des malades avec au plus trois lésions (45 %), la resection n’en reste pas moins la seule possibilité de survie à long terme [14]. Les patients ayant de petites métastases ont un meilleur pronostic que ceux ayant une tumeur plus volumineuse. Plus que la taille, c’est le pourcentage de foie envahi par la tumeur qui a une vraie valeur pronostique [15] avec une survie à cinq ans de seulement 15 %, au-dessus de 50 % de foie envahi [15].
Marqueurs tumoraux L’augmentation de l’ACE pré-opératoire est un facteur de mauvais pronostic [6, 16].
Le Ca 19-9, souvent moins étudié, pourrait également avoir une valeur pronostique importante [5].
Marges de résection Il est traditionnel de recommander une marge de resection de 1 cm pour toute exérèse de lésion tumorale maligne au niveau du foie. Cependant une équipe japonaise a récemment montré que 80 % des récidives locales se developpent dans une marge de 5 mm par rapport à la métastase [17]. Une marge de 5 mm pourrait donc s’avérer suffisante dans la majorité des cas [17].
Facteurs liés aux métastases extra-hépatiques C’est un autre facteur pronostique défavorable reconnu dans de nombreuses études.
Néanmoins la resection séquentielle des deux sites métastatiques quand elle se révèle potentiellement complète, est compatible avec un bénéfice de survie à long terme.
Ceci est particulièrement vrai pour les métastases pulmonaires dont l’exérèse séquentielle combinée à celle des métastases hépatiques offre une espérance de survie de 25 % à 45 % à cinq ans [18].

FIG. 1. — Survie à long terme des patients opérés de métastases hépatiques de cancer colorectal d’emblée résécables ou devenues résécables grâce à une chimiothérapie.
La chimiothérapie
La chimiothérapie à visée palliative
Elle constitue le traitement de référence des métastases hépatiques non résécablescar elle prolonge la durée de survie et améliore la qualité de vie. Alors que les taux de réponse objective n’était que de l’ordre de 20 à 30 % avec l’association de 5FU et d’acide folinique, l’apport de nouvelles drogues comme l’oxaliplatine ou l’irinotécan a permis d’augmenter les taux de réponse autour de 50 % et d’améliorer la médiane de survie de six mois à environ deux ans [19]. L’émergence des biothérapies telles que les inhibiteurs des récepteurs de l’Epidermal Growth Factor (EGFR) (Cétuximab) ou les inhibiteurs de l’angiogénèse (Bevacizumab) sont susceptibles d’améliorer encore ces résultats [20]. Ceux-ci restent néanmoins obérés à long terme par le fait que la survie à cinq ans des patients uniquement traités par chimiothérapie est de 5 %. Pour cette raison, la chirurgie est une perspective recherchée en cas de réponse à la chimiothérapie car elle est la seule à autoriser une survie prolongée.
La chimiothérapie associée à la chirurgie — La chimiothérapie pré-opératoire Elle est qualifiée de « néo-adjuvante » lorsqu’elle s’adresse à des patients d’emblée considérés comme résecables. C’est une chimiothérapie « d’induction » quand elle est administrée de nécéssité devant des métastases non résécables. Dans ce dernier cas, c’est la réduction tumorale observée sous l’effet de la chimiothérapie qui peut rendre ces patients résécables. L’expérience de l’Hôpital Paul Brousse (Figure 2) a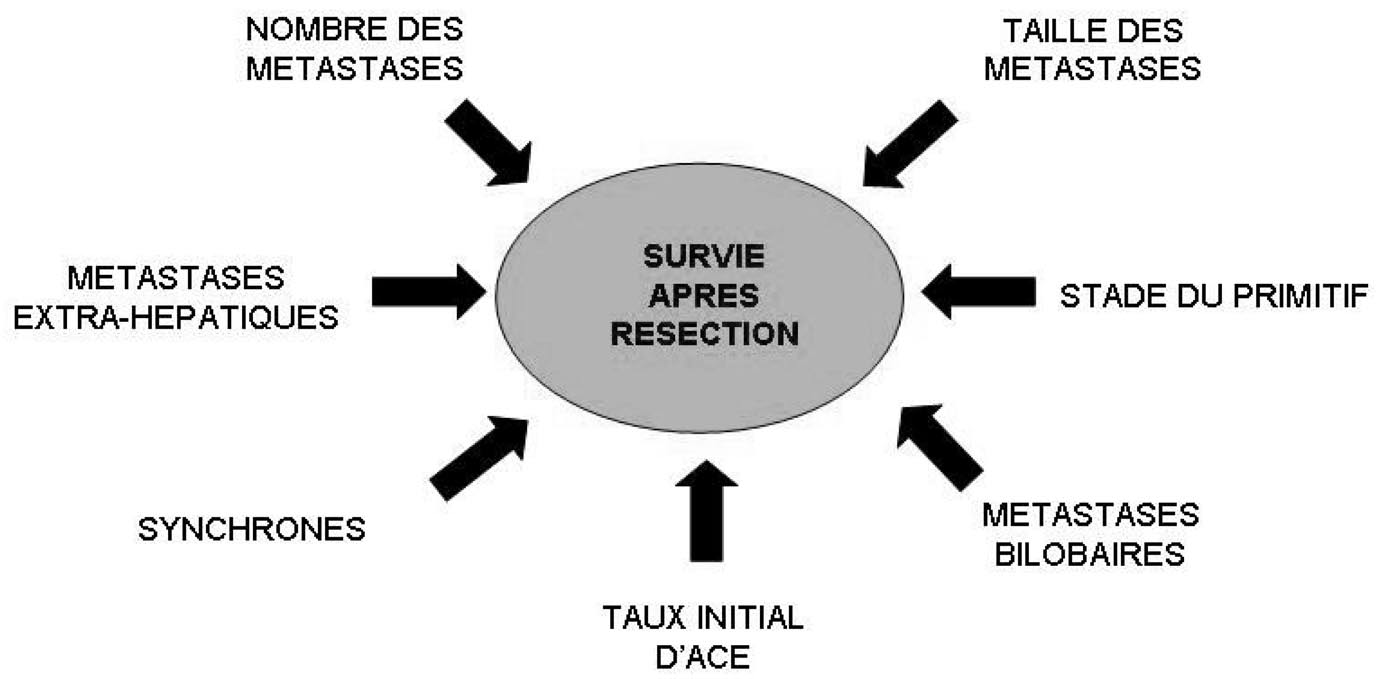
FIG. 2. — Facteurs pronostiques de la survie à long terme après résection des métastases hépatiques de cancer colorectal.
montré à ce titre que la résection après chimiothérapie des MHCCR s’accompagne d’une survie de 34 % à cinq ans et les taux de résécabilité peuvent être augmentés de 20 à 30 % [5]. Cette expérience initialement rapportée après administration chronomodulée de 5FU, acide folinique et oxaliplatine, est actuellement partagée par la plupart des centres, avec parfois des protocoles différents mais ayant pour point commun leur efficacité sur la réduction tumorale. Le consensus actuel consiste donc à proposer une résection hépatique à tous les patients initialement non résécables mais qui le deviennent sous l’effet de la chimiothérapie. L’effet bénéfique de la chimiothérapie combinée à la chirurgie dans les formes non résécables a étendu la problématique de l’intérêt de la chimiothérapie pré-opératoire aux formes d’emblée résécables. Une étude rétrospective a ainsi pu montrer que la chimiothérapie pré- opératoire serait susceptible d’augmenter la survie à long terme dans les formes multinodulaires (= 5 métastases) [21]. Une étude européenne (EORTC) est actuellement en cours pour tester cette hypothèse de façon prospective randomisée et multicentrique en utilisant une chimiothérapie de type ‘‘ FolFox ’’ (5Fu, Acide folinique et oxaliplatine) en pré- et post-opératoire comparativement à la chirurgie seule [22].
— La chimiothérapie post-opératoire Le risque de récidive après résection des métastases hépatiques est de 60 à 70 %, même lorsque les règles de la chirurgie carcinologique sont respectées [6]. Le principe de la chimiothérapie post-opératoire va donc reposer sur le traitement de la maladie microscopique potentielle que le chirurgien méconnaît lors de l’intervention d’exérèse. A ce jour, la seule étude ayant montré un réel bénéfice de la chimiothérapie post-résection est celle du Memorial Sloan-Kettering Cancer Center
de New York. Grâce à l’administration d’une chimiothérapie intra-artérielle utilisant le FUDR, la survie à deux ans passait de 72 % chez les patients uniquement traités par chimiothérapie systémique à 86 % chez les patients recevant une chimiothérapie intra-artérielle combinée à la chimiothérapie systémique [23]. Le bénéfice de la chimiothérapie intra-artérielle était surtout observé aux dépens de la récidive hépatique, la survie sans récidive hépatique étant de 90 % dans le groupe « chimiothérapie intra-artérielle » contre 60 % dans le groupe « chimiothérapie systémique » (P< 0.001) [23]. La chimiothérapie systémique avec l’utilisation de 5FU, s’est révélée bénéfique dans une étude retrospective [24]. Il y a tout lieu de penser néanmoins, que les essais en cours sont susceptibles de révéler une meilleure efficacité grâce à l’association du 5-Fu à l’oxaliplatine ou à l’irinotécan voire aux biothérapies (cetuximab, bevacizumab).
Les traitements locaux
La cryothérapie qui induit une nécrose par la congélation des tumeurs à des températures pouvant atteindre moins 180° C et la radiofréquence qui vise la destruction tumorale par la chaleur à des températures pouvant atteindre 100° C sont habituellement réservées aux métastases hépatiques non résécables. Les indications concernent essentiellement les tumeurs de taille inférieure à 4 cm et en nombre ≤ 3.
Pour les tumeurs inférieures à 25 mm une nécrose tumorale est observée dans plus de 90 % des cas. En revanche pour les tumeurs de taille plus importante, la récidive locale est fréquente.
Les stratégies thérapeutiques
Le concept de résécabilité C’est un élément crucial dans la stratégie thérapeutique car de la résécabilité découle le recours ou non à la chirurgie. C’est aussi la notion la plus difficile à définir, tant la résécabilité peut varier d’une équipe à l’autre en fonction de l’expertise chirurgicale et de l’interprétation que chacun peut avoir de la balance bénéfice/risque. L’évolution de ces dernières années s’est clairement faite vers une ‘‘ agressivité ’’ plus grande du traitement chirurgical et des strategies dites ‘‘ onco-chirurgicales ’’ combinant la chirurgie à la chimiothérapie.
Quatre grandes catégories de malades existent au moment du diagnostic des métastases :
— les patients d’emblée résécables (métastases hépatiques uniques ou ≤ 3 de siège unilatéral, à distance des vaissaux) — les patients marginalement résécables (contact vasculaire, marge prévisionnelle étroite, proportion de foie restant « limite ») — les patients non résécables mais susceptibles de le devenir en cas de réponse à la chimiothérapie (métastases hépatiques bilatérales mais à nette prédominance
unilatérale, sans localisations extrahépatiques ou avec métastases extrahépatiques limitées et potentiellement résécables — les patients définitivement non résécables (métastases multinodulaires étendues, localisations extrahépatiques multiples non résécables…) — Les métastases d’emblée résécables
La chirurgie doit être envisagée d’emblée car c’est le seul traitement à visée curative.
Néanmoins, la prise en compte des facteurs pronostiques négatifs chez un malade donné, l’efficacité plus grande de la chimiothérapie a fait émerger des nuances dans la prise en charge des malades résécables. Dans l’attente des résultats de l’étude multicentrique européenne analysant l’intérêt de la chimiothérapie pré-opératoire sur les métastases résécables, la résécabilité « technique » des MHCCR ne doit pas forcément impliquer une chirurgie d’emblée. De plus en plus, l’évolutivité de la maladie tumorale est prise en compte dans la chronologie de la décision chirurgicale et l’utilité d’une chimiothérapie première peut se discuter dans au moins 4 situations cliniques :
— Dans les formes multinodulaires (≥ 5 nodules), il semble que la réalisation d’une chimiothérapie néo-adjuvante améliore le pronostic.
— Dans les cas de résécabilité douteuse (Classe II), une chimiothérapie première peut permettre la réalisation d’une hépatectomie moins importante, plus satisfaisante au plan carcinologique, moins risquée et permettant plus facilement la réalisation de résections itératives ultérieures [25].
— Dans les situations d’évolutivité tumorale rapide, l’intérêt d’une chimiothérapie néo-adjuvante est d’utiliser une période de traitement pour tester l’agressivité du cancer et sa réponse au traitement, éléments qui reflètent la biologie tumorale, non encore directement appréciable en pratique courante. Nous avons récemment étudié cet aspect sur un groupe de cent trente et un patients ayant au moins 4 MHCCR et opérés après une chimiothéapie néo-adjuvante d’« épreuve » [26].
Après un suivi médian de trente mois, la survie globale à cinq ans des patients progressant sous chimiothérapie n’était que de 8 % alors qu’elle était respectivement de 37 % et 30 % chez les malades répondeurs ou stables.
— Dans les MHCCR synchrones, l’utilisation et la réponse à une chimiothérapie néo-adjuvante après la résection de la tumeur primitive colique peut aussi être une source d’amélioration de la survie après résection des métastases hépatiques.
Au total, même s’il n’existe en l’état actuel aucune étude prospective randomisée justifiant formellement l’utilisation d’une chimiothérapie néo-adjuvante dans les MHCCR résécables, il existe des arguments en faveur de son utilisation, dans certaines situations. L’efficacité croissante de la chimiothérapie et les bons résultats obtenus chez les malades initialement non résécables et qui le deviennent grâce à la chimiothérapie, viennent renforcer ces convictions. L’utilisation d’une chimiothérapie néo-adjuvante chez des malades présentant des facteurs de mauvais pronostic, permet aussi de mieux sélectionner ceux pour lesquels la chirurgie a le plus de
chance d’apporter un réel bénéfice de survie. Reste cependant à bien évaluer la toxicité potentielle que peut comporter la chimiothérapie sur le foie et son impact sur les complications de la chirurgie des métastases. Les premiers travaux révèlent qu’une toxicité existe [27] mais que son impact sur la morbidité post-opératoire est limitée.
— Les métastases d’emblée non résécables Dans ces cas, la chimiothérapie est actuellement la référence thérapeutique. Elle utilise le plus souvent le 5-Fluorouracile combiné à l’une des deux substances « majeures », l’oxaliplatine ou l’irinotécan. Ces combinaisons ont en effet démontré leur supériorité par rapport au « Fu-Fol » (5 Fu — Acide Folinique) classique [19].
La tendance est même actuellement d’y associer des produits de type anti-facteurs de croissance de type Cetuximab [20] ou anti-angiogénèse de type Bevacizumab [28].
L’objectif du traitement est clairement l’augmentation de la survie dans un cadre palliatif mais au delà, de permettre à certains patients d’être réséqués de leurs métastases alors qu’elles étaient au départ non résécables. Par cette stratégie qui s’est fait jour ces dernières années, le caractère palliatif du traitement s’ouvre vers une possibilité de rémission prolongée voire de traitement curatif.
Dans l’expérience pionnière de l’hôpital Paul Brousse [29, 5], parmi 1439 patients avec MHCCR, 335 (23 %) étaient d’emblée résécables et 1 104 (77 %) étaient non résécables [5]. Grâce à la chimiothérapie, 138 de ces 1 104 patients (12,5 %) ont pu être opérés. Des métastases extra-hépatiques potentiellement résécables étaient présentes chez 38 % de ces patients. C’est une réponse à une chimiothérapie de 1ere ligne (77 % des cas), de 2nd ligne (12 %) ou de 3ème ligne (9 %) qui a permis d’atteindre cette résécabilité secondaire. Une chrono-chimiothérapie par FOLFOX était utilisée dans 87 % des cas. Une résection curative a pu être effectuée chez 111 des 138 patients (80 %) et 27 patients (20 %) ont eu une chirurgie incomplète soit du fait d’une résection incomplète au niveau hépatique (9 cas) ou de l’impossibilité d’effectuer la résection ultérieure des localisations extra-hépatiques chez 18 patients.
Avec un suivi moyen de 48,7 mois, la survie globale a été de 52 %, 33 % et 23 % à trois, cinq et dix ans et la survie sans récidive était respectivement de 30 %, 22 % et 17 %. En analyse multivariée, quatre facteurs pré-opératoires se sont révélés prédictifs d’une diminution de la survie après hépatectomie : un primitif de type cancer du rectum, un CA 19-9 > 100 UI/L, un nombre de plus de deux métastases hépatiques et un diamètre maximal de plus de 10 cm. En fonction de la présence ou non de ces facteurs, un modèle permet d’estimer la survie à cinq ans qui est de 59 % en l’absence de tout facteur, de 30 % en présence d’un facteur, de 7 % en présence de deux facteurs et de 0-1 % en présence de plus de deux facteurs. Il importe bien sûr de confirmer ces résultats de façon prospective mais la prise en compte de ces facteurs disponibles avant la chirurgie peut constituer un élément important dans la prise de décision.
De nombreuses études ont maintenant reproduit cette expérience première avec des taux de résécabilité secondaire variant de 2 à 58 %, et des protocoles de chimiothé- rapie à base d’oxaliplatine, d’irinotécan voire de l’association des deux. Un consensus s’est donc fait sur le concept de proposer une chirurgie de resection à tous les patients ayant ‘‘ répondu ’’ de telle sorte à la chimiothérapie que leurs metastases deviennent potentiellement enlevables.
Elément notable dans notre étude, 7,2 % des patients présentaient une nécrose complète des métastases sur la pièce de résection après chimiothérapie. Autrement dit, 93 % des malades pourtant très répondeurs pour la plupart, à la chimiothérapie, avaient encore des tumeurs actives. Ces données incitent fortement à réséquer autant que possible, tous les anciens sites tumoraux métastatiques. La possibilité d’une disparition complète des métastases sous chimiothérapie (réponse complète) est la principale raison pour laquelle les malades doivent être périodiquement réévalués afin que les métastases restent visibles pour être réséquées dès qu’une hépatectomie potentiellement curative est réalisable.
Récemment, une étude portant sur quinze malades qui présentaient une réponse clinique complète après chimiothérapie, a montré que quatre d’entre eux (27 %) ont du être réséqués sur les données de l’échographie per-opératoire qui avait finalement retrouvé une métastase. Onze patients ont été simplement suivis avec au moins une métastase qui avait disparu [30]. Parmi eux, six n’ont pas eu de chimiothérapie complémentaire et un seul a récidivé localement à trois mois. Les autres ont été suivis respectivement à 55, 43, 33, 31, 31 et 25 mois et n’ont pas présenté de récidive hépatique.
Cependant, cette dernière étude est trop limitée pour permettre de remettre en cause le principe admis généralement de réséquer autant que possible les anciens sites métastatiques compte tenu de la forte probabilité de tumeur résiduelle même en cas de réponse complète.
— Les métastases hépatiques synchrones
C’est une situation ou il est actuellement difficile d’établir des recommandations claires car plusieurs stratégies sont possibles depuis la chimiothérapie première à la résection en un temps des métastases et de la tumeur primitive.
Le choix entre chimiothérapie ou chirurgie première dépend surtout de deux facteurs : le caractère symptomatique du cancer colo-rectal et la résécabilité potentielle des métastases hépatiques.
— En cas de symptomatologie occlusive, la résection de la tumeur primitive est d’emblée indiquée. La seule alternative serait la mise en place d’une prothèse colique susceptible d’éviter l’occlusion tout en autorisant la mise en route rapide d’une chimiothérapie.
— La résécabilité potentielle des métastases hépatiques, sous-tendue par l’importance de l’envahissement tumoral hépatique, peut également intervenir dans le choix thérapeutique. En cas d’envahissement hépatique important et de métas-
tases non résécables, le pronostic est davantage lié à la progression tumorale hépatique qu’à la prévention du risque occlusif. Une chimiothérapie première qui contrôle la progression tumorale avant toute chirurgie, même limitée à la tumeur primitive, peut tout à fait se justifier. Dans une étude récente portant sur des patients ayant des métastases hépatiques non résécables, cette attitude a permis, sans modifier la survie, d’éviter le risque de la chirurgie colique et diminuer la durée d’hospitalisation des malades non opérés par rapport aux malades comparables traités par chirurgie première de la tumeur primitive [31].
Les récidives tumorales après hépatectomie
Malgré le respect des règles carcinologiques, près des deux tiers des malades vont présenter une récidive tumorale dans les suites d’une chirurgie des métastases hépatiques.
La chimiothérapie adjuvante post-opératoire est-elle susceptible de réduire le risque de récidive ? Cette prévention a pu être établie grâce à une chimiothérapie intraartérielle hépatique utilisant du FUDR combinée à une chimiothérapie systémique [23]. En ce qui concerne la chimothérapie systémique seule, l’administration de 5 Fu associé à l’acide folinique, n’a pas fait définitivement la preuve de son efficacité. Les protocoles utilisant des associations plus efficaces de type FolFox ou FolFiri seront plus en mesure de démontrer dans un proche avenir leur efficacité dans cette indication [22].
Lorsque la récidive se produit, elle se fait sous forme de localisations hépatiques isolées dans un tiers des cas. Dans ces cas, le recours à une deuxième hépatectomie comporte le même risque opératoire et les mêmes résultats de survie que les premières hépatectomies.
Une évaluation récente que nous avons faite des troisièmes hépatectomies a permis d’établir des résultats analogues [11] : La mortalité opératoire est aussi faible et le bénéfice de survie à cinq ans (32 %) comparable à celui des hépatectomies préalables. Il convient donc de proposer une hépatectomie itérative chez tous les patients pour lesquels la résection est potentiellement curative.
La même attitude s’applique à la survenue de métastases extra-hépatiques en particulier pulmonaires dont la résection, après hépatectomie autorise une survie à cinq ans de 35 % tout à fait comparable à celle des métastases hépatiques ou pulmonaires isolées [18].
CONCLUSION
Le traitement des MHCCR qui ne comportait il y a quelques années que la chirurgie comme possibilité de survie à long terme chez un nombre très limité de patients, s’est désormais enrichi d’autres moyens thérapeutiques. La chimiothérapie permet d’améliorer la survie globale des patients et chez certains d’entre eux leur offre la
possibilté d’être opérés de leur métastases alors qu’ils étaient au départ non opérables. Les traitements locaux (radiofréquence, cryothérapie) en agissant sur les lésions non résécables permettent à une proportion plus grande de patients de bénéficier d’un traitement chirurgical « combiné ». De cette multidisciplinarité des traitements émerge une efficacité plus grande de la prise en charge des MHCCR, les réunions de concertation multidisciplinaire venant, par l’intervention combinée du chirurgien, du gastroentérologue, de l’oncologue et du radiologue, asseoir la décision du « bon traitement » à chaque moment de l’évolution de plus en plus longue des patients porteurs de MHCCR.
BIBLIOGRAPHIE [1] FAIVRE J., MANFREDI S., BOUVIER A.M. — [Epidemiology of colorectal cancer liver metastases].
Bull Acad Natl Med. 2003, 187, 815-822, discussion 822-813.
[2] STANGL R., ALTENDORF-HOFMANN A., CHARNLEY R.M., SCHEELE J. — Factors influencing the natural history of colorectal liver metastases. Lancet. 1994, 343, 1405-1410.
[3] ABDALLA E.K., VAUTHEY J.N., ELLIS L.M., ELLIS V., POLLOCK R., BROGLIO K.R., et al. —
Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastases. Ann Surg. 2004, 239, 818-825, discussion 825-817.
[4] MANN C.D., METCALFE M.S., LEOPARDI L.N., MADDERN G.J. — The clinical risk score :
emerging as a reliable preoperative prognostic index in hepatectomy for colorectal metastases.
Arch. Surg. , 2004, 139, 1168-1172.
[5] ADAM R., DELVART V., PASCAL G., VALEANU A., CASTAING D., AZOULAY D., et al. — Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy : a model to predict long-term survival. Ann. Surg., 2004, 240, 644-657, discussion 657-648.
[6] FONG Y., FORTNER J., SUN R.L., BRENNAN M.F., BLUMGART L.H. — Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer : analysis of 1001 consecutive cases. Ann. Surg. , 1999, 230 , 309-318, discussion 318-321.
[7] ADAM R., AKPINAR E., JOHANN M., KUNSTLINGER F., MAJNO P., BISMUTH H. — Place of cryosurgery in the treatment of malignant liver tumors. Ann. Surg., 1997, 225, 39-38, discussion 48-50.
[8] ADAM R., VINET E. — Regional treatment of metastasis : surgery of colorectal liver metastases.
Ann Oncol. 2004, 1 5 Suppl 4, iv103-106.
[9] SCHEELE J., STANGL R., ALTENDORF-HOFMANN A. — Hepatic metastases from colorectal carcinoma : impact of surgical resection on the natural history. Br. J. Surg. ,1990, 77, 1241-1246.
[10] ADAM R., LAURENT A., AZOULAY D., CASTAING D., BISMUTH H. — Two-stage hepatectomy : A planned strategy to treat irresectable liver tumors. Ann. Surg., 2000, 232, 777-785.
[11] ADAM R., PASCAL G., AZOULAY D., TANAKA K., CASTAING D., BISMUTH H. — Liver resection for colorectal metastases : the third hepatectomy. Ann. Surg., 2003, 238, 871-883, discussion 883-874.
[12] ZACHARIAS T., JAECK D., OUSSOULTZOGLOU E., BACHELLIER P., WEBER J.C. — First and repeat resection of colorectal liver metastases in elderly patients. Ann. Surg., 2004, 240, 858-865.
[13] NORDLINGER B., GUIGUET M., VAILLANT J.C., BALLADUR P., BOUDJEMA K., BACHELLIER P., et al. — Surgical resection of colorectal carcinoma metastases to the liver. A prognostic scoring
system to improve case selection, based on 1568 patients. Association Francaise de Chirurgie.
Cancer, 1996, 77 , 1254-1262.
[14] ADAM R. — Current surgical strategies for the treatment of colorectal cancer liver metastases.
Eur. J. Cancer, 2004, 7 , 21-26.
[15] ERCOLANI G., GRAZI G.L., RAVAIOLI M., CESCON M., GARDINI A., VAROTTI G., et al. — Liver resection for multiple colorectal metastases : influence of parenchymal involvement and total tumor volume, vs number or location, on long-term survival. Arch.Surg., 2002, 137, 1187-1192.
[16] CHOTI M.A., SITZMANN J.V., TIBURI M.F., SUMETCHOTIMETHA W., RANGSIN R., SCHULICK R.D., et al. — Trends in long-term survival following liver resection for hepatic colorectal metastases.
Ann. Surg. , 2002, 235 , 759-766.
[17] KOKUDO N., MIKI Y., SUGAI S., YANAGISAWA A., KATO Y., SAKAMOTO Y., et al. — Genetic and histological assessment of surgical margins in resected liver metastases from colorectal carcinoma : minimum surgical margins for successful resection. Arch. Surg., 2002, 137 , 833-840.
[18] VOGELSANG H., HAAS S., HIERHOLZER C., BERGER U., SIEWERT J.R., PRAUER H. — Factors influencing survival after resection of pulmonary metastases from colorectal cancer. Br. J. Surg., 2004, 91 , 1066-1071.
[19] DE GRAMONT A., FIGER A., SEYMOUR M., HOMERIN M., HMISSI A., CASSIDY J., et al. —
Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J. Clin. Oncol., 2000, 18, 2938-2947.
[20] TABERNO J.M., VAN CUTSEM E., SASTRE J., AL. E., editors. An international phase II study of cetuximab in combination with FOLFOX4 in the first-line treatment of patients with metastastic colorectal (CRC) expressing epidermal growth factor receptor (EGFR) : Preliminary results. Proc. Am. Soc. Clin. Oncol., 2004.
[21] TANAKA K., ADAM R., SHIMADA H., AZOULAY D., LEVI F., BISMUTH H. — Role of neoadjuvant chemotherapy in the treatment of multiple colorectal metastases to the liver. Br. J. Surg., 2003, 90, 963-969.
[22] NORDLINGER B., SORBYE H., DEBOIS M., AL. E., editors. Feasibility and risks of pre-operative chemotherapy with folfox4 and surgery for resectable colorectal cancer liver metastases. Interim results of the EORTC intergroup randomized phase III study 40983. Proc. Am. Soc. Clin.
Oncol., 2005.
[23] KEMENY N., HUANG Y., COHEN A.M., SHI W., CONTI J.A., BRENNAN M.F., et al. — Hepatic arterial infusion of chemotherapy after resection of hepatic metastases from colorectal cancer.
N. Engl. J. Med., 1999, 341, 2039-2048.
[24] FIGUERAS J., VALLS C., RAFECAS A., FABREGAT J., RAMOS E., JAURRIETA E. — Resection rate and effect of postoperative chemotherapy on survival after surgery for colorectal liver metastases. Br. J. Surg., 2001, 88, 980-985.
[25] ADAM R., BISMUTH H., CASTAING D., WAECHTER F., NAVARRO F., ABASCAL A., et al. — Repeat hepatectomy for colorectal liver metastases.
Ann. Surg. , 1997, 225, 51-60, discussion 60-52.
[26] ADAM R., PASCAL G., CASTAING D., AZOULAY D., DELVART V., PAULE B., et al. — Tumor progression while on chemotherapy : a contraindication to liver resection for multiple colorectal metastases ? Ann. Surg. , 2004, 240 , 1052-1061, discussion 1061-1054.
[27] RUBBIA-BRANDT L., AUDARD V., SARTORETTI P., ROTH A.D., BREZAULT C., LE CHARPENTIER M., et al. — Severe hepatic sinusoidal obstruction associated with oxaliplatin-based chemotherapy in patients with metastatic colorectal cancer.
Ann. Oncol. 2004, 15 , 460-466.
[28] HURWITZ H., FEHRENBACHER L., NOVOTNY W., CARTWRIGHT T., HAINSWORTH J., HEIM W., et al. — Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer.
N. Engl. J. Med., 2004, 350, 2335-2342.
[29] BISMUTH H., ADAM R., LEVI F., FARABOS C., WAECHTER F., CASTAING D., MAJNO P., ENGERRAN L., et al. — Resection of non resectable liver metastases from colorectal cancer after neoadjuvant chemotherapy.
Ann. Surg., 1996 Oct ; 224(4) : 509-20 ; discussion 520-2.
[30] ELIAS D., YOUSSEF O., SIDERIS L., DROMAIN C., BATON O., BOIGE V., et al. — Evolution of missing colorectal liver metastases following inductive chemotherapy and hepatectomy.
J. Surg.
Oncol., 2004, 86, 4-9.
[31] BENOIST S., PAUTRAT K., MITRY E., ROUGIER P., PENNA C., NORDLINGER B. — Treatment strategy for patients with colorectal cancer and synchronous irresectable liver metastases. Br. J.
Surg. , 2005, 92 , 1155-1160.
DISCUSSION
M. Denys PELLERIN
Quelle est, globalement, la qualité de vie des patients qui subissent des chimiothérapies itératives (vous avez cité le chiffre de dix-huit séries pour l’un de vos patients) et des interventions chirurgicales réitérées ?
Votre question met le doigt sur le point faible de cette stratégie de rendre résécables les métastases hépatiques irrésécables : c’est le poids de la chimiothérapie, qui doit être une chimiothérapie associant plusieurs médicaments et à forte dose. C’est ce dont se plaignent le plus les malades qui réclament la chirurgie le plus vite possible. Certaines chimiothérapies ont des effets secondaires plus pénibles que d’autres. Ainsi l’oxaliplatine qui donne des paresthésies distales, fort gênantes. Heureusement on dispose d’autres produits et on doit alors passer à une autre chimiothérapie. Comme je l’ai dit : dès que le malade est devenu opérable, il faut arrêter la chimiothérapie et opérer.
* Centre Hépato-Biliaire, Hôpital Paul Brousse, Assistance Publique Hopitaux de Paris, Faculté de Médecine Paris-Sud, 12 avenue P.V. Couturier, 94800 Villejuif Tirés à part : Professeur Henri BISMUTH, même adresse Article reçu et accepté le 26 novembre 2007
Bull. Acad. Natle Méd., 2007, 191, no 8, 1647-1660, séance du 27 novembre 2007


