Résumé
La révolution informatique a, dans quasiment tous les domaines de l’activité humaine et particulièrement en médecine, permis la naissance d’un nombre important de systèmes de diagnostic et de traitement qui peuvent pour une large part se substituer aux médecins. Ces outils, d’abord directement manipulés par l’homme, puis automatisés sont devenus de véritables robots programmés pour la réalisation de gestes directs. Dans cet article un système de navigation magnétique est décrit qui permet le pilotage à distance d’une sonde d’électrophysiologie et d’ablation par radiofréquence intracardiaque. Le développement parallèle de la réalité virtuelle permettant de recréer l’image des chambres cardiaques dans l’ordinateur, sa fusion avec l’image scannographique acquise en préopératoire et son inté- gration au système de navigation est discutée. Cette nouvelle technologie permet de traiter des cas les plus simples aux plus complexes, sans peine pour le médecin qui n’a plus à porter de tablier de plomb, et n’est plus soumis aux radiations ionisantes.
Summary
The computer revolution in medicine has given rise to important diagnostic and therapeutic systems that can virtually replace physicians. Hand-held tools have been fully automated, and robots can now be programmed to perform certain tasks. This article describes a magnetic navigation system allowing remote control of an electrophysiology and radiofrequency ablation catheter. The simultaneous development of virtual reality, allowing computer registration of the cardiac chamber image, its subsequent fusion with the computed tomographic image, and eventually with the magnetic navigation system, is discussed. This new technology can be used to treat both simple and complex cases, sparing the physician the burden of the lead coat and radiation exposure.
Les tachycardies ont toujours constitué une part importante des maladies du cœur.
Les travaux de Puech et la possibilité d’insérer des sondes par voie veineuse ouvrant la voie à l’analyse de l’ECG intracardiaque ont précédé la floraison d’une quantité importante de travaux analysant les mécanismes arythmogènes de façon précise [1].
Les premières interventions chirurgicales curatrices ont rapidement suivi, mais leur lourdeur et leur morbi-mortalité en ont limité l’expansion [2]. Il a fallu attendre 1982 pour que les premières tentatives de modification par cathéter (fulguration puis ablation par radiofréquence) permettent le traitement optimal de ces tachycardies et à la rythmologie de trouver la place importante qui est la sienne actuellement. Ainsi pratiquement toutes les tachycardies ont pu être traitées, sauf une : la fibrillation auriculaire. Ceci tenait, et dans une certain mesure tient encore, à la relative mauvaise compréhension de ses mécanismes initiateurs et perpétuateurs. C’est la mise en évidence de l’importance du facteur initiateur que sont les extrasystoles auriculaires naissant des veines pulmonaires qui a permis d’élaborer la technique d’ablation circonférentielle de leur abouchement dans l’oreillette [3]. Celle ci est particulièrement efficace pour prévenir les récidives dans les formes paroxystiques de cette tachycardie, mais elle est longue et éprouvante pour l’opérateur, durant volontiers plus de trois heures pendant lesquelles le port du tablier de plomb est nécessaire. En outre elle expose le patient et l’opérateur à des temps d’exposition aux radiations ionisantes pouvant dépasser soixante minutes [4]. Ces chiffres sont encore aggravés dans les formes chroniques de la fibrillation du fait de l’adjonction de lignes de radiofréquence dans les deux oreillettes.
C’est dans cet esprit, et essentiellement pour cette indication, qu’ont été conçus et développés des systèmes robotiques automatisant les procédures, et en permettant leur réalisation à distance par un médecin opérateur assis et à l’abri des rayons X.
Dans cet article nous traiterons dans un premier temps des robots en général, de l’évolution simultanée des systèmes d’aide à la localisation et de guidage, et finalement de leur combinaison dans le cadre de la robotique cardiaque.
LES ROBOTS
Un robot peut être défini comme un système automatique mécanisé capable de se substituer à l’homme et pouvant effectuer une ou plusieurs tâches, dans un environnement donné, de manière autonome, par l’exécution d’un programme. Le terme robot a été inventé par l’écrivain tchèque Karel Capek. Dans la pièce de science fiction « Rossum’s et Universal Robots », l’auteur utilise le terme robot pour la première fois dans l’histoire [5]. Ce terme, dérivé du tchèque « robota » qui signifie corvée ou du terme « robotovat » qui signifie travailler ou asservir. A l’heure actuelle les robots sont partout et utilisés dans l’industrie au sens large pour l’exécution de tâches répétitives et prédéfinies (peinture, soudure…). Généralement ceux-ci sont utiles en environnement hostile ou agressif.
Les robots médicaux
La diversification des champs d’application des robots dans le domaine médical est relativement récente. Neuromate est le premier robot du genre développé en 1989 à partir d’un prototype mis au point en 1985 par le Chu de Grenoble. Son application en neurochirurgie stéréotaxique permet avec une meilleure planification une plus grande précision et une exécution plus simple de diverses interventions cérébrales.
Les applications orthopédiques, et Orl ont été développées. Un état de l’art complet des applications non cardiologiques est disponible en langue française sur l’internet [6].
La robotique cardiaque : la navigation magnétique
Si récemment des interventions intra coronaires percutanées ont pu être réalisées à distance, le premier système et le plus développé à ce jour permettant la manipulation robotique de cathéters intracardiaques fait appel à la création artificielle d’un champ magnétique géant autour du corps [7-10]. Dans la version Niob de ce système développée par la société Stéréotaxis (St Louis, Mo, Usa), deux aimants géants permanents de plus de deux tonnes chacun sont plaqués contre la paroi du thorax, et leur orientation respective l’un par rapport à l’autre est contrôlée par ordinateur (Figure 1A). Il en résulte alors un vecteur intracardiaque de 0,08 Tesla au centre du cœur qui correspond à la somme de l’action des deux champs générés par les deux aimants. Un cathéter d’électrophysiologie et d’ablation, spécial par l’extrême souplesse de son bout distal, et qui est muni de trois charges magnétiques sur lesquelles le champ de force résultant va fortement s’appliquer, va alors répondre et s’orienter de façon extrêmement précise dans l’axe du champ.
L’opérateur, après avoir inséré le cathéter dans la cavité cardiaque à étudier, passe au poste de contrôle qui comprend une station de travail d’où il va piloter l’ensemble de l’intervention à l’aide d’un équipement informatique sophistiqué (Figure 1B). Les mouvements d’un cathéter peuvent être décomposés en trois principaux : l’avance et le recul, la flexion et l’extension et la rotation. Ces deux derniers vont pouvoir être généré par l’orientation des aimants. L’avance et le recul sont contrôlés par pas de 1 mm par un « avanceur de cathéters » actuellement piloté par un système de joystick et de boutons. Les autres mouvements sont programmés à l’aide d’un logiciel spécifique appelé « Navigant » (Figure 2). Un simple click avec déplacement de la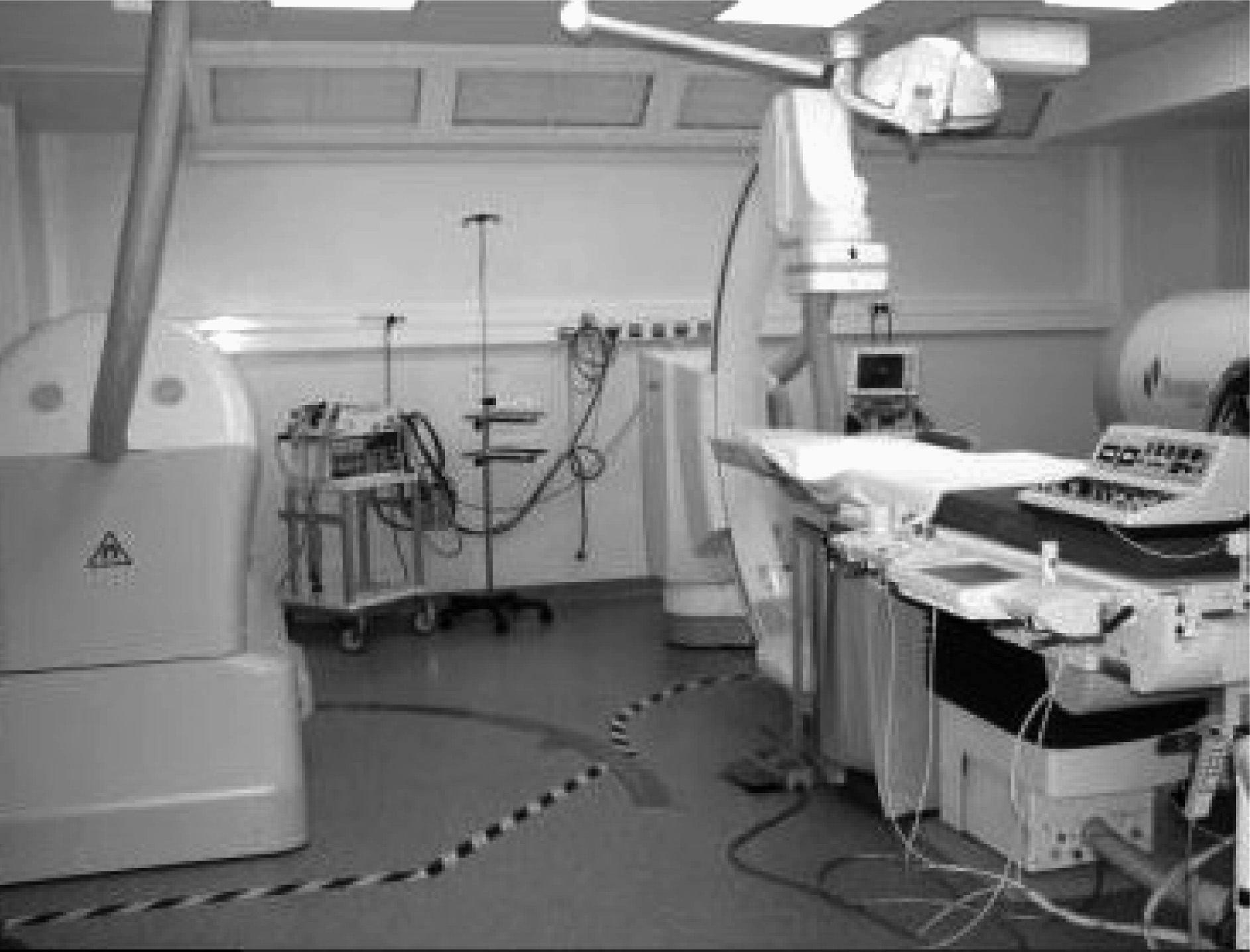

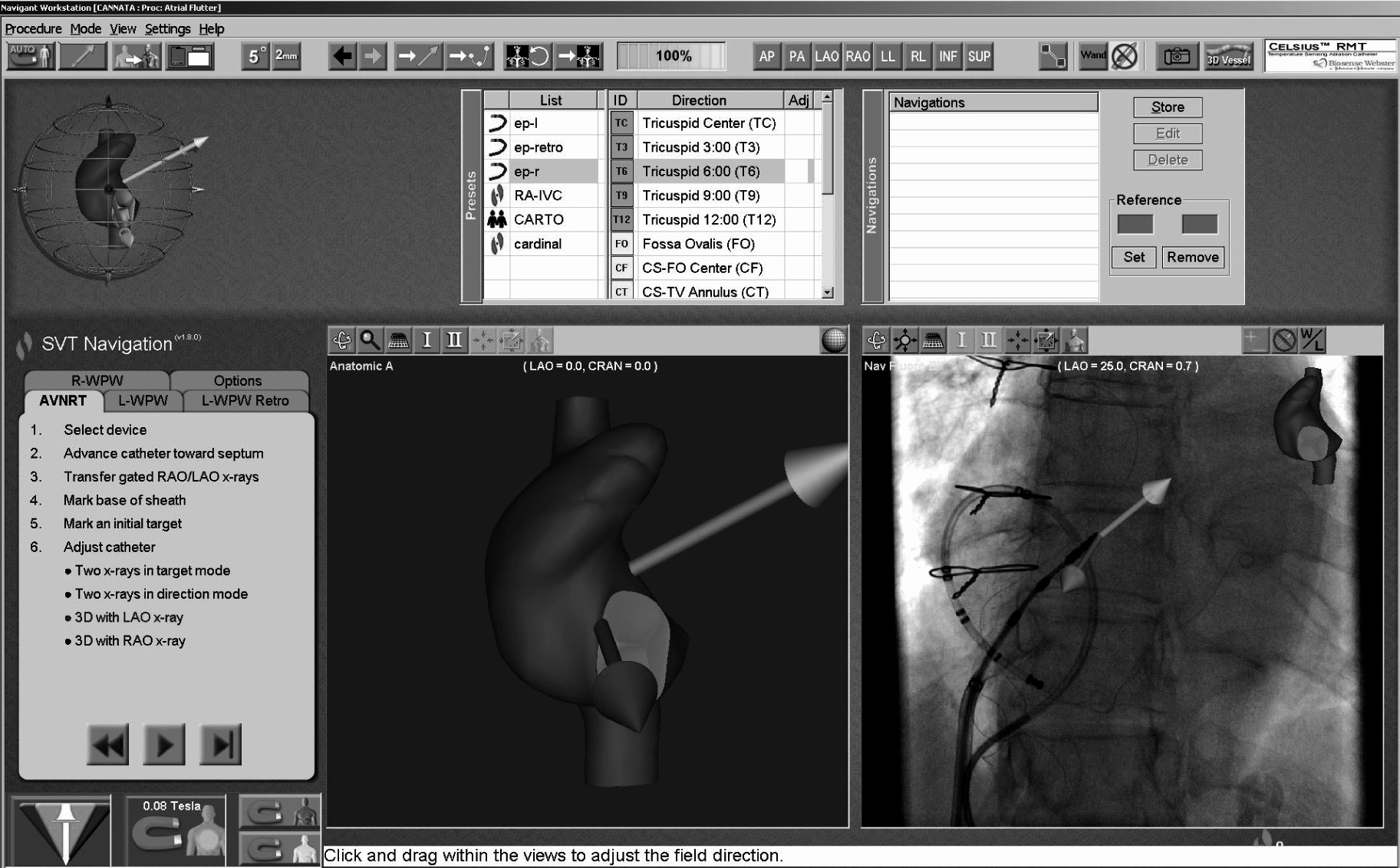
Fig. 2. — L’écran du logiciel Navigant.
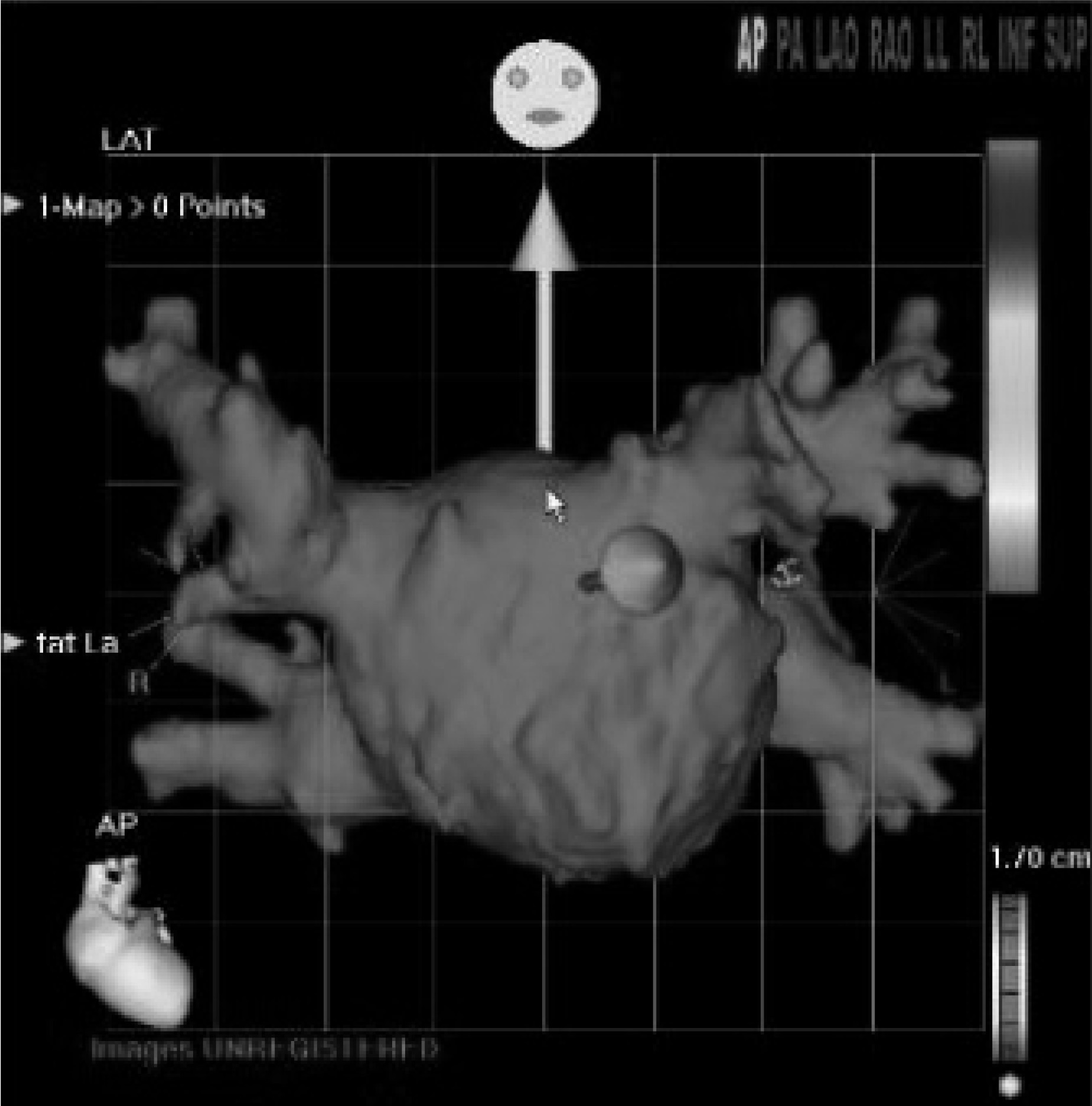
L’orientation du champ magnétique est représenté par une flèche orientée dans un espace tridimensionnel et symbolisant de champ dominant. Celui ci est imagé par deux flèches de couleurs. La verte représente le champ que l’opérateur souhaite programmer dans le futur immédiat, et la jaune le champ actuellement appliqué. La représentation graphique du vecteur peut se faire sur une silhouette artificielle correspondant approximativement à la cavité dans laquelle se trouve la sonde (panneau inférieur central) ou sur une vue radiologique (panneau inférieur droit).
souris permet de définir une nouvelle orientation du champ de force qui, instantanément appliqué, permet le déplacement immédiat de la sonde avec une précision et une reproductibilité extrême. Le champ de force lui même est représenté par un double système de flèches de couleur différentes. Tous les champs préalablement appliqués qui ont abouti au déplacement de la sonde dans une région intéressante peuvent être stockés pour réutilisation ultérieure. Le suivi radiologique du mouvement de la sonde, est alors le mode le plus simple de navigation magnétique. Le système permet aussi un mode qui, dans une certaine mesure, est encore plus simple et intuitif : la navigation basée sur la cible. Dans ce mode la cible est identifiée sur une silhouette stockée dans le logiciel et l’ordinateur calculera de lui même le ou les champ(s) nécessaire(s) à l’atteinte de la cible. L’approche de la zone d’intérêt est ainsi précise devant permettre un placement rapide du cathéter d’ablation.
Lors de la manipulation manuelle classique des cathéters, un problème, majeur limitant l’efficacité des tirs de radiofréquence est l’intermittence du contact sondetissu. En électrophysiologie classique (manuelle), la manipulation d’un cathéter par une poignée située à l’extérieur du corps, et dont l’extrémité active intracardiaque se situe à 1,10 m, et qui fait une ou plusieurs courbes parfois prononcées dans un cœur battant, rend difficile la permanence du contact entre l’électrode d’active et le tissu cardiaque. En navigation magnétique, le contrôle direct de l’extrémité distale de la sonde plaquée de façon active et permanente par le champ contre l’endocarde est un paramètre essentiel de l’efficacité de la navigation. La stabilité du contact cathétertissu est inégalée, même en présence de changement de rythme comme l’arrêt d’une tachycardie pendant un tir de radiofréquence, dans des anatomies complexes comme une veine cave supérieure gauche persistante, ou simplement dans des zones de stabilisation difficile telle la région de la voie lente du nœud auriculoventriculaire [8].
Le caractère extrêmement flexible de la sonde active est en outre un gage de sécurité.
De nombreux essais n’ont pas permis malgré l’appui direct de la sonde à divers endroits de l’oreillette gauche de chien d’obtenir une quelconque perforation cardiaque. La relativement faible force axiale appliquée sur le tissu (maximale autour de 15 g) est un avantage de sécurité évident mais peut au moins théoriquement limiter l’efficacité des tirs d’ablation. A contrario ces même flexibilité et précision dans la manipulation d’une sonde rend le franchissement de tortuosités multiples facile lors de l’implantation d’une sonde épicardique ventriculaire gauche dans les veines satellites du sinus coronaire.
L’utilisation de ce système se répand maintenant largement et de nombreuses tachycardies telles la réentrée intranodale, les voies accessoires, les tachycardies ventriculaires et même la fibrillation auriculaire habituellement traitées manuellement peuvent l’être de façon robotisée [12-16] LES SYSTÈMES D’AIDE À LA LOCALISATION ET DE GUIDAGE : LA RÉALITÉ VIRTUELLE ET LA FUSION D’IMAGES
La réalité virtuelle
Une des limitations de techniques de cathétérisme classique est le suivi de la progression d’un cathéter ou d’un guide dans une cavité ou un vaisseau par une surveillance en deux plans alors que la structure cardiaque est tridimensionnelle.
C’est alors l’expérience de l’opérateur et sa projection mentale de la position réelle dans l’espace de la cavité étudiée qui permettra la réalisation optimale de l’examen.
Le système Carto® a été le premier système de réalité virtuelle disponible en milieu rythmologique. Le principe en est basé sur la production de champs magnétiques thoraciques de très faible amplitude générée sous la table de cathétérisme au niveau du cœur (ceux-ci n’interfèrent pas avec ceux générés par les aimants utilisés lors de la navigation magnétique). Un capteur positionné dans la pointe d’un cathéter permet le repérage tridimensionnel extrêmement précis (un mm in vivo ) de la position de celui ci. Lorsqu’il touche la paroi endocardique, le contrôle visuel et l’enregistrement concomitant d’un électrogramme permet de valider la position tridimensionnelle de la pointe du cathéter. L’opération est répétée en déplaçant le cathéter jusqu’à ce qu’une silhouette apparaisse en trois dimensions dans l’ordina- teur représentant la cavité étudiée. Le nombre de points à acquérir est très variable en fonction de la précision voulue (entre cinquante et trois cent cinquante). A la fin de l’acquisition une silhouette représentant la cavité étudiée est disponible et manipulable dans l’espace virtuel de l’ordinateur. Dans celle ci un icône figurant la sonde d’ablation se déplace avec ses mouvements réels et permet a tout moment d’en connaître la position sans faire appel à la radiologie ; c’est ce qui s’appelle la « réalité augmentée » [6]. D’autres systèmes basés sur des concepts similaires sont maintenant disponibles sur le marché.
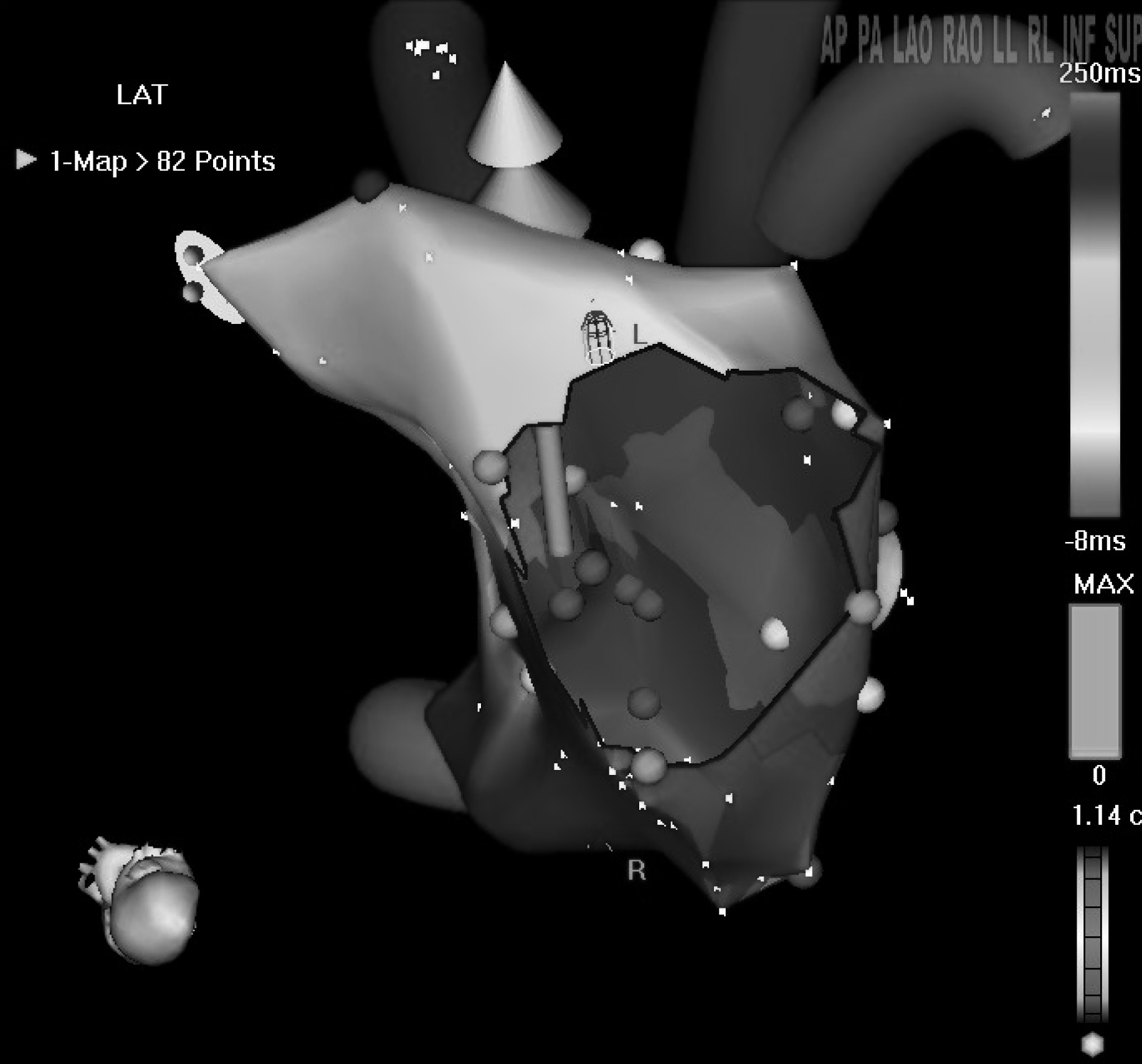
L’avantage de ces modélisations informatiques des cavités cardiaques est qu’elles sont porteuses d’informations quant à la chronologie locale des électrogrammes (cartographie d’activation en rythme sinusal et pertachycardique). La figure 3 en montre un exemple. Elles permettent en outre d’identifier et d’évaluer précisément des zones de voltage tissulaire variables. Par là même peuvent être dépistées des anomalies telles que des cicatrices intra-pariétales post chirurgicales dont le dessin sera réalisé dans la silhouette de la cavité étudiée ou des zones de silence électriques fréquentes dans les fibrillations auriculaire et flutter atypiques [9].
L’ imagerie radiologique informatique
Le scanner cardiaque, plus qu’actuellement l’Irm, a pris une importance extrême dans cette indication de par l’apparition des capteurs multiples permettant en un temps très court (vingt à vingt-cinq secondes) d’acquérir une image de la cavité étudiée avec un réalisme anatomique surprenant. Celle-ci peut elle-même être manipulée (et coupée) pour présenter une vue endoscopique de ces cavités, comme si l’observateur cheminait dans une cavité virtuelle dépourvue de sang. Ainsi peuvent être étudiés les rapports de structures anatomiquement proches qu’il est important de localiser précisément dans l’espace. Par exemple, la proximité (et la morphologie) de l’auricule gauche et sa relation aux veines pulmonaires (et tout particulièrement la veine pulmonaire supérieure gauche) peut être étudiée avec soin.
Plus récemment ont été décrites des anomalies jusque là inconnues tels des diverticules du toit, dont la taille est variable, et qui peuvent revêtir une importance toute particulière lors des procédures d’ablation [9].
Les limites de l’imagerie scanner sont cependant multiples. En effet, il est rarement acquit à jeun ce qui peut jouer via les conditions de charge sur le volume des cavités étudiées. Le rythme prévalant au moment de l’acquisition des images est aussi de toute première importance de par son son effet direct sur les volumes cavitaires mais aussi de par la difficulté de la synchronisation à l’électrocardiogramme en cas d’arythmie. L’irradiation du patient enfin n’est probablement pas négligeable. Celleci a surtout été étudiée dans l’évaluation coronarographique mais est considérée pour un scanner de 64 barrettes augmenter de façon non négligeable le risque de cancer pulmonaire ou du sein chez la jeune femme [10].
Fig. 3. — Reconstitution en réalité virtuelle de l’oreillette gauche dans un cas de flutter périmitral. La silhouette virtuelle est vue par en dessous a travers la valve mitrale. L’icône de la tête donne une idée de la position spatiale réelle de l’observateur. Outre de larges zones grise dépourvues d’électrogrammes (zones cicatricielles), il peut être noté que toutes les couleurs correspondant à l’échelle de temps de 258 ms sont représentées le long de la valve mitrale. Ceci authentifie un mouvement macro réentrant tournant autour de cette structure. L’ablation en a alors été réalisée rapidement avec succès par délivrance de tirs de radiofréquence entre la valve mitrale et la veine pulmonaire inférieure gauche.
La fusion d’images
La perfection des images est telle que l’étape ultérieure est la fusion de l’image scanner avec la silhouette obtenue par la cartographie informatisée. A l’heure nous écrivons cet article, la fusion ne peut être réalisée qu’avec la silhouette obtenue avec le système Carto. La figure 4 en montre un exemple. Après acquisition de la silhouette virtuelle point par point par la méthode classique telle que dans la figure précédente, celle ci est rapprochée dans l’ordinateur du scanner qui y a été préalablement injecté. Diverses étapes de synchronisation sont alors rapidement effectuées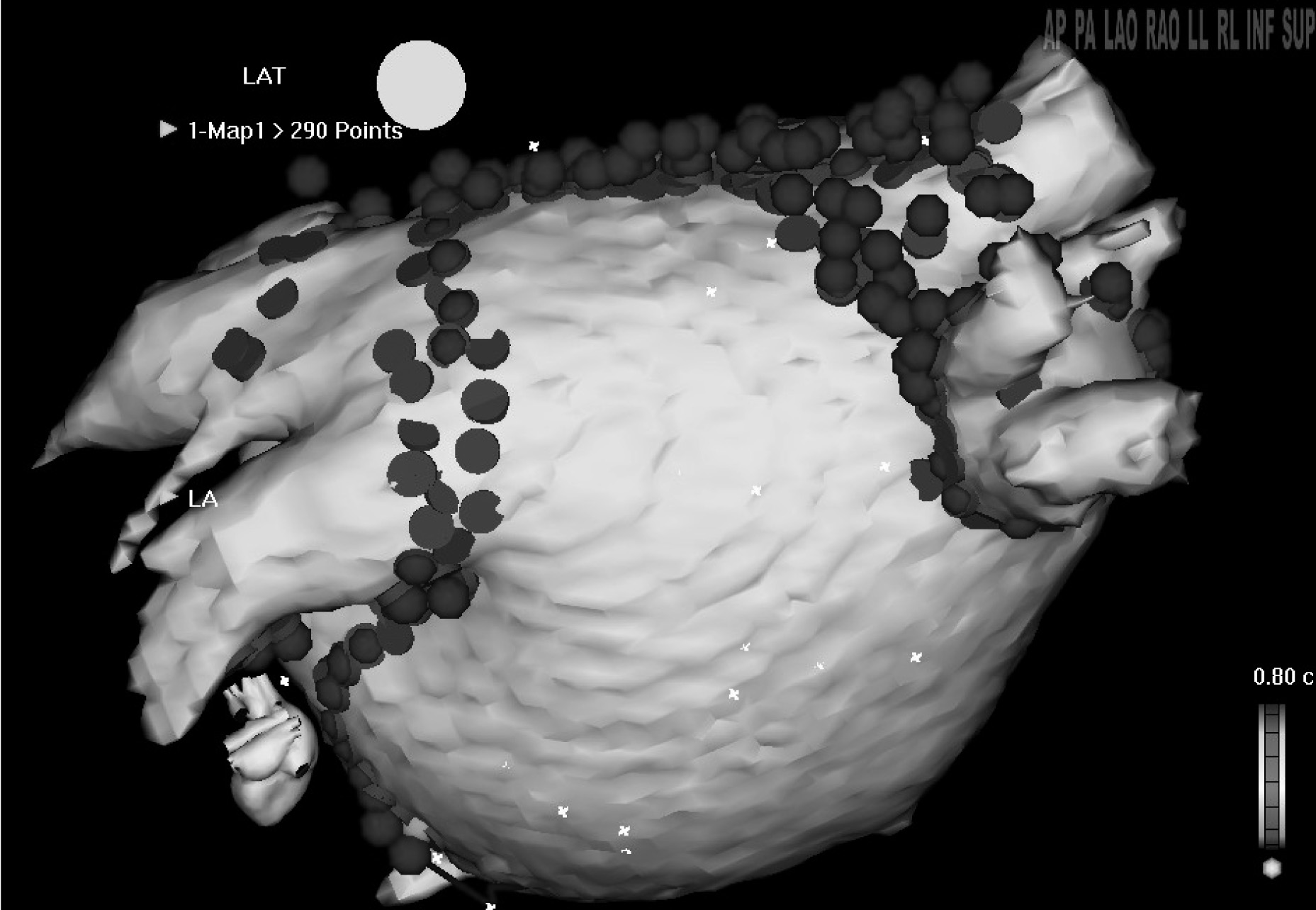
Fig. 4. Scanner de l’oreillette gauche tel qu’utilisé lors d’une ablation par radiofréquence en technique classique (manuelle). La vue scannographique est acquise en période préopératoire et injectée dans l’ordinateur qui permet la cartographie informatisée. Après acquisition de la silhouette auriculaire gauche telle que dans la figure 3, une fusion des deux images est réalisée.
La silhouette virtuelle est alors retirée et l’ablation par radiofréquence peut avoir lieu dans la silhouette scannographique. Les lésions de radiofréquence y apparaissent comme des points de couleurs sur la surface du scanner.
qui permettent la fusion des deux images avec une précision qui peut atteindre l’ordre du millimètre. Le cathéter visible lui en temps réel peut maintenant cheminer dans la silhouette scanner et l’ablation par radiofréquence peut alors être effectuée sous cette seule guidance. Ainsi le temps de scopie sera inférieur à celui de la manipulation sous contrôle radiologique des cathéters et la délivrance de radiofré- quence sera optimisée [11].
LA NAVIGATION MAGNÉTIQUE COUPLÉE À LA FUSION D’IMAGES : LA ROBOTIQUE CARDIAQUE
La complexité des systèmes informatiques de la navigation magnétique et la tendance inhérente à l’automatisation de ce type de système rendait logique son intégration à un système de cartographie informatisé des cavités cardiaques [12]. Le système Carto RMT (pour ReMoTe) réunit les deux approches [13].
Fig. 5. — Navigation magnétique dans l’image après fusion : Dans cet exemple après reconstitution de l’anatomie de l’oreillette gauche les vecteurs sont programmés pour orienter le champ magnétique directement dans l’image scanner. La procédure de navigation magnétique peut maintenant se dérouler dans la silhouette scanner.
Le niveau de sophistication est maintenant tel que de très nombreuses interventions peuvent être automatiquement préprogrammées puis effectuée de façon entièrement automatique. Ainsi une acquisition entière du volume de l’oreillette gauche utilisant le programme « Automap » peut ainsi être obtenue en quelques minutes. Dans notre expérience celle-ci est cependant insuffisante et nécessite un correction par l’acquisition de points supplémentaires. Une ligne d’ablation encerclant les veines pulmonaires peut aussi être pré-dessinée pour être automatiquement réalisée.
La centralisation du poste de commande de taches multiples mais maintenant automatisées rend maintenant courante la réalisation de procédures complexes par un seul opérateur. Le contrôle à distance permet de rendre les procédures beaucoup moins pénibles car le port du tablier de plomb par l’opérateur n’est plus nécessaire.
L’irradiation du médecin est limitée au temps d’insertion initial des sondes ce qui n’excède que rarement trois minutes de scopie.
Dans la première génération du Niobe, le volume des aimants limite les angulations de l’arceau du générateur de rayons X à environ 28° de chaque côté. La nouvelle génération d’aimants, plus mobile devrait encore atténuer cette limitation.
Il n’existe à l’heure actuelle que très peu d’études publiées portant sur de large séries de malades utilisant la robotique moderne. De petites séries portant sur diverses tachycardies ont permis de valider son concept et prouver son efficacité [6-11]. Un report de cas a permis de montrer la résolution d’un cas difficile de stimulation cardiaque par cette technique, ce qui s’était avéré impossible en manipulation manuelle [14]. Les études concernant la fibrillation auriculaire ne permettent guère de tirer des conclusions dans la mesure ou elles ne sont pas randomisées, leurs résultats sont contradictoires, et elles n’utilisent pas de cathéters irrigués qui ne sont pas encore disponibles mais ont, en manipulation manuelle, largement montré leur supériorité [15].
Limitations de la robotique dans le diagnostic et le traitement des troubles du rythme
La véritable limitation de ce système est encore son prix qui reste élevé et probablement peu accessible aux centres ne pratiquant pas un grand volume de procédures.
Pour ce qui est strictement du domaine de l’ablation des troubles du rythme, l’apparition de nouvelles sources d’énergie telle la cryoablation par cathéter peut entrer en concurrence avec la robotique. Celle-ci en effet offre à moindre coût l’avantage d’une excellente stabilité du contact tissulaire et la possibilité de tester l’efficacité et la sécurité de l’ablation par des tirs « tests » préalables (dont la lésion est réversible). Néanmoins en l’état actuel des choses son efficacité semble encore légèrement inférieure à celle de la radiofréquence [16]. Il est cependant probable que si une évolution technique efficace et rapide de la cryoablation telle que l’utilisation de gros ballons occlusifs prouvait être comparable à la radiofréquence, celle ci ne permettrait que l’ablation des cas simples comme la fibrillation paroxystique. Les cas plus complexes tels les formes persistantes ou certains flutters gauches post ablation de la fibrillation devrait pleinement bénéficier de la robotique. Enfin un autre système a récemment vu le jour qui, s’il permet efficacement la navigation a distance, ne remplit pas de taches autonome et programmable et ne répond qu’incomplètement de ce fait à la définition d’un robot [17].
CONCLUSION
Comme dans de nombreux domaines de la médecine, l’évolution des techniques a permis d’envisager la prise en charge de pathologies de plus en plus complexes. Il est probable que la gestion des ablations complexes continuera de faire appel à des systèmes dont l’informatisation sera de plus en plus sophistiquée [18]. L’intégration de la navigation dans les cartographies informatisée en un seul site de contrôle existe maintenant et il n’est pas impossible d’envisager que divers types de cathéters pouvant délivrer diverses sources d’énergies autres que la radiofréquence (cryoablation ou ultrasons) y soient prochainement associés. Dans le laboratoire d’un futur probablement proche, la navigation robotique sera une des options disponibles qui seule pourra faire face à des situations complexes et astreignantes pour le médecin.
BIBLIOGRAPHIE [1] Puech P., Latour H., Grolleau R. — Le flutter et ses limites.
Arch. Mal Cœur , 1970, 63 , 116-144.
[2] Obadia J.F. — Le traitement chirurgical des troubles du rythme. In Cardiologie et Maladies
Vasculaires. Société Française de Cardiologie. Editions Masson, 2007, 1117-1120.
[3] Haissaguerre M., Jaïs P., Shah D. et al . — Spontaneous Initiation of Atrial Fibrillation by
Ectopic Beats Originating in the Pulmonary Veins.
N. Engl. J. Med .,1998, 339 , 659.
[4] Sacher F., Jaïs P., Hocini M., et al. — Ablation endocavitaire des fibrillations atriales paroxystiques. Intérêt de l’isthme gauche.
Arch. Mal Cœur , 2004, 97 , 949-56.
[5] Capek K & J., Nigel Playfair P., Selver. R.U.R. — and The Insect Play. Oxford Paperbacks, 1921.
[6] Michael Michelin — La robotique médicale : http://www.lirmm.fr/doctiss04/art/S08.pdf.
[7] Ernst S., Ouyang F., Linder C. et al . — Initial Experience With Remote Catheter Ablation
Using a Novel Magnetic Navigation System ; Magnetic Remote Catheter Ablation.
Circulation , 2004, 109 , 1472-5.
[8] Kerzner R., Sanchez J.M., Osborn J.L. et al. — Radiofrequency ablation of atrioventricular nodal reentrant tachycardia using a novel magnetic guidance system compared with a conventional approach . Heart Rhythm , 2006 , 3(3), 261-7.
[9] Wongchaoren W., Tsao H.M., Wu M.H. et al . — Morphologic Characteristics of the Left
Atrial Appendage, Roof, and Septum : Implications for the Ablation of Atrial Fibrillation.
J.
Cardiovascular. Electrophysiol. , 2006, 17 (9), 951-956.
[10] Einstein A.J., Henzlova M.J., Rajagopalan S. — Estimated risk of cancer associated with radiation exposure from 64 slice computed tomography coronary arteriography. JAMA , 2007, 298 (3), 317-323.
[11] Pappone C., Santinelli V. — Non fluoroscopic mapping as a guide for atrial ablation : Current status and expectations for the future. Eur. Heart J ., 2007, 9 , 1136-1147.
[12] Saoudi N., Anselme F., Savoure A., Cribier A. — Les nouvelles techniques de cartographie invasive en électrophysiologie Arch. Mal Cœur , 2000, 93 (III) , 23-30.
[13] Saoudi N. — Remote magnetic Navigation combined with 3D electroanatomical Mapping and ablation system. European Cardiovascular Disease , 2007, 1 , 46.
[14] Saoudi N., Ricard P., Yaïci K. — Magnetic Navigation and voltage mapping guided implantation of a pacemaker in a previously unpaceable patient. Europace , 2007, 1 , 4-6.
[15] Di Biase L., Fahmi T.S., Patel D. et al . — Remote Magnetic Navigation. Human Experience in Pulmonary Vein Ablation.
J. Am. Coll. Cardiol ., 2007, 50 , 868-74.
[16] Moreira W., Manusama R., Timmermans C. et al . — Long term follow up after cryothermic ostial pulmonary vein isolation in paroxysmal atrial fibrillation.
J. Am. Coll. Cardiol ., 2008, 51 , 850-5.
[17] Kanagaratnam P., Koa-Wing M., Wallace D.T., Goldenberg A.S., Peters N.S., Davies D.W. — Experience of robotic catheter ablation in humans using a novel remotely steerable catheter sheath. J. Interventional Electrophysiol., 2008, 21 (1) , 19-26.
[18] Lindsay B. — Perspectives on the development of a magnetic navigation system for remote control of electrophysiology catheters. Europace , 2006, 4, 231-2.
* Cardiologie — Centre hospitalier Princesse Grâce — 98000 Principauté de Monaco. E-mail : nsaoudi@chpg.mc Tirés à part : Professeur Nadir Saoudi, même adresse Article reçu le 20 février 2008, accepté le 7 avril 2008
Bull. Acad. Natle Méd., 2008, 192, no 5, 1029-1041, séance du 13 mai 2008