Résumé
Les micro-organismes ne vivent que de façon éphémère sous une forme planctonique (cellules isolées ou en petits groupes). Pour survivre, surtout en milieu pauvre, ils adhèrent à une surface inerte ou vivante. Puis ils se multiplient, pour vivre dans une communauté protégée par une matrice extracellulaire, constituant un biofilm, qui les rend difficilement accessibles aux antimicrobiens. Les conséquences pour la Santé publique sont multiples. Les effets peuvent être bénéfiques : les biofilms de bactéries commensales protègent les organismes humains et animaux contre l’intrusion des bactéries pathogènes. Les biofilms de l’environnement peuvent avoir des effets délétères, en provoquant des épidémies par voie respiratoire, digestive, ou par l’intermédiaire de matériel médical implanté. La contamination par voie respiratoire provient du relargage dans l’atmosphère de fractions de biofilms formés dans des milieux chauds et humides (tours de refroidissement des systèmes de climatisation d’hôtels ou d’hôpitaux, eaux thermales chaudes, douches). Il en résulte des affections pulmonaires graves. La contamination par voie digestive, souvent méconnue, peut avoir pour origine la fabrication ou le conditionnement de denrées alimentaires. Le matériel médical implanté colonisé peut conduire à un état septique sévère. Le rôle des cathéters veineux centraux est étudié ici en relation avec le site de l’intervention chirurgicale. Les résultats de l’analyse in vivo indiquent que la contamination peut être exogène, mais aussi endogène. L’étude in vitro de biofilms montre que l’ablation du matériel étranger est la solution à privilégier. La prévention de ces accidents est difficile, car la formation des biofilms est multifactorielle. La connaissance des conditions physiques et biologiques de la prolifération des biofilms permet, dans une certaine mesure, de limiter leur installation et leur développement.
Summary
Micro-organisms do not always exist in planctonic forms (single cells or small groups). To survive, especially in limiting media, they may adhere to inert or living surfaces. This enables them to multiply within a community protected by an extracellular matrix, thus forming a biofilm which protects them from antimicrobials. Biofilms have many potential consequences for public health. Some are positive, such as the commensal biofilms that protect against pathogenic bacteria, while environmental biofilms may be a source of outbreaks of respiratory or gastrointestinal diseases or infections associated with implanted medical devices. Respiratory tract infection can be caused by aerosols of fragmented biofilms growing in warm humid conditions (air cooling towers, hot springs, showers, etc.). Digestive tract infection can arise from biofilms formed during food manufacturing or packaging processes. Colonized implanted medical devices can lead to sepsis. This article examines the role of central venous catheters, taking into account the surgical site. In vivo studies show that the source of catheter infection may be exogenous or endogenous, while in vitro studies of biofilms show that ablation of the device is the best solution. Prevention is difficult, as biofilm formation is multifactorial. Physical and biological knowledge of biofilms may help to limit their formation and growth.
INTRODUCTION
LES BIOFILMS
Les biofilms microbiens sont constitués d’une population de micro-organismes fixée sur un support inerte ou vivant. Ils sont reconnus comme particulièrement dangereux lorsqu’ils colonisent du matériel médical implanté. Mais leur incidence dans l’environnement public ou hospitalier n’est pas toujours suffisamment prise en compte, par méconnaissance du risque qu’ils représentent, comme en témoignent de nombreux accidents.
Depuis les travaux de Pasteur, cultivant les bactéries dans des milieux liquides, ou à la surface des mêmes milieux solidifiés par de la gélose, les microbiologistes, puis les hygiénistes, ont pris l’habitude de considérer la vie normale des bactéries sous forme de cellules planctoniques, c’est-à-dire évoluant librement dans un milieu liquide.
C’est une vision totalement erronée, car dans la nature, les bactéries, pour survivre en milieu pauvre (eaux des lacs, des rivières, de mer), ou dans les flux de milieux biologiques se fixent sur des supports pour former des biofilms.
Ils peuvent contenir une ou plusieurs espèces (bactéries, fungi, algues microscopiques) qui se protègent mutuellement d’éventuelles agressions extérieures par la sécrétion d’une matrice d’exopolymères, faite selon les espèces, de protéines ou de glycopolymères. Leur métabolisme ralenti et la matrice extracellulaire expliquent en partie leur sensibilité très réduite aux antibactériens. Le tableau 1 compare les modes de vie des populations de bactéries libres et de bactéries en biofilm.
Pour atteindre le support, les bactéries doivent d’abord dépasser les forces de répulsion entre les matériaux et leur propre surface, les plus avantagées étant celles qui possèdent des appendices tels que flagelles, fimbriae, antigènes d’adhésion.
Elles vont alors adhérer au support de façon irréversible. La fixation constitue pour les bactéries une agression, produisant un état de stress, réponse à tout événement physique ou chimique altérant brutalement leur environnement. Cet état se manifeste par la production rapide de toutes les protéines qu’elles sont capables de synthétiser (enzymes inductibles). Après avoir analysé leur nouvel environnement, les bactéries ne continueront à produire que les protéines de stress réellement utiles.
Puis elles vont se multiplier, le plus souvent lentement, et accueillir éventuellement d’autres micro-organismes, constituant une communauté de plus en plus dense [1].
Les micro-organismes fixés captent les nutriments en faible concentration d’un flux liquidien continu pour se multiplier. L’activité des cellules bactériennes ou fongiques immobilisées sur ou dans un gel est mise à profit pour la dépollution des eaux et des sols [2] ou encore pour la production de molécules à haute valeur ajoutée, notamment pour les molécules à carbone asymétrique. C’est le cas des acides aminés dont la synthèse chimique donne un produit racémique, alors que les microorganismes synthétisent directement la forme L [3]. Les acides aminés représentent un enjeu économique important, l’ajout de lysine et de tryptophane étant nécessaire à la nourriture animale d’origine végétale. L’acide L glutamique, agent de sapidité, est très utilisé dans l’industrie alimentaire, car il permet de diminuer la quantité de sel. Des médicaments sont aussi produits par ces techniques, comme la L DOPA, à partir de la tyrosine et les estroprogestatifs, à partir de divers stéroïdes.
Dans l’organisme des vertébrés, les biofilms de bactéries commensales des cavités naturelles protègent, en partie, contre l’invasion par des espèces pathogènes [4].
Cependant, selon leurs capacité d’adhésion, certaines souches pourront entrer en compétition avec les bactéries commensales et grâce à leurs agressines (toxines et autres substances), éventuellement les supplanter pour coloniser le tube digestif, les voies urinaires, les voies respiratoires, les méninges, l’émail dentaire, etc…
La plaque dentaire cariogène représente un modèle de biofilm en milieu ouvert dans lequel Streptococcus mutans présent en faible proportion parmi les nombreuses espèces constituant ce biofilm, est considéré comme le responsable majeur de la cariogenèse. Nous en avons étudié la formation, la prévention et la destruction [5].
LES BIOFILMS MICROBIENS SONT DANGEREUX POUR LA SANTÉ PUBLIQUE
Bactériens ou fongiques, les biofilms peuvent être à l’origine d’une contamination de nombreux individus par voie respiratoire, digestive ou par l’intermédiaire de maté- riel médical implanté.
Tableau 1. — Comparaison des propriétés des bactéries libres et en biofilm Bactéries incluses dans un biofilm Bactéries plantoniques (en suspension) Bios : vie (grec), film : couche (anglais)
Plankton : qui erre (grec)
Population fixée sur un support Cellules Inerte ou vivant libres milieu pauvre milieu riche une ou plusieurs espèces vivant isolées ou en petits groupes en communauté étroite dans une matrice extra-cellulaire peu de contacts entre elles, sauf si protéique ou polysaccharidique densité cellulaire importante en équilibre dynamique cycle de multiplication classique :
métabolisme ralenti phases : latence, multiplication exponentielle mais continu maximum stationnaire, déclin, repos.
peu sensibles aux antibactériens :
sensibles aux antibactériens, tant que antiseptiques, désinfectants, le métabolisme est actif, antibiotiques peu ou pas sensibles au repos.
Les contaminations par voie respiratoire à partir de biofilms développés sur des surfaces inertes sont assez fréquentes. Le plus souvent, elles font suite à des travaux sur les conduits de climatisation dont la chaleur et l’humidité permettent l’établissement de biofilms partiellement relargués dans l’atmosphère. Des épidémies d’infections pulmonaires graves se sont produites dans de nombreux hôpitaux, dues à des légionelles ( Legionella pneumophila ) ou à des Aspergillus [6, 7]. Pour la même raison, des hôtels récemment réaménagés pour recevoir des groupes importants ont été à l’origine d’épidémies, soit dans ces établissements (le congrès des légionnaires à Philadelphie en1976), soit dans les rues avoisinantes (Paris en 1998 à l’occasion de la coupe du monde de football [8]).
Les eaux thermales chaudes, les bains bouillonnants, peuvent aussi provoquer de tels accidents. Les pommes de douche sont également un lieu de colonisation par les biofilms : dans les services hospitaliers recevant des patients fragilisés, notamment par une immunodépression d’origine pathologique ou thérapeutique, elles sont le plus souvent protégées par des filtres HEPAR qui éliminent bactéries et fungi de toute taille.
Depuis peu, une enquête sur les moisissures présentes dans les logements, notamment en Ile-de-France où l’habitat ancien — voire vétuste — et surpeuplé est fréquent, a montré un impact possible sur la dégradation de la santé des occupants, à la suite de dégâts des eaux par exemple [9].
Les contaminations par voie digestive sont le plus souvent méconnues. Elles peuvent avoir diverses origines. Dans l’industrie agro-alimentaire ou pharmaceutique, les biofilms peuvent proliférer dans les récipients de stockage, les canalisations, les appareils de distribution, dont le nettoyage est difficile [10, 11]. En cas de contamination massive, le contrôle du produit fini empêchera sa libération. Mais une contamination de faible niveau peut passer inaperçue.
Le conditionnement lui même peut être la cause de la contamination du consommateur. Ainsi, dans les vitrines réfrigérées, les sachets de polyéthylène (PET) contenant des denrées alimentaires détaillées en portions (exemple jambon tranché) peuvent être des supports de biofilms de bactéries de l’environnement, comme divers Pseudomonas, Campylobacter, Listeria et autres espèces cryophiles. À l’ouverture du sachet, l’enroulement spontané du PET sur lui-même contamine les denrées. Les opercules en PET devraient être interdits [12].
Le matériel étranger peut être colonisé, qu’il soit implanté passagèrement (sonde, cathéter périphérique, fils de suture) ou plus longuement (cathéters veineux centraux (CVC), double J) ou définitivement (prothèses diverses). L’essaimage conduira à un état septique dont le seul remède est l’ablation du matériel contaminé. Un nouveau matériel ne pourra être implanté qu’après la guérison de cet état septique, habituellement quinze jours après l’apyrexie, plus longtemps dans le cas des prothèses.
Parmi les infections sur matériel étranger, nous nous sommes intéressés aux sondes urinaires, aux endoprothèses uretérales (doubles J) [13] et aux CVC [14].
CONTAMINATION DES CATHETERS VEINEUX CENTRAUX
MATÉRIEL ET MÉTHODES
Étude in vivo
Cathéters veineux centraux (CVC). Cette étude a porté sur 402 cathéters veineux centraux mis en place dans un service de chirurgie générale et digestive. Trois types de CVC ont été utilisés : DRUM CARTRIDGER, Venisystems, ABBOTT (polyuréthane) ; ANGIOGUIDER, Vialon ; LEADER-CATHR, Vygon (polyéthylène), implantés par voie sous-clavière, jugulaire interne, basilique, droites ou gauches.
Il a été établi un protocole d’hygiène très rigoureux de pose, d’entretien pour la plaie d’insertion et de la ligne, ainsi que pour les prélèvements et l’ablation.
Le matériel étudié a été un échantillon de la partie distale du cathéter maintenu en place pendant une période variable de 3 à 80 jours, en fonction des besoins thérapeutiques et éventuellement de la survenue d’une infection.
Dans chaque dossier ont été notés : la température du patient à l’ablation, l’état du site d’insertion, les résultats d’analyse bactériologique des échantillons de CVC et autres sites infectés éventuels. Dans quarante cas, une observation au Microscope électronique à balayage a pu être réalisée.
Étude in vitro
Pour mieux comprendre les risques encourus, nous avons exploré la vitalité des bactéries incluses dans un biofilm par des méthodes biochimiques et des méthodes microscopiques. Les essais ont été conduits sur des CVC neufs, et sur tuyau de TygonR, de 6,5 mm de diamètre.
Les biofilms ont été obtenus dans un Bioréacteur décrit dans l’annexe 1. Ils ont permis de disposer d’un grand nombre d’échantillons formés dans des conditions identiques (longueur disponible : environ 50 cm de tuyau). Les bactéries des biofilms ont été remises en suspension pour leur dénombrement dans un bain-marie à ultrasons : Ultrasonic Ney (Bioblocck).
Les images de Microscopie électronique à balayage (MEB) ont été obtenues sur un Jeol Jsm 255 à 15 KV, et la microscopie confocale a utilisé un appareil Biorad Mrc 600. Pour cette observation, les fluorochromes utilisés étaient le CDF et l’IP (Biorad).
Le CDF est un mélange de dérivés de diacétyl-fluorescéine apolaires : ils traversent la membrane intacte sans provoquer de lésion. Si la cellule possède une activité estérasique, l’hydrolyse libère la fluorescéine polaire, incapable de sortir de la cellule, qui manifeste alors une fluorescence verte.
L’IP, l’iodure de propidium ne pénètre pas à travers une membrane non lésée. S’il y a une lésion, la cellule fluoresce en rouge. Les mêmes fluorochromes ont servi à la cytométrie en flux, avec un Cytomètre Factar, Becton-Dicknison.
L’analyse biochimique a été conduite sur un biofilm natif et sur des biofilms décapés par 2, 4, 6, et 8 CE (Concentration Efficace). La concentration efficace (CE) est la concentration en antiseptique ou désinfectant bactéricide, c’est-à-dire capable de détruire au moins 105 cellules de quatre espèces bactériennes de référence en suspensions ajustées à 107 cellules/ml, dans un temps déterminé (norme CEN).
Nous avons mesuré l’activité des enzymes respiratoires et d’une enzyme inductible déshydrogénases (dosage du formazan formé à partir de l’iodure de nitotétrazolium INT), et de la β-galactosidase. L’ATP a été dosé par ATPmétrie, Les mesures des caractéristiques physiques des biomatériaux [15], calculs de l’énergie de surface et de l’hydrophobicité des bactéries sont données dans les annexes 2 et 3.
L’effet pro-inflammatoire des cathéters a été évalué par la capacité des cellules TPH1 de produire du TNF α en présence d’échantillons de CVC. La toxicité du TNFα produit a ensuite été évaluée sur la lignée cellulaire L929.
RÉSULTATS
Étude in vitro de la vitalité des bactéries en biofilm
La comparaison des activités enzymatiques des biofilms natifs et décapés par un désinfectant montre que le métabolisme des bactéries incluses dans un biofilm décroît depuis la surface vers le support, mais que chaque décapage libère l’activité des couches sous-jacentes. Ainsi, pour former 1 mg de formazan à partir de l’iodure de nitrotétrazolium (INT) il faut un nombre de bactéries, exprimé en log, égal à 4, 86 sur le biofilm initial, et après l’application de 8 CE, seulement 2,46 log. La récupé- ration de l’activité métabolique des couches profondes est très rapide : le biofilm se reconstitue en deux heures après l’application de 2 CE de désinfectant.
Les méthodes microscopiques : Une coupe de biofilm fixé, coloré, observée au microscope optique couplé avec un analyseur d’image , montre une forte densité des couches cellulaires proches du support, qui devient de plus en plus lâche vers la surface, avec des lacunes irrégulières [17].
L’utilisation de fluorochromes , CDF et IP appliquée à la Microscopie Confocale sur coupe de biofilm montre une très forte proportion de cellules rouges, donc avec lésions membranaires.Lesrarescellulesvertes,àmétabolismeactif,sontprochesdelasurface.
La Cytométrie en flux (CMF) permet de calculer la proportion de cellules marquées par le CDF, celle des cellules marquées par l’IP, et celles qui présentent un double marquage. L’abondance des cellules à double marquage signe les lésions membranaires de bactéries qui conservent une activité estérasique [18]. Les bactéries marquées par le CDF seul, capables d’activité estérasique mais sans lésions membranaires sont en très faibleproportion.
Les études biochimiques et microscopiques ont confirmé que les bactéries des couches profondes d’un biofilm sont des bactéries « au repos », c’est-à-dire à faible activité métabolique, et dont les membranes portent des lésions réversibles, puisque le biofilm peut se reconstituer après décapage des couches supérieures. Ce résultat est conforté par le fait que les bactéries d’un biofilm remises en suspension et ensemencées sur un milieu solide forment des colonies avec un certain retard par rapport aux bactéries planctoniques,retardcorrespondantautempsnécessaireàlaréparationdeslésions.
Ces résultats montrent que des cathéters contaminés que l’on prétendrait sans danger après l’application d’antibiotiques in situ conservent encore des bactéries capables de reprendre leur activité. C’est un argument de poids pour préférer l’ablation du matériel infecté à son traitement.
Étude des CVC in vivo
Les résultats ont révélé que les cathéters reconnus stériles provenaient d’interventions non ou peu septiques, alors que les CVC contaminés provenaient d’un acte en milieu septique. Le tableau 2 rassemble quelques exemples de résultats d’analyse bactériologique de cathéters, et éventuellement d’autres sites infectés, produits biologiques ou matériel médical. Il appelle quelques commentaires.
Lescathéterscolonisésassociésàdessyndromesinfectieux,corroborésparlaprésence des mêmes espèces bactériennes en d’autres sites de l’organisme, provenaient de patients soumis à une intervention en milieu septique. La nature de ces espèces était compatible avec la flore du site d’intervention, ce qui permettait d’en supposer l’origine.
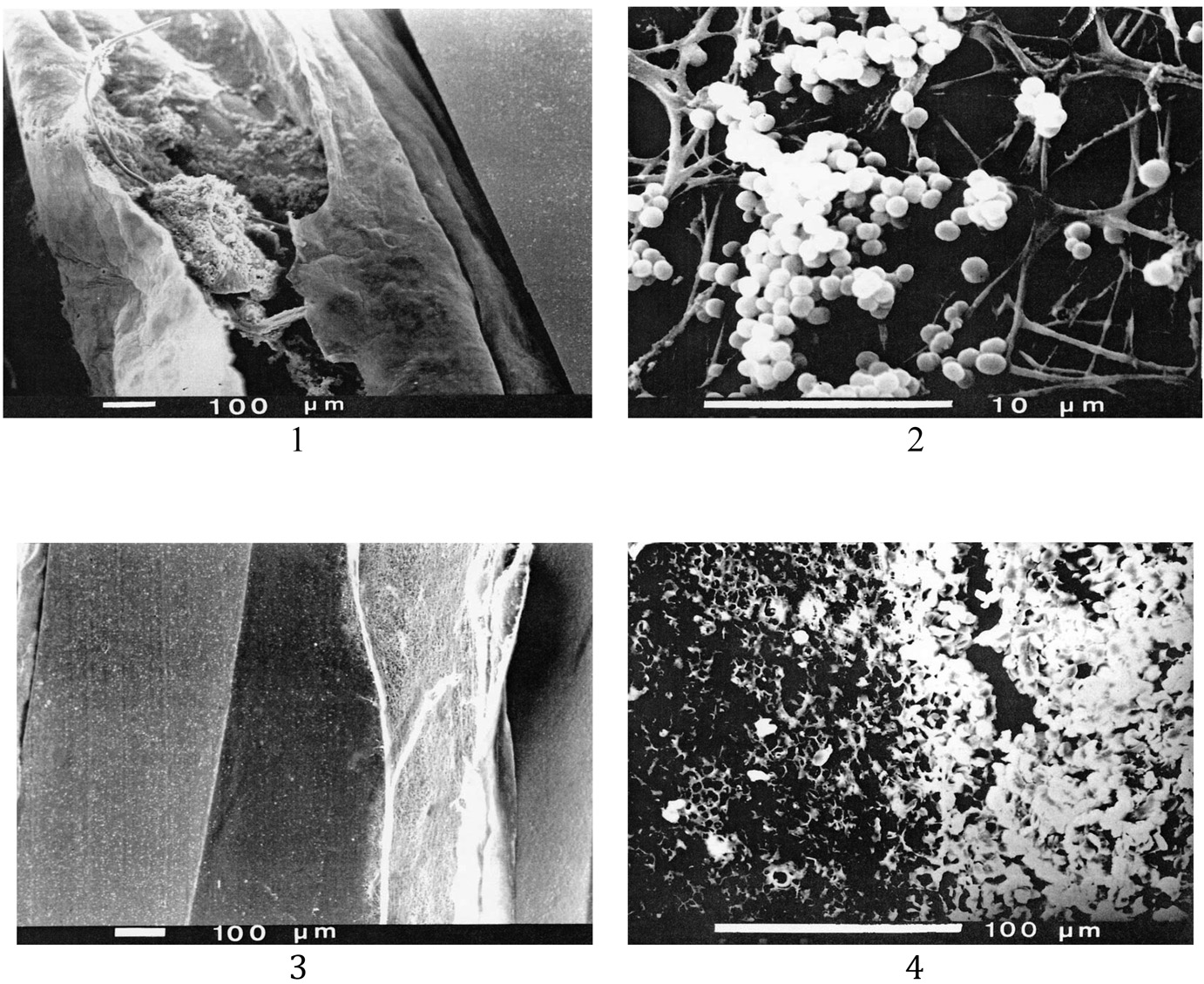
Fig. 1. — Observation au Microscope Électronique à Balayage (MEB) de CVC.
1. Angioguide 80j : Staphylocoque à coagulase négative sur thrombus.
2. Staphylocoque à coagulasse négative sur réseau de fibrine.
3. Biofilm de Staphylococcus aureus + Enterobacter cloacae. Le biofilm mixte présente l’aspect d’un cordon dense 4. Face externe de DRUMR : Klebsiella pneumoniae + Streptocoque α hémolytique, associés dans une matrice qui masque la morphologie des cellules bactériennes.
Les cathéters reconnus stériles à l’ablation provenaient en partie d’interventions en milieu non septique (adénome surrénalien, thyroïdectomie) mais aussi en partie de milieux septiques. Les conditions opératoires expliquent probablement ces différences.
Lorsque des espèces reconnues comme commensales de la peau ont été identifiées sur le cathéter et dans l’hémoculture, la contamination due à une faute d’asepsie est vraisemblable (staphylocoques à coagulase négative, corynébactéries).
L’incertitude persiste au sujet des cathéters reconnus contaminés au moment de l’ablation sans manifestation d’infection. Ils ont été retirés parce qu’ils n’étaient plus nécessaires, et c’est l’analyse systématique qui a révélé leur contamination. Auraientils conduit à un syndrome infectieux s’ils étaient restés en place plus longtemps ? Les défenses naturelles de ces patients ont vraisemblablement joué un rôle.
Tabeau 2. — Relations entre le site d’intervention et la colonisation des cathéters Cathéters stériles Cathéters colonisés Avec syndrome infectieux — Melaena et varices oesophagiennes origine endogène ?
Autres sites — Occlusion sur tumeur — Résection antérieure du rectum 9,4,14 BC — Drainage percut. Faux kyste ovarien — Néoplasie charnière rectosigmoïd 5 E — Hémicolectomie droite — Perfor. caecum sur tumeur rectum 4,11 D — Adénome surrénalien — Remise en circuit 5 F — Ulcère sus-cordal — Adénocarcinome de l’antre 3,8 G — Thyroïdectomie — Dilatat. des voies biliaires percut.
3,4 AC — Gastrectomie totale élargie — Cholécystite 4 A — Angiocholite 1,3,6 ponction Espèces bactériennes isolées sur les CVC — Remise en circuit 3,10 ACD — Reflux gastro-oesophagien 3,12 D — sigmoïdite 7 1. C.perfringens 8.Proteus spp 2. Corynebacteium spp 9.P. aeruginosa origine exogène ?
3. Enterococcus faecalis10. Serratia marcescens.
4. Enterobacter cloacae 11.Staphylococcus aur.
5. Escherichia coli 12.Staphylocoque coag_ – Angiome gastrique 12 A 6. Fusobacterium spp 13.Streptocoque αhém. — Remise en circuit 12 A 7. Klebsiella spp 14.Streptocoque βhém. — Péritonite post-opératoire 2, 12 A Sans syndrome infectieux Autres sites d’isolement – Résection colique 8,12 A. Hémoculture B. Liq. Péritonéal — Sténose du grêle 11 C. Saratoga D. ECBU E. Seringue — Cholécystite lithiasique 3 F. Ascite G. Plaie insertion H. bile — Pancréatite 11 — Syndrome occlusif 3 — Eventration 3,8 Ainsi paraît-il évident que le respect du protocole d’hygiène est une condition nécessaire mais non suffisante, et que la flore endogène du site d’intervention joue un rôle majeur , ce qui renforce l’idée de prévention par administration d’embols d’antibiotiques avant et/ou pendant l’intervention [19].
DISCUSSION
Autres facteurs de risque
Il existe d’autres facteurs de risque dans la contamination des CVC. Déjà signalés par REY en 1993 [20], ils ont fait l’objet d’études récentes.
La nature chimique du CVC influence son aptitude à fixer les bactéries. Elle conditionne l’hydrophobicité et l’énergie de surface du matériau : plus l’énergie de surface est élevée, plus grand est le risque d’adhésion. (Voir Annexe 1). Nos mesures ont montré une énergie de surface variant de 18,26 erg/cm2 pour le NutricathR, 39,26 pour le DrumR à 48,17 pour le LeadercathR, avec une aptitude croissante à la colonisation.
La détermination de l’hydrophobicité du matériau et des bactéries permet un classement des plus hydrophiles aux plus hydrophobes et devrait aider au choix du matériau du cathéter en fonction du type d’intervention. Les espèces bactériennes cutanées sont les plus hydrophobes (staphylocoques à coagulasse négative, coryné- bactéries). Elles adhèrent mieux sur matériau hydrophobe (téflon, silicone). Le protocole d’hygiène doit pouvoir éliminer ce risque de contamination. Les plus hydrophiles sont souvent des espèces pathogènes comme Pseudomonas, Serratia, Proteus, et des coccies comme Staphylococcus aureus , le plus souvent d’origine endogène [15]. Elles colonisent plus facilement les matériaux hydrophiles, tels le polyuréthane et le polyéthylène.
L’effet pro-inflammatoire du CVC est suggéré par la fréquence de l’inflammation du site d’insertion en cas d’infection. Nos essais ont montré des résultats voisins pour les CVC en silicone, polyuréthane, téflon et polyéthylène. Cet effet est sans doute un des facteurs de risque, mais d’importance mineure. Il correspond à la réaction de défense normale de la peau contre l’intrusion d’un corps étranger.
L’affinité des protéines plasmatiques pour le CVC influence davantage l’adhésion bactérienne. Par ordre décroissant, le fibrinogène, la fibronectine, le plasma total et la sérumalbumine créent une liaison forte entre bactéries et biomatériau [21].
L’âge du patient est un facteur de risque à prendre en considération pour le nouveau-né et le vieillard [22].
La Prévention des infections sur CVC est d’autant plus difficile qu’elles sont plurifactorielles.
La nécessité de prévention des infections sur CVC est essentielle pour la santé des patients en raison des risques encourus, mais également pour le coût engendré par une contamination. En effet, une infection sur CVC entraîne obligatoirement un traitement anti-infectieux, quelquefois un besoin de réanimation, ce qui conduit à une prolongation de la durée d’hospitalisation.
Les auteurs sont unanimes pour reconnaître l’importance de la formation du personnel à l’hygiène spécifique aux CVC [23] .
Le choix du CVC est difficile : une hydrophilie favorise une infection endogène, une hydrophobie facilite les contaminations manuportées. Dans tous les cas, il vaut mieux choisir un matériau fixant peu les protéines plasmatiques.
En l’absence de solution unique, il convient d’adopter des moyens palliatifs.
La mise en place d’un manchon ( en dacron, collagène, argent) évite le contact du CVC avec le tissu sous-cutané. Elle est pratiquement abandonnée.
La tunnellisation divise les utilisateurs : les uns sont favorables [24], les autres défavorables [25]. Si les mesures d’asepsie sont convenables, elle est inutile.
Les anticoagulants utilisés comme revêtement de CVC peuvent être utiles pour prévenir la thrombose. Le PET serait plus thrombogène que les autres biomaté- riaux. Il a été proposé d’utiliser une concentration efficace de citrate de sodium (supérieure ou égale à 0,5 %), une concentration subinhibitrice favorisant la croissance des souches de staphylocoques capables d’utiliser l’ion citrate comme seule source de carbone. Les différentes formes d’héparine seraient à proscrire car elles faciliteraient l’adhésion bactérienne [26].
Les CVC revêtus d’antiseptiques, comme la chlorhexidine et l’argent, sont appréciés par les uns [27], rejetés par les autres [28]. Certains soulignent le risque de résistance des bactéries [29].
Les CVC revêtus d’antibiotiques : sont crédités par certains auteurs d’une diminution de l’incidence des infections, et par conséquent d’un raccourcissement de la durée d’hospitalisation, diminuant le coût pour la santé publique et bénéficiant au patient [30] ; d’autres s’inquiètent du risque de résistance [31].
Un « verrou antibiotique », consiste à injecter par voie luminale, sous un très faible volume (ne dépassant pas celui du CVC), une forte concentration d’antibiotique (100 à 1000 fois la CMI, le plus souvent de vancomycine ou d’aminoside). La solution est laissée en place huit à dix heures par jour. Ce procédé est de plus en plus utilisé comme alternative à l’ablation du CVC, sauf si le contaminant est un Staphylococcus aureus, un Pseudomonas aeruginosa, un Candida albicans ou autre levure, ou encore une corynébactérie, et également en cas de choc septique ou de thrombophlébite suppurée. Dans ce cas, l’ablation suivie d’une antibiothérapie adaptée et prolongée quinze jours après l’apyrexie est la seule solution [32]. À la lumière des essais in vitro rapportés ci-dessus, il nous paraît difficile de souscrire à la proposition du « verrou antibiotique » : l’ablation devrait être la règle lors de toute infection sur CVC, quel que soit le micro-organisme en cause.
Les chambres d’implantation sont surtout utilisées en oncologie pédiatrique et adulte, notamment en hospitalisation à domicile, car leur manipulation est aisée.
Leur contamination est très rare, mais grave [33].
Les cathéters à lumières multiples sont unanimement déconseillés [34], car ils multiplient les risques par le nombre de voies.
L’état immunitaire du patient joue un rôle primordial, [35].
CONCLUSION
Selon nos observations, la meilleure prévention serait la surveillance attentive, par un personnel spécifiquement formé aux diverses manipulations aseptiques, associée à une durée d’implantation aussi courte que possible, bien que nous n’ayons pas objectivé de relation significative entre la durée d’implantation et la contamination des CVC dans la série étudiée.
De façon plus générale, la prévention des accidents provoqués par les biofilms concerne tous les niveaux de responsabilité : l’ingéniérie de fabrication, de conditionnement, de maintenance, les actes médicaux et les soins infirmiers, aussi bien dans le domaine des activités publiques que privées. La formation doit être adaptée à chaque type de responsabilité, relayée au niveau des hôpitaux par les CLINS, et dans le domaine public ou privé par les ingénieurs en hygiène et sécurité.
REMERCIEMENTS
L’auteur remercie le Professeur J.B. Flament du service de chirurgie générale et digestive du CHU de Reims pour son accueil et sa disponibilité, Véronique Vernet-Garnier (laboratoire de Bactériologie) et Odile Bajolet (CLIN) pour le partage amical de leurs compétences.
BIBLIOGRAPHIE [1] Charaklis W.G. — Biofilm development : a process analysis.
In Microbial adhésion and aggrégation. MARSCHAL K.C. Ed. Berlin, Springer Verlag, 1984, 137-157.
[2] Valo R.J., Häggblom M.M., Salkinoja-Salonen M.S. — Bioremediation of chlorophenol containing simulated ground water by immobilized bacteria. Water Research, 1990, 24, 2, 253-258.
[3] Amin G. — Continuous production of glutamic acid in a vertical rotative immobilized cell reactor of the bacterium Corynebaterium glutamicum. Bioresource Technology , 1994, 47, 2 , 113-119.
[4] Costerton J.W., Cheng K.J., Geesey G.G., Ladd T.I., Nickel J.G., Dagupta M., Marrie T.J. — Bacterial biofilms in nature and disease. Annu. Rev. Microbiol., 1987, 41, 435-464.
[5] Jacquelin L.F., Brisset L., Le Magrex-Debar E., Carquin J., Gellé M.P., Choisy C. — Prévention de la plaque dentaire cariogène. Étude des structures impliquées dans l’adhésion et la co-agrégation chez S treptococcus mutans et Streptococcus sobrinus. Path. Biol. , 1995, 43 , 371-377.
[6] Perraud M., Piens M.A., Nicoloyannis N., Girard P., Sepetjan M., Garin J.P. — Invasive nosocomial pulmonary aspergillosis : risk factors and hospital building works. Epidem. Inf. , 1987, 99 , 407-412.
[7] Boukari S., Michel-Nguyen A., Dumas H., Ranque S. — Champignons isolés d’hémocultures au CHU de Marseille. Med. Mal. Infect., 2010, 38, supp 2 , 153.
[8] Decludt B., Guillotin L., Van Gastel B., Dubrou S., Jarraud S., Perrocheau A., Caulier D., Peyrolle M., Capek I., Ledrans M., Étienne J. — Foyer épidémique de légionellose à Paris en Juin 1998. BEH, 1999, 21.
[9] Host S., Grange D., Chatignoux E., Sommen C., Moularat S., Dusséaux M., Bex-Capelle V. — Effets sanitaires des moisissures dans l’habitat. Enquête Esmha, pilote d’une enquête épidémiologique en Ile-de-France. Rapport de synthèse, septembre 2010. 12e congrès des Observatoires de Santé Régionaux (ORS), 9-10 nov. 2010, Lyon. Territoire et santé des populations.
[10] Carsenti-Etesse H., Keita-Perse O., Dellamonica P. — Nettoyage des matériels et adhésion bactérienne : quelle efficacité ? Presse Médicale, 1997, 26 no 37 , 1800-1805.
[11] Jullien C. — Caractère hygiénique des matériaux utilisés dans les agro-industries — Contribution des caractéristiques de surface des micro-organismes (spores de Bacillus ) et des maté- riaux.
Thèse de Doctorat de l’Université de Compiègne en Génie enzymatique, Bioconversion et Microbiologie , 2001.
[12] Le Magrex-Debar E., Lemoine J., Gellé M.P., Jacquelin L.F., Choisy C. — Evaluation of biohazards in dehydrated biofilms on foodstuff packaging. J. Food Microbiol. , 2000, 55 , 239- 243.
[13] Choisy C., Hérard A., Vernet-Garnier V., Le Magrex-Debar E., Jacquelin L.F. — Infections sur matériel étranger : colonisation des endoprothèses urétérales. Bull. Acad. Nat.
Med., 1998, 182 , 1709-1722.
[14] Gellé M.P., Jacquelin L.F., Le Magrex E., Carquin J., Burde A., Flament J.B., Porokhov B., Choisy C. — Central venous catheters associated infections : influence of surface properties of biomatérials and infectious bacteria. Medical Microbiology Letters , 1995, 5, supp 1, S 59.
[15] Bellon-Fontaine M.N., Rault J., Van Oss C.J. — A novel method to determine the électron donor/électron acceptor on Lewis acid-base properties of microbial cells. Colloïds and Surfaces B : Biointerfaces, 1996, 7 , 47-53.
[16] Le Magrex E., Brisset L., Jacquelin L.F., Carquin J., Bonnaveiro N., Choisy C. — Susceptibility to antibacterials and compared metabolism of suspended bacteria versus embedded bacteria in biofilms. Colloïds and Surfaces B, Biointerfaces, 1994, 2 , 89-95.
[17] Brisset L., Jacquelin L.F., Le Magrex E., Carquin J., Choisy C. — Quantification des biofilms bactériens in vitro . Intérêt et limites. Adhésion des micro-organismes aux surfaces.
Lavoisier Tec-Doc Ed, Paris . 1995, 220-235.
[18] Gellé M.P., Jacaquelin L.F., Choisy C. — Comparaison de la vitalité des bactéries libres et des bactéries en biofilm par Cytométrie en Flux. Annales Pharm. Françaises , 2003, 61, no 4 , 243-252.
[19] Porokhov B. — Problèmes bactériologiques liés au cathétérisme veineux central. Thèse pour l’obtention du diplôme d’État de Docteur en Pharmacie, Université de REIMS, 1990.
[20] Rey D. — Complications infectieuses liées aux cathéters veineux.
Path. Biol. , 1993, 41, no 5 , 500-508.
[21] Vaudaux P., Pittet D., Haeberli A., Lerch P.G., Morgenthaler J.J., Proctor R.A., Waldvogel F.A., Lew D.P. — Fibronectin is more active than fibrin in promoting Staphylococcus aureus adhérence to inserted intravascular catheters. J. Infect. Dis. , 1993, 167 , 635-641.
[22] Lemarié C., Savagner C., Leboucher B., Le Bouedec S., Six P., Branger B. — Central venous catheter-related bacteremia in neonatalogy. Med . Mal. Infect., 2006, 36, 4, 213-218.
[23] Leboucher B., Leblanc M., Berlie I., Savagner C., Lemarié C., Le Bouedec S. — Effectiveness of an information report on the prévention of nosocomial bloodstream infections in néonatal care unit. Archives de Pédiatrie , 2006, 13, no 5 , 436-441.
[24] Timsit J.F., Bruneel F., Cheval C. — Use of tunelled fémoral catheters to prevent catheterrelative infection. A randomised control trial. Ann. Intern. Med., 1999, 130, no 9, 729-735.
[25] Combe C., Pisoni R.L., Port F.K., Young E.W., Canaud B., Mapes D.L., Held P.J. — Dialysis outcomes and practice patterns study : Data on the use of central venous catheters in chronic hemodialysis. Nephrology , 2001, 22 , no 8, 379-384.
[26] Shanks R.M.Q., Sargent J.L., Martinez R.M., Graber M.L., O’Toole G.A. — Catheter lock solutions influence staphylococcal biofilm on abiotic surfaces. Nephrology Dialysis, Transplantation, 2006, 21, no 8, 2247-2255.
[27] Rupp M.E., Lisco S.J., Lipsett A., Perl T.M., Kitting K., Civetta J.M. et al. — Effect of a second-generation venous catheter impregnated with chlorhexidine and silver sulfadiazine on central catheter-related infections. Ann. Intern. Med. , 2005, 143 , 570-580.
[28] Odetola F.O., Dechert R.E., Vanderelzen K., Chenoweth C., Moler F.W. — Antimicrobial- I impregnated catheters for reducing nosocomial catheter-associated blood stream infections in the pediatric intensive care unit.
Clinical Intensive care, 2006, 17(1-2), 33-40.
[29] Tattawasart U., Maillard J.Y., Furr J.R., Russel A.D. — Development of resistance to chlorhexidine diacetate and cetylpyridinium chloride in Pseudomonas stutzeri and changes in antibiotic susceptibility.
J.Hosp. Infect. , 1999, 42(3), 219-229.
[30] Bougle C., Leroyer R. — Anti-infecive coated central venous catheters : technical aspects and clinical studies. J. Pharm. Clinique , 2003, 22 (3), 159-167.
[31] Longuet P. — Diagnosis and management of long-term central venous catheter-related infections. Med. Mal. Infect. , 2003, 33 (12) , 613-618.
[32] Tambe S.M., Sampath L., Modak S.M. — In vitro evaluation of the risk of developing bacterial resistance to antiseptics and antibiotics used in médical devices. J. Antimicrob. Chemotherap. , 2001, 47 (5), 589-598.
[33] Darlay A.L., Girard R., Réat C., Morandat L., Fabry J. — Sites implantables, suivi prospectif des complications infectieuses et non infectieuses. Hygiène, 2000, 8 (5) , 258-263.
[34] Gil R.T., Kruse J.A., Thill-Baharozian M.C., Carlson R.W. — Triple-vs single-lumen cebtral venous cathéters. A prospective study in a critically ill population. Arch. Intern. Med. , 1989, 149, 1139-1143.
[35] Abdelkefi A., Achour W., Torjman L., Ladeb S., Ben Othman T., Ben Hassen A., Hsari M., Benabdeladhim A. — Infectious complications related to non-tunneled central venous cathé- ters in immunocompromised patients : Prospective study about 210 cases. Ann. Fr. Anesth.
Réanim, 2003, 22 (9) , 773-777.
DISCUSSION
M. Claude-Henri CHOUARD
Vous venez de nous confirmer que les biofilms pathologiques se développent à la frontière floue qui sépare les milieux intérieurs et les milieux extérieurs de l’économie. C’est vrai pour ces cathéters qui font l’objet de votre remarquable présentation. C’est vrai également pour cette plaque dentaire, sur le développement de laquelle vous vous êtes aussi penchée il y a quelques années. Mais c’est particulièrement vrai pour toute une série d’infections chroniques des voies aérodigestives supérieures et des voies urinaires. Le Professeur Küss se plaisait à rappeler les nombreux points communs qu’ont toujours eu entre elles nos deux spécialités, l’urologie et l’oto-rhino-laryngologie, notamment parce qu’elles siègent l’une et l’autre sur ces frontières entre ces deux milieux. Nous observions que les balanites, les urétrites, les cystites, tout comme les rhinites, les amygdalites, la pyorrhée alvéolodentaire ou les gingivites, se soignent depuis des siècles par de l’acide trichloracétique (au un tiers ou au un dizième) ou par d’autres topiques (tel le nitrate d’argent), sans qu’on n’en ait jamais compris l’action jusqu’au début de ce siècle. Depuis dix ans, des chercheurs, comme vous, nous ont appris que ces médicaments du passé agissent en brûlant la coque de ces biofilms :
ils permettent ainsi aux défenses naturelles de reprendre localement leur rôle sur les microbes mis à nu par cette action jusque-là empirique. Ne pourrait-on, par une collabora- tion thérapeutique transversale multispécialisée, suggérer aux soignants qui s’émeuvent de la surinfection locale d’un cathéter, d’essayer, avant de se résoudre à l’enlever, l’usage local de l’un de ces topiques sur la collerette bourgeonnante qui marque, sur la peau rougie, la frontière entre ces milieux intérieurs et extérieurs ? J’ai été amené à le faire autrefois sur certaines prothèses auditives trans-cutanées.
Le site d’insertion des cathéters veineux centraux (CVC) doit faire l’objet d’une surveillance pluriquotidienne et de soins d’antisepsie renouvelés, afin d’éviter une contamination par la flore cutanée du patient et/ou du personnel soignant. C’est surtout (mais pas seulement) lorsqu’il se produit une telle contamination que la plaie montre une réaction inflammatoire avec signes d’infection. Une antisepsie bien conduite aurait dû l’éviter, mais une erreur de manipulation de la ligne, ou l’utilisation de pansements de mauvaise qualité sont toujours possibles. Néanmoins, la plupart des auteurs reconnaissent que l’analyse microbiologique de l’empreinte de cette plaie a peu de valeur pronostique pour l’infection sur CVC. En principe, seule une recherche négative pourrait infirmer l’infection. Mais la présence de micro-organismes ne signe pas l’infection. Par ailleurs, notre étude montre que l’origine des infections sur CVC en chirurgie septique est essentiellement endogène. Dans ce cas au moins, l’antisepsie que vous suggérez est certes nécessaire, voire indispensable, mais pas suffisante. Vous suggérez également la destruction du biofilm : c’est le meilleur moyen de l’éliminer en combinant l’action mécanique et un désinfectant (ex : industrie laitière) ou un antiseptique (ex : plaque dentaire). Mais on ne peut courir le risque de détacher des fragments de biofilm dans les CVC, ils pourraient se fixer puis proliférer dans un vaisseau, un organe…
ANNEXES TECHNIQUES
Annexe 1
Bioréacteur : il est constitué d’une boucle de Tygon (de longueur telle que v=60ml) dans laquelle le milieu circule à grande vitesse (150ml/mn) grâce à une pompe P1 (Masterflex) un milieu de culture suffisamment dilué pour empêcher la multiplication des bactéries dans le liquide. Cette boucle est reliée à une alimentation ajustée, grâce à une pompe P2, de telle sorte que le taux de dilution soit de 2,5 à 3 H-1.
L’effluent est recueilli dans un récipient contenant de l’eau de Javel. Le biofilm atteint son équilibre en cinq jours.
Annexe 2
Énergie de surface des CVC γ s (ergs/cm2)
Elle est calculée par l’équation de
Van Oss γ = γ sLW+ γ AB dans laquelle s γ
LW = forces de Van der Waals, γ AB , forces acido-basiques γAB = 2 (γ s — x γ s +)1/2
L’angle que fait la tangente à une goutte de liquide avec la surface est mesuré à l’aide d’un goniomètre (KRÜSS).
3 mesures sont faites : une avec un liquide apolaire (αbromonaphtalène ou di-iodométhane), sans forces acido-basiques, 2 avec 2 liquides polaires : l’eau et le formamide avec forces AB.
Les caractéristiques des liquides polaires et apolaires sont donnés dans des tables. Les trois mesures d’angle de la goutte permettent de calculer γ LW, γ + et γ +, donc γ .
s s s s Résultats : moyenne de dix essais sur les surfaces extérieures et intérieures, DRUMR= 36,26 ergs/cm2, LEADERCATHR = 48,17 ergs/cm2.
Annexe 3
Mesure de l’hydrophobicité des bactéries = Bacterial Adherence To Hydrocarbones (BATH).
Mesure de la DO d’une suspension bactérienne dans du KNO × 10 -3 Molaire 420 3 DO initiale = DOi. Ajouter 0,2ml d’hexane pour 2,4 ml de suspension bactéries.
Mesurer la nouvelle DO . L’hydrophobicité est DOi — DO / DOi 420
Bull. Acad. Natle Méd., 2011, 195, nos 4 et 5, 1105-1120, séance du 10 mai 2011