Résumé
Le cancer de la prostate se diagnostique à un stade localisé par le dépistage individuel (toucher rectal et dosage du taux de PSA à partir de cinquante ans). Ce diagnostic se fait à un stade asymptomatique. L’amélioration de la détection se fait grâce à la cartographie biopsique étendue et l’Imagerie par Résonance Magnétique (IRM) avec biopsies dirigées. Une meilleure connaissance de l’histoire naturelle du cancer et les progrès de l’IRM permettent de savoir avant le traitement, la situation, le volume, l’extension locale et le pronostic du cancer. Ces améliorations seront importantes dans les années à venir pour l’indication et les modalités de traitements du cancer notamment par traitement partiel ou focal dont l’objectif est l’ablation du cancer sans séquelles urinaires ou sexuelles. Ce traitement partiel ou focal est une alternative aux traitements actuels de surveillance active et de traitement radical.
Summary
Prostate cancer can be diagnosed by individual screening (digital examination and PSA assay at age > 50 y) when still localized and asymptomatic. The diagnosis is confirmed by staged biopsies and by magnetic resonance imaging (MRI) with targeted biopsies. A better knowledge of the natural history of prostate cancer, together with improvements in MRI, can help to predict the location, volume, local extension and prognosis prior to treatment. This is particularly important for focal or partial treatment, aimed at removing the cancer without creating functional urinary or sexual disorders.
Localisation du cancer au sein des zones histologiques de la prostate
La prostate comprend trois zones glandulaires principales : la zone périphérique (ZP) qui recouvre les faces latérales et postérieure de la prostate, la zone centrale
Fig. 1. — Anatomie zonale de la prostate.
(ZC) de forme conique s’étendant de la base au veru-montanum traversée par les canaux éjaculateurs et enfin la zone de transition (ZT) comprenant deux lobes situés dans la partie antérieure de la prostate de part et d’autre de l’urètre proximal. La ZT est en contact en avant avec le stroma fibro-musculaire antérieur (SFMA) et est séparée de la ZP par une bande stromale appelée frontière de la ZT (fig. 1). La ZT est le siège de l’hypertrophie bénigne de la prostate (HBP) [1].
Les cancers originaires de la ZT représentent 40 % des séries autopsiques et 25 à 30 % des cancers dans les séries de prostatectomie totale[2]. Ils sont habituellement considérés comme de meilleur pronostic à volume et grade égal que le cancer de la ZP [3]. Ces cancers sont peu accessibles au toucher rectal. Leur développement au sein des zones prostatiques glandulaires et du stroma fibro-musculaire (SFM) dépend à la fois des frontières entre ces zones et de la croissance de l’HBP [4].
Volume tumoral, différentiation et pronostic
Le cancer de la prostate nait à l’extrémité des acinis glandulaires des canaux des ZP et ZT, à partir des lésions précancéreuses (Prostatic Intraepitheleil Neoplasia). Les cancers se développent ensuite au sein du stroma fibro-musculaire en suivant les plans de faible résistance. C’est pourquoi ils ont tendance à se conformer aux zones où ils sont nés, étant arrêtés par la capsule ou les frontières fibro-musculaires entre les zones [5]. Leur indifférenciation augmente avec le volume tumoral. Les cancers bien différenciés sont de grade 3 de Gleason. L’indifférenciation concerne le passage aux grades 4 et 5 [3]. Les groupes à risque de D’AMICO sont très utilisés pour estimer le pronostic [6]. On distingue trois groupes :
— groupe à faible risque : PSA < à 10 ng/ml, score de Gleason 6 et stade clinique T1c ou T2a.
— groupe à risque intermédiaire : PSA entre 11 et 20 ng/ml, ou score de Gleason = 7 ou stade clinique T2b.
— groupe à risque élevé : PSA > 20 ng/ml ou score de Gleason de 8 à 10 ou stade clinique T2c.
Ces groupes à risque ont été validés pour estimer le risque de progression après prostatectomie totale, radiothérapie externe et curiethérapie. Ils sont prédictifs du temps de doublement TD du PSA et donc du risque de récidive biologique. Le TD PSA est lui-même corrélé au risque de décès par cancer de la prostate.
Actuellement le % de grade 4 ou 5 est l’élément pronostic le plus important pour prédire le risque métastatique et donc de décès. En fait le volume de la partie indifférenciée est déterminant [7] (3,2cc de grade 4 ou 5) et est associé à un risque de 60 % de métastases ganglionnaires. Un cancer est visible en imagerie à partir de 0,2cc (7mm de diamètre). Il est admis qu’à partir de 0,5cc, (10 mm de diamètre) il est de volume significatif, c’est-à-dire qu’il peut être responsable de morbidité et de mortalité et dans les dix à quinze ans.
Diagnostic par biopsies
Actuellement, les cancers sont diagnostiqués indépendamment de leur volume, devant une élévation de PSA à 4ng/ml, parfois en s’aidant de biopsies de saturation (plus de vingt biopsies systématisées) [8]. Un des défis actuels est de pouvoir ne pas diagnostiquer les cancers non significatifs (< 0,2 cc) pour ne pas avoir à les traiter, de ne diagnostiquer que les cancers significatifs (à partir de 0,2 ou 0,5cc), de les localiser et de ne traiter si possible que le foyer tumoral.
Ce défi est en passe d’être relevé par l’imagerie par IRM dynamique, qui potentiellement peut détecter une lésion, permettre de diriger les biopsies, de guider le traitement et de surveiller.
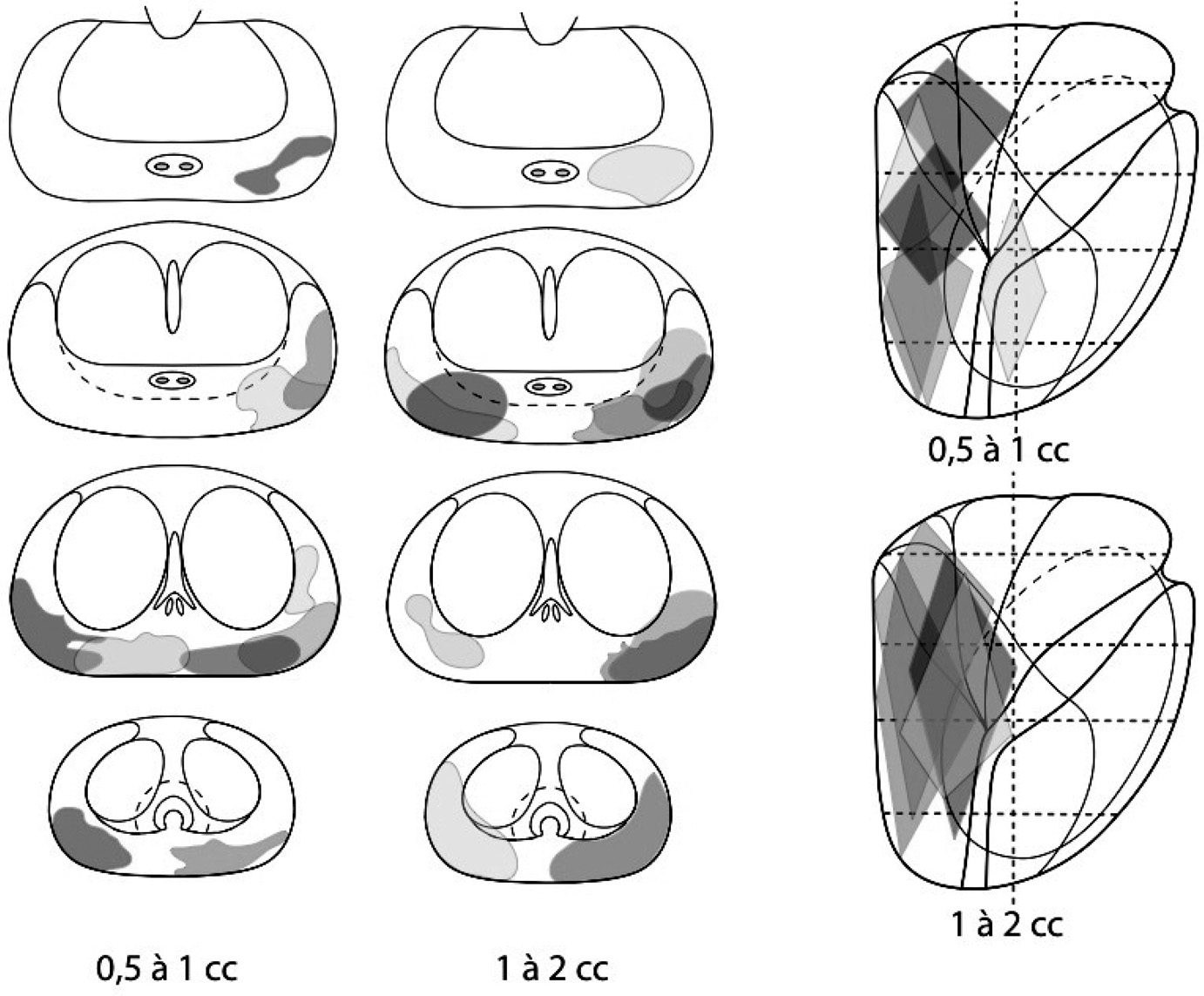
Fig. 2. — Répartition de 21 cancers antérieurs de 0,5 à 2cc, originaires de la zone périphérique. Le contour de chaque cancer correspond à celui de leur plus grande surface et est situé sur l’une des coupes transverses étagées de la base (en haut) à l’apex (en bas). 10/21 sont représentés sur les coupes sagittales. La surface correspond à leurs grands axes antéro-postérieur et vertical Développement des cancers dans la prostate
Ils ont tendance à rester dans la zone où ils sont nés jusqu’à un volume de 2 à 4cc [4].
Leur développement est observé grâce à l’IRM dynamique, et à l’étude des pièces opératoires de prostatectomie totale. Les corrélations entre l’imagerie, les biopsies et l’anatomo-pathologie démontrent le potentiel de l’IRM dynamique. Leur développement se fait soit au sein de la ZP, de la ZT, soit dans le SFMA se conformant aux contours de ces zones [9].
Les cancers postérieurs de volume < 2cc sont situés en majorité dans la partie postérieure et la moitié inférieure de la ZP. Ils sont surtout postéro-latéraux (fig 2).
Ces cancers sont visibles en imagerie échographique et parfois palpables s’ils sont de densité et de volume suffisant. Ils sont prélevés par les biopsies systématisées postérieures (fig 3). Cependant 20 % d’entre eux sont situés dans la corne antérolatérale de la ZP, non palpables et non visibles en imagerie échographique. Ils sont par contre détectés en IRM.
Fig. 3. — Représentation schématique 3D de cancers postérieurs de la zone périphérique à des localisations et des volumes variables, permettant d’illustrer le type de détection par biopsie systématisée (aiguilles) ou dirigée sur une anomalie à l’IRM dynamique Les cancers antérieurs de volume < 2cc sont situés soit dans la ZT en majorité dans le tiers antérieur et la moitié inférieure, soit dans le SFMA (fig 4). Leurs contours et leurs sièges sont prédictibles et peuvent être classés en 3 types, soit ZT, soit SFMA soit ZT et SFMA (fig 5) (Lemaitre Eur Radiol 2008 sous presse). Il n’y a pas à ce jour d’explication connue à la présence d’adénocarcinome dans le SFMA. L’hypothèse sur l’exclusion secondaire de cancers originaires de la ZT au cours du développement de l’HBP est supportée par les observations des cancers antérieurs à différents volumes et donc de stades de développement (Bouyé The Prostate 2008 sous presse).
L’intérêt de la connaissance du lieu d’origine et du mode d’extension des cancers antérieurs est diagnostique. Ces cancers sont sous-estimés par les schémas de dix à douze biopsies postérieures standards [10]. L’imagerie par échographie est peu sensible alors que l’IRM dynamique permet leur identification et aide à guider les biopsies.
Modalités des biopsies prostatiques pour le diagnostic du cancer
Le protocole standard de douze prélèvements échoguidés est recommandé en l’absence d’anomalie au toucher rectal (stade clinique T1) [11]. Pour chaque lobe, trois prélèvements périphériques (un à l’apex, un dans la zone médiane et un à la base) et trois prélèvements paramédians (un à l’apex, un dans la zone médiane et un à la base) sont réalisés. En cas d’anomalie au toucher rectal (stades cliniques T2 et
Fig. 4. — Répartition de 16 cancers antérieurs de 0,5 à 2cc, originaires de la zone de transition. Le contour de chaque cancer correspond à celui de leur plus grande surface et est situé sur lune des coupes transverses étagées de la base (en haut) à l’apex (en bas). 6/16 sont représentés sur les coupes sagittales. La surface correspond à leurs grands axes antéro-postérieur et vertical T3) ou de lésion suspecte à l’imagerie, un prélèvement supplémentaire est recommandé dans la zone suspecte.
Les protocoles extensifs (vingt prélèvements de la partie postérieure de la glande ou biopsies dites de saturation), en particulier pour les prostates de volume supérieur à 50 cc, augmentent la détection des cancers, mais ne sont pas recommandés en pratique courante car leur bénéfice reste à clarifier. En effet ils améliorent dans une étude le taux de détection de 40 à 52 % [8]. Cependant ils sont probablement associés à une détection de cancers non significatifs, prélevés au hasard de la biopsie systématisée mais ces résultats non pas été évalués.
Les biopsies dirigées sur une anomalie à l’IRM
Pour certains auteurs, l’IRM endo-rectale permet de détecter et de localiser les foyers de cancer dans la glande prostatique [12].
Fig. 5. — Représentation schématique 3D de cancers antérieurs de la zone de transition et du stroma antérieur à des localisations et des volumes variables, permettant d’illustrer le type de détection par biopsie systématisée (aiguilles) ou dirigée sur une anomalie à l’IRM dynamique L’imagerie par résonance magnétique
Il existe différentes techniques d’IRM, incluant l’IRM dynamique et la spectroscopie[13]. L’imagerie de perfusion ou IRM de contraste après injection IV de Gadolinium détecte les foyers tumoraux de plus de 0,2 cc. La spectroscopie détecte les tumeurs de plus de 0,5 cc. avec une sensibilité de 75 % [14]. L’IRM pondérée en diffusion localise le cancer avec une sensibilité de 87 % et une spécificité de 72 % [12].
La sensibilité et la valeur prédictive négative de l’IRM est de 95 % pour les cancers > 0,33 cc [9] (fig 6).
Des études sont en cours pour déterminer la faisabilité des biopsies prostatiques guidées par IRM avec recalage d’image. Cette technique de biopsies prostatiques n’est pas utilisée en routine. Elle est en cours d’investigation dans plusieurs centres en France. L’imagerie fournit aussi des informations utiles pour établir de la façon la plus fiable possible le stade de la tumeur (extension locale, ganglionnaire et métastatique) et orienter la décision thérapeutique.
CONCLUSION
L’IRM est appelée à s’imposer comme l’examen clé pour le diagnostic et la stadification intra, péri-prostatique et régionale. Ces améliorations seront déterminantes dans les années à venir pour l’indication et les modalités de traitements du cancer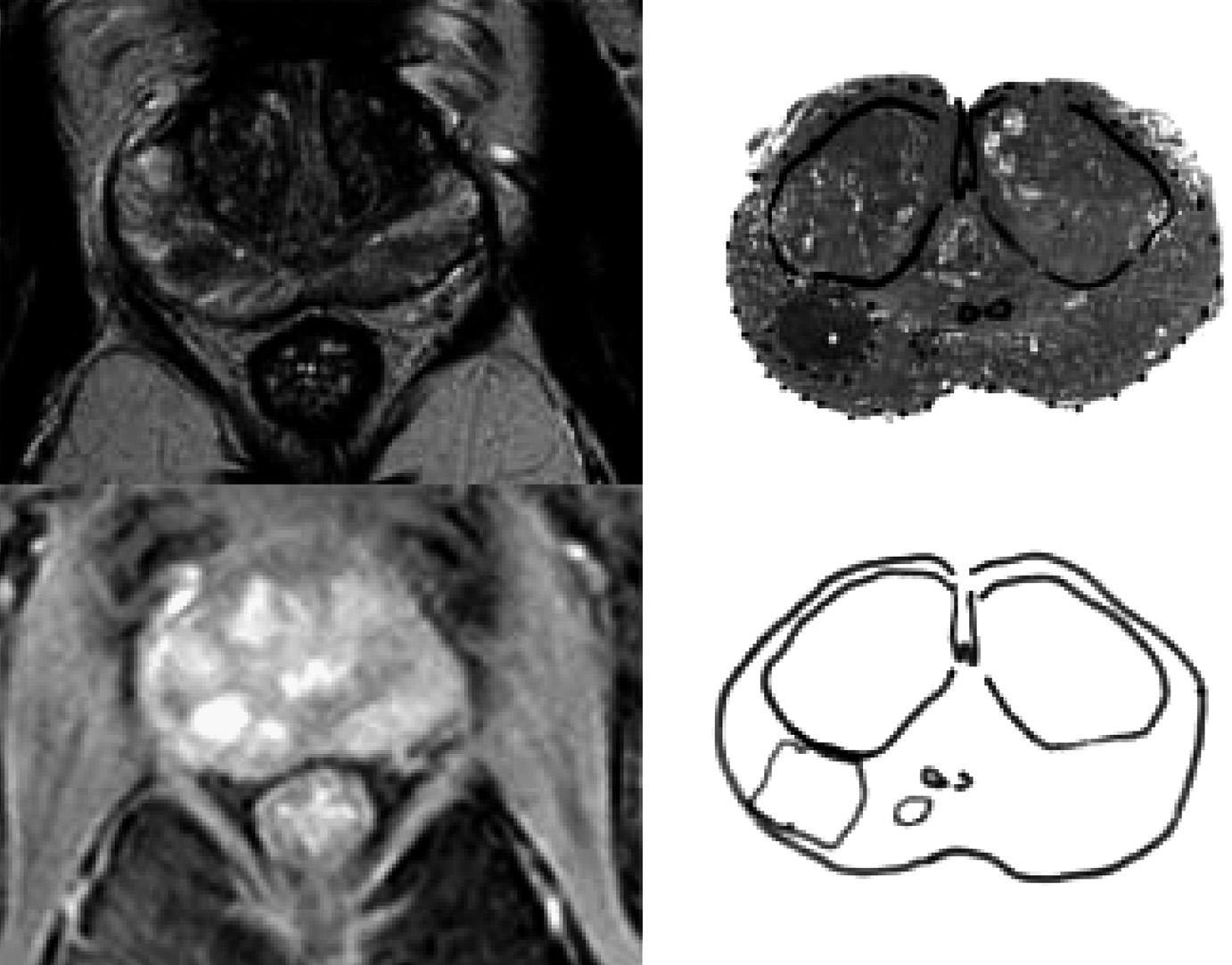
Fig. 6. — IRM T2 (en haut à gauche) et T1 avec injection (en bas à droite) et coupes histologique (en haut à droite) et cartographie (en bas à droite). Cancer de la zone périphérique gauche PSA=8ng/ml vol=1.35cc stade pT2 grade 4-5=80 % notamment par traitement partiel ou focal dont l’objectif est l’ablation du cancer sans séquelles urinaires ou sexuelles. Ce traitement partiel ou focal est une alternative aux traitements actuels de surveillance active et de traitement radical.
BIBLIOGRAPHIE [1] Villers A., Steg A., Boccon-Gibod L. — Anatomy of the prostate : review of the different models. Eur Urol., 1991, 20(4) , 261-8.
[2] Villers A., McNeal J.E., Freiha F.S., Stamey T.A. — Multiple cancers in the prostate.
Morphologic features of clinically recognized versus incidental tumors. Cancer . 1992 Nov 1, 70(9) , 2313-8.
[3] Stamey T.A., Sozen T.S., Yemoto C.M., McNeal J.E. — Classification of localized untreated prostate cancer based on 791 men treated only with radical prostatectomy : common ground for therapeutic trials and TNM subgroups. J. Urol., 1998 Jun, 159(6) , 2009-12.
[4] McNeal J.E., Haillot O. — Patterns of spread of adenocarcinoma in the prostate as related to cancer volume. Prostate . 2001 Sep 15, 49(1) , 48-57.
[5] McNeal J.E., Redwine E.A., Freiha F.S., Stamey T.A. — Zonal distribution of prostatic adenocarcinoma. Correlation with histologic pattern and direction of spread. Am. J. Surg.
Pathol ., 1988 Dec, 12(12) , 897-906.
[6] D’Amico A.V., Whittington R., Malkowicz S.B., Fondurulia J., Chen M.H., Kaplan I. et al . — Pretreatment nomogram for prostate-specific antigen recurrence after radical prostatectomy or external-beam radiation therapy for clinically localized prostate cancer.
J. Clin. Oncol ., 1999 Jan, 17(1) , 168-72.
[7] McNeal J.E., Villers A.A., Redwine E.A., Freiha F.S., Stamey T.A. — Histologic differentiation, cancer volume, and pelvic lymph node metastasis in adenocarcinoma of the prostate.
Cancer . 1990 Sep 15, 66(6) , 1225-33.
[8] Ravery V., Dominique S., Panhard X., Toublanc M., Boccon-Gibod L., Boccon-Gobod L.
— The 20-core prostate biopsy protocol-a new gold standard ? The Journal of urology . 2008
Feb, 179(2) , 504-7.
[9] Villers A., Puech P., Mouton D., Leroy X., Ballereau C., Lemaitre L. — Dynamic contrast enhanced, pelvic phased array magnetic resonance imaging of localized prostate cancer for predicting tumor volume : correlation with radical prostatectomy findings. The Journal of urology . 2006 Dec, 176(6 Pt 1) , 2432-7.
[10] Augustin H., Erbersdobler A., Graefen M., Jaekel T., Haese A., Huland H. et al . —
Differences in biopsy features between prostate cancers located in the transition and peripheral zone. BJU Int . 2003 Apr, 91(6) , 477-81.
[11] Villers A., Mouton D., Rebillard X., Chautard D., Ruffion A., Staerman F. et al . — [Biopsy technique and biopsy schemes for a first series of prostatic biopsies].
Prog. Urol., 2004
Apr, 14(2) , 144-53.
[12] Kirkham A.P., Emberton M., Allen C. — How Good is MRI at Detecting and Characterising Cancer within the Prostate ? European urology . 2006 Dec, 50(6) , 1163-75.
[13] Cornud F, Bellin MF, Portalez D. — [MRI and staging evaluation of prostate cancer].
J
Radiol ., 2006 Feb, 87(2 Pt 2) , 228-43.
[14] Cornud F., Rebillard X., Villers A., Peyromaure M., Soulie M. — [Place of contrast imaging in prostate cancer detection]. Prog. Urol., 2006 June, 16(3), 275-80.
DISCUSSION
M. Christian NEZELOF
Le diagnostic histopathologique du cancer est un diagnostic difficile, notamment la distinction, entre une atrophie prostatique et un foyer cancéreux, peut être ardu voire impossible.
La rentabilité des biopsies varie selon les opérateurs. Certains sont performants, d’autres non. Le postulat reliant le taux du PSA au volume du cancer de la prostate est-il toujours vrai ?
Pour des valeurs de PSA < 4 ng/ml, le volume tumoral n’est pas corrélé à la valeur du PSA. Pour des valeurs de PSA > 4 ng/ml, les conclusions des études sont encore divergentes. En pratique, plus la prostate est de faible volume (< 30cc) et plus le PSA est élevé, plus celui-ci est corrélé au volume tumoral.
M. Pierre GODEAU
Le fait d’avoir utilisé des pièces anatomiques de prostatectomie totale pour cancer de la vessie n’est-il pas un biais de sélection ?
Cela est exact. Ce biais n’est pas connu. L’âge moyen des patients opérés de cancer de vessie était de 74,5 ans. Les facteurs de risque du cancer de prostate autre que l’âge n’étant pas connus dans cette série, on ne peut éliminer le fait qu’il y ait un lien entre cancer de vessie et risque plus élevé ou plus faible de cancer de prostate.
M. Jacques ROUËSSÉ
Quelle est la morbidité des biopsies pratiquées pour le diagnostic initial ?
Elle augmente avec le nombre de biopsies. Pour une série de douze biopsies par voie transrectale, les risques de complications graves sont de 2 %, soit par infection urinaire potentiellement grave soit par hémorragie rectale persistante. En cas de gestion inadé- quate, le risque de mortalité n’est pas nul.
Bull. Acad. Natle Méd., 2008, 192, no 5, 1003-1012, séance du 27 mai 2008