Résumé
L’élaboration d’un traitement de fond de l’arthrose est un enjeu majeur de santé publique. L’imagerie joue un rôle essentiel dans l’évaluation expérimentale et clinique de ces traitements. Les radiographies restent, en pratique, incontournables par leur simplicité d’emploi. Cependant, l’imagerie par résonance magnétique nucléaire (IRM) a révolutionné l’imagerie du cartilage dont elle donne une vision directe sans utiliser les rayons X. En recherche, on peut tirer de l’IRM une information quantifiée non seulement sur la morphologie et la volumétrie du cartilage mais aussi sur sa composition. Différentes séquences IRM reflètent son contenu en eau, l’organisation du réseau de fibrilles de collagène et l’état des protéoglycanes qui le composent. L’arthroscanner (arthrographie par injection d’un produit de contraste dans l’articulation suivie d’un examen tomodensitométrique à rayons X) et l’arthro-IRM (arthrographie suivie d’une IRM) donnent une vue en coupes fines et en trois dimensions du cartilage.
Summary
Development of drugs able to modify the natural course of osteoarthritis is a major research objective. Imaging methods are needed to evaluate the effect of new medications in the experimental and clinical settings. Conventional radiographs are the gold-standard technique for routine imaging. However, magnetic resonance imaging (MRI) has transformed hyaline cartilage imaging by providing direct visualization without exposure to radiation. In addition, MRI can provide direct cartilage volumetry and tissue characterization for research purposes, using specific sequences. MRI can also give information on the content and organization of the collagen fibril network and proteoglycan chains, as well as water content. Computed tomography, arthrography and MR-arthrography require contrast medium injection into the joint space but provide high-resolution 3D images of the hyaline and fibrous cartilage.
INTRODUCTION
L’élaboration d’un traitement de fond de l’arthrose est un enjeu majeur de santé publique. L’imagerie joue un rôle essentiel dans l’évaluation de ces traitements. Les radiographies simples ne donnent qu’une image indirecte de l’épaisseur du cartilage articulaire mais montrent l’ensemble de l’articulation, en particulier l’os souschondral. Elles restent en pratique incontournables de part leur simplicité d’emploi.
C’est le seul examen qui montre les articulations du membre inférieur en charge.
L’Imagerie par Résonance Magnétique nucléaire (IRM) a révolutionné l’imagerie du cartilage dont elle donne une vision directe sans utiliser les rayons X et sans nécessiter d’injection d’un produit de contraste. Les progrès techniques font qu’elle fournit une vision de plus en plus précise du cartilage. L’arthroscanner (arthrographie par injection d’un produit de contraste dans l’articulation suivie d’un examen tomodensitométrique à rayons X) et l’arthro-IRM (arthrographie suivie d’une IRM) donnent une vue en coupes fines et en trois dimensions du cartilage dont les contours sont soulignés par le produit de contraste injecté.
En routine, les radiographies suffisent. Quand elles sont normales ou ne permettent pas d’expliquer les symptômes, l’IRM et, si nécessaire, l’arthroscanner ou l’arthroIRM sont utilisés.
En recherche, on peut tirer de l’IRM non seulement une information sur la morphologie du cartilage mais aussi sur sa composition. Différentes séquences IRM reflètent son contenu en eau, l’organisation du réseau de fibrilles de collagène et l’état des protéoglycannes qui le composent.
RADIOGRAPHIES
Les radiographies sont le moyen d’exploration le plus simple pour suivre les patients. C’est la méthode de référence, seule reconnue actuellement par la FDA comme critère de jugement des essais cliniques de phase III sur l’arthrose. Cependant, elles posent un problème de standardisation qui est indispensable pour obtenir une reproduction suffisante dans les études longitudinales. L’épaisseur de l’interligne articulaire, qui reflète l’épaisseur du cartilage, varie en fait en fonction de la position de l’articulation et des conditions techniques de réalisation notamment l’angulation du faisceau de rayons X et la distance entre l’objet et le film. Ceci est particulièrement vrai au genou où la sphéricité des surfaces articulaires fémorales et tibiales autorise une multitude de projections antéro-postérieures tangentes aux différentes zones de l’interligne articulaire. En outre, l’épaisseur apparente de l’interligne articulaire dépend de celle des cartilages hyalins fémoraux et tibiaux mais aussi
de l’état et de la position du ménisque. En radiographie, seuls les amincissements diffus des cartilages articulaires retentissent sur la hauteur de l’interligne. Ceci explique la faible sensibilité aux changements de cette technique et le grand intérêt actuel pour l’IRM.
IMAGERIE PAR RESONANCE MAGNETIQUE NUCLEAIRE (IRM)
Aspect IRM du cartilage normal
Quand une acquisition en résonance magnétique nucléaire est faite alors que la surface du cartilage est perpendiculaire au champ magnétique principal (B0), le cartilage normal est caractérisé par la présence de trois couches de signal différents, avec de la superficie à la profondeur, une fine couche superficielle de bas signal, une épaisse couche transitionnelle de signal élevé et une couche profonde adjacente à l’os sous-chondral de bas signal (Figure 1). Ces trois couches reflètent la variation continue du signal T2 (temps de relaxation horizontal où les tissus hydratés présentent un signal élevé) du cartilage en fonction de la profondeur. D’autres paramètres comme le temps de relaxation T1 (temps de relaxation longitudinal), la diffusion et la densité des protons ont peu d’influence sur le signal du cartilage. Le temps de relaxation T2 du cartilage articulaire est très variable allant de 50 millisecondes pour la couche intermédiaire à 10 millisecondes et même beaucoup moins pour la couche profonde. Les séquences T2 à temps d’écho long (TE) font apparaître ces variations et ces différentes couches, tandis que les séquences à TE court en écho de gradient montrent un cartilage de signal uniforme. Bien que le cartilage ait un aspect macroscopique assez uniforme, il existe des variations microscopiques dans l’orientation des fibres collagènes, dans la concentration en eau, en chondrocytes et en protéoglycanes en fonction de la profondeur qui rendent compte de l’anisotropie du signal T2 du cartilage. D’ailleurs, l’aspect en couche varie avec l’orientation de la surface du cartilage par rapport à celle du champ magnétique principal (B0), preuve de l’influence de la microstructure du cartilage sur le signal IRM [1].
Dans les tissus hautement structurés comme le cartilage, la limitation de la mobilité de l’eau et sa conséquence, l’augmentation des intéractions entre les dipôles, raccourcit le T2. Dans ce type de tissu, le T2 dépend non seulement de la distance entre les noyaux mais aussi de l’orientation par rapport au champ principal B0. Quand le vecteur inter-nucléaire s’écarte du B0, le T2 s’allonge pour atteindre un effet maximal à un angle d’environ 54,7° avec le BO (phénomène de l’angle magique) [2].
Des études suggèrent fortement que l’orientation des fibrilles de collagène dans les différentes couches du cartilage rendent compte des variations de T2 et de signal dans le cartilage [1, 3]. Ainsi, les fibrilles sont parallèles à la surface dans la couche superficielle, perpendiculaires dans la couche profonde et courbes, formant des arcades, dans la couche intermédiaire [4] (Figure 2).
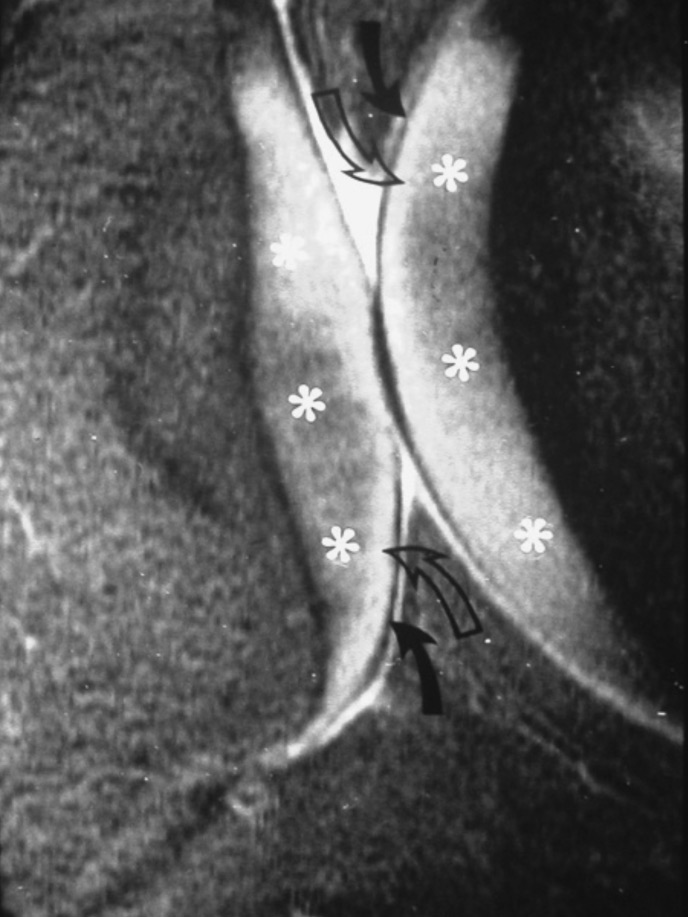
FIG. 1. — Aspect des cartilages du genou fémoral et rotulien sur une IRM à haut champ magné- tique : noter les 3 couches : superficielle, noire (flèche courbe noire), transitionnelle, blanche (flèche courbe creuse) et profonde (étoiles). L’effacement du signal (gris) de la couche profonde (rotule, étoile en haut et à gauche) est dû au phénomène de l’angle magique (voir texte).
Cependant, des inconnues persistent encore sur l’origine de ces variations du T2 dans le cartilage. Ainsi, l’influence estimée des fibres collagènes sur le contenu en eau est trop faible pour rendre compte à elle seule de l’influence de l’orientation des fibrilles collagènes sur le signal du cartilage [5]. Le phénomène de l’angle magique fournit une explication complémentaire aux variations en profondeur du T2 du cartilage. On a vu que les fibrilles collagènes sont orientées perpendiculairement à la surface dans la couche profonde puis s’incurvent et forment des arches dans la couche intermédiaire pour devenir horizontales dans la couche superficielle (Figure 2). Ainsi, le phénomène de l’angle magique, va progressivement croître de la profondeur où l’orientation des fibrilles est parallèle au champ principal à la couche intermédiaire. Le signal passe par un maximum quand l’orientation des fibrilles est inclinée à environ 55° par rapport à l’orientation du champ B0 pour décroître à nouveau en allant vers la surface où les fibrilles deviennent progressivement parallèles à la surface du cartilage et que l’angle qu’elle forme avec le B0 se rapproche de 90° [6]. En outre, l’image de la tranche du cartilage apparaît striée comme sur une coupe anatomique, montrant que l’IRM reflète l’architecture macroscopique du cartilage [7, 8]. L’étude du plateau tibial montre que les variations en T2 et en signal peuvent refléter des caractéristiques architecturales de la matrice propre à une articulation donnée [8].
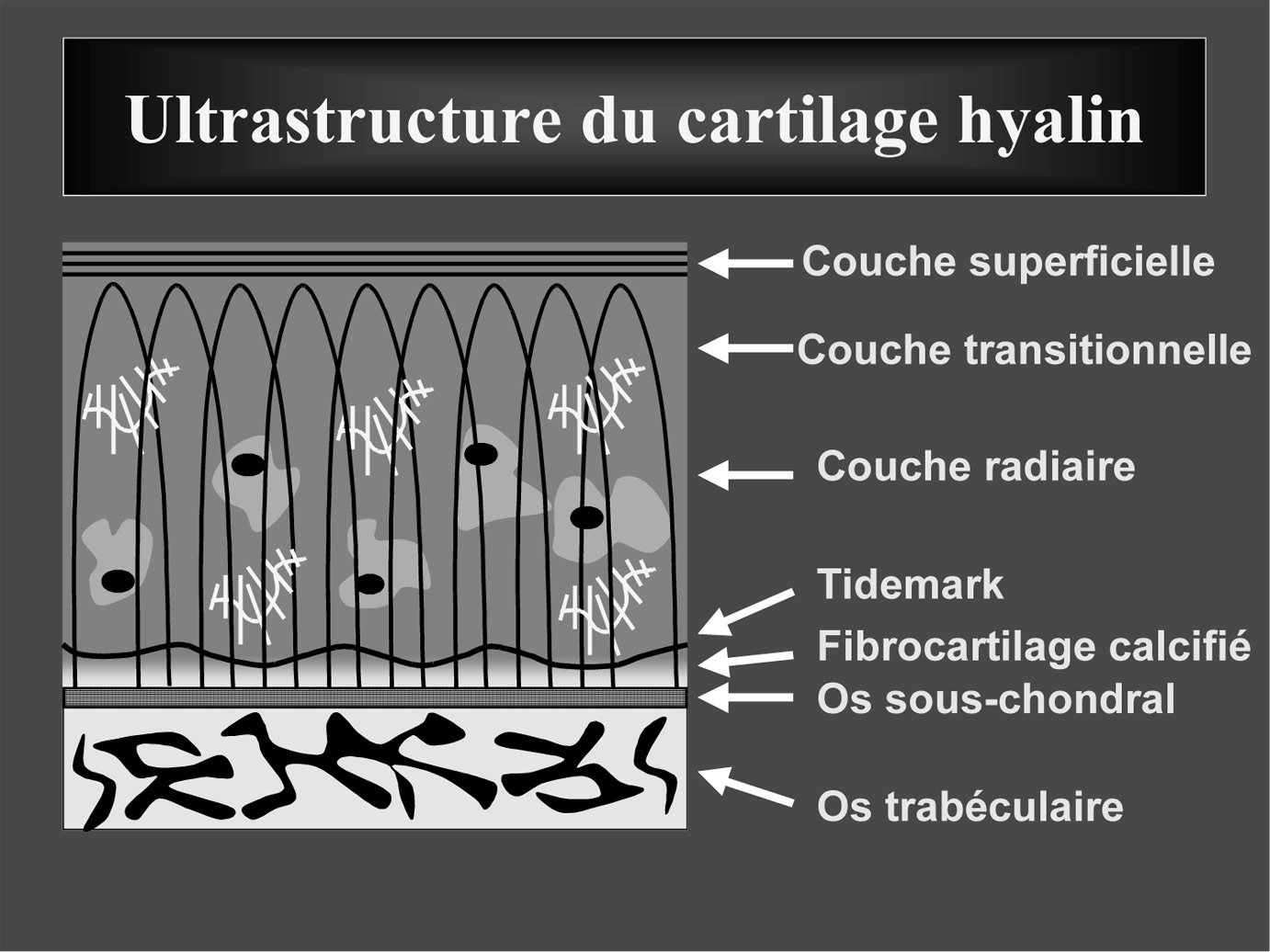
FIG. 2. —Schéma de l’ultra-structure du cartilage hyaline (schema dû à l’obligeance de C. Chung (21)).
Étude IRM du cartilage en pratique clinique
Les paramètres qui influent directement sur l’imagerie IRM du cartilage sont la résolution spatiale, le rapport signal sur bruit et la séquence d’acquisition. Il existe un grand nombre de séquences IRM ayant des avantages différents en terme de résolution spatiale, de rapport signal sur bruit et de contraste avec les tissus environnants notamment le liquide articulaire. Les séquences FAST Spin-Echo (FSE) et les séquences Spoiled Gradient-Recalled Echo (SPGR) sont les séquences d’acquisition les plus répandues.
Les séquences FSE, pondérées en densité de protons ou en T2 (Figure 3), avec ou sans saturation de la graisse sont les plus couramment utilisées en routine puisqu’elles donnent une vue d’ensemble des ligaments, de l’os sous-chondral, des ménisques et du cartilage. Elles sont acquises relativement rapidement. En outre, le transfert de magnétisation inhérent à ces séquences améliore la visibilité des anomalies cartilagineuses. Sur ces séquences, le cartilage a un signal intermédiaire et le liquide articulaire a un signal intense. Les anomalies cartilagineuses peuvent apparaître sous forme de défect localisé, d’un amincissement diffus de l’épaisseur ou encore d’une zone de signal augmenté sans anomalie de surface dûe à une augmentation localisée du contenu en eau du cartilage, secondaire à une désorganisation de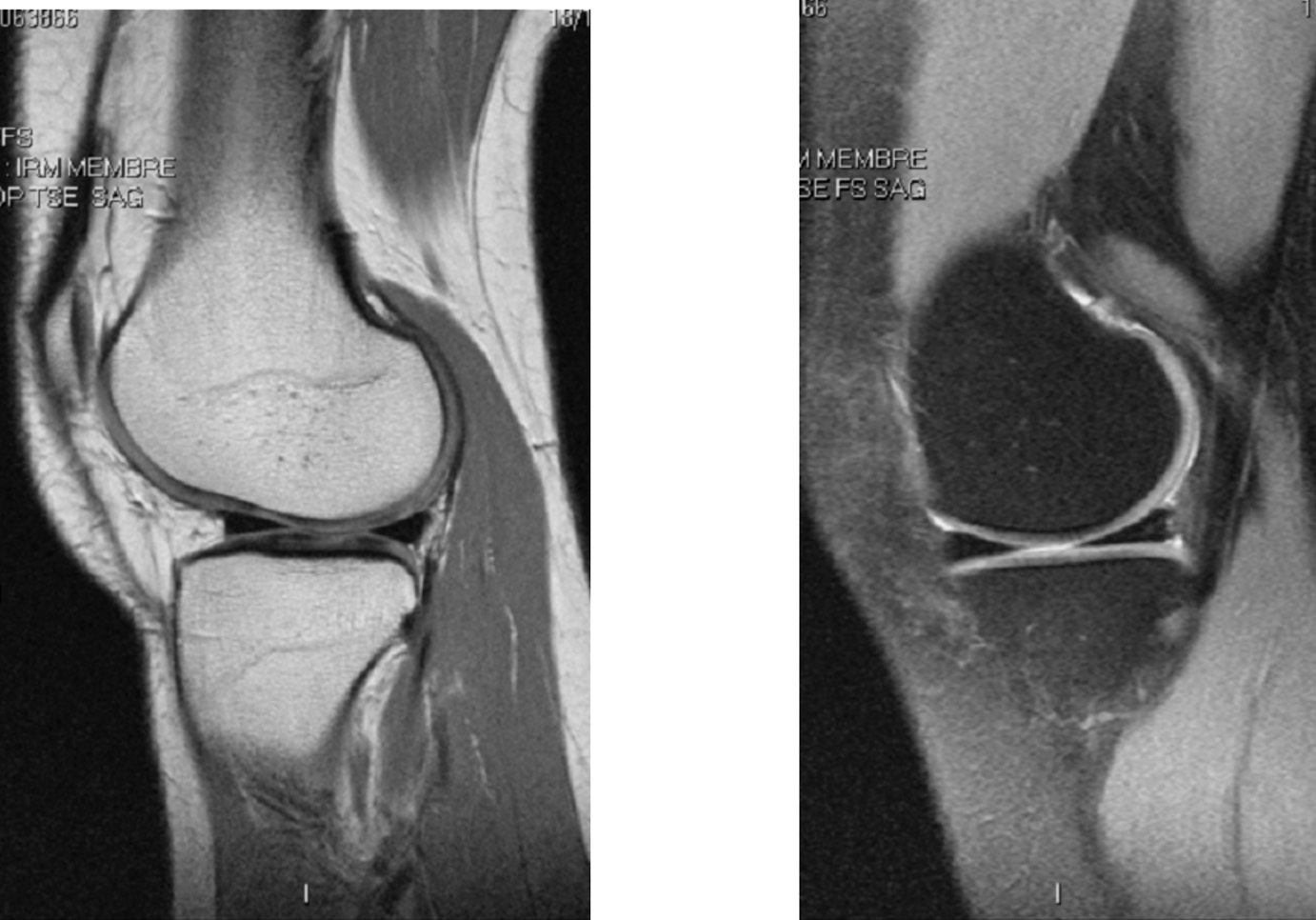
FIG. 3. — IRM du genou : coupes sagittales en densité de protons(à gauche) et en T2 (à droite) montrant le cartilage normal et les ménisques.
l’ultrastructure du collagène [9]. Ces séquences ont une sensibilité de 94 % dans la détection des lésions cartilagineuses vérifiées à l’arthroscopie [10]. L’inconvénient des séquences FSE en deux dimensions est l’épaisseur des coupes (3 mm) conférant au voxel (unité volumique représentée) une dimension très anisotrope et donc une résolution spatiale nettement moindre dans les plans reconstruits que dans le plan d’acquisition.
Par rapport aux séquences FSE, les séquences 3D-SPGR pondérées en T1 ont comme avantage de donner des coupes fines (1 mm), contiguës, en haute résolution dans tous les plans de l’espace et en une seule acquisition avec un fort contraste. En outre, ces séquences ne sont pas sensibles à l’artéfact de déplacement chimique.
Plusieurs études ont montré que ces séquences mettaient en évidence des ulcérations cartilagineuses avec une bonne sensibilité et spécificité [11, 12]. Les inconvénients de ces séquences, à l’inverse, sont un temps d’acquisition plus long que les séquences FSE (sept à dix minutes), et une sensibilité majorée à l’artéfact de susceptibilité magnétique et aux artéfacts visibles autour des débris métalliques ce qui peut être très gênant en cas d’intervention chirurgicale antérieure.
Étude IRM du cartilage en recherche
Étude morphométrique
Ces études ne sont possibles qu’au genou, où le cartilage a une épaisseur suffisante pour autoriser des mesures. Il est possible de quantifier le volume du cartilage ou de faire une cartographie de son épaisseur.
Les mesures de volume de cartilage sont faites à partir d’une acquisition 3D écho de gradient (le plus souvent 3D-SPGR). Ces mesures ont une excellente reproductibilité et un coefficient de variation de 2 à 4 % [13, 14]. Cette précision permet d’utiliser l’IRM dans des études longitudinales. Dans l’arthrose, la perte peut devenir significative, compte tenu de l’erreur de mesure, après une année ou deux. Les mesures d’épaisseur sur toute l’étendue de l’articulation sont générées par segmentation manuelle et représentation paramétrique bi-cubique (cube de 0.8 mm de diamètre) [14]. Ces mesures permettent de détecter des modifications locales de l’épaisseur contrairement aux mesures volumiques. Elles sont cependant moins précises et moins sensibles aux changements.
Séquences permettant de caractériser l’ultrastructure du cartilage
Plusieurs séquences IRM peuvent refléter l’ultrastructure du cartilage :
— La plus courante est la cartographie T2 . On sait que le temps de relaxation T2 du cartilage est fonction de son contenu en eau et de l’ultrastructure du collagène du tissu. Le temps de relaxation en T2 peut être quantifié et suivi grâce à des séquences multi-échos. La mesure de la distribution spatiale du T2 peut montrer les zones où le contenu en eau est accru ou diminué du fait d’altérations du cartilage. Le vieillissement s’accompagne d’une augmentation diffuse du T2 de la couche transitionnelle [9]. Ces séquences sont particulièrement intéressantes dans les études portant sur les médicaments ciblant directement la matrice collagène comme les inhibiteurs des métallo-protéases. Les séquences utilisées résultent d’un compromis entre le temps d’examen, le nombre d’écho, la résolution spatiale et le rapport signal sur bruit.
— Les séquences en transfert de magnétisation donnent aussi un reflet du collagène cartilagineux.
— La diffusion du Gadolinium dans le cartilage après son injection intra-veineuse évalue l’intégrité des chaînes de protéoglycanes en mesurant la densité locale en charges négatives du cartilage. On utilise des séquences en inversion-récupération avec des paramètres tels que le cartilage normal apparaît vide de signal. En cas d’altération des protéoglycanes, la charge négative de ces molécules diminue et le Gadolinium-DTPA qui est aussi chargé négativement peut y pénétrer. Des études ont démontré l’existence d’une relation inversement proportionnelle entre la distribution du Gadolinium-DTPA et la présence d’altérations ou de déplétion en glyco-amino-glycanes [19, 20]. On ignore encore si les anomalies visibles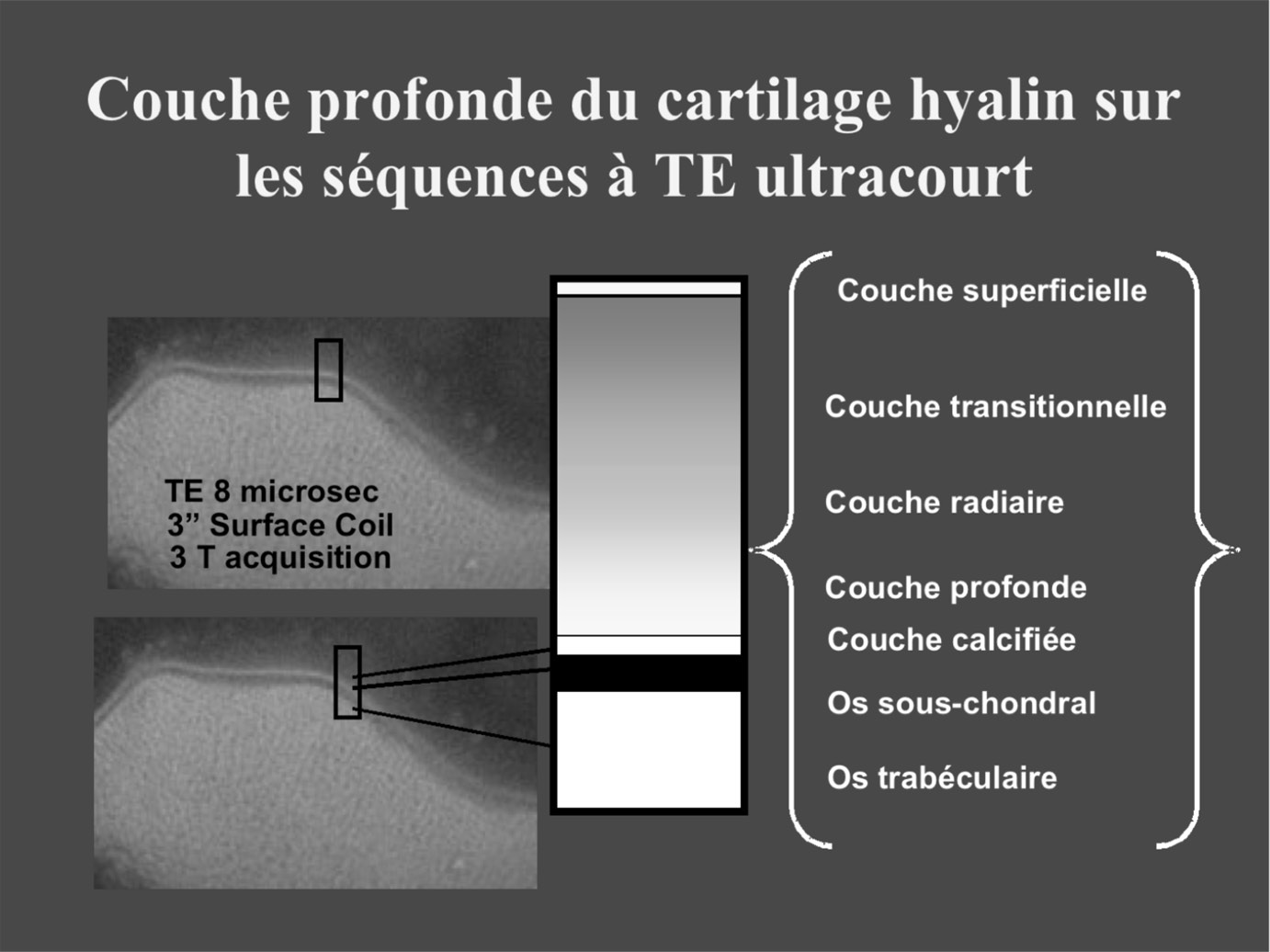
FIG. 4. — Aspect du cartilage rotulien sur les séquences à temps d’écho ultra-court (8 microsecondes). Notez que la couche profonde calcifiée du cartilage est en hypersignal alors qu’elle est en hyposignal en imagerie classique (image due à l’obligeance de C. Chung).
sur les séquences en diffusion de Gadolinium précèdent celles visibles en imagerie T2.
— L’imagerie de diffusion utilise comme paramètre le coefficient de diffusion apparent qui décroît quand on utilise des temps de diffusion longs parce que les molécules d’eau sont, à l’état normal, limitées dans leur déplacement par les composantes du cartilage, principalement le réseau de collagène aux temps de diffusion utilisés. L’altération du réseau de collagène se manifeste par un raccourcissement du temps de diffusion.
— Les séquences utilisant un temps d’écho extrêmement court (ultra-short TE) :
l’imagerie classique en séquences T1 et densité de protons permet d’explorer les couches transitionnelle et radiaire du cartilage hyalin où les T2 s’échelonnent entre 10 et 50 millisecondes (figure 4). En revanche, la couche profonde du cartilage où les T2 sont de l’ordre de 10 micro-secondes sont vides de signal sur ces séquences. Les séquences à TE extrêmement court (quelques dizaines de micro-secondes) permettent d’obtenir une évaluation quantitative et qualitative de la couche profonde calcifiée du cartilage fémoro-tibial et fémoro-patellaire sur pièce anatomique (Figure 4) [21].
— L’imagerie par résonance magnétique du sodium est radicalement différente de l’IRM habituelle fondée sur la résonance des protons d’hydrogène. Elle nécessite des machines spéciales de recherche avec un très haut champ magnétique. Les molécules de sodium se couplent aux charges électriques abondantes présentes sur les couches sulfates et carboxylates des protéoglycanes. Les atomes ayant un nombre impair de protons ou de neutrons possèdent un moment de spin du noyau et présentent donc un phénomène de résonance magnétique. Le sodium23 est un exemple des noyaux autres que l’hydrogène qui peuvent être utilisés en imagerie du cartilage (où le sodium est relativement abondant). Mais la fré- quence de résonance basse, la faible concentration et le T2 plus court du sodium par rapport au proton d’hydrogène font que l’imagerie par résonance magnétique in-vivo du sodium est un défi et nécessite des antennes émettrices et réceptrices dédiées et des temps d’acquisitions longs. L’imagerie du sodium est très sensible à la concentration en protéoglycanes et permet de déceler des régions de déplétion en protéoglycanes.
LES EXAMENS AVEC INJECTION INTRA-ARTICULAIRE DE CONTRASTE : ARTHROSCANNER ET ARTHRO-IRM
L’arthroscanner consiste en une acquisition scanner après injection intra-articulaire d’un produit de contraste iodé (Figure 5). Ses inconvénients sont de nécessiter une ponction articulaire et d’être irradiant notamment à la hanche où les gonades sont proches. Cependant, c’est le seul examen qui donne une imagerie isotropique (volume élémentaire « voxel » cubique) de résolution élevée (cube de 0.4 mm de côté), équivalente dans tous les plans de l’espace à partir d’une seule acquisition. Cet examen montre le contour du cartilage et toutes les fissures ou ulcérations qui communiquent avec l’articulation. En revanche, il ne donne aucune information sur le contenu propre du cartilage. C’est l’examen de référence dans l’étude fine du cartilage articulaire en routine clinique.
L’arthro-IRM consiste en une acquisition IRM avec une séquence pondérée en T1 notamment écho de gradient T1 3D (3D-SPGR) couplée à l’injection de contraste du Gadolinium dans l’articulation. Cet examen nécessite une ponction articulaire mais n’est pas irradiant (Figure 6). Sa résolution est un peu inférieure à celle du scanner et n’est pas égale dans les trois plans de l’espace. En revanche, il donne des informations complémentaires sur la substance des ménisques, des ligaments et sur l’état de l’os sous-chondral (œdème).
LES DIFFERENTS TYPES DE LESIONS CARTILAGINEUSES
Le vieillissement est souvent assimilé à la dégénérescence du cartilage articulaire.
Cependant, contrairement à une idée reçue, l’épaisseur du cartilage de la hanche par exemple ne diminue pas avec l’âge chez le sujet normal. Les lésions du cartilage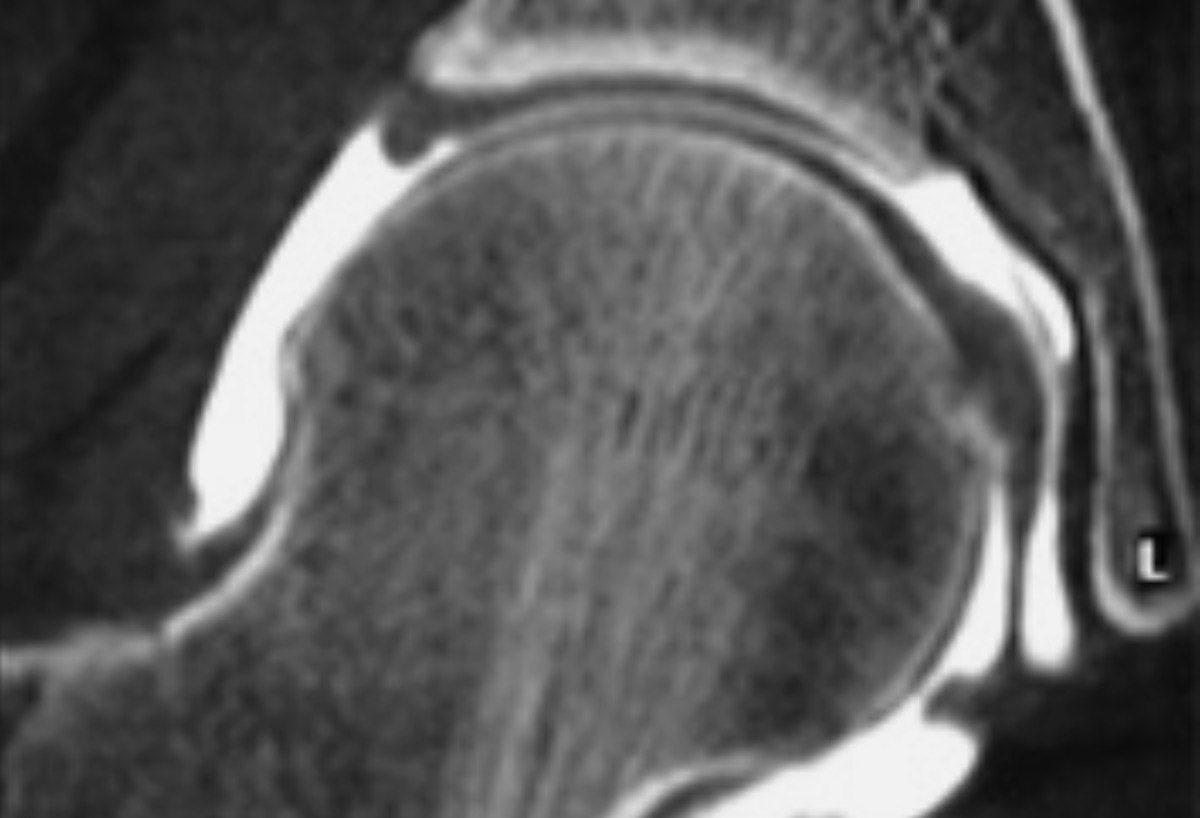
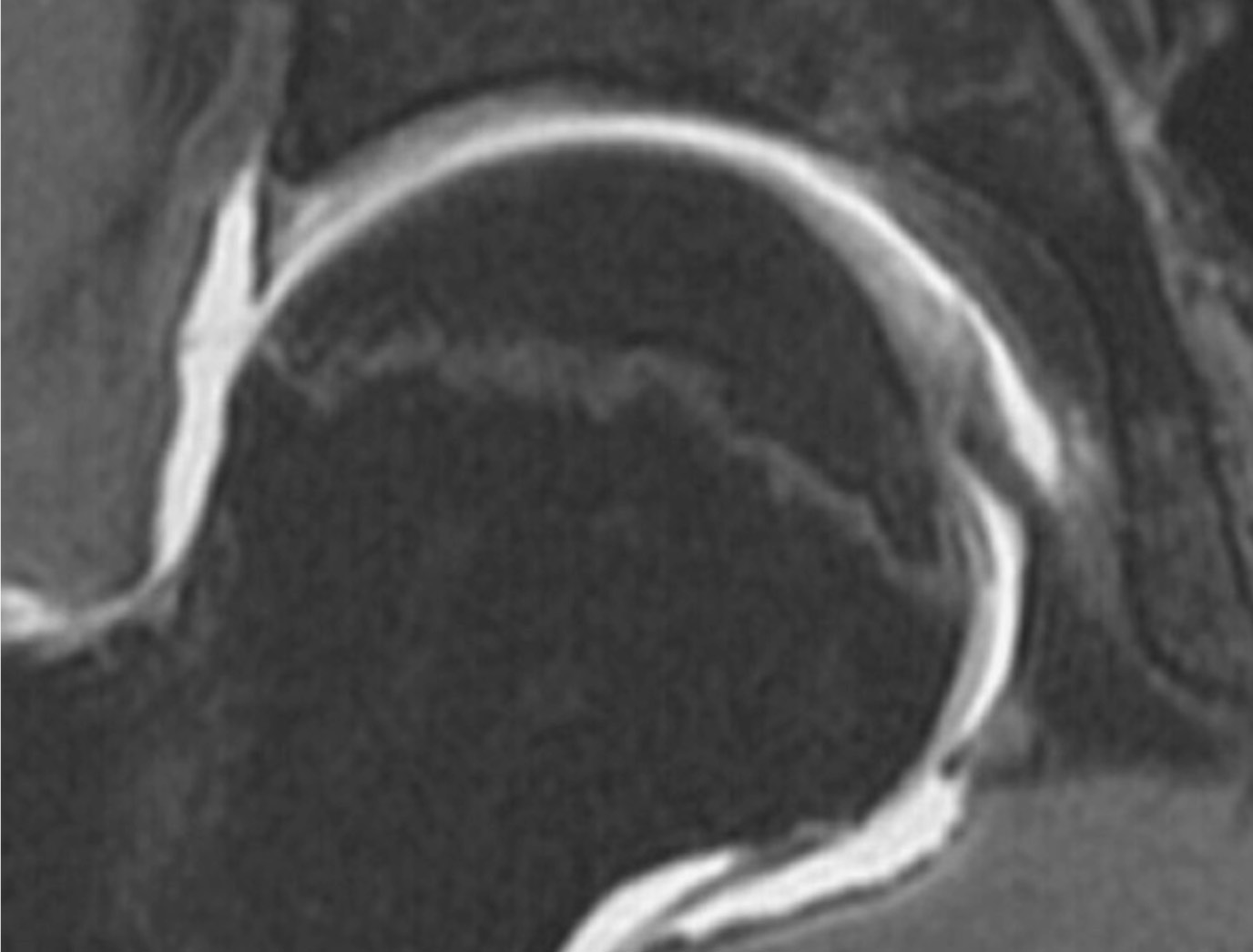
FIG. 5. — Exemple d’arthroscanner de hanche normale (coupe coronale).
FIG. 6. — Exemple d’arthro-IRM de hanche normale (coupe coronale).
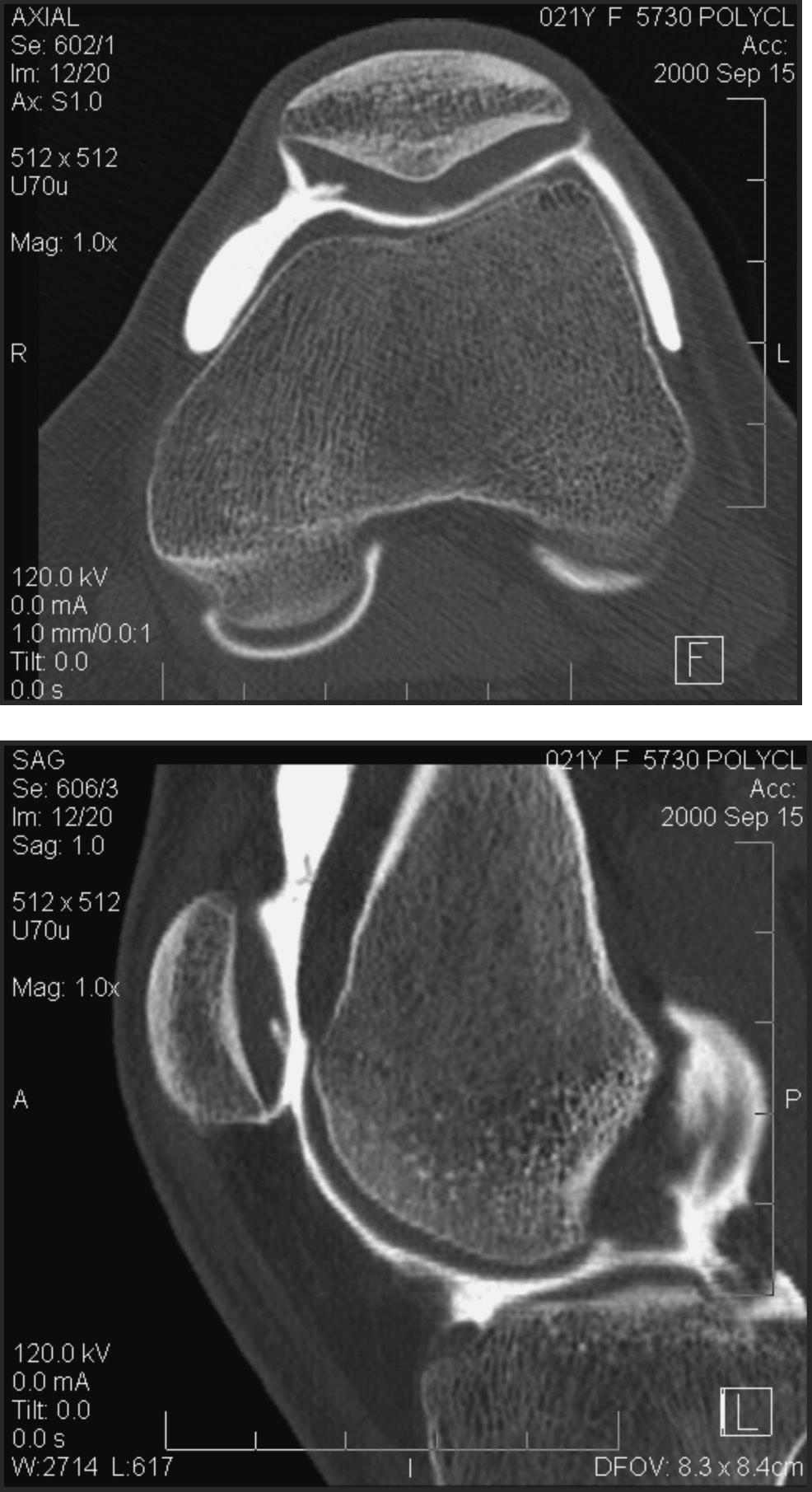
FIG. 7. — Arthroscanner du genou. Coupes axiale et sagittale montrant une fissure du cartilage rotulien.

FIG. 8. — Exemple de chondropathie rotulienne (flèche) en IRM 3 Teslas (cliché dû à l’obligeance de Mark Schweitzer) articulaire peuvent être de nature dégénérative, traumatique, micro-traumatique ou constitutionnelle.
Les lésions cartilagineuses dégénératives peuvent se manifester par un amincissement diffus du cartilage qui sera visible sur les radiographies ou des anomalies plus localisées qui peuvent être visibles en IRM ou qui ne sont mises en évidence que par les examens avec injection intra-articulaire d’un produit de contraste (arthroscanner, arthro-IRM). Les anomalies localisées consistent en des ulcérations (perte de substance) atteignant ou non l’os sous-chondral, des fissures plus ou moins profondes, des amincissements ou simplement des irrégularités de surface (Figure 7). Les ulcérations sont classées en fonction de leur profondeur. Les amincissements diffus ne seront reconnus que si le lecteur a connaissance de l’existence de variations normales de l’épaisseur du cartilage en fonction de la zone articulaire (exemple des gradients d’épaisseur du cartilage du cotyle et de la tête fémorale à la hanche).
Paradoxalement, à un stade de début de l’arthrose, le cartilage peut au contraire s’épaissir transitoirement par excès d’hydratation, conséquence de la dégénérescence du collagène. Enfin, à un stade initial, les anomalies peuvent se limiter à une
augmentation de signal dans l’épaisseur du cartilage sans qu’il n’y ait d’anomalie de contour (Figure 8). Les lésions cartilagineuses dégénératives peuvent s’accompagner d’épanchement articulaire, d’ostéophytose et surtout d’anomalie de l’os souschondral. En l’absence de traumatisme, un œdème de l’os sous-chondral des condyles du genou indique avec une grande spécificité (87,5 %) la présence d’une ulcération chondrale de plus de 50 % d’épaisseur du cartilage [22].
Les lésions cartilagineuses traumatiques peuvent avoir l’aspect d’ulcérations à bords nets et à angle obtus, de fissures franches plus ou moins profondes ou d’impactions sous-chondrales, selon que le mécanisme traumatique consiste en un cisaillement, une torsion ou une impaction. Elles sont le plus souvent associées à des lésions ligamentaires. L’œdème de l’os sous-chondral est habituellement franc dans les lésions fraîches et profondes par impaction ou cisaillement, plus discret dans les délaminations et les lésions cartilagineuses superficielles.
Au genou, la prévalence et la sévérité des lésions cartilagineuses augmenteraient avec l’âge et l’index de masse corporelle (BMI) [23]. Dans une étude de suivi par IRM sur deux ans, 33 % des lésions cartilagineuses diminuent ou disparaissent tandis que 37 % augmentent de stade [23]. Dans cette étude, l’aggravation est corrélée au sexe féminin, à l’âge et à l’index de masse corporelle [23].
SUIVI DES TRAITEMENTS CHIRURGICAUX DES DEFECTS CARTILAGINEUX
Plusieurs techniques de réparation sont en développement et nécessitent un suivi évolutif (24).
Les techniques de perforation, abrasion et chondroplastie des défects cartilagineux visent à favoriser la formation de néo-vaisseaux à partir de l’os sous-chondral et l’afflux de précurseurs cellulaires susceptibles de former un cartilage ou un fibrocartilage de substitution à partir du caillot sanguin initial. Ces techniques sont surtout recommandées dans les pertes cartilagineuses de petite taille. L’IRM montre la réaction de l’os sous-chondral puis le remplissage progressif du défect. Dans la transplantation de greffon ostéochondral, plusieurs cylindres constitués de cartilage et de son os sous-chondral sont prélevés dans une partie saine et non portante de l’articulation du même patient et réimplantés dans le défect ostéochondral. L’IRM permet de contrôler le positionnement des greffons, le caractère congruent de la surface cartilagineuse reconstruite, et l’intégration des greffons dans l’os et le cartilage environnant [24]. Après des phases de revascularisation et d’œdème, les greffons retrouvent un signal graisseux normal en six à neuf mois. L’implantation de chondrocytes antologues sous une couverture périostée est une autre technique de comblement des pertes cartilagineuses actuellement difficile à pratiquer en Europe faute de laboratoire agréé pour la culture des chondrocytes.
CONCLUSION
Les progrès de l’imagerie et de l’informatique permettent aujourd’hui d’obtenir des images de haute définition en trois dimensions du cartilage articulaire. Outre ces informations d’ordre morphologique, l’IRM a le potentiel de renseigner sur la composition et la structure du cartilage dans les conditions qui sont actuellement du domaine de la recherche. Ces progrès vont probablement encore s’accélérer dans les prochaines années pour répondre aux besoins d’évaluation des nouveaux traitements médicaux de fond de l’arthrose qui devraient bientôt apparaître.
BIBLIOGRAPHIE [1] RUBENSTEIN J.D., KIM J.K., MOROVA-PROTZNER I., STANCHEV P.L., HENKELMAN R.M. — Effects of collagen orientation on MR imaging characteristics of bovine articular cartilage.
Radiology, 1993, 188, 219-226.
[2] MLYNARIK V., TRATTNIG S. — Physicochemical properties of normal articular cartilage and its MR appearance. Invest. Radiol., 2000, 35 , 89-594.
[3] XIA Y., FARQUHAR T., BURTON-WURSTER N., LUST G. — Origin of cartilage laminae in MRI.
J.
Magn. Reson. Imaging , 1997, 7, 889-894.
[4] MOW V.C., FITHIAN DC., KELLY M. — Fundamentals of articular cartilage and meniscus biomechanics. In : Ewing JW, ed.. Articular cartilage and knee joint function . New York, NY,
Raven Press, 1990, 1-18.
[5] GRUNDER W., WAGNER M., WERNER A. — MR-microscopic visualization of anisotropic internal cartilage structures using the magic angle technique. Magn. Reson. Med. 1998, 39 , 376-382.
[6] JEFFERY A.K., BLUNN G.W., ARCHER C.W., BENTLEY G. — Three-dimensional collagen architecture in bovine articular cartilage. J. Bone Joint Surg. Br., 1991, 73 , 795-801.
[7] GOODWIN D.W., DUNN J.F. — High-resolution magnetic resonance imaging of articular cartilage : correlation with histology and pathology. Top Magn. Reson. Imaging, 1998, 9 , 337-347.
[8] GOODWIN D.W., ZIAM WADGHIRI Y., ZHU H., VINTON C.J., SMITH E.D., DUNN J.F. —The macroscopic structure of tibial plateau articular cartilage : influence of a characteristic matrix architecture on MRIs. AJR ., 2004, 182 , 311-318 [9] MOSHER T.J., DARDZINSKI B.J., SMITH M.B. — Human articular cartilage : influence of aging and early symptomatic degeneration on the spatial variation of T2-preliminary findings at 3 T.
Radiology, 2000, 214 , 259-266 [10] BREDELLA M.A., TRIMAN P.F.J., PETERFY C.G. et al . — Accuracy of T2-weighted fast spin-echo
MR imaging with fat saturation in detecting cartilage defects in the knee : comparison with arthroscopy in 130 patients. AJR., 1999, 172 , 1073-1080.
[11] DISLER D.G., MCCAULAY T.R., WIRTH C.R., FUCHS M.C. — Detection of knee hyaline articular cartilage defects using fat-suppressed three-dimensional spoiled gradient-echo MR imaging : comparison with standard MR imaging and correlation with arthroscopy. AJR., 1995, 165, 377-382.
[12] RECHT M.P., KRAMER J., MARCELIS S. et al . — Abnormalities of articular cartilage in the knee ;
analysis of available MR techniques.
Radiology, 1993, 187 , 473-478.
[13] ECKSTEIN F., SITTECK H., GAVAZZENIA A., MILZ S., PUTZ R., REISER M. — Assessment of articular cartilage volume and thickness with magnetic resonance imaging (MRI). Trans.
Orthop. Res. Soc ., 1995, 20 , 194.
[14] PETERFY C.G., VAN DIJKE C.F., JANZEN D. et al. — Quantification of articular cartilage in the knee by pulsed saturation transfer and fat-suppressed MRI : optimisation and validation.
Radiology , 1994, 192 , 485-491.
[15] PETERFY C., WHITE D., ZHAO J., VAN DIJKE C., GENANT H. — Longitudinal measurement of knee articular cartilage volume in osteoarthritis. American College of Rheumatology . San Diego, 1998.
[16] GOLD G.E., HARGREAVES B.A., REEDER S.B., VASANAWALA S.S., BEAULIEU C.F. — Controversies in Protocol Selection in the Imaging of Articular Cartilage. Seminars in musculoskeletal radiology, 2005, 9, 161-172 [17] RECHT M.P., GOODWIN D.W., WINALSKI C.S., WHITE L.M. — MRI of Articular Cartilage :
Revisiting Current Status and Future Directions. AJR ., 2005, 185 , 899-914 [18] DARDZINSKI B.J., MOSHER T.J., LI S., VAN SLYKE M.A., SMITH M.B. — Spatial varation of T2 in human articular cartilage. Radiology , 1997, 205 , 546-550 [19] BASHIR A., GRAY M.L., BURSTEIN D. — Gd-DTPA as a measure of cartilage degradation.
Magn. Reson. Med., 1996, 36 , 665-673.
[20] BASHIR A., GRAY M.L., HARTKE J., BURSTEIN D. — Nondestructive imaging of human cartilage glycosaminoglycan concentration by MRI. Magn. Reson. Med., 1999, 41 , 857-865.
[21] CHUNG C.B., DWEK J.R, BEACH S., HAGHIGHI P., PUNI R., BYDDER G.M. ULTRASHORT T.E. — Imaging Evaluation of the Femorotibial and Patellofemoral Cartilage of the Knee : Imaging Comparison with Histology in 10 Cadaveric Specimens to Establish the Normal and Pathologic MR Appearance of the Deep Layer of Articular Cartilage. Radiology , Supplement 2005.
[22] KIJOWSKI R., STATON P., FINE J., DE SMET A. — Subchondral Bone Marrow Edema in Patients with Degeneration of the Articular Cartilage of the Knee Joint. Radiology : 2006, 238 , 943-949.
[23] DING G., CICUTTINI F., SCOTT F., COOLEY H., BOON C., JONES G. — Natural History of Knee Cartilage Defects and Factors Affecting Change. Arch. Intern. Med ., 166 , Mar 27, 2006 [24] RECHT M., WHITE L.M., WINALSKI C . et al . — MR imaging of cartilage repair procedures.
Skeletal Radiol., 2003, 32 , 185-200.
DISCUSSION
M. CLaude-Henri CHOUARD
L’IRM peut-elle vérifier qu’au niveau du site de prélèvement d’un cartilage costal, on assiste avec le temps à une reconstruction du cartilage lorsque le périchondre a été conservé, et saturé ?
La réponse à votre question sera une extrapolation puisqu’il n’existe pas, à ma connaissance, d’étude en IRM des greffes de cartilage costaux. Par assimilation avec ce qui a été observé dans les greffons ostéchondraux transplantés aux genoux, on peut supposer que les images IRM montreraient une vascularisation progressive et un œdème du greffon dans les premiers mois. Après six à neuf mois, le cartilage reprendrait un signal normal (noir en T2 et peu vasculaire).
M. Emmanuel CABANIS
L’utilisation du Gadolinium (en IRM) est-elle par voie IV (mise en évidence d’une néovascularisation sur greffon par exemple), ou aussi, par voie intra-articulaire, comme l’iode en scanner RX (« arthro-scanner ») ? L’apport du 3-Tesla est-il aussi important pour l’évaluation de l’os sous-chondral que pour le cartilage ?
L’arthro-IRM est habituellement obtenue par injection intra-articulaire de gadolunium (arthro-IRM directe). Le contraste avec le cartilage est alors excellent. Il est aussi possible d’obtenir une arthro-IRM en injectant le gadolinium par voie intraveineuse, puis en demandant au patient de mobiliser activement son membre afin d’augmenter le flux sanguin et la sécrétion du gadolinium par la membrane synoviale dans le liquide articulaire (arthroIRM indirecte). L’IRM 3 Teslas donne un contraste (rapport signal sur bruit) supérieur à celui de l’IRM 1,5 Teslas du fait de l’augmentation du champ magnétique. Ceci est particulièrement important pour l’imagerie fonctionnelle rapide du cerveau notamment et pour l’imagerie très fine, du cartilage par exemple. L’avantage est moins certain pour l’os sous-chondral car le gain en résolution spatiale est contrecarré par une augmentation de l’artéfact de déplacement chimique qui est majoré à 3 Teslas.
M. Patrice QUENEAU
Quelles sont les utilisations actuelles de l’arthro-scanner et de l’arthro-IRM dans le bilan pré-opératoire de la mise en place d’une prothèse de hanche ou d’une prothèse du genou, pour ne prendre que ces deux exemples courants, à l’heure où sont mises en place en France actuellement annuellement environ 80 000 prothèses de hanches et 40 000 prothèses de genou ? Quel est le coût d’un arthro-scanner et d’un arthro-IRM ?
En routine, clinique des radiographies simples bien faites suffisent comme complément de l’interrogatoire et de l’examen clinique du patient dans l’immense majorité des cas.
Dans quelques cas cependant où les radiographies donnent un résultat équivoque, l’arthro-scanner (de préférence à l’arthro-IRM) sera utile pour confirmer l’importance des lésions cartilagineuses. On peut en même temps profiter de la ponction articulaire nécessaire pour injecter le produit de contraste pour faire un test anesthésique.
* Radiologie Ostéo-articulaire, Hôpital Lariboisière — 75010 Paris. Tirés à part : Professeur Jean-Denis LAREDO, même adresse. Article reçu et accepté le 9 octobre 2006.
Bull. Acad. Natle Méd., 2006, 190, no 7, 1459-11474, séance du 24 octobre 2006


